第五部分 铜的化合物的制备——2024届高考化学攻破实验专项训练(含解析)
文档属性
| 名称 | 第五部分 铜的化合物的制备——2024届高考化学攻破实验专项训练(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 578.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 21:49:10 | ||
图片预览


文档简介
第五部分 铜的化合物的制备——2024届高考化学攻破实验专项训练
学校:___________姓名:___________班级:___________考号:___________
一、单选题
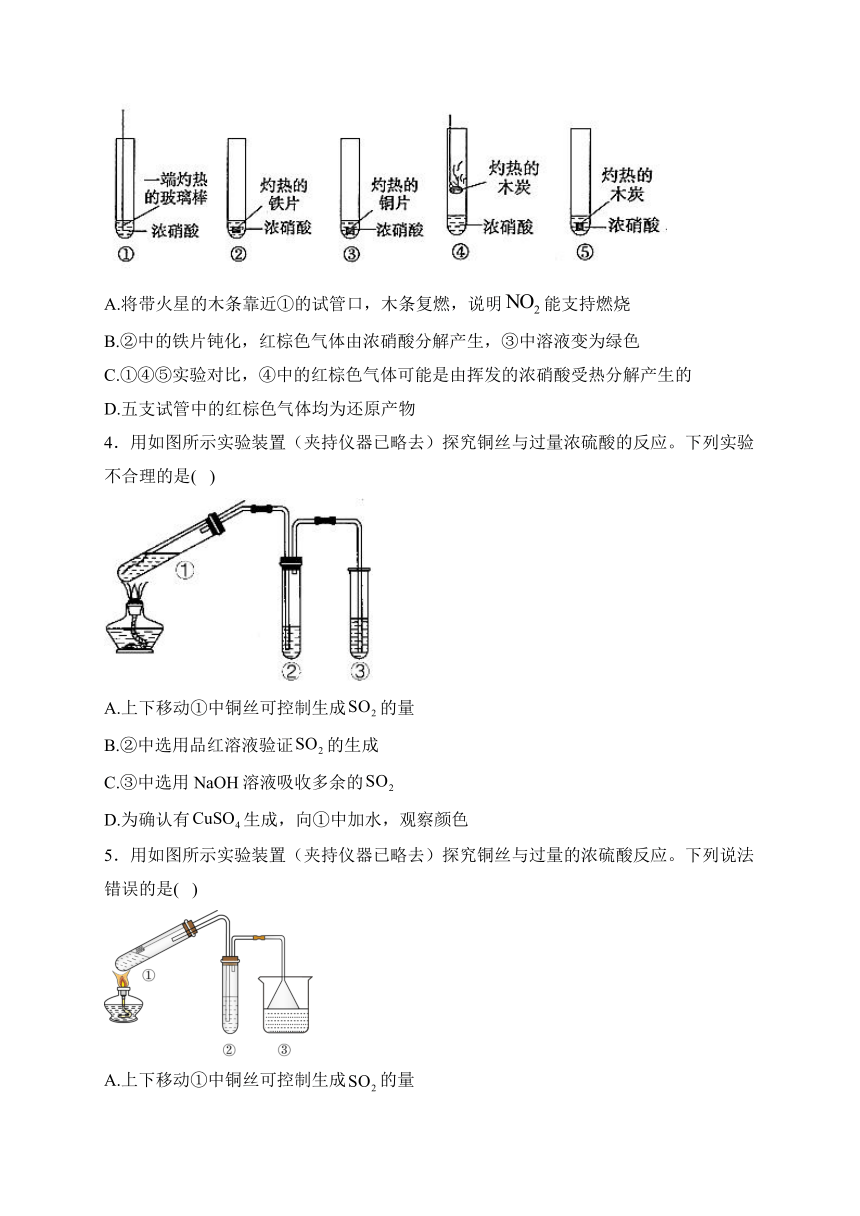
1.按如图所示装置进行实验,探究硫酸铜的分解产物。实验后反应管中残留固体为红色粉末(经检测为Cu2O)。下列说法错误的是( )
A.加热前需打开K1和K2,缓缓通入一段时间N2
B.A的作用是吸收尾气,防止污染空气
C.可将BaCl2溶液换成Ba(NO3)2溶液
D.若品红溶液不褪色,硫酸铜分解的化学方程式为4CuSO42Cu2O+4SO3↑+O2↑
2.38.4Cu与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到和的混合溶液,反应过程及有关数据如图所示
下列有关判断不正确的是( )
A.硝酸在反应中既体现氧化性又体现酸性
B.氮的氧化物和NaOH溶液反应时,NO作还原剂
C.混合气体中的物质的量是0.1mol,生成
D.若浓硝酸体积为200mL,则其物质的量浓度为11mol/L
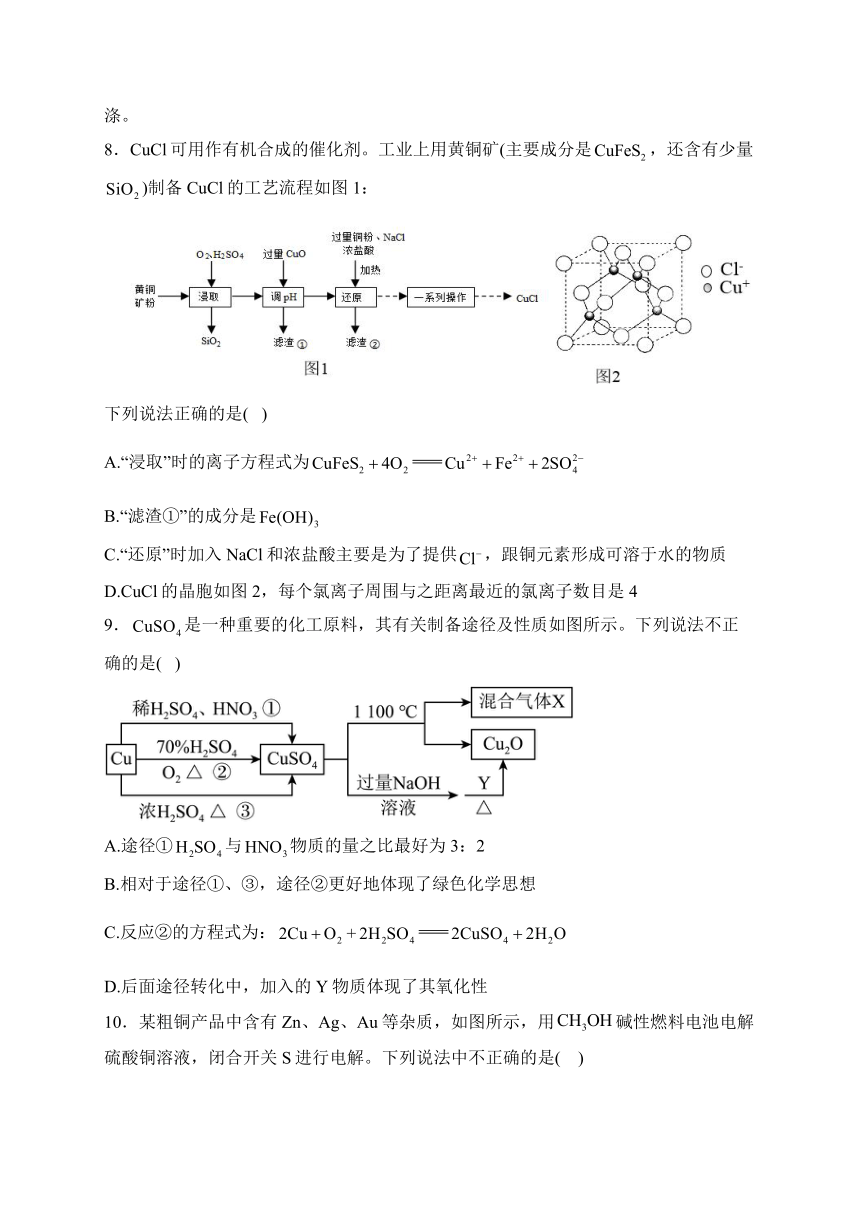
3.为了探究浓硝酸的性质,进行以下五组实验,均观察到红棕色气体。下列分析错误的是( )
A.将带火星的木条靠近①的试管口,木条复燃,说明能支持燃烧
B.②中的铁片钝化,红棕色气体由浓硝酸分解产生,③中溶液变为绿色
C.①④⑤实验对比,④中的红棕色气体可能是由挥发的浓硝酸受热分解产生的
D.五支试管中的红棕色气体均为还原产物
4.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制生成的量
B.②中选用品红溶液验证的生成
C.③中选用NaOH溶液吸收多余的
D.为确认有生成,向①中加水,观察颜色
5.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量的浓硫酸反应。下列说法错误的是( )
A.上下移动①中铜丝可控制生成的量
B.①中发生反应的化学方程式为
C.③中选用溶液吸收多余的
D.为确认生成,向①中加水,观察颜色
6.学习小组设计如下实验探究Cu与浓硝酸反应混合液呈绿色的原因。
实验Ⅰ:向浓硝酸中加入铜粉,产生红棕色气体,溶液变为绿色,将溶液分成两份于两支小试管中。
实验Ⅱ:向其中一支小试管中加入铜粉,振荡,充分反应,溶液变为蓝色。
实验Ⅲ:将另一支小试管稍微加热,放出红棕色气体,溶液变为蓝色。
实验Ⅳ:取2g硫酸铜溶于蒸馏水中,溶液为蓝色,继续加入无色的亚硝酸钠溶液,混合后溶液变为绿色。
下列说法错误的是( )
A.铜与浓硝酸反应生成
B.实验中溶液为绿色是因为硝酸铜浓度变大
C.向实验绿色溶液中加入蒸馏水可能发生反应
D.Cu与浓硝酸反应过程中可能产生不稳定的亚硝酸铜导致溶液呈绿色
7.辉铜矿[,含杂质]合成目标产物的流程如下。下列说法正确的是( )
A.步骤Ⅰ在足量中煅烧产生气体的主要成分:
B.步骤Ⅱ得溶液C中溶质的主要成分:和
C.1mol中含有σ键数目为16
D.为得纯净目标产物,步骤Ⅳ的实验操作步骤依次:加热蒸发、冷却结晶、抽滤洗涤。
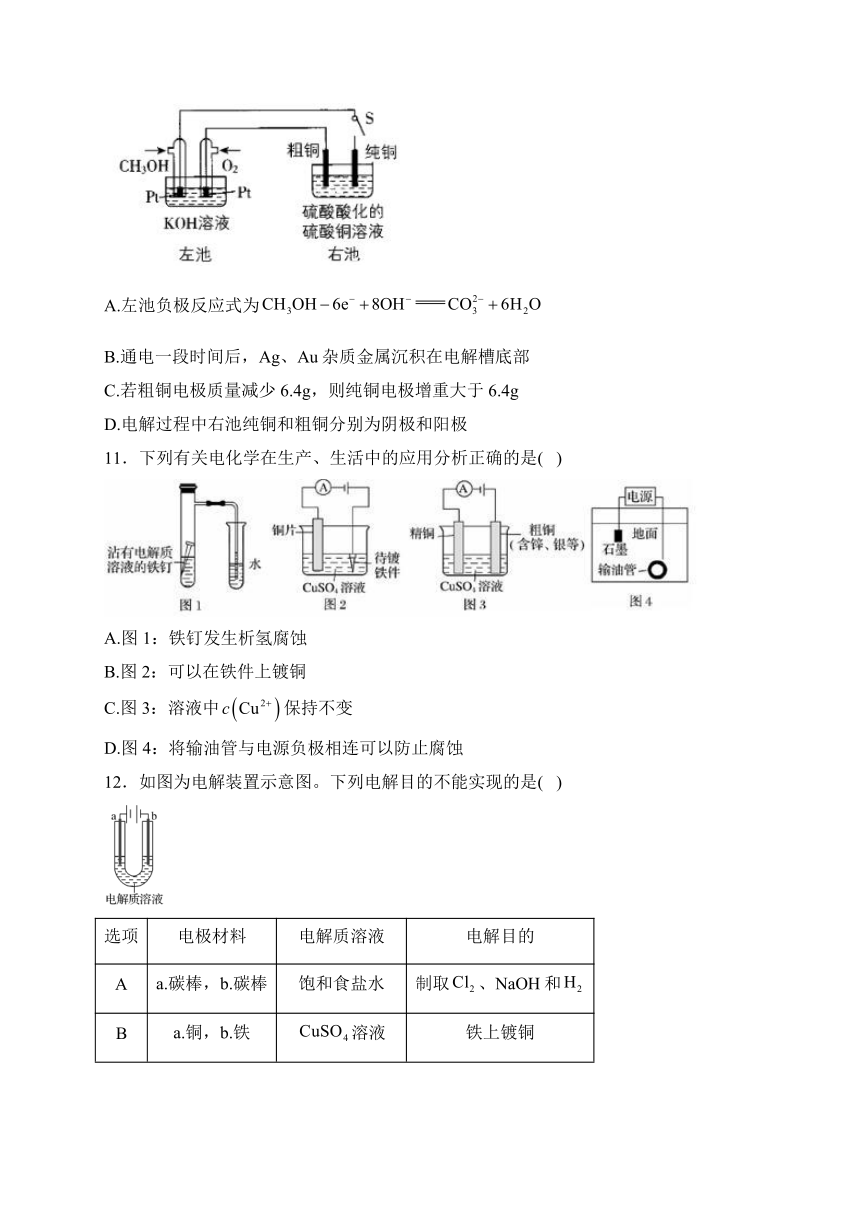
8.CuCl可用作有机合成的催化剂。工业上用黄铜矿(主要成分是,还含有少量)制备CuCl的工艺流程如图1:
下列说法正确的是( )
A.“浸取”时的离子方程式为
B.“滤渣①”的成分是
C.“还原”时加入NaCl和浓盐酸主要是为了提供,跟铜元素形成可溶于水的物质
D.CuCl的晶胞如图2,每个氯离子周围与之距离最近的氯离子数目是4
9.是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
A.途径①与物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.反应②的方程式为:
D.后面途径转化中,加入的Y物质体现了其氧化性
10.某粗铜产品中含有Zn、Ag、Au等杂质,如图所示,用碱性燃料电池电解硫酸铜溶液,闭合开关S进行电解。下列说法中不正确的是( )
A.左池负极反应式为
B.通电一段时间后,Ag、Au杂质金属沉积在电解槽底部
C.若粗铜电极质量减少6.4g,则纯铜电极增重大于6.4g
D.电解过程中右池纯铜和粗铜分别为阴极和阳极
11.下列有关电化学在生产、生活中的应用分析正确的是( )
A.图1:铁钉发生析氢腐蚀
B.图2:可以在铁件上镀铜
C.图3:溶液中保持不变
D.图4:将输油管与电源负极相连可以防止腐蚀
12.如图为电解装置示意图。下列电解目的不能实现的是( )
选项 电极材料 电解质溶液 电解目的
A a.碳棒,b.碳棒 饱和食盐水 制取、NaOH和
B a.铜,b.铁 溶液 铁上镀铜
C a.粗铜,b.精铜 溶液 电解精炼铜
D a.铁,b.碳棒 稀溶液 制取少量和
注:表中的粗铜含有锌、铁、镍、金、铂等杂质。
A.A B.B C.C D.D
13.图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法正确的是( )
A.图Ⅰ中b为纯铜,电解过程中质量减轻,发生的反应为
B.图Ⅰ中向a极移动,但不放电
C.图Ⅱ中如果a、b间用导线连接时,钢闸门作正极
D.图Ⅱ中如果a、b间连接直流电源利用外加电流阴极保护法保护钢闸门时,则X必须用锌
二、实验题
14.某兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜的精炼原理,如图所示,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲装置中通入氧气的电极是____极(填“正”或“负”),丙装置中精铜电极发生的电极反应式为___________________。
(2)乙装置中电解的总反应的离子方程式为__________________,阳极产物为____________________。
(3)如果粗铜中含有锌、银等杂质,反应一段时间后,丙装置中硫酸铜溶液浓度将_______(填“增大”、“减小”或“不变”)。
(4)丙装置中精铜电极的质量增加了6.4g,则甲装置中消耗的的质量为_______g,乙装置中铁电极上生成的气体在标准状况下体积为_______L。
15.某铜矿石的主要成分是,还含有少量的和某工厂利用此矿石炼制精铜的工艺流程如下所示(已知:)
(1)滤液A中铁元素的存在形式为 (填离子符号),生成该离子的离子方程式为 。检验滤液A中存在该离子的试剂为 (填试剂名称)
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为 ,
在实验室中完成此实验还需要的试剂是 。
a.
b. KCI
c. Mg
d.
(3)为使固体混合物D在空气中灼烧完全分解,应 ,直至连续两次测定的实验结果相同(或质量相差小于0.1 g);灼烧时必须用到的实验仪器是 。
(4)溶液G与固体混合物B反应的离子方程式为 。
(5)将溶液滴入一定量的溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是 。
参考答案
1.答案:C
解析:加热前打开K1、K2,缓缓通入一段时间N2,目的是将装置内的空气赶出,防止空气对分解产物产生干扰,A项正确;硫酸铜分解时有硫氧化物生成,故A的作用是吸收尾气,以防止污染空气,B项正确;BaCl2溶液的作用是检验SO3,品红溶液的作用是检验SO2,Ba(NO3)2溶液能与SO2反应,生成BaSO4和NO,对SO3的检验有干扰,且此时品红溶液无法检验SO2,故不能将BaCl2溶液换成Ba(NO3)2溶液,C项错误;若品红溶液不褪色,说明CuSO4分解过程中无SO2生成,则CuSO4分解的生成物中有Cu2O、SO3,由于铜元素化合价降低,则氧元素化合价升高,生成物中还有O2,配平化学方程式为4CuSO42Cu2O+4SO3↑+O2↑,B项正确。
2.答案:C
解析:A.铜和硝酸反应生成硝酸铜和氮的化合物,硝酸部分被还原,作氧化剂,有部分生成盐,表现出酸性,故A正确;
B.氮的氧化物和NaOH溶液反应时,NO转化为高价态氮,故作还原剂,故B正确;
D.由分析可知,若浓硝酸体积为200mL,则其物质的量浓度为11mol/L,D正确;
故选C。
3.答案:B
解析:A.①该溶液中只有浓硝酸,插入灼热的玻璃棒后产生红棕色气体,说明受热条件下浓硝酸分解生成气体,将带火星的木条靠近①的试管口,木条复燃,说明能支持燃烧,故A正确;
B.②灼热的铁片加入浓硝酸后,发生氧化还原反应生成气体,而在常温下才钝化,③灼热的铜片加入浓硝酸后,发生氧化还原反应生成硝酸铜、气体和水,溶液变为蓝色,故B错误;
C.①④⑤实验对比,④中的红棕色气体可能是由挥发的浓硝酸受热分解产生的,故C正确;
D.五支试管中的红棕色气体均是硝酸生成的,氮元素化合价降低,所以均为还原产物,故D正确;
故选:B。
4.答案:D
解析:移动铜丝,可控制铜丝与浓硫酸的接触面积,从而控制的生成量,故A合理;能使品红溶液褪色,故B合理;有毒,且属于酸性氧化物,可用NaOH溶液吸收,故C合理;浓硫酸过量,试管中剩余浓硫酸,向①中加水易导致浓硫酸喷出试管而发生危险,应将反应后的混合液慢慢加入大量水中,故D不合理。
5.答案:D
解析:A.当铜丝与浓硫酸接触时才能反应,当往上移动铜丝,铜丝与浓硫酸不接触,反应停止,故上下移动①中铜丝可控制生成的量,A项正确;
B.用铜片和浓硫酸反应制取,方程式正确,B项正确;
C.可与碱反应,可用溶液吸收多余的,C项正确;
D.反应停止后,①中浓硫酸过量,有剩余,将水加入①中会造成试管中液体飞溅,发生危险,D项错误;
故选D。
6.答案:B
解析:A.铜与浓硝酸反应生成、硝酸铜和水,故A正确;
B.根据实验Ⅳ可能是生成了亚硝酸铜而变为绿色,因此实验中溶液为绿色不是因为硝酸铜浓度变大,故B错误;
C.向实验绿色溶液中加入蒸馏水可能发生反应二氧化氮和水反应生成硝酸和一氧化氮,其反应方程式为,故C正确;
D.根据实验Ⅳ说明Cu与浓硝酸反应过程中可能产生不稳定亚硝酸铜导致溶液呈绿色,故D正确。
综上所述,答案为B。
7.答案:C
解析:A.步骤Ⅰ在足量中煅烧产生气体的主要成分:,A错误;
B.步骤Ⅱ得溶液C中溶质的主要成分:、和,B错误;
C.已知1个中含有4×3=12个N-Hσ键和4个Cu-N配位键也是σ键,故1mol中含有σ键数目为16,C正确;
D.从流程看,溶液D中阴离子主要为氯离子为得纯净目标产物,溶液D中引入硫酸根,再向滤液中加入乙醇,再过滤、洗涤、干燥,D错误;
故答案为:C。
8.答案:C
解析:A.“浸取”时,在酸性条件下与氧气发生氧化还原反应,反应的离子方程式为:,A错误;
B.加入过量氧化铜调节pH的目的是将铁离子转化为氢氧化铁除去,因此“滤渣①”的成分是和过量的CuO,B错误;
C.“还原”时加入NaCl和浓盐酸主要是为了提供,跟铜元素形成可溶于水的物质,然后经过一系列操作得到CuCl,C正确;
D.由CuCl的晶胞图可知,每个氯离子周围与之距离最近的氯离子数目是12,D错误;
答案选C。
9.答案:D
解析:A.途径①中Cu和、反应生成,Cu与混酸反应的离子反应为,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,要使途径①所得溶液只含3mol,则消耗的物质的量为2mol时,的物质的量为3mol,所用混酸中与物质的量之比最好为3:2,故A正确;
B.①③中生成有毒气体,②中Cu、氧气、硫酸反应生成硫酸铜和水,则途径②更好地体现了绿色化学思想,故B正确;
C.反应②中Cu和氧气、硫酸反应生成硫酸铜和水,化学方程式为:,故C正确;
D.硫酸铜与氢氧化钠生成氢氧化铜沉淀,与Y生成氧化亚铜,知Y可为葡萄糖,葡萄糖与氢氧化铜反应的方程式为:,该过程中Cu元素化合价下降,作为氧化剂,是还原剂,体现还原性,故D错误;
故选D。
10.答案:C
解析:左池为原电池,负极发生氧化反应,甲醇失去电子在碱性条件下生成和,负极反应式为,故A正确;通电一段时间后,不如Cu活泼的Ag、Au杂质金属不能被氧化,沉积在电解槽底部形成阳极泥,故B正确;比Cu活泼的杂质金属Zn优先于Cu被氧化,Zn的相对原子质量比Cu大,转移电子数相同时,若粗铜电极质量减少6.4g,则纯铜电极质量增加小于6.4g,故C错误;电解精炼铜时,粗铜作阳极,纯铜作阴极,故D正确。
11.答案:D
解析:题图1,若电解质溶液呈酸性,则铁钉发生析氢腐蚀,若电解质溶液呈碱性或中性测铁钉发生吸氧腐蚀,A项错误;
题图2,在铁件上镀铜,铜片作阳极,应与电源正极相连,待镀铁件作阴极,应与电源负极相连,B项错误;
题图3,电解精炼铜时,阳极上锌先放电,铜后放电,而阴极上是放电,故电解质溶液中减小,C项错误;
题图4采用外加电流的阴极保护法,将输油管与电源负极相连,输油管作阴极,可以防止腐蚀,D项正确。
12.答案:D
解析:A.以碳棒为电极,电解氯化钠溶液,氯离子在阳极放电生成氯气,氢离子在阴极放电生成氢气和NaOH,故A可以实现;
B.铁上镀铜时,Fe为镀件,Cu为镀层金属,镀件作阴极被保护,则阳极为铜,阴极为铁,故B可以实现;
C.电解精炼粗铜时,粗铜作阳极,纯铜作阴极,电解质溶液为可溶性的铜盐,故C可以实现;
D.若活泼金属铁作阳极,则铁失电子生成,无法得到氧气,故D不能实现;
故选D。
13.答案:C
解析:粗铜的精炼中,粗铜作阳极,纯铜作阴极,所以为纯铜,b为粗铜,A错误;电解时,电解质溶液中的阴离子向阳极移动,所以硫酸根离子向b极移动,B错误;牺牲阳极保护法中,被保护的金属作原电池正极,图Ⅱ中如果a、b间用导线连接,钢闸门作正极,C正确;外加电流阴极保护法中,被保护的钢闸门连接直流电源的负极,所以图Ⅱ中如果a、b间连接直流电源,钢闸门作阴极,但X不一定用锌,D错误。
14.答案: (1)正 ;
(2);
(3)减小
(4)0.4;2.24
解析:甲装置中通入甲烷气体的一极为负极,通入氧气的为正极,装置乙为电解氯化钠溶液的装置,Fe电极为阴极,C电极为阳极,丙装置为电解精炼铜的装置,精铜极为阴极,粗铜极为阳极。
(1)燃料电池中通入氧气的一极为正极,丙装置中精铜电极为阴极,电极反应式为
(2)乙装置为电解饱和食盐水,阴极上氢离子得电子,生成氢气和氢氧根离子,阳极上氯离子失电子,生成氯气,总离子方程式为。阳极产物为氯气。
(3)如果粗铜中含有锌、银等杂质,丙装置中阳极上Zn、Cu失电子生成相应的金属离子,而Ag成为阳极泥,电极反应式为,。反应一段时间,溶液中有一部分硫酸铜被硫酸锌所代替,从而使硫酸铜溶液浓度将减小。
(4)丙装置中精铜电极的质量增加了6.4g,说明转移电子0.2mol,则甲装置中消耗的为0.025mol,质量为0.4g。乙装置中铁极上生成的氢气为0.2mol,在标准状况下体积为2.24L。
15.答案:(1) 氯水和KSCN溶液(或双氧水和KSCN溶液等,合理即可)
(2) ac
(3)灼烧,冷却至室温后称重,重复多次 坩埚
(4)
(5)[或
解析:(1)溶于酸反应生成铜和铜盐,铜和铁离子反应生成亚铁离子和铜离子,所以滤液A中含亚铁离子,检验亚铁离子的方法为先加KSCN溶液,若不变色,再加氯水,变红色,说明含有亚铁离子。
(2)金属A1与氧化铁、氧化铜发生置换反应生成金属单质,该反应的化学方程式为,其中用于焊接钢轨的反应为,进行铝热反应还需要氯酸钾和镁条来引发该反应。
(3)为使固体完全分解,应反复灼烧,多次称量,灼烧应在坩埚中进行。
(4)向固体混合物B中加足量的NaOH溶液,二氧化硅与之反应生成硅酸钠和水。
(5)生成的绿色不溶于水的盐(不含结晶水)为铜绿,化学式为。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.按如图所示装置进行实验,探究硫酸铜的分解产物。实验后反应管中残留固体为红色粉末(经检测为Cu2O)。下列说法错误的是( )
A.加热前需打开K1和K2,缓缓通入一段时间N2
B.A的作用是吸收尾气,防止污染空气
C.可将BaCl2溶液换成Ba(NO3)2溶液
D.若品红溶液不褪色,硫酸铜分解的化学方程式为4CuSO42Cu2O+4SO3↑+O2↑
2.38.4Cu与一定量浓硝酸恰好完全反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到和的混合溶液,反应过程及有关数据如图所示
下列有关判断不正确的是( )
A.硝酸在反应中既体现氧化性又体现酸性
B.氮的氧化物和NaOH溶液反应时,NO作还原剂
C.混合气体中的物质的量是0.1mol,生成
D.若浓硝酸体积为200mL,则其物质的量浓度为11mol/L
3.为了探究浓硝酸的性质,进行以下五组实验,均观察到红棕色气体。下列分析错误的是( )
A.将带火星的木条靠近①的试管口,木条复燃,说明能支持燃烧
B.②中的铁片钝化,红棕色气体由浓硝酸分解产生,③中溶液变为绿色
C.①④⑤实验对比,④中的红棕色气体可能是由挥发的浓硝酸受热分解产生的
D.五支试管中的红棕色气体均为还原产物
4.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )
A.上下移动①中铜丝可控制生成的量
B.②中选用品红溶液验证的生成
C.③中选用NaOH溶液吸收多余的
D.为确认有生成,向①中加水,观察颜色
5.用如图所示实验装置(夹持仪器已略去)探究铜丝与过量的浓硫酸反应。下列说法错误的是( )
A.上下移动①中铜丝可控制生成的量
B.①中发生反应的化学方程式为
C.③中选用溶液吸收多余的
D.为确认生成,向①中加水,观察颜色
6.学习小组设计如下实验探究Cu与浓硝酸反应混合液呈绿色的原因。
实验Ⅰ:向浓硝酸中加入铜粉,产生红棕色气体,溶液变为绿色,将溶液分成两份于两支小试管中。
实验Ⅱ:向其中一支小试管中加入铜粉,振荡,充分反应,溶液变为蓝色。
实验Ⅲ:将另一支小试管稍微加热,放出红棕色气体,溶液变为蓝色。
实验Ⅳ:取2g硫酸铜溶于蒸馏水中,溶液为蓝色,继续加入无色的亚硝酸钠溶液,混合后溶液变为绿色。
下列说法错误的是( )
A.铜与浓硝酸反应生成
B.实验中溶液为绿色是因为硝酸铜浓度变大
C.向实验绿色溶液中加入蒸馏水可能发生反应
D.Cu与浓硝酸反应过程中可能产生不稳定的亚硝酸铜导致溶液呈绿色
7.辉铜矿[,含杂质]合成目标产物的流程如下。下列说法正确的是( )
A.步骤Ⅰ在足量中煅烧产生气体的主要成分:
B.步骤Ⅱ得溶液C中溶质的主要成分:和
C.1mol中含有σ键数目为16
D.为得纯净目标产物,步骤Ⅳ的实验操作步骤依次:加热蒸发、冷却结晶、抽滤洗涤。
8.CuCl可用作有机合成的催化剂。工业上用黄铜矿(主要成分是,还含有少量)制备CuCl的工艺流程如图1:
下列说法正确的是( )
A.“浸取”时的离子方程式为
B.“滤渣①”的成分是
C.“还原”时加入NaCl和浓盐酸主要是为了提供,跟铜元素形成可溶于水的物质
D.CuCl的晶胞如图2,每个氯离子周围与之距离最近的氯离子数目是4
9.是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
A.途径①与物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.反应②的方程式为:
D.后面途径转化中,加入的Y物质体现了其氧化性
10.某粗铜产品中含有Zn、Ag、Au等杂质,如图所示,用碱性燃料电池电解硫酸铜溶液,闭合开关S进行电解。下列说法中不正确的是( )
A.左池负极反应式为
B.通电一段时间后,Ag、Au杂质金属沉积在电解槽底部
C.若粗铜电极质量减少6.4g,则纯铜电极增重大于6.4g
D.电解过程中右池纯铜和粗铜分别为阴极和阳极
11.下列有关电化学在生产、生活中的应用分析正确的是( )
A.图1:铁钉发生析氢腐蚀
B.图2:可以在铁件上镀铜
C.图3:溶液中保持不变
D.图4:将输油管与电源负极相连可以防止腐蚀
12.如图为电解装置示意图。下列电解目的不能实现的是( )
选项 电极材料 电解质溶液 电解目的
A a.碳棒,b.碳棒 饱和食盐水 制取、NaOH和
B a.铜,b.铁 溶液 铁上镀铜
C a.粗铜,b.精铜 溶液 电解精炼铜
D a.铁,b.碳棒 稀溶液 制取少量和
注:表中的粗铜含有锌、铁、镍、金、铂等杂质。
A.A B.B C.C D.D
13.图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法正确的是( )
A.图Ⅰ中b为纯铜,电解过程中质量减轻,发生的反应为
B.图Ⅰ中向a极移动,但不放电
C.图Ⅱ中如果a、b间用导线连接时,钢闸门作正极
D.图Ⅱ中如果a、b间连接直流电源利用外加电流阴极保护法保护钢闸门时,则X必须用锌
二、实验题
14.某兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜的精炼原理,如图所示,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
(1)甲装置中通入氧气的电极是____极(填“正”或“负”),丙装置中精铜电极发生的电极反应式为___________________。
(2)乙装置中电解的总反应的离子方程式为__________________,阳极产物为____________________。
(3)如果粗铜中含有锌、银等杂质,反应一段时间后,丙装置中硫酸铜溶液浓度将_______(填“增大”、“减小”或“不变”)。
(4)丙装置中精铜电极的质量增加了6.4g,则甲装置中消耗的的质量为_______g,乙装置中铁电极上生成的气体在标准状况下体积为_______L。
15.某铜矿石的主要成分是,还含有少量的和某工厂利用此矿石炼制精铜的工艺流程如下所示(已知:)
(1)滤液A中铁元素的存在形式为 (填离子符号),生成该离子的离子方程式为 。检验滤液A中存在该离子的试剂为 (填试剂名称)
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为 ,
在实验室中完成此实验还需要的试剂是 。
a.
b. KCI
c. Mg
d.
(3)为使固体混合物D在空气中灼烧完全分解,应 ,直至连续两次测定的实验结果相同(或质量相差小于0.1 g);灼烧时必须用到的实验仪器是 。
(4)溶液G与固体混合物B反应的离子方程式为 。
(5)将溶液滴入一定量的溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是 。
参考答案
1.答案:C
解析:加热前打开K1、K2,缓缓通入一段时间N2,目的是将装置内的空气赶出,防止空气对分解产物产生干扰,A项正确;硫酸铜分解时有硫氧化物生成,故A的作用是吸收尾气,以防止污染空气,B项正确;BaCl2溶液的作用是检验SO3,品红溶液的作用是检验SO2,Ba(NO3)2溶液能与SO2反应,生成BaSO4和NO,对SO3的检验有干扰,且此时品红溶液无法检验SO2,故不能将BaCl2溶液换成Ba(NO3)2溶液,C项错误;若品红溶液不褪色,说明CuSO4分解过程中无SO2生成,则CuSO4分解的生成物中有Cu2O、SO3,由于铜元素化合价降低,则氧元素化合价升高,生成物中还有O2,配平化学方程式为4CuSO42Cu2O+4SO3↑+O2↑,B项正确。
2.答案:C
解析:A.铜和硝酸反应生成硝酸铜和氮的化合物,硝酸部分被还原,作氧化剂,有部分生成盐,表现出酸性,故A正确;
B.氮的氧化物和NaOH溶液反应时,NO转化为高价态氮,故作还原剂,故B正确;
D.由分析可知,若浓硝酸体积为200mL,则其物质的量浓度为11mol/L,D正确;
故选C。
3.答案:B
解析:A.①该溶液中只有浓硝酸,插入灼热的玻璃棒后产生红棕色气体,说明受热条件下浓硝酸分解生成气体,将带火星的木条靠近①的试管口,木条复燃,说明能支持燃烧,故A正确;
B.②灼热的铁片加入浓硝酸后,发生氧化还原反应生成气体,而在常温下才钝化,③灼热的铜片加入浓硝酸后,发生氧化还原反应生成硝酸铜、气体和水,溶液变为蓝色,故B错误;
C.①④⑤实验对比,④中的红棕色气体可能是由挥发的浓硝酸受热分解产生的,故C正确;
D.五支试管中的红棕色气体均是硝酸生成的,氮元素化合价降低,所以均为还原产物,故D正确;
故选:B。
4.答案:D
解析:移动铜丝,可控制铜丝与浓硫酸的接触面积,从而控制的生成量,故A合理;能使品红溶液褪色,故B合理;有毒,且属于酸性氧化物,可用NaOH溶液吸收,故C合理;浓硫酸过量,试管中剩余浓硫酸,向①中加水易导致浓硫酸喷出试管而发生危险,应将反应后的混合液慢慢加入大量水中,故D不合理。
5.答案:D
解析:A.当铜丝与浓硫酸接触时才能反应,当往上移动铜丝,铜丝与浓硫酸不接触,反应停止,故上下移动①中铜丝可控制生成的量,A项正确;
B.用铜片和浓硫酸反应制取,方程式正确,B项正确;
C.可与碱反应,可用溶液吸收多余的,C项正确;
D.反应停止后,①中浓硫酸过量,有剩余,将水加入①中会造成试管中液体飞溅,发生危险,D项错误;
故选D。
6.答案:B
解析:A.铜与浓硝酸反应生成、硝酸铜和水,故A正确;
B.根据实验Ⅳ可能是生成了亚硝酸铜而变为绿色,因此实验中溶液为绿色不是因为硝酸铜浓度变大,故B错误;
C.向实验绿色溶液中加入蒸馏水可能发生反应二氧化氮和水反应生成硝酸和一氧化氮,其反应方程式为,故C正确;
D.根据实验Ⅳ说明Cu与浓硝酸反应过程中可能产生不稳定亚硝酸铜导致溶液呈绿色,故D正确。
综上所述,答案为B。
7.答案:C
解析:A.步骤Ⅰ在足量中煅烧产生气体的主要成分:,A错误;
B.步骤Ⅱ得溶液C中溶质的主要成分:、和,B错误;
C.已知1个中含有4×3=12个N-Hσ键和4个Cu-N配位键也是σ键,故1mol中含有σ键数目为16,C正确;
D.从流程看,溶液D中阴离子主要为氯离子为得纯净目标产物,溶液D中引入硫酸根,再向滤液中加入乙醇,再过滤、洗涤、干燥,D错误;
故答案为:C。
8.答案:C
解析:A.“浸取”时,在酸性条件下与氧气发生氧化还原反应,反应的离子方程式为:,A错误;
B.加入过量氧化铜调节pH的目的是将铁离子转化为氢氧化铁除去,因此“滤渣①”的成分是和过量的CuO,B错误;
C.“还原”时加入NaCl和浓盐酸主要是为了提供,跟铜元素形成可溶于水的物质,然后经过一系列操作得到CuCl,C正确;
D.由CuCl的晶胞图可知,每个氯离子周围与之距离最近的氯离子数目是12,D错误;
答案选C。
9.答案:D
解析:A.途径①中Cu和、反应生成,Cu与混酸反应的离子反应为,硝酸根离子由硝酸提供,氢离子由硝酸和硫酸提供,要使途径①所得溶液只含3mol,则消耗的物质的量为2mol时,的物质的量为3mol,所用混酸中与物质的量之比最好为3:2,故A正确;
B.①③中生成有毒气体,②中Cu、氧气、硫酸反应生成硫酸铜和水,则途径②更好地体现了绿色化学思想,故B正确;
C.反应②中Cu和氧气、硫酸反应生成硫酸铜和水,化学方程式为:,故C正确;
D.硫酸铜与氢氧化钠生成氢氧化铜沉淀,与Y生成氧化亚铜,知Y可为葡萄糖,葡萄糖与氢氧化铜反应的方程式为:,该过程中Cu元素化合价下降,作为氧化剂,是还原剂,体现还原性,故D错误;
故选D。
10.答案:C
解析:左池为原电池,负极发生氧化反应,甲醇失去电子在碱性条件下生成和,负极反应式为,故A正确;通电一段时间后,不如Cu活泼的Ag、Au杂质金属不能被氧化,沉积在电解槽底部形成阳极泥,故B正确;比Cu活泼的杂质金属Zn优先于Cu被氧化,Zn的相对原子质量比Cu大,转移电子数相同时,若粗铜电极质量减少6.4g,则纯铜电极质量增加小于6.4g,故C错误;电解精炼铜时,粗铜作阳极,纯铜作阴极,故D正确。
11.答案:D
解析:题图1,若电解质溶液呈酸性,则铁钉发生析氢腐蚀,若电解质溶液呈碱性或中性测铁钉发生吸氧腐蚀,A项错误;
题图2,在铁件上镀铜,铜片作阳极,应与电源正极相连,待镀铁件作阴极,应与电源负极相连,B项错误;
题图3,电解精炼铜时,阳极上锌先放电,铜后放电,而阴极上是放电,故电解质溶液中减小,C项错误;
题图4采用外加电流的阴极保护法,将输油管与电源负极相连,输油管作阴极,可以防止腐蚀,D项正确。
12.答案:D
解析:A.以碳棒为电极,电解氯化钠溶液,氯离子在阳极放电生成氯气,氢离子在阴极放电生成氢气和NaOH,故A可以实现;
B.铁上镀铜时,Fe为镀件,Cu为镀层金属,镀件作阴极被保护,则阳极为铜,阴极为铁,故B可以实现;
C.电解精炼粗铜时,粗铜作阳极,纯铜作阴极,电解质溶液为可溶性的铜盐,故C可以实现;
D.若活泼金属铁作阳极,则铁失电子生成,无法得到氧气,故D不能实现;
故选D。
13.答案:C
解析:粗铜的精炼中,粗铜作阳极,纯铜作阴极,所以为纯铜,b为粗铜,A错误;电解时,电解质溶液中的阴离子向阳极移动,所以硫酸根离子向b极移动,B错误;牺牲阳极保护法中,被保护的金属作原电池正极,图Ⅱ中如果a、b间用导线连接,钢闸门作正极,C正确;外加电流阴极保护法中,被保护的钢闸门连接直流电源的负极,所以图Ⅱ中如果a、b间连接直流电源,钢闸门作阴极,但X不一定用锌,D错误。
14.答案: (1)正 ;
(2);
(3)减小
(4)0.4;2.24
解析:甲装置中通入甲烷气体的一极为负极,通入氧气的为正极,装置乙为电解氯化钠溶液的装置,Fe电极为阴极,C电极为阳极,丙装置为电解精炼铜的装置,精铜极为阴极,粗铜极为阳极。
(1)燃料电池中通入氧气的一极为正极,丙装置中精铜电极为阴极,电极反应式为
(2)乙装置为电解饱和食盐水,阴极上氢离子得电子,生成氢气和氢氧根离子,阳极上氯离子失电子,生成氯气,总离子方程式为。阳极产物为氯气。
(3)如果粗铜中含有锌、银等杂质,丙装置中阳极上Zn、Cu失电子生成相应的金属离子,而Ag成为阳极泥,电极反应式为,。反应一段时间,溶液中有一部分硫酸铜被硫酸锌所代替,从而使硫酸铜溶液浓度将减小。
(4)丙装置中精铜电极的质量增加了6.4g,说明转移电子0.2mol,则甲装置中消耗的为0.025mol,质量为0.4g。乙装置中铁极上生成的氢气为0.2mol,在标准状况下体积为2.24L。
15.答案:(1) 氯水和KSCN溶液(或双氧水和KSCN溶液等,合理即可)
(2) ac
(3)灼烧,冷却至室温后称重,重复多次 坩埚
(4)
(5)[或
解析:(1)溶于酸反应生成铜和铜盐,铜和铁离子反应生成亚铁离子和铜离子,所以滤液A中含亚铁离子,检验亚铁离子的方法为先加KSCN溶液,若不变色,再加氯水,变红色,说明含有亚铁离子。
(2)金属A1与氧化铁、氧化铜发生置换反应生成金属单质,该反应的化学方程式为,其中用于焊接钢轨的反应为,进行铝热反应还需要氯酸钾和镁条来引发该反应。
(3)为使固体完全分解,应反复灼烧,多次称量,灼烧应在坩埚中进行。
(4)向固体混合物B中加足量的NaOH溶液,二氧化硅与之反应生成硅酸钠和水。
(5)生成的绿色不溶于水的盐(不含结晶水)为铜绿,化学式为。
同课章节目录
