2.3分子结构与物质的性质课时4课件 (共20张PPT)人教版(2019)选择性必修2
文档属性
| 名称 | 2.3分子结构与物质的性质课时4课件 (共20张PPT)人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-06 00:00:00 | ||
图片预览






文档简介
(共20张PPT)
第二章 分子结构与性质
第三节 分子结构与
物质的性质
课时4
分子间作用力 范德华力 氢键
存在范围 作用力强弱 对物质性质 的影响
分子之间
比化学键键能小1~2个数量级
主要影响物理性质(熔沸点)
X—H...Y—
(X、Y为N O F)
大大提升物质熔沸点
复习回顾
B
P65
1.
3.溶解性
(1)温度(一般T↑,S↑)
压强(P↑,气体S↑)
(2)分子结构角度:相似相溶
“相似相溶”规律
①分子的极性
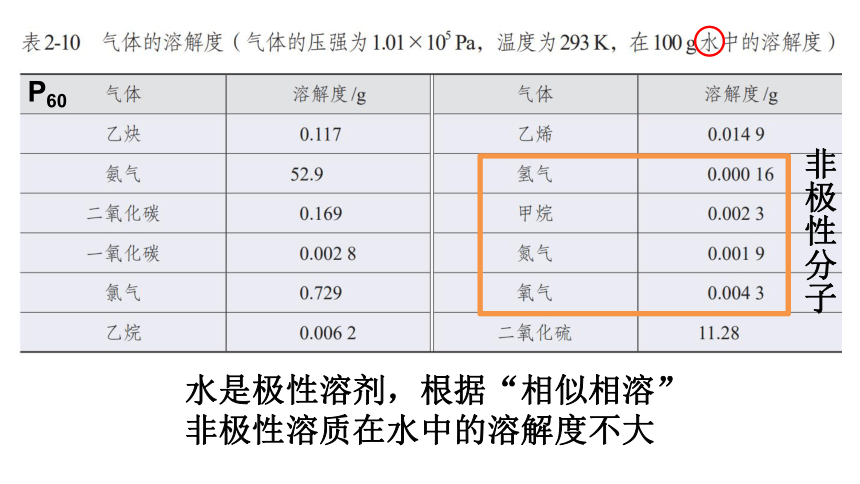
P59非极性溶质一般能溶于非极性溶剂(CCl4等),
极性溶质一般能溶于极性溶剂(水、乙醇等);
②分子结构的相似性
(如CH3CH2OH在H2O中的溶解度比CH3(CH2)4OH大)
水是极性溶剂,根据“相似相溶”
非极性溶质在水中的溶解度不大
非极性分子
P60
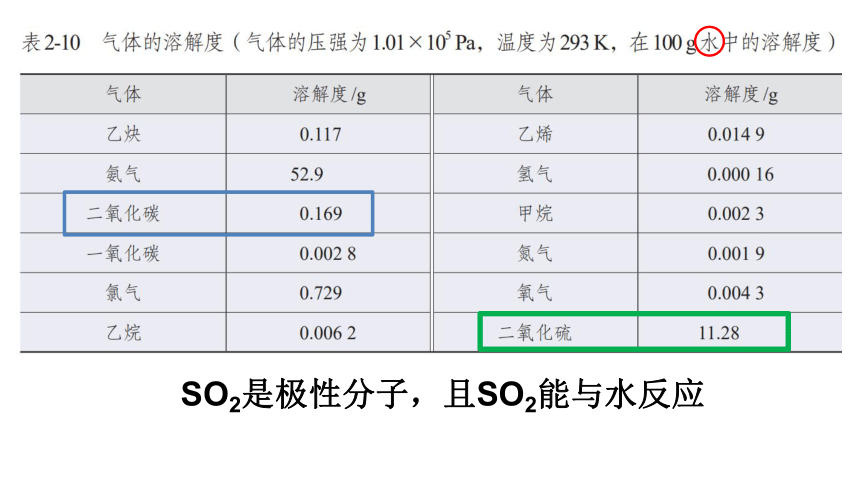
异常数据: CO2、Cl2,是非极性分子
但在水中具有较好的溶解度。
化学反应: 如果溶质与水发生化学反应,可增大溶解度
SO2是极性分子,且SO2能与水反应
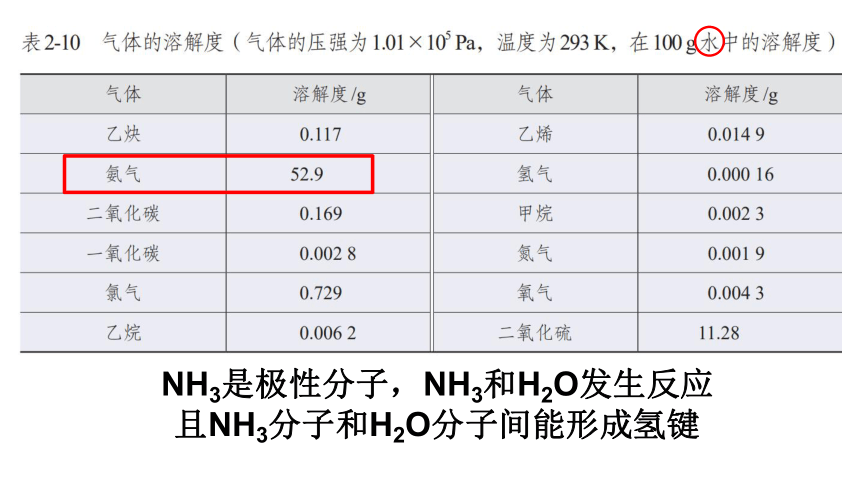
NH3是极性分子,NH3和H2O发生反应
且NH3分子和H2O分子间能形成氢键
3.溶解性的影响因素
(1)温度、压强
(2)相似相溶
①分子的极性 ②分子的结构
(3)发生化学反应
(4)形成氢键
(P59溶剂与溶质之间的氢键作用力越大,溶解性越好)
【思考与讨论】P59(3)
利用物质的溶解性的影响因素解释实验现象
碘水
上层:水
下层:碘的CCl4溶液(紫红色)
萃取
CCl4
浓KI溶液
P62
B
D
认识手性分子
下列两分子能否平移、旋转等方式实现叠合?
三、分子的手性
1.P60具有完全相同的组成和原子排列的一对分子,互为镜面,
却在三维空间里不能叠合,互称手性异构体(或对映异构体)。
有手性异构体的分子叫做手性分子。
2.手性分子形成条件:
同一个碳原子上连有四个不同的原子/基团
Cl
F
Cl
F
H
H
3.意义:在生命科学和药物生产方面有广泛的应用。
4.手性合成:只得到或主要得到一种手性分子的合成方法。
(主要利用手性催化剂)
三、分子的手性
C
B
7
P63
(1)分子的空间结构决定,水分子是V形,二氧化碳分子是直线形
(2)结构相似,范德华力↑,熔沸点↑
(3)随着烃基的增长,醇类结构与水分子结构差距越大,溶解度越小
(4)因为NH3能形成氢键
第二章 分子结构与性质
第三节 分子结构与
物质的性质
课时4
分子间作用力 范德华力 氢键
存在范围 作用力强弱 对物质性质 的影响
分子之间
比化学键键能小1~2个数量级
主要影响物理性质(熔沸点)
X—H...Y—
(X、Y为N O F)
大大提升物质熔沸点
复习回顾
B
P65
1.
3.溶解性
(1)温度(一般T↑,S↑)
压强(P↑,气体S↑)
(2)分子结构角度:相似相溶
“相似相溶”规律
①分子的极性
P59非极性溶质一般能溶于非极性溶剂(CCl4等),
极性溶质一般能溶于极性溶剂(水、乙醇等);
②分子结构的相似性
(如CH3CH2OH在H2O中的溶解度比CH3(CH2)4OH大)
水是极性溶剂,根据“相似相溶”
非极性溶质在水中的溶解度不大
非极性分子
P60
异常数据: CO2、Cl2,是非极性分子
但在水中具有较好的溶解度。
化学反应: 如果溶质与水发生化学反应,可增大溶解度
SO2是极性分子,且SO2能与水反应
NH3是极性分子,NH3和H2O发生反应
且NH3分子和H2O分子间能形成氢键
3.溶解性的影响因素
(1)温度、压强
(2)相似相溶
①分子的极性 ②分子的结构
(3)发生化学反应
(4)形成氢键
(P59溶剂与溶质之间的氢键作用力越大,溶解性越好)
【思考与讨论】P59(3)
利用物质的溶解性的影响因素解释实验现象
碘水
上层:水
下层:碘的CCl4溶液(紫红色)
萃取
CCl4
浓KI溶液
P62
B
D
认识手性分子
下列两分子能否平移、旋转等方式实现叠合?
三、分子的手性
1.P60具有完全相同的组成和原子排列的一对分子,互为镜面,
却在三维空间里不能叠合,互称手性异构体(或对映异构体)。
有手性异构体的分子叫做手性分子。
2.手性分子形成条件:
同一个碳原子上连有四个不同的原子/基团
Cl
F
Cl
F
H
H
3.意义:在生命科学和药物生产方面有广泛的应用。
4.手性合成:只得到或主要得到一种手性分子的合成方法。
(主要利用手性催化剂)
三、分子的手性
C
B
7
P63
(1)分子的空间结构决定,水分子是V形,二氧化碳分子是直线形
(2)结构相似,范德华力↑,熔沸点↑
(3)随着烃基的增长,醇类结构与水分子结构差距越大,溶解度越小
(4)因为NH3能形成氢键
