1.1反应热的测量与计算第3课时学案(含答案)2023-2024学年高二化学苏教版(2019)选择性必修第一册
文档属性
| 名称 | 1.1反应热的测量与计算第3课时学案(含答案)2023-2024学年高二化学苏教版(2019)选择性必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 150.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-07 00:00:00 | ||
图片预览



文档简介
1.1 第3课时 反应热的测量与计算
【学习目标】
1.通过实验了解定量测定反应热的基本原理和实验方法,能正确分析误差产生的原因并能采取适当措施减小误差,培养科学探究能力。
2.通过交流讨论理解盖斯定律的本质,能用盖斯定律进行有关焓变的简单计算,构建运用盖斯定律进行相关判断或计算的思维模型。
【合作探究】
任务1 了解中和反应反应热的测定
【新知生成】
1.测定仪器: 。
2.测定数据:盐酸、NaOH溶液的温度,反应后体系的 。
3.计算公式: 。
4.实验过程
(1)实验测量
按下列操作步骤测定盐酸与氢氧化钠溶液反应的反应热。
①用量筒量取50mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计(如图)的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
②用另一量筒量取50mL 0.50 mol·L-1 NaOH溶液,用温度计测量并记录NaOH溶液的温度。
③打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用环形玻璃搅拌棒匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)。
④重复上述步骤两次。
在上述过程中,提高测定反应热准确度的措施有 。
(2)数据处理
[取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)]
①为记录本实验的实验数据,请设计实验记录表。
②量热计直接测得的数据是 ,计算反应放出的热量的公式为 。
③计算反应热。(为了计算简便,近似地认为实验所用酸、碱溶液的密度与水相同,都是1g·mL-1,中和后生成的溶液的热容与液态水相同,为4.18J·g-1·℃-1)
④若上述实验测得t2-t1=3.4℃,则ΔH= (精确至0.01)kJ·mol-1。
(3)误差分析
在下表空格内填“偏大”、“偏小”或“不变”。
引起误差的原因 中和反应ΔH
保温措施不好
将环形玻璃搅拌棒改成铜棒
搅拌不充分
量取NaOH溶液和盐酸时,均仰视刻度线
用同浓度的氨水代替NaOH溶液
用同浓度的CH3COOH溶液代替盐酸
最后记录的温度不是最高温度
【答案】1.简易量热计 2.最高温度 3.ΔH=- 4.(1)用了保温效果较好的量热计;温度计使用后及时冲洗;用环形玻璃搅拌棒匀速搅拌;操作动作迅速;多次测量取平均值
(2)①
实验 次数 反应物的温度/℃ 反应前体 系的温度 反应后体 系的温度 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ (t2-t1)/℃
1
2
3
②体系温度的变化 Q=cmΔt(Q:反应放出的热量,m:反应混合液的总质量,c:反应混合液的比热容,Δt:反应前后溶液温度的变化量)
③50mL 0.50 mol·L-1盐酸的质量m1=50g,50mL 0.50 mol·L-1 NaOH溶液的质量m2=50g。中和后生成的溶液的热容c=4.18J·g-1·℃-1,则放出的热量为(m1+m2)·c·(t2-t1)=0.418(t2-t1)kJ,生成1 mol H2O时的反应热ΔH=-kJ·mol-1
④-56.85 (3)偏大 偏大 偏大 偏小 偏大 偏大
偏大
【核心突破】
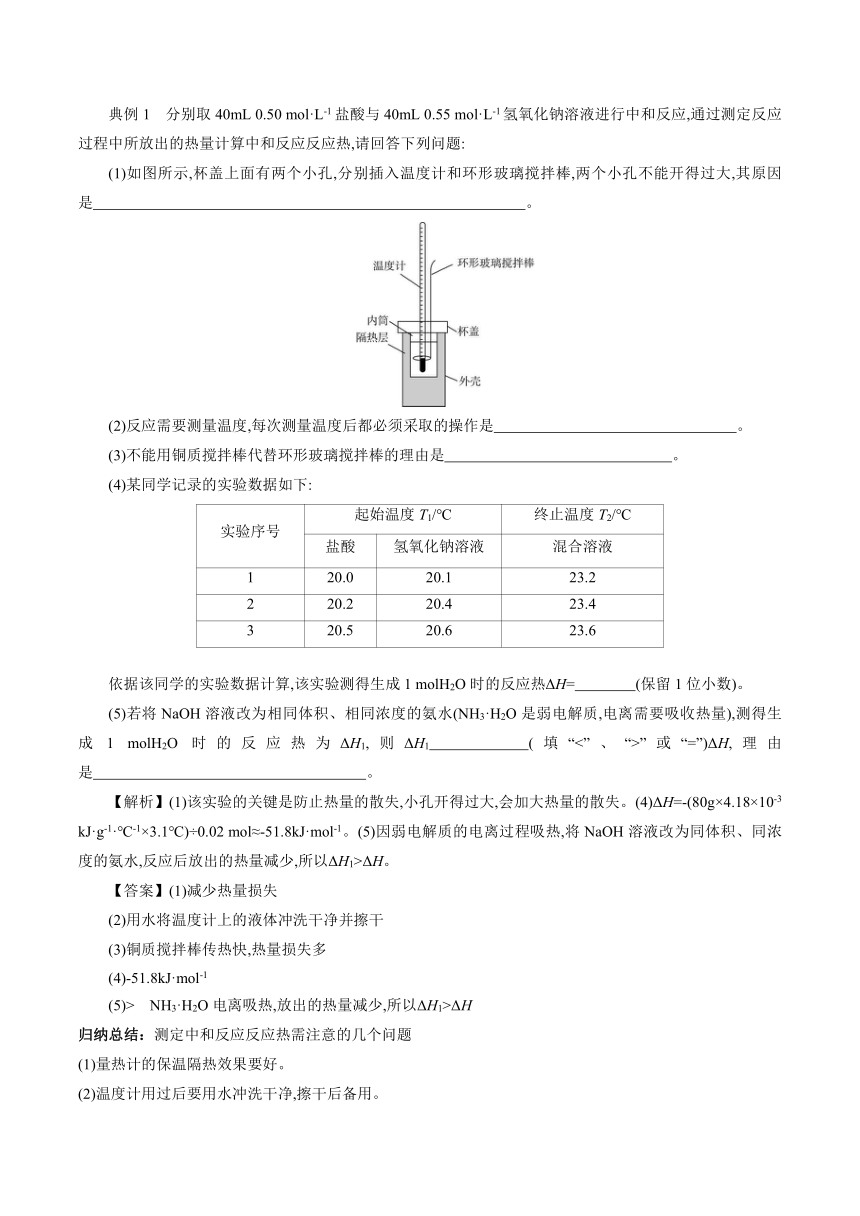
典例1 分别取40mL 0.50 mol·L-1盐酸与40mL 0.55 mol·L-1氢氧化钠溶液进行中和反应,通过测定反应过程中所放出的热量计算中和反应反应热,请回答下列问题:
(1)如图所示,杯盖上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是 。
(2)反应需要测量温度,每次测量温度后都必须采取的操作是 。
(3)不能用铜质搅拌棒代替环形玻璃搅拌棒的理由是 。
(4)某同学记录的实验数据如下:
实验序号 起始温度T1/℃ 终止温度T2/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.5 20.6 23.6
依据该同学的实验数据计算,该实验测得生成1 molH2O时的反应热ΔH= (保留1位小数)。
(5)若将NaOH溶液改为相同体积、相同浓度的氨水(NH3·H2O是弱电解质,电离需要吸收热量),测得生成1 molH2O时的反应热为ΔH1,则ΔH1 (填“<”、“>”或“=”)ΔH,理由是 。
【解析】(1)该实验的关键是防止热量的散失,小孔开得过大,会加大热量的散失。(4)ΔH=-(80g×4.18×10-3 kJ·g-1·℃-1×3.1℃)÷0.02 mol≈-51.8kJ·mol-1。(5)因弱电解质的电离过程吸热,将NaOH溶液改为同体积、同浓度的氨水,反应后放出的热量减少,所以ΔH1>ΔH。
【答案】(1)减少热量损失
(2)用水将温度计上的液体冲洗干净并擦干
(3)铜质搅拌棒传热快,热量损失多
(4)-51.8kJ·mol-1
(5)> NH3·H2O电离吸热,放出的热量减少,所以ΔH1>ΔH
归纳总结:测定中和反应反应热需注意的几个问题
(1)量热计的保温隔热效果要好。
(2)温度计用过后要用水冲洗干净,擦干后备用。
(3)实验中要用酸、碱的稀溶液。
(4)碱液(或酸液)稍过量,以确保酸(或碱)完全反应。
(5)读取的中和反应后的温度(t2)是反应混合液的最高温度。
(6)实验操作过程中动作要迅速,尽量减少热量损失。
训练1 下列有关中和反应反应热的测定说法正确的是( )
A.图中仪器a为温度计,仪器b为玻璃棒
B.为了确保测量结果的精准,溶液中HCl和NaOH的物质的量必须相等
C.所用酸和碱浓度不宜太高,否则混合过程被稀释并伴随反应外的热量变化
D.实验过程中两溶液要快速混合,记录混合瞬间的温度计读数作为反应前温度
【解析】A项,图中仪器a为温度计,用来测量反应体系最高温度,仪器b为环形玻璃搅拌棒,用来搅拌,使溶液充分反应,错误;B项,为了保证HCl完全反应,通常加稍过量的NaOH溶液,错误;C项,浓的酸和碱混合时因互相稀释而放热,影响实验结果,故所用酸和碱浓度不宜太高,正确;D项,实验过程中两溶液要快速混合,尽量减少热量散失,观察温度计变化,记录反应体系的最高温度,反应前温度应在混合前分别测量,错误。
【答案】C
训练2 在测定中和反应反应热的实验中,下列说法正确的是(弱酸电离时吸热)( )
A.使用环形玻璃搅拌器是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与内筒底部接触
C.用0.50 mol·L-1的NaOH溶液分别与0.50 mol·L-1的盐酸、醋酸溶液反应,若所取的溶液体积相等,则测得的中和反应反应热的绝对值相同
D.在测定中和反应反应热的实验中,应将NaOH溶液缓缓倒入装有盐酸的内筒中
【解析】反应速率越慢,达到完全反应用时越长,热量散失越多,所以使用环形玻璃搅拌器是为了加快反应速率,可以减小实验误差,A项正确;温度计水银球应浸入溶液中,但不能与内筒底部接触,否则会造成测定的中和热数值不准确,B项错误;盐酸是强酸,醋酸是弱酸,反应过程中醋酸还会继续电离,吸收热量,会使测定的中和热数值不同,C项错误;在测定中和反应反应热的实验中,NaOH溶液应迅速倒入装有盐酸的内筒中,减小热量散失,减小实验误差,D项错误。
【答案】A
任务2 盖斯定律及其应用
【学习情境】
某人从山下A点到达山顶B点,无论是翻山越岭攀登而上,还是坐缆车直奔山顶,山的高度(图中的h)总是不变的,即此人势能的变化只与起点A和终点B的海拔差有关,而与由A点到B点的途径无关。一个化学反应也是如此,不论是一步完成的还是分几步完成的,其反应热是相同的,这就是盖斯定律。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
【新知生成】
1.内容:一个化学反应,不管是 完成的,还是 完成的,其反应热是 的。
2.意义:对于进行得很慢的反应、不容易直接进行的反应、有副反应发生的反应,测定其反应热有困难,如果利用 ,就可以间接地把它们的反应热计算出来。
3.应用
(1)若某个化学反应的ΔH=+akJ·mol-1,则其逆反应的ΔH= kJ·mol-1。
(2)若某个化学反应的化学方程式可由另外几个反应的化学方程式相加减而得到,则该反应的反应热也可以由这几个反应的反应热 而得到。
【答案】1.一步 分几步 相同 2.盖斯定律
3.(1)-a (2)相加减
【核心突破】
典例2 根据已知信息,按要求写出指定反应的热化学方程式。
(1)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)2Li2O(s) ΔH=-1196 kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式: 。
(2)工业上制取硝酸铵的流程图如下所示:
NH3NONO2HNO3NH4NO3
已知:4NO(g)+4NH3(g)+O2(g)4N2(g)+6H2O(g) ΔH=-1745.2 kJ·mol-1;
6NO(g)+4NH3(g)5N2(g)+6H2O(g) ΔH=-1925.2 kJ·mol-1。
则反应Ⅰ的热化学方程式可表示为 。
【解析】(1)2LiH(s)2Li(s)+H2(g) ΔH=+182 kJ·mol-1
2Li(s)+O2(g)Li2O(s) ΔH=-598 kJ·mol-1
H2(g)+O2(g)H2O(l) ΔH=-286 kJ·mol-1
将上述三式相加得:2LiH(s)+O2(g)Li2O(s)+H2O(l) ΔH=-702 kJ·mol-1。
(2)将已知的两个热化学方程式从上到下依次标记为①和②,根据盖斯定律可知①×5-②×4得4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1025.2 kJ·mol-1。
【答案】(1)2LiH(s)+O2(g)Li2O(s)+H2O(l) ΔH=-702 kJ·mol-1
(2)4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1025.2 kJ·mol-1
归纳总结:利用盖斯定律计算反应热的方法
(1)加合法:运用所给热化学方程式通过加减等方法得到所求的热化学方程式。
“加合法”计算反应热的注意事项:
①热化学方程式同乘以或除以某一个数时,反应热数值也必须乘以或除以该数。
②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。
③对于同一热化学方程式来说,正反应和逆反应,ΔH的数值相等,符号相反。
④热化学方程式中的反应热指反应按所给形式完全进行时的反应热。
(2)虚拟路径法
若反应物A转化为生成物D,可以有两种途径:
①由A直接变成D,反应热为ΔH。
②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:
则有ΔH=ΔH1+ΔH2+ΔH3。
训练3 含氮化合物与生产、生活和环境息息相关。NO加速臭氧层破坏,其反应过程如图所示。
已知:O3(g)+O(g)2O2(g) ΔH=-391.9kJ·mol-1
反应1:O3(g)+NO(g)NO2(g)+O2(g) ΔH1=-199.5kJ·mol-1
则反应2的热化学方程式为 。
【答案】NO2(g)+O(g)NO(g)+O2(g) ΔH=-192.4 kJ·mol-1
训练4 根据下列条件计算有关反应的焓变:
(1)已知:Ti(s)+2Cl2(g)TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知:2H2(g)+O2(g)2H2O(g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)2NO(g) ΔH=-180.5 kJ·mol-1
则反应6NO(g)+4NH3(g)5N2(g)+6H2O(g)的ΔH= 。
(3)已知下列反应反应热的数值:
反应序号 化学反应 反应热
① Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) ΔH1=-24.8 kJ·mol-1
② 3Fe2O3(s)+CO(g)2Fe3O4(s)+CO2(g) ΔH2=-47.2 kJ·mol-1
③ Fe3O4(s)+CO(g)3FeO(s)+CO2 (g) ΔH3=-19.4 kJ·mol-1
④ FeO(s)+CO(g)Fe(s)+CO2(g) ΔH4
则反应④的ΔH4= (保留至小数点后1位)kJ·mol-1。
【解析】(1)由已知反应得:
TiCl4(l)Ti(s)+2Cl2(g) ΔH=+804.2 kJ·mol-1 ①
4Na(s)+2Cl2(g)4NaCl(s) ΔH=-1764.0 kJ·mol-1 ②
4Na(s)4Na(l) ΔH=+10.4 kJ·mol-1 ③
将①+②-③得,TiCl4(l)+4Na(l)Ti(s)+4NaCl(s)
ΔH=+804.2 kJ·mol-1-1764.0 kJ·mol-1-10.4 kJ·mol-1=-970.2 kJ·mol-1
(2)由已知反应得:
6H2(g)+3O2(g)6H2O(g) ΔH1=-1450.8 kJ·mol-1 ①
2N2(g)+6H2(g)4NH3(g) ΔH2=-184.8 kJ·mol-1 ②
3N2(g)+3O2(g)6NO(g) ΔH3=-541.5 kJ·mol-1 ③
①-②-③得,6NO(g)+4NH3(g)5N2(g)+6H2O(g) ΔH=(-1450.8+184.8+541.5) kJ·mol-1=-724.5 kJ·mol-1
(3)将得,FeO(s)+CO(g)Fe(s)+CO2(g),则 ΔH 4=≈+1.9 kJ·mol-1
【答案】(1)-970.2 (2)-724.5 kJ·mol-1 (3)+1.9
课堂小结
【随堂检测】
1.在测定中和反应反应热的实验中,下列叙述错误的是( )
A.实验操作动作要迅速,尽量减少热量损失
B.实验中可使酸液或碱液稍微过量
C.实验时需记录酸、碱的初始温度和反应后的最高温度
D.可以用KOH溶液代替NaOH溶液,浓硫酸代替盐酸
【解析】可以用KOH溶液代替NaOH溶液,但不能用浓硫酸代替盐酸,因为浓硫酸溶于水时会放出热量,影响测定结果。
【答案】D
2.已知H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1。下列关于中和反应反应热的说法中正确的是( )
A.在稀溶液中所有酸和碱反应的中和反应反应热数值都相等
B.在稀溶液中1 mol酸和1 mol碱反应放出的热量都相等
C.在稀溶液中HCl和NaOH反应、HNO3和KOH反应的中和反应反应热相等
D.将浓硫酸滴入稍过量的氢氧化钠溶液中刚好生成1 mol水时,产生的热量即为中和反应反应热
【解析】弱酸与弱碱在溶液中主要以分子形式存在,由于电离吸热,故生成1 mol液态水放出的热量小于57.3 kJ,A项错误;一元酸和二元酸与一元碱和二元碱反应放出的热量不相等,B项错误;HCl和NaOH反应、HNO3和KOH反应的热化学方程式都是H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1,C项正确;浓硫酸稀释要放热,所以放出的热量大于57.3 kJ,D项错误。
【答案】C
3.能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为-285.8 kJ·mol-1、-282.5 kJ·mol-1、-726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)CH3OH(l) ΔH=-127.4 kJ·mol-1
B.CO(g)+2H2(g)CH3OH(l) ΔH=+127.4 kJ·mol-1
C.CO(g)+2H2(g)CH3OH(g) ΔH=-127.4 kJ·mol-1
D.CO(g)+2H2(g)CH3OH(g) ΔH=+127.4 kJ·mol-1
【解析】根据目标反应与三种反应热的关系,利用盖斯定律,首先计算出目标反应的反应热ΔH=2×(-285.8 kJ·mol-1)+(-282.5 kJ·mol-1)-(-726.7 kJ·mol-1)=-127.4 kJ·mol-1,然后根据甲醇为液态,即可确定A项正确。
【答案】A
4.钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤如下:
TiO2TiCl4Ti
已知:①C(s)+O2(g)CO2(g) ΔH1;
②2CO(g)+O2(g)2CO2(g) ΔH2;
③TiO2(s)+2Cl2(g)TiCl4(s)+O2(g) ΔH3。
则反应TiO2(s)+2Cl2(g)+2C(s)TiCl4(s)+2CO(g)的ΔH为( )
A.ΔH3+2ΔH1+2ΔH2
B.ΔH3+2ΔH1+ΔH2
C.ΔH3+2ΔH1-ΔH2
D.ΔH3+2ΔH1-2ΔH2
【解析】利用盖斯定律,将③+2×①-②可得TiO2(s)+2Cl2(g)+2C(s)TiCl4(s)+2CO(g) ΔH=ΔH3+2ΔH1-ΔH2,故选C项。
【答案】C
【学习目标】
1.通过实验了解定量测定反应热的基本原理和实验方法,能正确分析误差产生的原因并能采取适当措施减小误差,培养科学探究能力。
2.通过交流讨论理解盖斯定律的本质,能用盖斯定律进行有关焓变的简单计算,构建运用盖斯定律进行相关判断或计算的思维模型。
【合作探究】
任务1 了解中和反应反应热的测定
【新知生成】
1.测定仪器: 。
2.测定数据:盐酸、NaOH溶液的温度,反应后体系的 。
3.计算公式: 。
4.实验过程
(1)实验测量
按下列操作步骤测定盐酸与氢氧化钠溶液反应的反应热。
①用量筒量取50mL 0.50 mol·L-1盐酸,打开杯盖,倒入量热计(如图)的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
②用另一量筒量取50mL 0.50 mol·L-1 NaOH溶液,用温度计测量并记录NaOH溶液的温度。
③打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用环形玻璃搅拌棒匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)。
④重复上述步骤两次。
在上述过程中,提高测定反应热准确度的措施有 。
(2)数据处理
[取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)]
①为记录本实验的实验数据,请设计实验记录表。
②量热计直接测得的数据是 ,计算反应放出的热量的公式为 。
③计算反应热。(为了计算简便,近似地认为实验所用酸、碱溶液的密度与水相同,都是1g·mL-1,中和后生成的溶液的热容与液态水相同,为4.18J·g-1·℃-1)
④若上述实验测得t2-t1=3.4℃,则ΔH= (精确至0.01)kJ·mol-1。
(3)误差分析
在下表空格内填“偏大”、“偏小”或“不变”。
引起误差的原因 中和反应ΔH
保温措施不好
将环形玻璃搅拌棒改成铜棒
搅拌不充分
量取NaOH溶液和盐酸时,均仰视刻度线
用同浓度的氨水代替NaOH溶液
用同浓度的CH3COOH溶液代替盐酸
最后记录的温度不是最高温度
【答案】1.简易量热计 2.最高温度 3.ΔH=- 4.(1)用了保温效果较好的量热计;温度计使用后及时冲洗;用环形玻璃搅拌棒匀速搅拌;操作动作迅速;多次测量取平均值
(2)①
实验 次数 反应物的温度/℃ 反应前体 系的温度 反应后体 系的温度 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ (t2-t1)/℃
1
2
3
②体系温度的变化 Q=cmΔt(Q:反应放出的热量,m:反应混合液的总质量,c:反应混合液的比热容,Δt:反应前后溶液温度的变化量)
③50mL 0.50 mol·L-1盐酸的质量m1=50g,50mL 0.50 mol·L-1 NaOH溶液的质量m2=50g。中和后生成的溶液的热容c=4.18J·g-1·℃-1,则放出的热量为(m1+m2)·c·(t2-t1)=0.418(t2-t1)kJ,生成1 mol H2O时的反应热ΔH=-kJ·mol-1
④-56.85 (3)偏大 偏大 偏大 偏小 偏大 偏大
偏大
【核心突破】
典例1 分别取40mL 0.50 mol·L-1盐酸与40mL 0.55 mol·L-1氢氧化钠溶液进行中和反应,通过测定反应过程中所放出的热量计算中和反应反应热,请回答下列问题:
(1)如图所示,杯盖上面有两个小孔,分别插入温度计和环形玻璃搅拌棒,两个小孔不能开得过大,其原因是 。
(2)反应需要测量温度,每次测量温度后都必须采取的操作是 。
(3)不能用铜质搅拌棒代替环形玻璃搅拌棒的理由是 。
(4)某同学记录的实验数据如下:
实验序号 起始温度T1/℃ 终止温度T2/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.1 23.2
2 20.2 20.4 23.4
3 20.5 20.6 23.6
依据该同学的实验数据计算,该实验测得生成1 molH2O时的反应热ΔH= (保留1位小数)。
(5)若将NaOH溶液改为相同体积、相同浓度的氨水(NH3·H2O是弱电解质,电离需要吸收热量),测得生成1 molH2O时的反应热为ΔH1,则ΔH1 (填“<”、“>”或“=”)ΔH,理由是 。
【解析】(1)该实验的关键是防止热量的散失,小孔开得过大,会加大热量的散失。(4)ΔH=-(80g×4.18×10-3 kJ·g-1·℃-1×3.1℃)÷0.02 mol≈-51.8kJ·mol-1。(5)因弱电解质的电离过程吸热,将NaOH溶液改为同体积、同浓度的氨水,反应后放出的热量减少,所以ΔH1>ΔH。
【答案】(1)减少热量损失
(2)用水将温度计上的液体冲洗干净并擦干
(3)铜质搅拌棒传热快,热量损失多
(4)-51.8kJ·mol-1
(5)> NH3·H2O电离吸热,放出的热量减少,所以ΔH1>ΔH
归纳总结:测定中和反应反应热需注意的几个问题
(1)量热计的保温隔热效果要好。
(2)温度计用过后要用水冲洗干净,擦干后备用。
(3)实验中要用酸、碱的稀溶液。
(4)碱液(或酸液)稍过量,以确保酸(或碱)完全反应。
(5)读取的中和反应后的温度(t2)是反应混合液的最高温度。
(6)实验操作过程中动作要迅速,尽量减少热量损失。
训练1 下列有关中和反应反应热的测定说法正确的是( )
A.图中仪器a为温度计,仪器b为玻璃棒
B.为了确保测量结果的精准,溶液中HCl和NaOH的物质的量必须相等
C.所用酸和碱浓度不宜太高,否则混合过程被稀释并伴随反应外的热量变化
D.实验过程中两溶液要快速混合,记录混合瞬间的温度计读数作为反应前温度
【解析】A项,图中仪器a为温度计,用来测量反应体系最高温度,仪器b为环形玻璃搅拌棒,用来搅拌,使溶液充分反应,错误;B项,为了保证HCl完全反应,通常加稍过量的NaOH溶液,错误;C项,浓的酸和碱混合时因互相稀释而放热,影响实验结果,故所用酸和碱浓度不宜太高,正确;D项,实验过程中两溶液要快速混合,尽量减少热量散失,观察温度计变化,记录反应体系的最高温度,反应前温度应在混合前分别测量,错误。
【答案】C
训练2 在测定中和反应反应热的实验中,下列说法正确的是(弱酸电离时吸热)( )
A.使用环形玻璃搅拌器是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与内筒底部接触
C.用0.50 mol·L-1的NaOH溶液分别与0.50 mol·L-1的盐酸、醋酸溶液反应,若所取的溶液体积相等,则测得的中和反应反应热的绝对值相同
D.在测定中和反应反应热的实验中,应将NaOH溶液缓缓倒入装有盐酸的内筒中
【解析】反应速率越慢,达到完全反应用时越长,热量散失越多,所以使用环形玻璃搅拌器是为了加快反应速率,可以减小实验误差,A项正确;温度计水银球应浸入溶液中,但不能与内筒底部接触,否则会造成测定的中和热数值不准确,B项错误;盐酸是强酸,醋酸是弱酸,反应过程中醋酸还会继续电离,吸收热量,会使测定的中和热数值不同,C项错误;在测定中和反应反应热的实验中,NaOH溶液应迅速倒入装有盐酸的内筒中,减小热量散失,减小实验误差,D项错误。
【答案】A
任务2 盖斯定律及其应用
【学习情境】
某人从山下A点到达山顶B点,无论是翻山越岭攀登而上,还是坐缆车直奔山顶,山的高度(图中的h)总是不变的,即此人势能的变化只与起点A和终点B的海拔差有关,而与由A点到B点的途径无关。一个化学反应也是如此,不论是一步完成的还是分几步完成的,其反应热是相同的,这就是盖斯定律。换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
【新知生成】
1.内容:一个化学反应,不管是 完成的,还是 完成的,其反应热是 的。
2.意义:对于进行得很慢的反应、不容易直接进行的反应、有副反应发生的反应,测定其反应热有困难,如果利用 ,就可以间接地把它们的反应热计算出来。
3.应用
(1)若某个化学反应的ΔH=+akJ·mol-1,则其逆反应的ΔH= kJ·mol-1。
(2)若某个化学反应的化学方程式可由另外几个反应的化学方程式相加减而得到,则该反应的反应热也可以由这几个反应的反应热 而得到。
【答案】1.一步 分几步 相同 2.盖斯定律
3.(1)-a (2)相加减
【核心突破】
典例2 根据已知信息,按要求写出指定反应的热化学方程式。
(1)LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)2Li2O(s) ΔH=-1196 kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式: 。
(2)工业上制取硝酸铵的流程图如下所示:
NH3NONO2HNO3NH4NO3
已知:4NO(g)+4NH3(g)+O2(g)4N2(g)+6H2O(g) ΔH=-1745.2 kJ·mol-1;
6NO(g)+4NH3(g)5N2(g)+6H2O(g) ΔH=-1925.2 kJ·mol-1。
则反应Ⅰ的热化学方程式可表示为 。
【解析】(1)2LiH(s)2Li(s)+H2(g) ΔH=+182 kJ·mol-1
2Li(s)+O2(g)Li2O(s) ΔH=-598 kJ·mol-1
H2(g)+O2(g)H2O(l) ΔH=-286 kJ·mol-1
将上述三式相加得:2LiH(s)+O2(g)Li2O(s)+H2O(l) ΔH=-702 kJ·mol-1。
(2)将已知的两个热化学方程式从上到下依次标记为①和②,根据盖斯定律可知①×5-②×4得4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1025.2 kJ·mol-1。
【答案】(1)2LiH(s)+O2(g)Li2O(s)+H2O(l) ΔH=-702 kJ·mol-1
(2)4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-1025.2 kJ·mol-1
归纳总结:利用盖斯定律计算反应热的方法
(1)加合法:运用所给热化学方程式通过加减等方法得到所求的热化学方程式。
“加合法”计算反应热的注意事项:
①热化学方程式同乘以或除以某一个数时,反应热数值也必须乘以或除以该数。
②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减。
③对于同一热化学方程式来说,正反应和逆反应,ΔH的数值相等,符号相反。
④热化学方程式中的反应热指反应按所给形式完全进行时的反应热。
(2)虚拟路径法
若反应物A转化为生成物D,可以有两种途径:
①由A直接变成D,反应热为ΔH。
②由A经过B变成C,再由C变成D,每步的反应热分别为ΔH1、ΔH2、ΔH3。
如图所示:
则有ΔH=ΔH1+ΔH2+ΔH3。
训练3 含氮化合物与生产、生活和环境息息相关。NO加速臭氧层破坏,其反应过程如图所示。
已知:O3(g)+O(g)2O2(g) ΔH=-391.9kJ·mol-1
反应1:O3(g)+NO(g)NO2(g)+O2(g) ΔH1=-199.5kJ·mol-1
则反应2的热化学方程式为 。
【答案】NO2(g)+O(g)NO(g)+O2(g) ΔH=-192.4 kJ·mol-1
训练4 根据下列条件计算有关反应的焓变:
(1)已知:Ti(s)+2Cl2(g)TiCl4(l) ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)Ti(s)+4NaCl(s)的ΔH= kJ·mol-1。
(2)已知:2H2(g)+O2(g)2H2O(g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)2NO(g) ΔH=-180.5 kJ·mol-1
则反应6NO(g)+4NH3(g)5N2(g)+6H2O(g)的ΔH= 。
(3)已知下列反应反应热的数值:
反应序号 化学反应 反应热
① Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g) ΔH1=-24.8 kJ·mol-1
② 3Fe2O3(s)+CO(g)2Fe3O4(s)+CO2(g) ΔH2=-47.2 kJ·mol-1
③ Fe3O4(s)+CO(g)3FeO(s)+CO2 (g) ΔH3=-19.4 kJ·mol-1
④ FeO(s)+CO(g)Fe(s)+CO2(g) ΔH4
则反应④的ΔH4= (保留至小数点后1位)kJ·mol-1。
【解析】(1)由已知反应得:
TiCl4(l)Ti(s)+2Cl2(g) ΔH=+804.2 kJ·mol-1 ①
4Na(s)+2Cl2(g)4NaCl(s) ΔH=-1764.0 kJ·mol-1 ②
4Na(s)4Na(l) ΔH=+10.4 kJ·mol-1 ③
将①+②-③得,TiCl4(l)+4Na(l)Ti(s)+4NaCl(s)
ΔH=+804.2 kJ·mol-1-1764.0 kJ·mol-1-10.4 kJ·mol-1=-970.2 kJ·mol-1
(2)由已知反应得:
6H2(g)+3O2(g)6H2O(g) ΔH1=-1450.8 kJ·mol-1 ①
2N2(g)+6H2(g)4NH3(g) ΔH2=-184.8 kJ·mol-1 ②
3N2(g)+3O2(g)6NO(g) ΔH3=-541.5 kJ·mol-1 ③
①-②-③得,6NO(g)+4NH3(g)5N2(g)+6H2O(g) ΔH=(-1450.8+184.8+541.5) kJ·mol-1=-724.5 kJ·mol-1
(3)将得,FeO(s)+CO(g)Fe(s)+CO2(g),则 ΔH 4=≈+1.9 kJ·mol-1
【答案】(1)-970.2 (2)-724.5 kJ·mol-1 (3)+1.9
课堂小结
【随堂检测】
1.在测定中和反应反应热的实验中,下列叙述错误的是( )
A.实验操作动作要迅速,尽量减少热量损失
B.实验中可使酸液或碱液稍微过量
C.实验时需记录酸、碱的初始温度和反应后的最高温度
D.可以用KOH溶液代替NaOH溶液,浓硫酸代替盐酸
【解析】可以用KOH溶液代替NaOH溶液,但不能用浓硫酸代替盐酸,因为浓硫酸溶于水时会放出热量,影响测定结果。
【答案】D
2.已知H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1。下列关于中和反应反应热的说法中正确的是( )
A.在稀溶液中所有酸和碱反应的中和反应反应热数值都相等
B.在稀溶液中1 mol酸和1 mol碱反应放出的热量都相等
C.在稀溶液中HCl和NaOH反应、HNO3和KOH反应的中和反应反应热相等
D.将浓硫酸滴入稍过量的氢氧化钠溶液中刚好生成1 mol水时,产生的热量即为中和反应反应热
【解析】弱酸与弱碱在溶液中主要以分子形式存在,由于电离吸热,故生成1 mol液态水放出的热量小于57.3 kJ,A项错误;一元酸和二元酸与一元碱和二元碱反应放出的热量不相等,B项错误;HCl和NaOH反应、HNO3和KOH反应的热化学方程式都是H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1,C项正确;浓硫酸稀释要放热,所以放出的热量大于57.3 kJ,D项错误。
【答案】C
3.能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为-285.8 kJ·mol-1、-282.5 kJ·mol-1、-726.7 kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g)CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)CH3OH(l) ΔH=-127.4 kJ·mol-1
B.CO(g)+2H2(g)CH3OH(l) ΔH=+127.4 kJ·mol-1
C.CO(g)+2H2(g)CH3OH(g) ΔH=-127.4 kJ·mol-1
D.CO(g)+2H2(g)CH3OH(g) ΔH=+127.4 kJ·mol-1
【解析】根据目标反应与三种反应热的关系,利用盖斯定律,首先计算出目标反应的反应热ΔH=2×(-285.8 kJ·mol-1)+(-282.5 kJ·mol-1)-(-726.7 kJ·mol-1)=-127.4 kJ·mol-1,然后根据甲醇为液态,即可确定A项正确。
【答案】A
4.钛被称为“第三金属”,其制取原料为金红石(TiO2),制取步骤如下:
TiO2TiCl4Ti
已知:①C(s)+O2(g)CO2(g) ΔH1;
②2CO(g)+O2(g)2CO2(g) ΔH2;
③TiO2(s)+2Cl2(g)TiCl4(s)+O2(g) ΔH3。
则反应TiO2(s)+2Cl2(g)+2C(s)TiCl4(s)+2CO(g)的ΔH为( )
A.ΔH3+2ΔH1+2ΔH2
B.ΔH3+2ΔH1+ΔH2
C.ΔH3+2ΔH1-ΔH2
D.ΔH3+2ΔH1-2ΔH2
【解析】利用盖斯定律,将③+2×①-②可得TiO2(s)+2Cl2(g)+2C(s)TiCl4(s)+2CO(g) ΔH=ΔH3+2ΔH1-ΔH2,故选C项。
【答案】C
