化学人教版(2019)选择性必修三1.1有机化合物的结构特点(共59张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修三1.1有机化合物的结构特点(共59张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 16.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-08 08:27:24 | ||
图片预览





文档简介
(共59张PPT)
第一章
有机化合物的结构特点与研究方法
第一节 有机化合物的结构特点
【有机化学的发展】
1770年——
1806年——
1828年——
1848年——
1874年——
分离提纯有机物
酒石 酒石酸
尿液 尿素
鸦片 吗啡
“有机”和“生命力”
来自
动植物
有机物
来自
矿物
无机物
人工合成有机物
NH4CNO(氰酸铵)
NH2–C–NH2(尿素)
O
△
维勒(德国):
1828年 尿素
1845年 醋酸
1854年 油脂
明确是C化合物
碳氢化合物及其衍生物
尿素
2015年10月8日,中国科学家屠呦呦因发现抗疟新药——青蒿素和双氢青蒿素,获2015年诺贝尔生理学或医学奖。
青蒿素和双氢青蒿素属于有机物,青蒿素分子中含有哪些官能团?
青蒿素
按所含元素的种类,归为烃还是烃的衍生物?
按碳的骨架分类,属于哪类有机物?
按官能团的种类分类,属于哪类有机物?
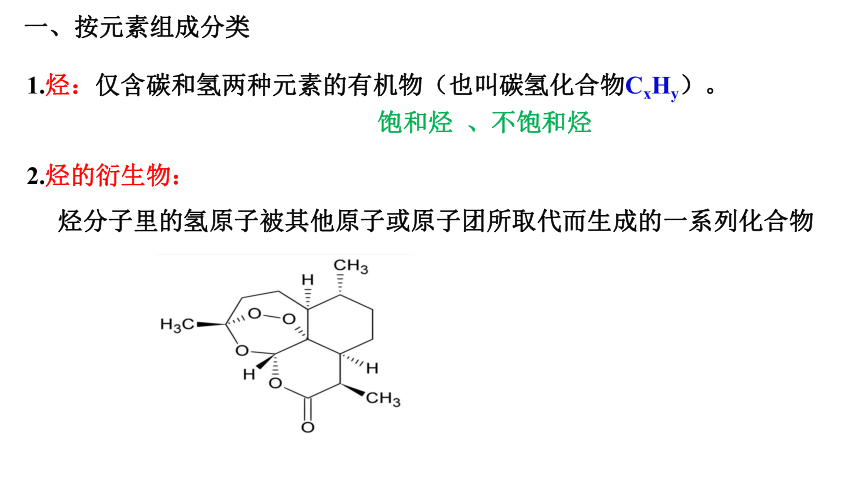
1.烃:仅含碳和氢两种元素的有机物(也叫碳氢化合物CxHy)。
2.烃的衍生物:
烃分子里的氢原子被其他原子或原子团所取代而生成的一系列化合物
一、按元素组成分类
饱和烃 、不饱和烃
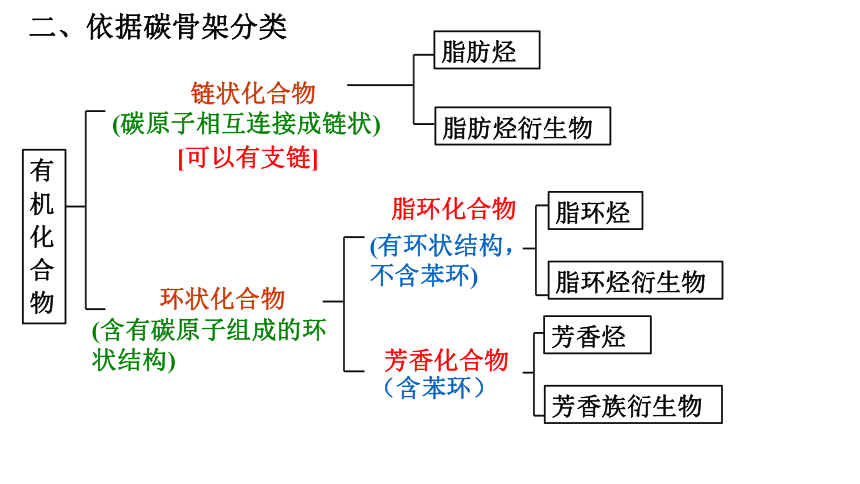
有机化合物
脂肪烃
脂肪烃衍生物
脂环烃
脂环烃衍生物
芳香烃
芳香族衍生物
链状化合物
(碳原子相互连接成链状)
环状化合物
(含有碳原子组成的环状结构)
脂环化合物
(有环状结构,不含苯环)
芳香化合物
(含苯环)
[可以有支链]
二、依据碳骨架分类
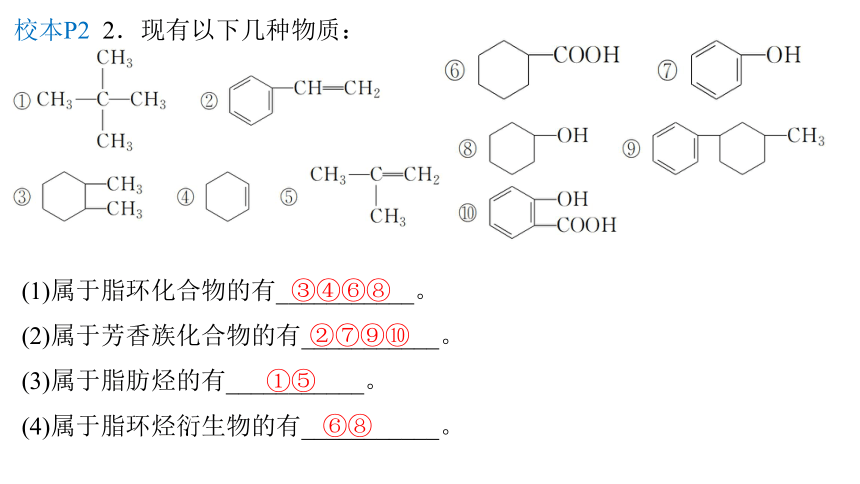
校本P2 2.现有以下几种物质:
(1)属于脂环化合物的有___________。
(2)属于芳香族化合物的有___________。
(3)属于脂肪烃的有___________。
(4)属于脂环烃衍生物的有___________。
③④⑥⑧
②⑦⑨⑩
①⑤
⑥⑧
CH3CH2OH
CH3COOH
CH3OCH3
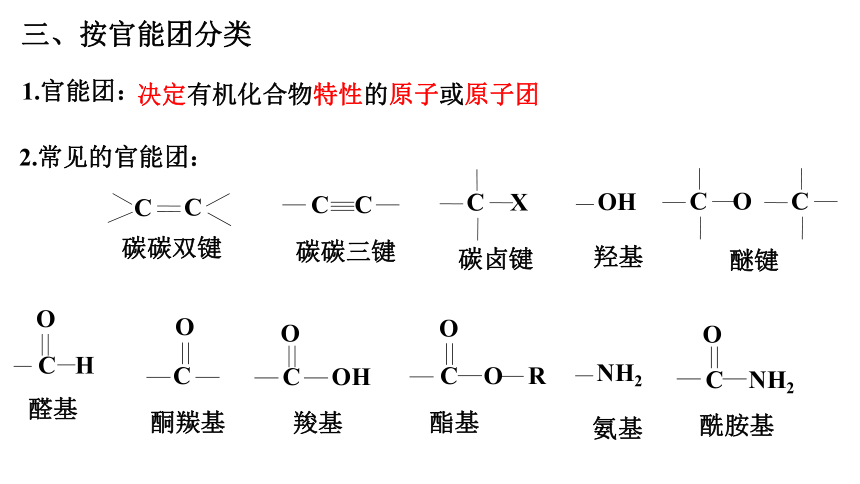
1.官能团:
决定有机化合物特性的原子或原子团
碳碳双键
碳碳三键
碳卤键
羟基
醛基
酮羰基
羧基
酯基
C C
OH
C H
O
C
O
C OH
O
2.常见的官能团:
C
C
C X
C O R
O
氨基
NH2
酰胺基
C NH2
O
醚键
C O
C
三、按官能团分类
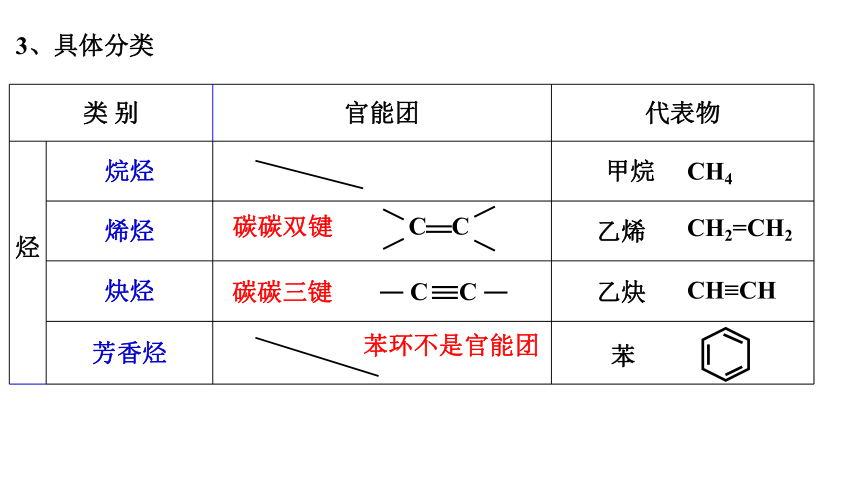
类 别 官能团 代表物
烃 烷烃
烯烃
炔烃
芳香烃
CH2=CH2
CH≡CH
C C
C C
甲烷 CH4
碳碳双键
乙烯
碳碳三键
苯
乙炔
3、具体分类
苯环不是官能团
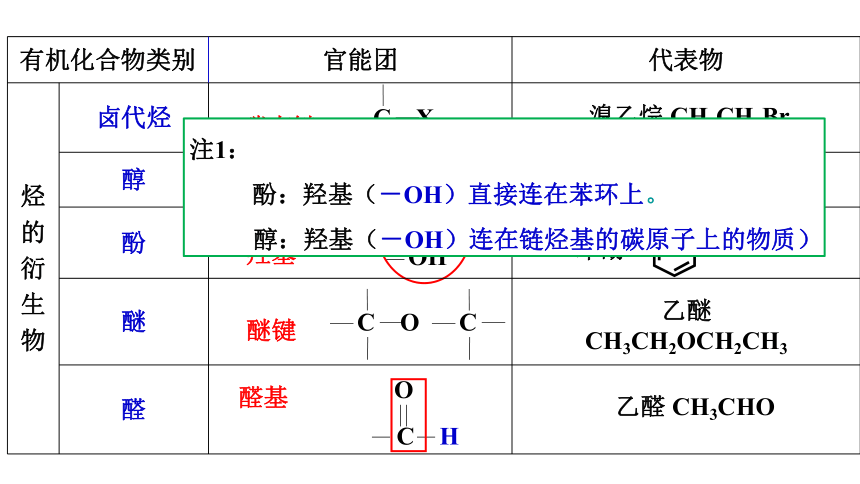
有机化合物类别 官能团 代表物
烃 的 衍 生 物 卤代烃
醇
酚
醚
醛
OH
碳卤键
羟基
羟基
醚键
醛基
溴乙烷 CH3CH2Br
乙醇 C2H5OH
苯酚
乙醚 CH3CH2OCH2CH3
乙醛 CH3CHO
OH
C H
O
C X
C O
C
OH
注1:
酚:羟基(-OH)直接连在苯环上。
醇:羟基(-OH)连在链烃基的碳原子上的物质)
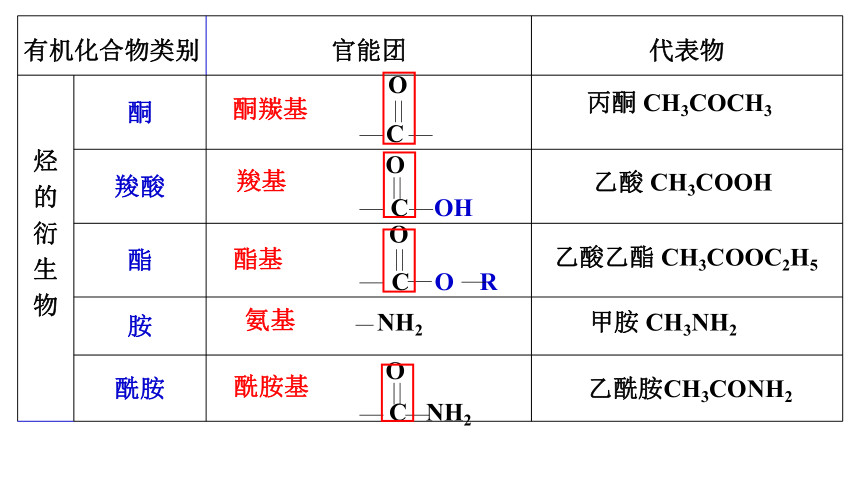
有机化合物类别 官能团 代表物
烃 的 衍 生 物 酮
羧酸
酯
胺
酰胺
乙酸 CH3COOH
乙酸乙酯 CH3COOC2H5
甲胺 CH3NH2
乙酰胺CH3CONH2
羧基
酯基
氨基
酰胺基
C OH
O
C O R
O
NH2
C NH2
O
丙酮 CH3COCH3
酮羰基
C
O
注2:含 (羰基)的官能团区别
C
O
C
O
羰基 :由一个碳原子和一个氧原子以双键相连形成的一种原子团。
C
O
R
H
R’
羰基两端与两个烃基(-R、-R’)相连构成的化合物叫做酮,官能团为酮羰基(羰基)
C
O
R
羰基一端连接烃基(-R),另一端连接氢原子(H)构成的化合物叫做醛,官能团为醛基
C
O
R(H)
OH
羰基一端连接烃基(-R) ,另一端连接羟基(-OH)构成的化合物叫做酸,官能团为羧基
烷烃失去n个氢原子剩余的原子团
注3:官能团、基、根(离子)的区别
D
B
教材P6
教材P12
教材P12
①按所含元素的种类,青蒿素归为烃还是烃的衍生物?
②按碳的骨架分类,青蒿素属于哪类有机物?
③青蒿素中哪些官能团,若按官能团的种类分类,属于哪类有机物?
为纪念瑞士化学家Reichstein 1933年首次合成维生素C,瑞士曾发行了一枚印有维生素C分子的3D效果邮票,如图1所示(图中小短棍可表示单键、双键或三键),其结构如图2所示:
①按所含元素的种类,归为烃还是烃的衍生物?
②按碳的骨架分类,属于哪类有机物?
③该物质中有哪些官能团,若按官能团的种类分类,属于哪类有机物?
C
校本P4
1.(2023·重庆北碚区高二开学考试)某有机化合物的结构简式如图所示,该有机化合物中不存在的官能团是( )
A.酯基 B.碳碳双键 C.羧基 D.羟基
校本P4
2.拟除虫菊酯是一类高效、低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的氯氰菊酯的结构简式如图所示,下列对该有机化合物的叙述正确的是( )
A.属于芳香烃 B.属于芳香族化合物,含有醚键和酯基两种官能团
C.属于卤代烃 D.可使酸性KMnO4溶液褪色
D
范托夫与碳价四面体学说
早期的有机化合物结构理论认为有机化合物的分子结构都是平面形的,分子中所有的原子都处在同一平面内。例如,甲烷的碳原子和氢原子都在同一平面上。
但是这种结构理论无法解释下列现象,如果甲烷的两个氢原子被两个氯原子取代得到的二氯甲烷,按照平面结构理论应当有两种异构体。事实证明,组成为CH2Cl2的分子不存在异构体。
1874年,范霍夫发表了《空间化学引论》,他认为建立在平面结构基础上的化合物的结构式并不能反映它的真实结构,在甲烷分子中,碳的4个价键指向正四面体的顶点,碳原子位于四面体的中心,氢原子位于四面体的4个顶点。
科学史话
按照不同的分类方法,可将共价键分为不同的类型:
(1)按共用电子对数目
单键:如H-H键
双键:如C=C键
三键:如C≡C键
(2)按共用电子对是否偏移
非极性键
极性键
(3)按原子轨道的重叠方式
σ键
π键
【回顾】共价键的分类
共价键的类型
σ键:
π键:
以“头碰头”形式重叠,可绕键轴旋转
p轨道以“肩并肩”形式重叠,镜面对称,不能绕键轴旋转
有机化合物的共价键
双键中含有一个σ键和一个π键
单键是σ键
三键中含有一个σ键和两个π键
四、有机化合物中的共价键
有机物 甲烷 乙烯 乙炔
分子式 CH4 C2H4 C2H2
结构式
球棍模型
碳原子轨道杂化方式 /化学键
分子的 空间构型
C=C
H
H
H
H
H-C≡C-H
正四面体
平面型
“2+4共面”
直线型
“2+2共线”
sp2杂化
σ键 π键
sp3杂化
σ键
sp杂化
σ键、π键
(一)共价键的类型与有机反应类型的关系
①含有C—H σ键,能发生取代反应;
②含有π键,能发生加成反应。
按共用电子对是否偏移
非极性键
极性键
(二)共价键极性与有机反应
共价键的极性对有机物化学性质的影响?
【实验1-1】 乙醇、H2O与Na反应
水和钠 无水乙醇和钠
实验现象
反应方程式
剧烈程度 2Na+2H2O
=2NaOH+H2↑
2CH3CH2OH+2Na
→2CH3CH2ONa+H2↑
浮、熔、游、响、红
钠沉入底部,有气体产生,最终钠粒消失
剧烈程度:H2O > CH3CH2OH
【实验1-1】 乙醇、H2O与Na反应
【思考】1、试从乙醇的结构分析乙醇为什么能和金属钠反应?
乙醇分子中氢氧键极性强,能够发生断裂
2、为什么乙醇和钠反应不如水与钠反应剧烈?
由于乙醇分子中乙基为推电子基团,乙醇分子中氢氧键极性比水分子中氢氧键的极性弱,乙醇比水更难电离出氢离子。
结论:电负性差值越大,共用电子对偏移程度越大,共价键极性越强,
在反应中越容易断裂。
电负性:H—2.1 C—2.5 O—3.5
极性:H—O > C—O > C—H
3.同样条件下,乙酸、无水乙醇、水分别与钠的反应剧烈程度比较?
乙酸 > 水 >乙醇
由于乙酸中羰基的吸电子效应(O的电负性较大),使其分子中H-O的极性比水中H-O的强,故乙酸具有弱酸性。
4.试从键的极性强弱角度比较甲酸、乙酸、丙酸的酸性强弱?
甲酸>乙酸>丙酸
烃基为推电子基团,烃基越长推电子效应越大,使羧基中的羟基极性越小,羧酸的酸性越弱。
结论:基团之间的相互影响使官能团中化学键的极性发生变化,从而
影响官能团和物质的性质。
由于-OH中氧原子的电负性较大,乙醇分子中的C-O键极性也较强,也可断裂,
+H—Br +H2O
电负性:H—2.1 C—2.5 O—3.5
极性:H—O > C—O > C—H
有机物分子中共价键断裂的位置存在多种可能,相对无机反应,有机反应一般速率较小,副反应较多,产物较复杂
B
校本P7
1.下列说法不正确的是( )
A.π键由两个p轨道以“肩并肩”的形式重叠形成
B.通过π键连接的原子或原子团可绕键轴旋转
C.σ键和π键的强度不同
D.乙烷分子中的共价键全为σ键,而乙烯分子中含σ键和π键
D
校本P7
2.下列关于有机化合物中化学键的说法不正确的是( )
A.烷烃中的化学键均为σ键
B.CH3NH2中C—H的极性比N—H的极性弱
C.乙醇分子中含有极性键和非极性键
D.1个丙炔分子中含有5个σ键和3个π键
校本P7
3.下列说法不正确的是( )
A.乙醇与Na反应比水与Na反应缓慢的原因为乙醇中H—O的极性弱
B.乙醇的酯化反应断裂的化学键是C—O σ键
C.乙醇与HBr反应断裂的化学键是乙醇中的C—O σ键
D.有机反应一般反应速率较小,产物较复杂
B
拓展延伸
五、有机物结构的表示方法
(一)两种空间模型
(1)空间填充模型
表示原子的相对大小及连接形式,更接近分子的真实结构。
(2)球棍模型
表示分子的空间结构
(立体形状)。
(二)六种表示式
(1)分子式
(2)最简式(实验式)
用元素符号表示化合物分子中各元素的原子个数比的最简关系式
丙烯:
乙醇:
用元素符号表示分子的组成及相对分子质量的化学式。
(3)电子式
在元素符号周围用 “.”和 “×”表示元素原子的最外层电子的式子
(4)结构式
用一条短线表示一个共价键,表示分子中的原子排列和结合方式。
丙烯:
乙醇:
(5)结构简式
在结构式基础上省略C-C、C-H键,合并同一C上H,重点突出结构特点。
(6)键线式
将碳、氢元素符号省略,只表示分子中键的连接情况和官能团,每个拐点或终点均表示有一个碳原子。
A
A
【练习】请写出下列物质的分子式。
C7H8O5
C8H7NOCl2
C15H20O4
名称 正戊烷 异戊烷 新戊烷
结构简式 CH3(CH2)3CH3 CH3CH2CH(CH3)2 C(CH3)4
相同点 不同点 戊烷(C5H12)的三种结构,如下所示:
分子式都是C5H12 、 化学性质相似
分子结构不同,物理性质不同, 支链越多,沸点越低
分子式相同:同相对分子量、同组成元素、同质量分数、同最简式;
结构不同 :原子连接方式不同、原子的连接顺序不同、不同物质;
(一)同分异构现象概念:化合物分子式相同而结构不同的现象
①同分
②异构
(二)同分异构体:
具有相同分子式不同结构的化合物互称为同分异构体
六、同分异构概念
D
校本P8
1.(2023·枣庄高二联考)下列说法不正确的是( )
A.分子式为C3H8与C6H14的两种有机化合物一定互为同系物
B.具有相同的分子式,但结构不同的有机化合物一定互为同分异构体
C.两个相邻同系物一定相差一个CH2原子团
D.具有相同的相对分子质量,但结构不同的有机化合物一定互为同分异构体
四、同分异构体的类型
同分异构现象
构造异构
立体异构
碳架异构
顺反异构
对映异构
位置异构
官能团异构
异构类型 分类标准 类别
碳架异构 C4H10
位置异构 C4H8
C6H4Cl2
官能团异构 C2H6O
(一)有机化合物的构造异构现象
碳骨架不同
官能团的位置不同
官能团
种类不同
(二)有机化合物的立体异构现象
(1)对映异构(手性异构)
当有机物分子中的饱和碳原子连接着4个不同的原子或原子团时,就可能存在对映异构现象。
如乳酸有以下两种对映异构体:
(2)顺反异构
由于碳碳双键不能自由旋转,当有机物分子中含有碳碳双键且每个双键碳原子所连的另外两个原子或原子团不同时就存在顺反异构现象。
顺式异构体
两个相同原子或基团在双键同侧
反式异构体
两个相同原子或基团在双键异侧
填序号
(1)互为同分异构体的是_ _______。
(2)属于碳架异构的是________。
(3)属于位置异构的是________。
(4)属于官能团异构的是________。
(5)属于同一种物质的是________。
①②③⑤⑥
①
②
③⑤⑥
④
【思考】烷烃存在什么异构?
烷烃只存在碳架异构
四、同分异构的书写方法
碳架异构——减碳法:先确定碳链结构,再补氢原子
书写己烷C6H14的同分异构体
注意:A.找中心对称线,对称C支链不重复
B.减C数目不超过C原子数的1/2
C.补H(碳(C)4价原则)
D.甲基不连主链两端;乙基不连主链两端的第二位
丙基不连主链两端的第三位……
减碳法:先碳架,再补氢
【练习】书写庚烷C7H16同分异构体
书写戊烯C5H10的同分异构体
烯烃存在 ①碳架异构→②官能团位置异构
【思考】烯烃存在什么异构?
插入法:先写出具有此碳原子数的烷烃的同分异构体的碳链骨架,再根据碳链的对称性,将官能团插入碳链中,最后用氢原子补足碳的四个价键。(适用于烯烃、炔烃、酮、醚)
【思考】C5H10同分异构体有多少种
烯烃的同分异构体还有环烷烃
书写步骤:类别异构→碳架异构→位置异构
书写戊烷C5H11Cl的同分异构体
等效氢
①同一碳原子上的氢原子等效;
③处于对称位置上的氢原子等效。
1.等效氢原子法
②同一碳原子上所连接甲基上的氢原子等效;
有机物中有几种等效氢就有几种一元取代物
五、有机物同分异构体数目判断的技巧
CH3CH2CH2CH2CH3
CH3-CH2-CH-CH2-CH3
CH2
CH3
CH3
CH3 – C – CH2- CH3
CH3
【练习】1.判断下列有机物的一氯取代物数目:
【思考】CH3CH2CH2CH2CH3的二氯取代物有多少种:
第一章
有机化合物的结构特点与研究方法
第一节 有机化合物的结构特点
【有机化学的发展】
1770年——
1806年——
1828年——
1848年——
1874年——
分离提纯有机物
酒石 酒石酸
尿液 尿素
鸦片 吗啡
“有机”和“生命力”
来自
动植物
有机物
来自
矿物
无机物
人工合成有机物
NH4CNO(氰酸铵)
NH2–C–NH2(尿素)
O
△
维勒(德国):
1828年 尿素
1845年 醋酸
1854年 油脂
明确是C化合物
碳氢化合物及其衍生物
尿素
2015年10月8日,中国科学家屠呦呦因发现抗疟新药——青蒿素和双氢青蒿素,获2015年诺贝尔生理学或医学奖。
青蒿素和双氢青蒿素属于有机物,青蒿素分子中含有哪些官能团?
青蒿素
按所含元素的种类,归为烃还是烃的衍生物?
按碳的骨架分类,属于哪类有机物?
按官能团的种类分类,属于哪类有机物?
1.烃:仅含碳和氢两种元素的有机物(也叫碳氢化合物CxHy)。
2.烃的衍生物:
烃分子里的氢原子被其他原子或原子团所取代而生成的一系列化合物
一、按元素组成分类
饱和烃 、不饱和烃
有机化合物
脂肪烃
脂肪烃衍生物
脂环烃
脂环烃衍生物
芳香烃
芳香族衍生物
链状化合物
(碳原子相互连接成链状)
环状化合物
(含有碳原子组成的环状结构)
脂环化合物
(有环状结构,不含苯环)
芳香化合物
(含苯环)
[可以有支链]
二、依据碳骨架分类
校本P2 2.现有以下几种物质:
(1)属于脂环化合物的有___________。
(2)属于芳香族化合物的有___________。
(3)属于脂肪烃的有___________。
(4)属于脂环烃衍生物的有___________。
③④⑥⑧
②⑦⑨⑩
①⑤
⑥⑧
CH3CH2OH
CH3COOH
CH3OCH3
1.官能团:
决定有机化合物特性的原子或原子团
碳碳双键
碳碳三键
碳卤键
羟基
醛基
酮羰基
羧基
酯基
C C
OH
C H
O
C
O
C OH
O
2.常见的官能团:
C
C
C X
C O R
O
氨基
NH2
酰胺基
C NH2
O
醚键
C O
C
三、按官能团分类
类 别 官能团 代表物
烃 烷烃
烯烃
炔烃
芳香烃
CH2=CH2
CH≡CH
C C
C C
甲烷 CH4
碳碳双键
乙烯
碳碳三键
苯
乙炔
3、具体分类
苯环不是官能团
有机化合物类别 官能团 代表物
烃 的 衍 生 物 卤代烃
醇
酚
醚
醛
OH
碳卤键
羟基
羟基
醚键
醛基
溴乙烷 CH3CH2Br
乙醇 C2H5OH
苯酚
乙醚 CH3CH2OCH2CH3
乙醛 CH3CHO
OH
C H
O
C X
C O
C
OH
注1:
酚:羟基(-OH)直接连在苯环上。
醇:羟基(-OH)连在链烃基的碳原子上的物质)
有机化合物类别 官能团 代表物
烃 的 衍 生 物 酮
羧酸
酯
胺
酰胺
乙酸 CH3COOH
乙酸乙酯 CH3COOC2H5
甲胺 CH3NH2
乙酰胺CH3CONH2
羧基
酯基
氨基
酰胺基
C OH
O
C O R
O
NH2
C NH2
O
丙酮 CH3COCH3
酮羰基
C
O
注2:含 (羰基)的官能团区别
C
O
C
O
羰基 :由一个碳原子和一个氧原子以双键相连形成的一种原子团。
C
O
R
H
R’
羰基两端与两个烃基(-R、-R’)相连构成的化合物叫做酮,官能团为酮羰基(羰基)
C
O
R
羰基一端连接烃基(-R),另一端连接氢原子(H)构成的化合物叫做醛,官能团为醛基
C
O
R(H)
OH
羰基一端连接烃基(-R) ,另一端连接羟基(-OH)构成的化合物叫做酸,官能团为羧基
烷烃失去n个氢原子剩余的原子团
注3:官能团、基、根(离子)的区别
D
B
教材P6
教材P12
教材P12
①按所含元素的种类,青蒿素归为烃还是烃的衍生物?
②按碳的骨架分类,青蒿素属于哪类有机物?
③青蒿素中哪些官能团,若按官能团的种类分类,属于哪类有机物?
为纪念瑞士化学家Reichstein 1933年首次合成维生素C,瑞士曾发行了一枚印有维生素C分子的3D效果邮票,如图1所示(图中小短棍可表示单键、双键或三键),其结构如图2所示:
①按所含元素的种类,归为烃还是烃的衍生物?
②按碳的骨架分类,属于哪类有机物?
③该物质中有哪些官能团,若按官能团的种类分类,属于哪类有机物?
C
校本P4
1.(2023·重庆北碚区高二开学考试)某有机化合物的结构简式如图所示,该有机化合物中不存在的官能团是( )
A.酯基 B.碳碳双键 C.羧基 D.羟基
校本P4
2.拟除虫菊酯是一类高效、低毒,对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的氯氰菊酯的结构简式如图所示,下列对该有机化合物的叙述正确的是( )
A.属于芳香烃 B.属于芳香族化合物,含有醚键和酯基两种官能团
C.属于卤代烃 D.可使酸性KMnO4溶液褪色
D
范托夫与碳价四面体学说
早期的有机化合物结构理论认为有机化合物的分子结构都是平面形的,分子中所有的原子都处在同一平面内。例如,甲烷的碳原子和氢原子都在同一平面上。
但是这种结构理论无法解释下列现象,如果甲烷的两个氢原子被两个氯原子取代得到的二氯甲烷,按照平面结构理论应当有两种异构体。事实证明,组成为CH2Cl2的分子不存在异构体。
1874年,范霍夫发表了《空间化学引论》,他认为建立在平面结构基础上的化合物的结构式并不能反映它的真实结构,在甲烷分子中,碳的4个价键指向正四面体的顶点,碳原子位于四面体的中心,氢原子位于四面体的4个顶点。
科学史话
按照不同的分类方法,可将共价键分为不同的类型:
(1)按共用电子对数目
单键:如H-H键
双键:如C=C键
三键:如C≡C键
(2)按共用电子对是否偏移
非极性键
极性键
(3)按原子轨道的重叠方式
σ键
π键
【回顾】共价键的分类
共价键的类型
σ键:
π键:
以“头碰头”形式重叠,可绕键轴旋转
p轨道以“肩并肩”形式重叠,镜面对称,不能绕键轴旋转
有机化合物的共价键
双键中含有一个σ键和一个π键
单键是σ键
三键中含有一个σ键和两个π键
四、有机化合物中的共价键
有机物 甲烷 乙烯 乙炔
分子式 CH4 C2H4 C2H2
结构式
球棍模型
碳原子轨道杂化方式 /化学键
分子的 空间构型
C=C
H
H
H
H
H-C≡C-H
正四面体
平面型
“2+4共面”
直线型
“2+2共线”
sp2杂化
σ键 π键
sp3杂化
σ键
sp杂化
σ键、π键
(一)共价键的类型与有机反应类型的关系
①含有C—H σ键,能发生取代反应;
②含有π键,能发生加成反应。
按共用电子对是否偏移
非极性键
极性键
(二)共价键极性与有机反应
共价键的极性对有机物化学性质的影响?
【实验1-1】 乙醇、H2O与Na反应
水和钠 无水乙醇和钠
实验现象
反应方程式
剧烈程度 2Na+2H2O
=2NaOH+H2↑
2CH3CH2OH+2Na
→2CH3CH2ONa+H2↑
浮、熔、游、响、红
钠沉入底部,有气体产生,最终钠粒消失
剧烈程度:H2O > CH3CH2OH
【实验1-1】 乙醇、H2O与Na反应
【思考】1、试从乙醇的结构分析乙醇为什么能和金属钠反应?
乙醇分子中氢氧键极性强,能够发生断裂
2、为什么乙醇和钠反应不如水与钠反应剧烈?
由于乙醇分子中乙基为推电子基团,乙醇分子中氢氧键极性比水分子中氢氧键的极性弱,乙醇比水更难电离出氢离子。
结论:电负性差值越大,共用电子对偏移程度越大,共价键极性越强,
在反应中越容易断裂。
电负性:H—2.1 C—2.5 O—3.5
极性:H—O > C—O > C—H
3.同样条件下,乙酸、无水乙醇、水分别与钠的反应剧烈程度比较?
乙酸 > 水 >乙醇
由于乙酸中羰基的吸电子效应(O的电负性较大),使其分子中H-O的极性比水中H-O的强,故乙酸具有弱酸性。
4.试从键的极性强弱角度比较甲酸、乙酸、丙酸的酸性强弱?
甲酸>乙酸>丙酸
烃基为推电子基团,烃基越长推电子效应越大,使羧基中的羟基极性越小,羧酸的酸性越弱。
结论:基团之间的相互影响使官能团中化学键的极性发生变化,从而
影响官能团和物质的性质。
由于-OH中氧原子的电负性较大,乙醇分子中的C-O键极性也较强,也可断裂,
+H—Br +H2O
电负性:H—2.1 C—2.5 O—3.5
极性:H—O > C—O > C—H
有机物分子中共价键断裂的位置存在多种可能,相对无机反应,有机反应一般速率较小,副反应较多,产物较复杂
B
校本P7
1.下列说法不正确的是( )
A.π键由两个p轨道以“肩并肩”的形式重叠形成
B.通过π键连接的原子或原子团可绕键轴旋转
C.σ键和π键的强度不同
D.乙烷分子中的共价键全为σ键,而乙烯分子中含σ键和π键
D
校本P7
2.下列关于有机化合物中化学键的说法不正确的是( )
A.烷烃中的化学键均为σ键
B.CH3NH2中C—H的极性比N—H的极性弱
C.乙醇分子中含有极性键和非极性键
D.1个丙炔分子中含有5个σ键和3个π键
校本P7
3.下列说法不正确的是( )
A.乙醇与Na反应比水与Na反应缓慢的原因为乙醇中H—O的极性弱
B.乙醇的酯化反应断裂的化学键是C—O σ键
C.乙醇与HBr反应断裂的化学键是乙醇中的C—O σ键
D.有机反应一般反应速率较小,产物较复杂
B
拓展延伸
五、有机物结构的表示方法
(一)两种空间模型
(1)空间填充模型
表示原子的相对大小及连接形式,更接近分子的真实结构。
(2)球棍模型
表示分子的空间结构
(立体形状)。
(二)六种表示式
(1)分子式
(2)最简式(实验式)
用元素符号表示化合物分子中各元素的原子个数比的最简关系式
丙烯:
乙醇:
用元素符号表示分子的组成及相对分子质量的化学式。
(3)电子式
在元素符号周围用 “.”和 “×”表示元素原子的最外层电子的式子
(4)结构式
用一条短线表示一个共价键,表示分子中的原子排列和结合方式。
丙烯:
乙醇:
(5)结构简式
在结构式基础上省略C-C、C-H键,合并同一C上H,重点突出结构特点。
(6)键线式
将碳、氢元素符号省略,只表示分子中键的连接情况和官能团,每个拐点或终点均表示有一个碳原子。
A
A
【练习】请写出下列物质的分子式。
C7H8O5
C8H7NOCl2
C15H20O4
名称 正戊烷 异戊烷 新戊烷
结构简式 CH3(CH2)3CH3 CH3CH2CH(CH3)2 C(CH3)4
相同点 不同点 戊烷(C5H12)的三种结构,如下所示:
分子式都是C5H12 、 化学性质相似
分子结构不同,物理性质不同, 支链越多,沸点越低
分子式相同:同相对分子量、同组成元素、同质量分数、同最简式;
结构不同 :原子连接方式不同、原子的连接顺序不同、不同物质;
(一)同分异构现象概念:化合物分子式相同而结构不同的现象
①同分
②异构
(二)同分异构体:
具有相同分子式不同结构的化合物互称为同分异构体
六、同分异构概念
D
校本P8
1.(2023·枣庄高二联考)下列说法不正确的是( )
A.分子式为C3H8与C6H14的两种有机化合物一定互为同系物
B.具有相同的分子式,但结构不同的有机化合物一定互为同分异构体
C.两个相邻同系物一定相差一个CH2原子团
D.具有相同的相对分子质量,但结构不同的有机化合物一定互为同分异构体
四、同分异构体的类型
同分异构现象
构造异构
立体异构
碳架异构
顺反异构
对映异构
位置异构
官能团异构
异构类型 分类标准 类别
碳架异构 C4H10
位置异构 C4H8
C6H4Cl2
官能团异构 C2H6O
(一)有机化合物的构造异构现象
碳骨架不同
官能团的位置不同
官能团
种类不同
(二)有机化合物的立体异构现象
(1)对映异构(手性异构)
当有机物分子中的饱和碳原子连接着4个不同的原子或原子团时,就可能存在对映异构现象。
如乳酸有以下两种对映异构体:
(2)顺反异构
由于碳碳双键不能自由旋转,当有机物分子中含有碳碳双键且每个双键碳原子所连的另外两个原子或原子团不同时就存在顺反异构现象。
顺式异构体
两个相同原子或基团在双键同侧
反式异构体
两个相同原子或基团在双键异侧
填序号
(1)互为同分异构体的是_ _______。
(2)属于碳架异构的是________。
(3)属于位置异构的是________。
(4)属于官能团异构的是________。
(5)属于同一种物质的是________。
①②③⑤⑥
①
②
③⑤⑥
④
【思考】烷烃存在什么异构?
烷烃只存在碳架异构
四、同分异构的书写方法
碳架异构——减碳法:先确定碳链结构,再补氢原子
书写己烷C6H14的同分异构体
注意:A.找中心对称线,对称C支链不重复
B.减C数目不超过C原子数的1/2
C.补H(碳(C)4价原则)
D.甲基不连主链两端;乙基不连主链两端的第二位
丙基不连主链两端的第三位……
减碳法:先碳架,再补氢
【练习】书写庚烷C7H16同分异构体
书写戊烯C5H10的同分异构体
烯烃存在 ①碳架异构→②官能团位置异构
【思考】烯烃存在什么异构?
插入法:先写出具有此碳原子数的烷烃的同分异构体的碳链骨架,再根据碳链的对称性,将官能团插入碳链中,最后用氢原子补足碳的四个价键。(适用于烯烃、炔烃、酮、醚)
【思考】C5H10同分异构体有多少种
烯烃的同分异构体还有环烷烃
书写步骤:类别异构→碳架异构→位置异构
书写戊烷C5H11Cl的同分异构体
等效氢
①同一碳原子上的氢原子等效;
③处于对称位置上的氢原子等效。
1.等效氢原子法
②同一碳原子上所连接甲基上的氢原子等效;
有机物中有几种等效氢就有几种一元取代物
五、有机物同分异构体数目判断的技巧
CH3CH2CH2CH2CH3
CH3-CH2-CH-CH2-CH3
CH2
CH3
CH3
CH3 – C – CH2- CH3
CH3
【练习】1.判断下列有机物的一氯取代物数目:
【思考】CH3CH2CH2CH2CH3的二氯取代物有多少种:
