1.2元素周期表、律(共34张ppt)化学人教版(2019)选择性必修2
文档属性
| 名称 | 1.2元素周期表、律(共34张ppt)化学人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-08 00:00:00 | ||
图片预览




文档简介
(共34张PPT)
第一章 原子结构与性质
第二节 原子结构与元素性质
元素周期表、律
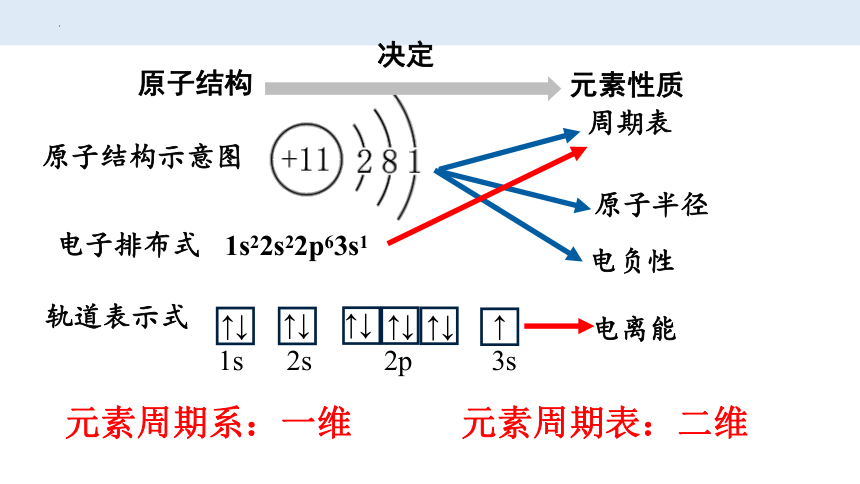
原子结构
原子结构示意图
电子排布式
轨道表示式
1s22s22p63s1
元素性质
原子半径
电离能
电负性
决定
周期表
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s 2s 2p 3s
元素周期系:一维 元素周期表:二维
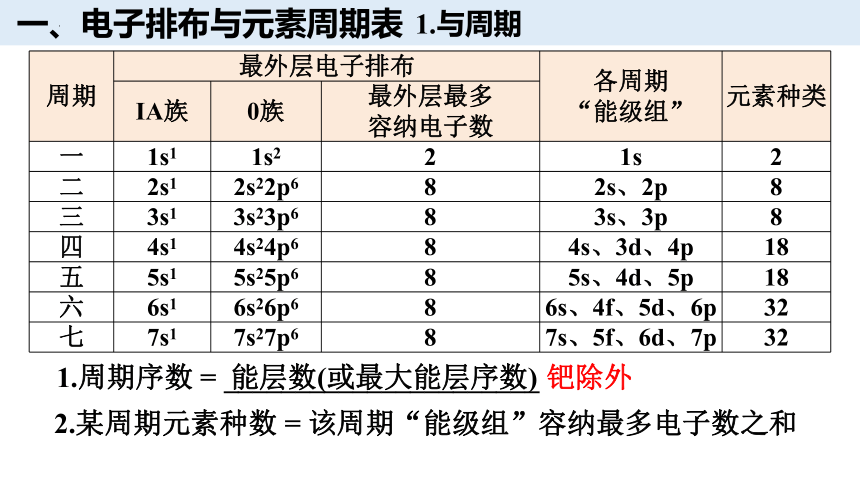
一、电子排布与元素周期表
周期 最外层电子排布 各周期 “能级组” 元素种类
ⅠA族 0族 最外层最多 容纳电子数 一 1s1 1s2 2 1s 2
二 2s1 2s22p6 8 2s、2p 8
三 3s1 3s23p6 8 3s、3p 8
四 4s1 4s24p6 8 4s、3d、4p 18
五 5s1 5s25p6 8 5s、4d、5p 18
六 6s1 6s26p6 8 6s、4f、5d、6p 32
七 7s1 7s27p6 8 7s、5f、6d、7p 32
1.周期序数 = ______________________ 钯除外
2.某周期元素种数 = 该周期“能级组”容纳最多电子数之和
能层数(或最大能层序数)
1.与周期
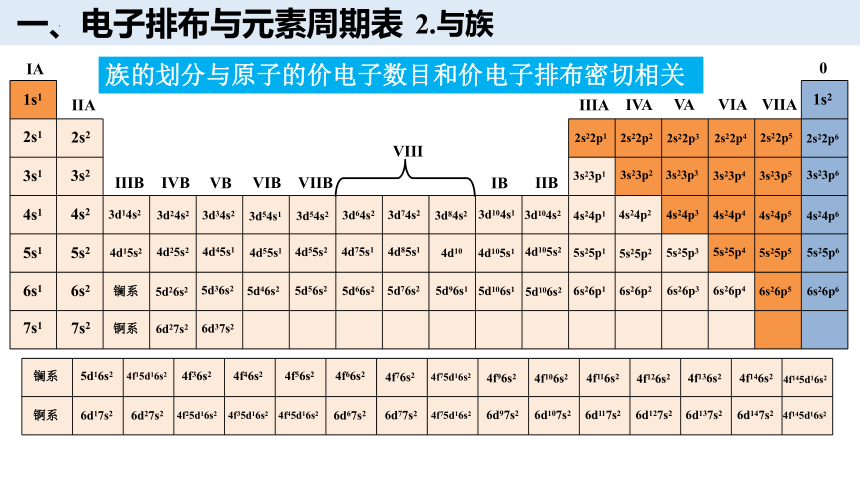
2.与族
一、电子排布与元素周期表
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
VA
IVA
IIIA
IIB
IB
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
VIII
IIA
族的划分与原子的价电子数目和价电子排布密切相关
2.与族
一、电子排布与元素周期表
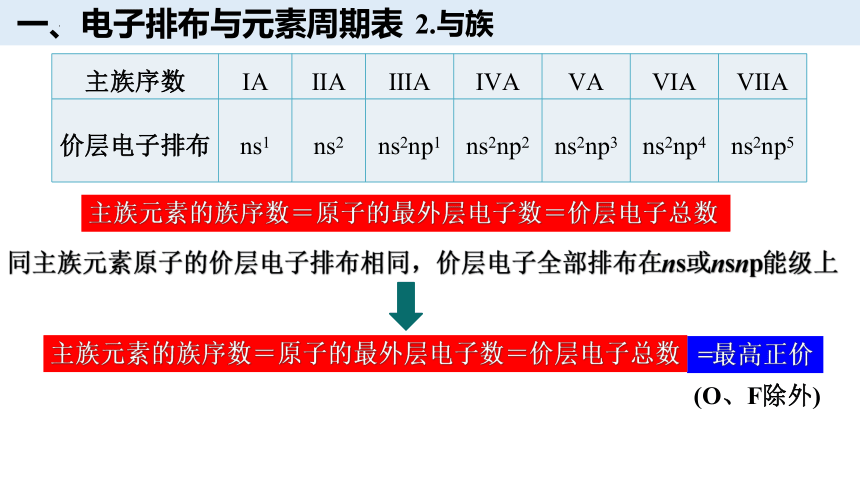
主族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
价层电子排布 ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5
主族元素的族序数=原子的最外层电子数=价层电子总数
同主族元素原子的价层电子排布相同,价层电子全部排布在ns或nsnp能级上
=最高正价
(O、F除外)
主族元素的族序数=原子的最外层电子数=价层电子总数
2.与族
一、电子排布与元素周期表
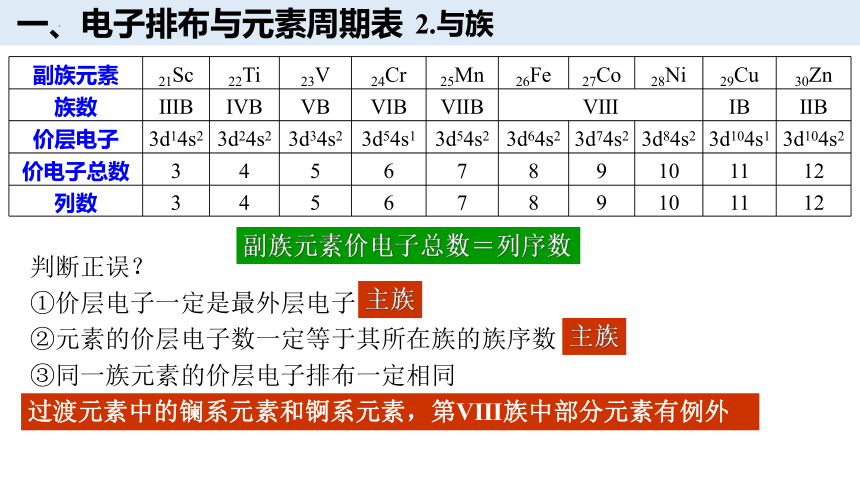
副族元素 21Sc 22Ti 23V 24Cr 25Mn 26Fe 27Co 28Ni 29Cu 30Zn
族数 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
价层电子 3d14s2 3d24s2 3d34s2 3d54s1 3d54s2 3d64s2 3d74s2 3d84s2 3d104s1 3d104s2
价电子总数 3 4 5 6 7 8 9 10 11 12
列数 3 4 5 6 7 8 9 10 11 12
副族元素价电子总数=列序数
判断正误?
①价层电子一定是最外层电子
②元素的价层电子数一定等于其所在族的族序数
③同一族元素的价层电子排布一定相同
主族
主族
过渡元素中的镧系元素和锕系元素,第Ⅷ族中部分元素有例外
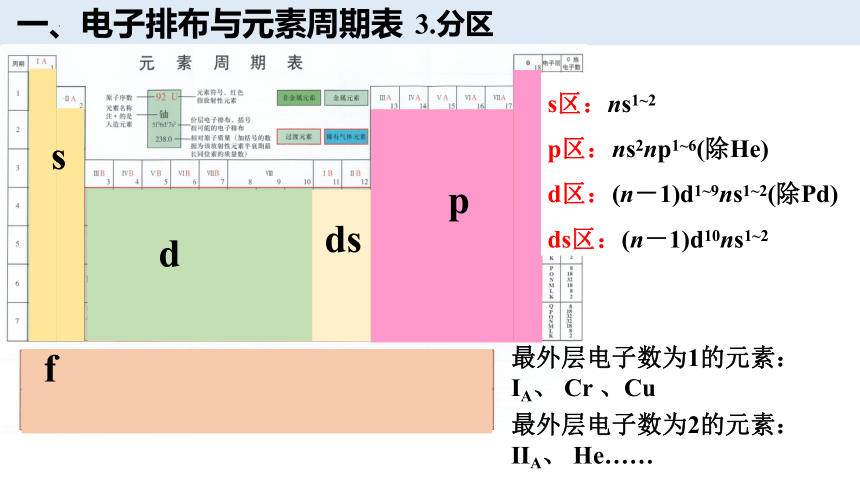
3.分区
一、电子排布与元素周期表
s
p
d
f
ds
最外层电子数为1的元素:
ⅠA、 Cr 、Cu
最外层电子数为2的元素:
ⅡA、 He……
s区:ns1~2
p区:ns2np1~6(除He)
d区:(n-1)d1~9ns1~2(除Pd)
ds区:(n-1)d10ns1~2
已知某元素的原子序数为25,试写出该元素原子的电子排布式,并指出该元素在周期表中所属周期、族和区。
结构
位置
1s22s22p63s23p6 3d54s2
或 [Ar] 3d54s2
第四周期
d 区
VIIB族
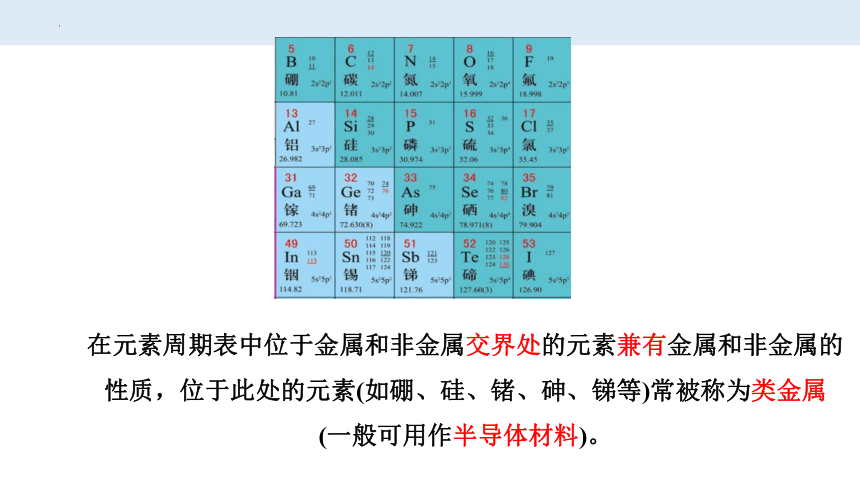
在元素周期表中位于金属和非金属交界处的元素兼有金属和非金属的性质,位于此处的元素(如硼、硅、锗、砷、锑等)常被称为类金属
(一般可用作半导体材料)。
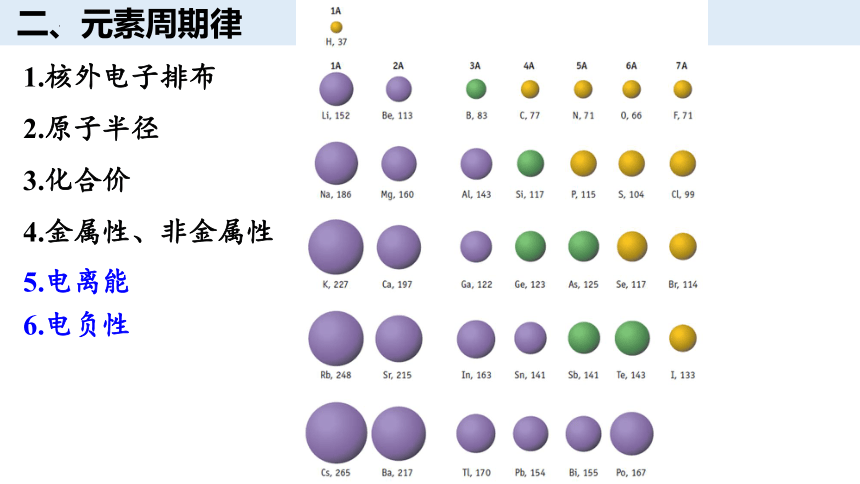
二、元素周期律
随着原子序数的递增,元素的物理、化学性质呈现周期性变化
二、元素周期律
1.核外电子排布
2.原子半径
3.化合价
4.金属性、非金属性
5.电离能
6.电负性
(1)同周期从左到右,原子半径逐渐______;
(2)同主族从上到下,原子半径逐渐_____。
(3)电子层数越多,半径___________。
增大
不一定越大
核电荷数增大,核对电子的吸引力增强
电子层数增多,电子间的排斥力增强
减小
原子半径变化核心:带电微粒间相互作用
原子半径 ≠ 最外层电子到原子核的距离
1.电子层数
2.核电荷数
3.电子总数
离子半径如何比较?
长周期部分元素半径
二、元素周期律
第一电离能
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量。符号为I1
逐级电离能:I1文字说理:随着电子的逐个失去,阳离子所带的正电荷数越来越高,离子半径也会越来越小,核对电子的引力作用增强,再要失去一个电子需克服的电性引力也越来越大,消耗的能量也越来越高
影响电离能的因素:核电荷数、原子半径、电子构型
二、元素周期律
第一电离能
同主族元素,从上至下,随着原子序数的增加,I1呈现减小趋势
I1数值越小
原子越容易失去第一个电子
能层增多
电子的排斥力增强
意义
解释
二、元素周期律
第一电离能
同一周期中,碱金属元素的I1最小,稀有气体元素的I1最大
同周期主族元素,从左至右,随着原子序数的递增,I1呈现增大的趋势
原子核对外层电子的吸引力增大
解释
同周期元素的I1最小的和最大的分别是什么元素?
同周期元素的I1变化趋势如何,原因?
【思考】为什么B的I1小于Be O的I1小于N Al的I1小于Mg S的I1小于P
碱金属的电离能与碱金属的活泼性存在什么联系?
碱金属元素的I1越小,原子越容易失去电子,活泼性越强
可否将I1作为判定金属活动性顺序的依据?
元素 Na Mg Al
496 738 578
4 562 1 451 1 817
6 912 7 733 2 745
9 543 10 540 11 575
13 353 13 630 14 830
16 610 17 995 18 376
20 114 21 703 23 293
电离能
(kJ·mol-1)
电离能与元素的化合价是否有联系?
可否将I1作为判定金属活动性顺序的依据?
金属活动性:Na>Mg>Al
第一电离能:Mg>Al>Na
逐级电离能
元素的逐级电离能有何变化规律?与原子的核外电子排布有何关系?
电子亲和能
元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是 ;氮元素的E1呈现异常的原因是 。
电子亲和能
同周期随着核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大;
氮元素的2p能级达到半满状态,原子相对稳定,不易失去电子,也不容易得到电子
想出一个好点子最好的办法,就是想出很多的点子。
——莱纳斯·鲍林
二、元素周期律
电负性
鲍林
①键合电子:
原子中用于形成化学键的电子
②电负性:描述不同元素的原子对键合电子吸引力的大小电负性越大的原子,对键合电子的吸引力越大
指定氟的电负性为4.0,锂的电负性为1.0,
计算其他元素的相对电负性(稀有气体未计)
同主族元素的电负性变化趋势如何?
同主族元素,自上而下,元素的电负性逐渐变小
同周期元素的电负性变化趋势如何?
同周期元素,自左向右,元素的电负性逐渐增大
【重点】电负性的应用
(1)判断元素的金属性和非金属性及其强弱
(2)判断元素的化合价
(3)判断化学键及化合物的类型
(4)判断化学键的极性强弱
(5)解释“对角线”规则
二、元素周期律
电负性
电负性 > 1.8 非金属元素
电负性 < 1.8 金属元素
电负性 ≈ 1.8 类金属元素
金属元素的电负性越小,越活泼;
非金属元素的电负性越大,越活泼
【重点】电负性的应用
(1)判断元素的金属性和非金属性及其强弱
(2)判断元素的化合价
(3)判断化学键及化合物的类型
(4)判断化学键的极性强弱
(5)解释“对角线”规则
二、元素周期律
电负性
①电负性数值小的元素在化合物中吸引电子的能力弱,化合价为正值
②电负性数值大的元素在化合物中吸引电子的能力强,化合价为负值
H O Cl
H
C
H
H
H
H
Si
H
H
H
【重点】电负性的应用
(1)判断元素的金属性和非金属性及其强弱
(2)判断元素的化合价
(3)判断化学键及化合物的类型
(4)判断化学键的极性强弱
(5)解释“对角线”规则
二、元素周期律
电负性
①电负性差值大于1.7,形成离子键
②电负性差值小于1.7,形成共价键
判断化合物类型AlF3、AlCl3
【重点】电负性的应用
(1)判断元素的金属性和非金属性及其强弱
(2)判断元素的化合价
(3)判断化学键及化合物的类型
(4)判断化学键的极性强弱
(5)解释“对角线”规则
二、元素周期律
电负性
若两种不同的非金属元素的原子间形成共价键,则必为极性键,且成键原子的电负性之差越大,键的极性越强
键的极性:
H-F>H-Cl>H-Br
某些主族元素与右下方的主族元素的某些性质是相似的,
Li与Mg
①燃烧都只生成氧化物;
②都能直接与N2反应生成氮化物(Li3N、Mg3N2)。
③对应氢氧化物加热时都可分解生成氧化物和H2O。
④对应碳酸盐均不稳定,受热均能分解生成相应氧化物和CO2。
⑤含锂和镁的某些盐,如碳酸盐、磷酸盐等均难溶于水。
对角线规则
对角线规则
Be与Al
2Al+6HCl = 2AlCl3+3H2↑
Be+2HCl = BeCl2+H2↑
2Al+2NaOH+2H2O = 2NaAlO2+3H2↑
Be+2NaOH = Na2BeO2+H2↑
Al2O3+6HCl = 2AlCl3+3H2O
BeO+2HCl = BeCl2+H2O
Al2O3+2NaOH = 2NaAlO2+H2O
Be(OH)2+2NaOH=Na2BeO2+ 2H2O
Al(OH)3+NaOH=NaAlO2+ 2H2O
Al(OH)3+3HCl = AlCl3+3H2O
Be(OH)2+2HCl = BeCl2+2H2O
BeO+2NaOH = Na2BeO2+H2O
B与Si
AlCl3是共价化合物,则BeCl2也是共价化合物
Si的熔点高、硬度大,则B也具有高熔点和大的硬度
Si3N4与BN均由相应原子直接构成
最高价氧化物对应水化物的酸均为弱酸
单质的氧化性逐渐增强
元素的非金属性逐渐增强
最高价氧化物对应水化物的酸性越来越强
与氢气化合的难易程度越来越容易
最简单气态氢化物的稳定性越来越稳定
单质的还原性逐渐增强
元素的金属性逐渐增强
最高价氧化物对应水化物的碱性越来越强
与水或酸反应的剧烈程度越来越剧烈
元素的电负性逐渐增强
元素的I1逐渐增大(注意反常)
元素的电负性逐渐减小
元素的I1逐渐减小(注意反常)
第一章 原子结构与性质
第二节 原子结构与元素性质
元素周期表、律
原子结构
原子结构示意图
电子排布式
轨道表示式
1s22s22p63s1
元素性质
原子半径
电离能
电负性
决定
周期表
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1s 2s 2p 3s
元素周期系:一维 元素周期表:二维
一、电子排布与元素周期表
周期 最外层电子排布 各周期 “能级组” 元素种类
ⅠA族 0族 最外层最多 容纳电子数 一 1s1 1s2 2 1s 2
二 2s1 2s22p6 8 2s、2p 8
三 3s1 3s23p6 8 3s、3p 8
四 4s1 4s24p6 8 4s、3d、4p 18
五 5s1 5s25p6 8 5s、4d、5p 18
六 6s1 6s26p6 8 6s、4f、5d、6p 32
七 7s1 7s27p6 8 7s、5f、6d、7p 32
1.周期序数 = ______________________ 钯除外
2.某周期元素种数 = 该周期“能级组”容纳最多电子数之和
能层数(或最大能层序数)
1.与周期
2.与族
一、电子排布与元素周期表
1s1
2s1
3s1
4s1
5s1
6s1
7s1
2s2
3s2
4s2
5s2
6s2
7s2
2s22p1
3s23p1
4s24p1
5s25p1
6s26p1
2s22p2
3s23p2
4s24p2
5s25p2
6s26p2
2s22p3
3s23p3
4s24p3
5s25p3
6s26p3
2s22p4
3s23p4
4s24p4
5s25p4
6s26p4
2s22p5
3s23p5
4s24p5
5s25p5
6s26p5
2s22p6
3s23p6
4s24p6
5s25p6
6s26p6
1s2
3d14s2
4d15s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
4d55s1
5d26s2
镧系
5d66s2
4d75s1
5d76s2
4d85s1
5d96s1
4d10
5d106s1
4d105s1
4d105s2
5d106s2
6d27s2
锕系
5d46s2
4d55s2
4d45s1
4d25s2
5d36s2
5d56s2
6d37s2
镧系
锕系
5d16s2
6d17s2
4f15d16s2
4f46s2
4f36s2
4f56s2
4f76s2
4f66s2
4f75d16s2
4f106s2
4f96s2
4f146s2
4f136s2
4f126s2
4f116s2
4f145d16s2
6d27s2
4f25d16s2
4f35d16s2
6d77s2
6d67s2
4f75d16s2
6d97s2
6d117s2
6d127s2
6d137s2
6d147s2
6d107s2
4f45d16s2
4f145d16s2
IA
VA
IVA
IIIA
IIB
IB
IVB
IIIB
VB
VIB
VIIB
VIIA
VIA
0
VIII
IIA
族的划分与原子的价电子数目和价电子排布密切相关
2.与族
一、电子排布与元素周期表
主族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
价层电子排布 ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5
主族元素的族序数=原子的最外层电子数=价层电子总数
同主族元素原子的价层电子排布相同,价层电子全部排布在ns或nsnp能级上
=最高正价
(O、F除外)
主族元素的族序数=原子的最外层电子数=价层电子总数
2.与族
一、电子排布与元素周期表
副族元素 21Sc 22Ti 23V 24Cr 25Mn 26Fe 27Co 28Ni 29Cu 30Zn
族数 ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB
价层电子 3d14s2 3d24s2 3d34s2 3d54s1 3d54s2 3d64s2 3d74s2 3d84s2 3d104s1 3d104s2
价电子总数 3 4 5 6 7 8 9 10 11 12
列数 3 4 5 6 7 8 9 10 11 12
副族元素价电子总数=列序数
判断正误?
①价层电子一定是最外层电子
②元素的价层电子数一定等于其所在族的族序数
③同一族元素的价层电子排布一定相同
主族
主族
过渡元素中的镧系元素和锕系元素,第Ⅷ族中部分元素有例外
3.分区
一、电子排布与元素周期表
s
p
d
f
ds
最外层电子数为1的元素:
ⅠA、 Cr 、Cu
最外层电子数为2的元素:
ⅡA、 He……
s区:ns1~2
p区:ns2np1~6(除He)
d区:(n-1)d1~9ns1~2(除Pd)
ds区:(n-1)d10ns1~2
已知某元素的原子序数为25,试写出该元素原子的电子排布式,并指出该元素在周期表中所属周期、族和区。
结构
位置
1s22s22p63s23p6 3d54s2
或 [Ar] 3d54s2
第四周期
d 区
VIIB族
在元素周期表中位于金属和非金属交界处的元素兼有金属和非金属的性质,位于此处的元素(如硼、硅、锗、砷、锑等)常被称为类金属
(一般可用作半导体材料)。
二、元素周期律
随着原子序数的递增,元素的物理、化学性质呈现周期性变化
二、元素周期律
1.核外电子排布
2.原子半径
3.化合价
4.金属性、非金属性
5.电离能
6.电负性
(1)同周期从左到右,原子半径逐渐______;
(2)同主族从上到下,原子半径逐渐_____。
(3)电子层数越多,半径___________。
增大
不一定越大
核电荷数增大,核对电子的吸引力增强
电子层数增多,电子间的排斥力增强
减小
原子半径变化核心:带电微粒间相互作用
原子半径 ≠ 最外层电子到原子核的距离
1.电子层数
2.核电荷数
3.电子总数
离子半径如何比较?
长周期部分元素半径
二、元素周期律
第一电离能
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量。符号为I1
逐级电离能:I1
影响电离能的因素:核电荷数、原子半径、电子构型
二、元素周期律
第一电离能
同主族元素,从上至下,随着原子序数的增加,I1呈现减小趋势
I1数值越小
原子越容易失去第一个电子
能层增多
电子的排斥力增强
意义
解释
二、元素周期律
第一电离能
同一周期中,碱金属元素的I1最小,稀有气体元素的I1最大
同周期主族元素,从左至右,随着原子序数的递增,I1呈现增大的趋势
原子核对外层电子的吸引力增大
解释
同周期元素的I1最小的和最大的分别是什么元素?
同周期元素的I1变化趋势如何,原因?
【思考】为什么B的I1小于Be O的I1小于N Al的I1小于Mg S的I1小于P
碱金属的电离能与碱金属的活泼性存在什么联系?
碱金属元素的I1越小,原子越容易失去电子,活泼性越强
可否将I1作为判定金属活动性顺序的依据?
元素 Na Mg Al
496 738 578
4 562 1 451 1 817
6 912 7 733 2 745
9 543 10 540 11 575
13 353 13 630 14 830
16 610 17 995 18 376
20 114 21 703 23 293
电离能
(kJ·mol-1)
电离能与元素的化合价是否有联系?
可否将I1作为判定金属活动性顺序的依据?
金属活动性:Na>Mg>Al
第一电离能:Mg>Al>Na
逐级电离能
元素的逐级电离能有何变化规律?与原子的核外电子排布有何关系?
电子亲和能
元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是 ;氮元素的E1呈现异常的原因是 。
电子亲和能
同周期随着核电荷数依次增大,原子半径逐渐变小,故结合一个电子释放出的能量依次增大;
氮元素的2p能级达到半满状态,原子相对稳定,不易失去电子,也不容易得到电子
想出一个好点子最好的办法,就是想出很多的点子。
——莱纳斯·鲍林
二、元素周期律
电负性
鲍林
①键合电子:
原子中用于形成化学键的电子
②电负性:描述不同元素的原子对键合电子吸引力的大小电负性越大的原子,对键合电子的吸引力越大
指定氟的电负性为4.0,锂的电负性为1.0,
计算其他元素的相对电负性(稀有气体未计)
同主族元素的电负性变化趋势如何?
同主族元素,自上而下,元素的电负性逐渐变小
同周期元素的电负性变化趋势如何?
同周期元素,自左向右,元素的电负性逐渐增大
【重点】电负性的应用
(1)判断元素的金属性和非金属性及其强弱
(2)判断元素的化合价
(3)判断化学键及化合物的类型
(4)判断化学键的极性强弱
(5)解释“对角线”规则
二、元素周期律
电负性
电负性 > 1.8 非金属元素
电负性 < 1.8 金属元素
电负性 ≈ 1.8 类金属元素
金属元素的电负性越小,越活泼;
非金属元素的电负性越大,越活泼
【重点】电负性的应用
(1)判断元素的金属性和非金属性及其强弱
(2)判断元素的化合价
(3)判断化学键及化合物的类型
(4)判断化学键的极性强弱
(5)解释“对角线”规则
二、元素周期律
电负性
①电负性数值小的元素在化合物中吸引电子的能力弱,化合价为正值
②电负性数值大的元素在化合物中吸引电子的能力强,化合价为负值
H O Cl
H
C
H
H
H
H
Si
H
H
H
【重点】电负性的应用
(1)判断元素的金属性和非金属性及其强弱
(2)判断元素的化合价
(3)判断化学键及化合物的类型
(4)判断化学键的极性强弱
(5)解释“对角线”规则
二、元素周期律
电负性
①电负性差值大于1.7,形成离子键
②电负性差值小于1.7,形成共价键
判断化合物类型AlF3、AlCl3
【重点】电负性的应用
(1)判断元素的金属性和非金属性及其强弱
(2)判断元素的化合价
(3)判断化学键及化合物的类型
(4)判断化学键的极性强弱
(5)解释“对角线”规则
二、元素周期律
电负性
若两种不同的非金属元素的原子间形成共价键,则必为极性键,且成键原子的电负性之差越大,键的极性越强
键的极性:
H-F>H-Cl>H-Br
某些主族元素与右下方的主族元素的某些性质是相似的,
Li与Mg
①燃烧都只生成氧化物;
②都能直接与N2反应生成氮化物(Li3N、Mg3N2)。
③对应氢氧化物加热时都可分解生成氧化物和H2O。
④对应碳酸盐均不稳定,受热均能分解生成相应氧化物和CO2。
⑤含锂和镁的某些盐,如碳酸盐、磷酸盐等均难溶于水。
对角线规则
对角线规则
Be与Al
2Al+6HCl = 2AlCl3+3H2↑
Be+2HCl = BeCl2+H2↑
2Al+2NaOH+2H2O = 2NaAlO2+3H2↑
Be+2NaOH = Na2BeO2+H2↑
Al2O3+6HCl = 2AlCl3+3H2O
BeO+2HCl = BeCl2+H2O
Al2O3+2NaOH = 2NaAlO2+H2O
Be(OH)2+2NaOH=Na2BeO2+ 2H2O
Al(OH)3+NaOH=NaAlO2+ 2H2O
Al(OH)3+3HCl = AlCl3+3H2O
Be(OH)2+2HCl = BeCl2+2H2O
BeO+2NaOH = Na2BeO2+H2O
B与Si
AlCl3是共价化合物,则BeCl2也是共价化合物
Si的熔点高、硬度大,则B也具有高熔点和大的硬度
Si3N4与BN均由相应原子直接构成
最高价氧化物对应水化物的酸均为弱酸
单质的氧化性逐渐增强
元素的非金属性逐渐增强
最高价氧化物对应水化物的酸性越来越强
与氢气化合的难易程度越来越容易
最简单气态氢化物的稳定性越来越稳定
单质的还原性逐渐增强
元素的金属性逐渐增强
最高价氧化物对应水化物的碱性越来越强
与水或酸反应的剧烈程度越来越剧烈
元素的电负性逐渐增强
元素的I1逐渐增大(注意反常)
元素的电负性逐渐减小
元素的I1逐渐减小(注意反常)
