2.2.2化学平衡移动(共28张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 2.2.2化学平衡移动(共28张ppt)化学人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-08 00:00:00 | ||
图片预览



文档简介
(共28张PPT)
第二章 化学反应速率与平衡
第二节 化学平衡
第二课时 平衡移动
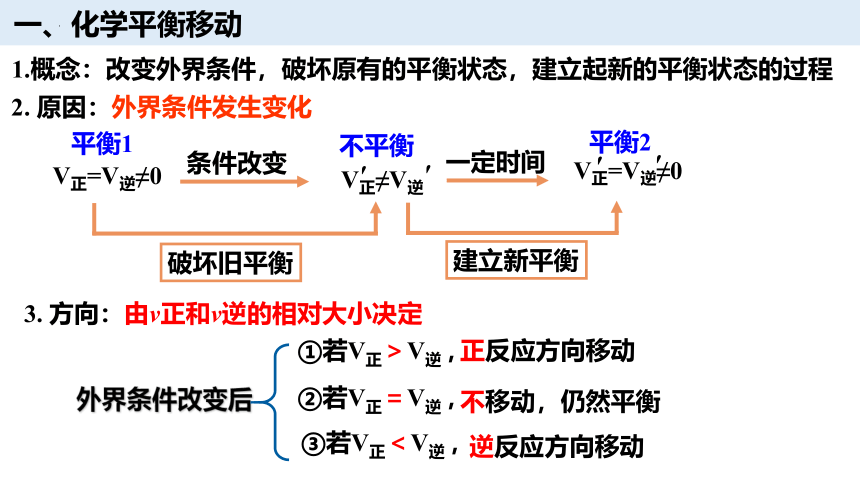
一、化学平衡移动
1.概念:改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程
2. 原因:外界条件发生变化
V正=V逆≠0
条件改变
平衡1
建立新平衡
破坏旧平衡
V正=V逆≠0
′
′
一定时间
V正≠V逆
′
′
平衡2
不平衡
①若V正>V逆 ,
正反应方向移动
不移动,仍然平衡
②若V正=V逆 ,
逆反应方向移动
③若V正<V逆 ,
外界条件改变后
3. 方向:由v正和v逆的相对大小决定
平衡
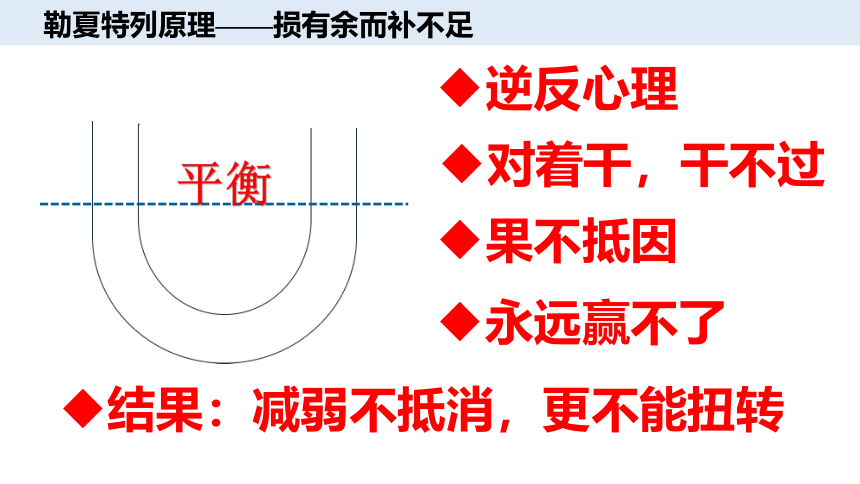
勒夏特列原理——损有余而补不足
结果:减弱不抵消,更不能扭转
对着干,干不过
果不抵因
逆反心理
永远赢不了
在其他条件不变的情况下:
正反应方向移动
逆反应方向移动
v正> v逆
v正< v逆
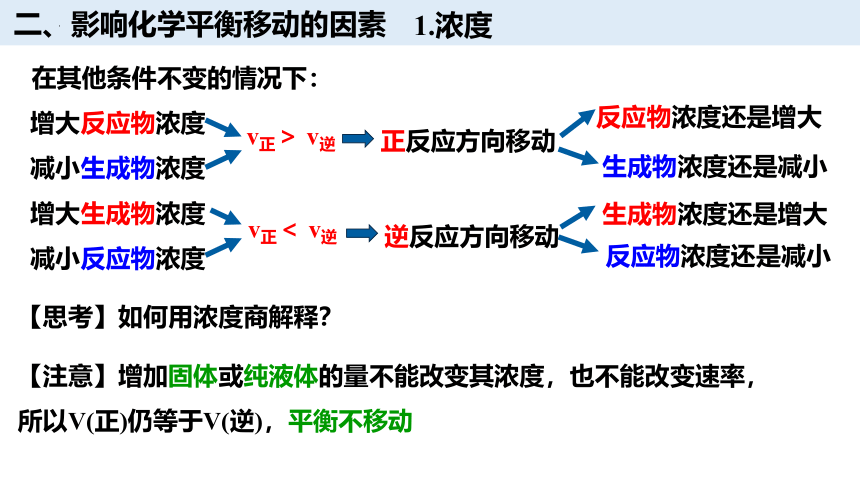
【注意】增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以V(正)仍等于V(逆),平衡不移动
二、影响化学平衡移动的因素
1.浓度
增大反应物浓度
减小生成物浓度
增大生成物浓度
减小反应物浓度
【思考】如何用浓度商解释?
反应物浓度还是增大
反应物浓度还是减小
生成物浓度还是增大
生成物浓度还是减小
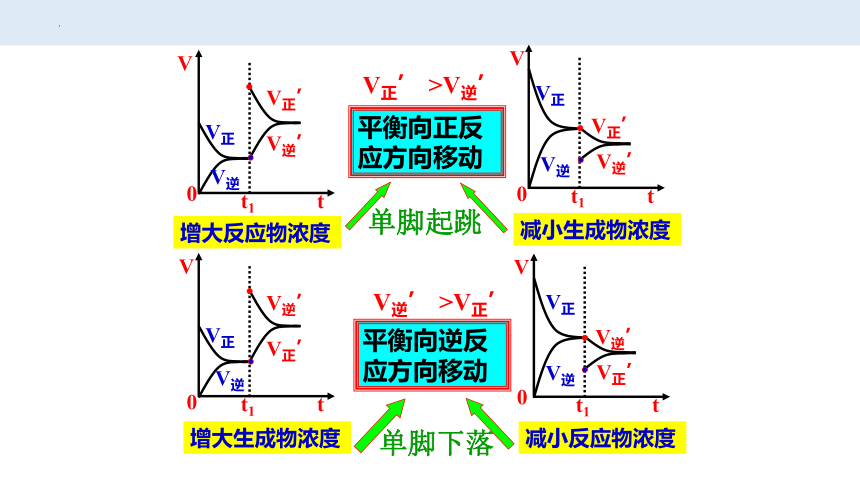
V正
V逆
V正’
V逆’
0
V
t1
t
增大反应物浓度
V正’
V逆’
V正
V逆
0
V
t1
t
增大生成物浓度
减小反应物浓度
平衡向正反应方向移动
平衡向逆反应方向移动
减小生成物浓度
V正
V逆
V正’
V逆’
0
V
t1
t
V正’ >V逆’
0
V正
V逆
V正’
V逆’
V
t1
t
V逆’ >V正’
单脚起跳
单脚下落
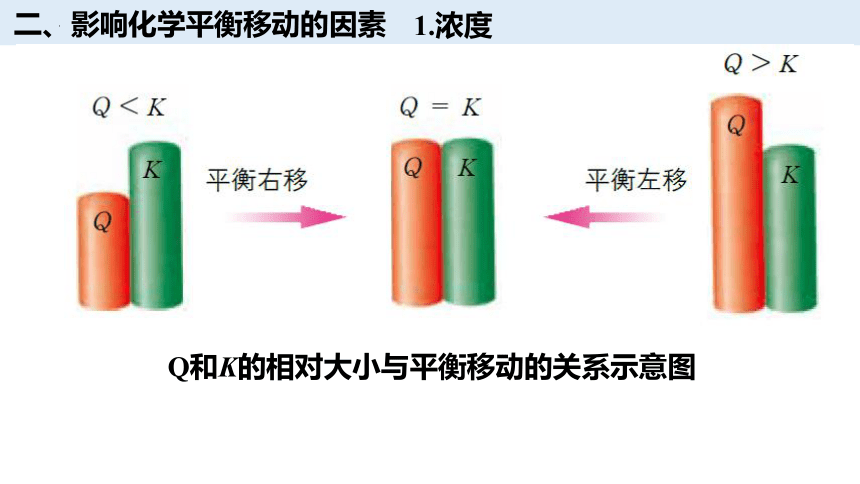
二、影响化学平衡移动的因素
1.浓度
Q和K的相对大小与平衡移动的关系示意图
二、影响化学平衡移动的因素
2.压强
反应体系中有气体参加且反应前后总体积发生改变 aA(g)+bB(g) cC(g)+dD(g) a+b≠c+d Δυg ≠ 0
【牢记】对于有气态物质参与的反应,在一定温度下,改变体系压强,各气态物质的浓度也同等倍数被改变
【思考】如何用浓度商解释?(定量分析)
但最终压强仍然增大
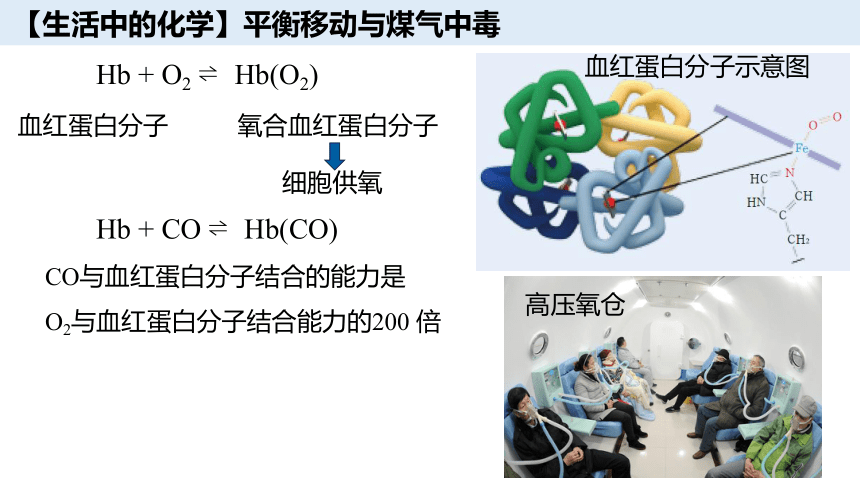
血红蛋白分子示意图
Hb + O2 Hb(O2)
血红蛋白分子
氧合血红蛋白分子
Hb + CO Hb(CO)
CO与血红蛋白分子结合的能力是
O2与血红蛋白分子结合能力的200 倍
细胞供氧
高压氧仓
【生活中的化学】平衡移动与煤气中毒
V正
V逆
V正’
V逆’
0
V
t1
t
增大压强(压缩体积)
mA(g)+nB (g) pC (g)+qD (g)
①当 m + n > p + q时
0
V正
V逆
V正’
V逆’
V
t1
t
减小压强(膨胀体积)
平衡正移
V正’ > V逆’
平衡逆移
V逆’>V正’
压强通过改变体积等程度改变浓度作用于体系
V正
V逆
V正’
V逆’
0
V
t1
t
增大压强(压缩体积)
mA(g)+nB (g) pC (g)+qD (g)
②当 m + n < p + q时
0
V正
V逆
V正’
V逆’
V
t1
t
减小压强(膨胀体积)
平衡逆移
V逆’>V正’
平衡正移
V正’ > V逆’
V正
V逆
V正’
V逆’
0
V
t1
t
增大压强(压缩体积)
mA(g)+nB (g) pC (g)+qD (g)
③当 m + n = p + q时
0
V正
V逆
V正’
V逆’
V
t1
t
减小压强(膨胀体积)
平衡不移动
V正’ = V逆’
平衡不移动
V正’ = V逆’
例1:已知化学反应2A( )+B(g) 2C( )达到平衡,当增大压强时,平衡向逆反应方向移动,则A和C的状态可能是什么?
例2:恒温,一定压强下的密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g),达平衡后, 将压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确的是( )
A.平衡正移 B.(a+b)>(c+d)
C.Z的体积分数变小 D.X的转化率变大
C为g,A为s或l或aq
C
二、影响化学平衡移动的因素
3.温度
在其他条件不变的情况下:
【注意】温度
吸热反应对温度的变化更敏感!(阿伦尼乌斯)
V正 和 V逆都
但V(吸热反应方向)增加更多
升高温度使吸热反应的K 增大,向吸热反应方向移动,温度仍然升高
降低温度使放热反应的K 增大,向放热反应方向移动,温度仍然降低
【思考】用浓度商解释?
【判断】仅由温度或压强改变引起的平衡正向移动,反应物转化率一定增大?
√
mA(g)+nB (g) pC (g)+qD (g)
ΔH<0
V正
V逆
V正’
V逆’
0
V
t1
t
升高温度
平衡逆移
V正’ > V逆’
降低温度
平衡正移
V逆’>V正’
0
V正
V逆
V正’
V逆’
V
t1
t
mA(g)+nB (g) pC (g)+qD (g)
ΔH>0
V正
V逆
V正’
V逆’
0
V
t1
t
升高温度
平衡逆移
V正’ > V逆’
降低温度
平衡正移
V逆’>V正’
0
V正
V逆
V正’
V逆’
V
t1
t
二、影响化学平衡移动的因素
4.催化剂
0
V正
V逆
V正’
V逆’
V
t1
t
加入正催化剂
平衡不移动
V正’ = V逆’
催化剂同等程度改变化学反应速率,V’ (正)=V’ (逆)
因此不影响化学平衡,平衡不移动;
但可以改变反应到达平衡所需要的时间
【思考】用什么理论定量解释?
1.勒夏特列原理(定性)
【定义】在一个达到平衡的反应中,如果改变影响平衡的条件之一(c\P\T),平衡向着能够减弱这种改变的方向移动
【例】在1L 的密闭的烧瓶中发生反应,N2O4(g) 2NO2(g),
达到平衡后,加入1mol N2O4 ,平衡向 移动,
若再加入1molNO2,平衡向 移动
右
左
结果:抵抗不抵消,更不能扭转
三、平衡移动判断
经验视角
对着干,干不过
逆反心理
2.反应速率(定量)
三、平衡移动判断
①若V正>V逆 ,
正反应方向移动
不移动
②若V正=V逆 ,
逆反应方向移动
③若V正<V逆 ,
外界条件改变后
速率视角
Qc = K 化学平衡; Qc<K 正向进行; Qc>K 逆向进行
3.浓度商(定量)
恒温条件下,1L密闭容器中发生反应,该反应放热,现已经达到平衡,各物质的物质的量为:2mol、 1mol、 3mol
2SO2(g) + O2 (g) 2SO3 (g)
①再向容器中同时加入3mol O2和3mol SO3,平衡移动方向是?
不移动
②再对容器加热,平衡移动方向是?
逆向
③再对容器压缩体积,平衡移动方向是?
正向
④再向容器中充入氦气,保持体积不变,平衡移动方向是?
不移动
三、平衡移动判断
平衡视角
若将平衡体系Fe3++3SCN- Fe(SCN)3中Fe3+的浓度由1mol·L-1增加到2mol·L-1,平衡如何移动?并证明:在新平衡状态下,1 mol·L-1(已知,同温下,某平衡时刻,三种物质浓度分别为1、5、4mol/L)
在某温度下,将0.1 molN2和0.3mol H2的气态混合物充入10 L的密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),平衡时, c(N2)=0.0080 mol·L-1,加压,将容器压缩为原来的一半。 c(N2)在什么范围?
已知反应3A(g)+B(g) 2C(g)+2D(g) ΔH<0,下图中,a、b曲线分别表示在不同条件下,A与B反应时D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采取的措施是?
①增大A的浓度
②升高温度
③增大D的浓度
④加入催化剂
⑤恒温下,缩小反应容器体积
⑥加入稀有气体,保持容器内压强不变
√
√
√
在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):下列结论正确的是
A.反应Ⅰ:ΔH>0,p2>p1
B.反应Ⅱ:ΔH<0,T2>T1
C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2D.反应Ⅳ:ΔH<0,T2>T1
C
【思考】温度对平衡常数的影响?
温度升高时,平衡向吸热方向移动
果不抵因
N2(g)+3H2(g) 2NH3(g) △H<0
恒容,升温至原来的两倍
恒温恒容
恒温,加压至原来的两倍
加催化剂
加N2至原来的两倍
加NH3至原来的两倍
抽NH3至原来的一半
Q =
c2(NH3)
c (N2) c3(H2)
平衡时刻浓度
任意时刻浓度
K =
c2(NH3)
c (N2) c3(H2)
N2(g)+3H2(g) 2NH3(g) △H<0
恒容,升温至原来的两倍
恒温恒容
恒温,加压至原来的两倍
加催化剂
加N2至原来的两倍
加NH3至原来的两倍
抽NH3至原来的一半
v = k cm(A) cn(B)
逆反应方向移动
①若v正> v逆 ,
正反应方向移动
不移动,仍然平衡
②若v正= v逆 ,
③若v正< v逆 ,
平衡移动方向:v正和v逆的相对大小决定
第二章 化学反应速率与平衡
第二节 化学平衡
第二课时 平衡移动
一、化学平衡移动
1.概念:改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程
2. 原因:外界条件发生变化
V正=V逆≠0
条件改变
平衡1
建立新平衡
破坏旧平衡
V正=V逆≠0
′
′
一定时间
V正≠V逆
′
′
平衡2
不平衡
①若V正>V逆 ,
正反应方向移动
不移动,仍然平衡
②若V正=V逆 ,
逆反应方向移动
③若V正<V逆 ,
外界条件改变后
3. 方向:由v正和v逆的相对大小决定
平衡
勒夏特列原理——损有余而补不足
结果:减弱不抵消,更不能扭转
对着干,干不过
果不抵因
逆反心理
永远赢不了
在其他条件不变的情况下:
正反应方向移动
逆反应方向移动
v正> v逆
v正< v逆
【注意】增加固体或纯液体的量不能改变其浓度,也不能改变速率,所以V(正)仍等于V(逆),平衡不移动
二、影响化学平衡移动的因素
1.浓度
增大反应物浓度
减小生成物浓度
增大生成物浓度
减小反应物浓度
【思考】如何用浓度商解释?
反应物浓度还是增大
反应物浓度还是减小
生成物浓度还是增大
生成物浓度还是减小
V正
V逆
V正’
V逆’
0
V
t1
t
增大反应物浓度
V正’
V逆’
V正
V逆
0
V
t1
t
增大生成物浓度
减小反应物浓度
平衡向正反应方向移动
平衡向逆反应方向移动
减小生成物浓度
V正
V逆
V正’
V逆’
0
V
t1
t
V正’ >V逆’
0
V正
V逆
V正’
V逆’
V
t1
t
V逆’ >V正’
单脚起跳
单脚下落
二、影响化学平衡移动的因素
1.浓度
Q和K的相对大小与平衡移动的关系示意图
二、影响化学平衡移动的因素
2.压强
反应体系中有气体参加且反应前后总体积发生改变 aA(g)+bB(g) cC(g)+dD(g) a+b≠c+d Δυg ≠ 0
【牢记】对于有气态物质参与的反应,在一定温度下,改变体系压强,各气态物质的浓度也同等倍数被改变
【思考】如何用浓度商解释?(定量分析)
但最终压强仍然增大
血红蛋白分子示意图
Hb + O2 Hb(O2)
血红蛋白分子
氧合血红蛋白分子
Hb + CO Hb(CO)
CO与血红蛋白分子结合的能力是
O2与血红蛋白分子结合能力的200 倍
细胞供氧
高压氧仓
【生活中的化学】平衡移动与煤气中毒
V正
V逆
V正’
V逆’
0
V
t1
t
增大压强(压缩体积)
mA(g)+nB (g) pC (g)+qD (g)
①当 m + n > p + q时
0
V正
V逆
V正’
V逆’
V
t1
t
减小压强(膨胀体积)
平衡正移
V正’ > V逆’
平衡逆移
V逆’>V正’
压强通过改变体积等程度改变浓度作用于体系
V正
V逆
V正’
V逆’
0
V
t1
t
增大压强(压缩体积)
mA(g)+nB (g) pC (g)+qD (g)
②当 m + n < p + q时
0
V正
V逆
V正’
V逆’
V
t1
t
减小压强(膨胀体积)
平衡逆移
V逆’>V正’
平衡正移
V正’ > V逆’
V正
V逆
V正’
V逆’
0
V
t1
t
增大压强(压缩体积)
mA(g)+nB (g) pC (g)+qD (g)
③当 m + n = p + q时
0
V正
V逆
V正’
V逆’
V
t1
t
减小压强(膨胀体积)
平衡不移动
V正’ = V逆’
平衡不移动
V正’ = V逆’
例1:已知化学反应2A( )+B(g) 2C( )达到平衡,当增大压强时,平衡向逆反应方向移动,则A和C的状态可能是什么?
例2:恒温,一定压强下的密闭容器中发生反应:aX(g)+bY(g) cZ(g)+dW(g),达平衡后, 将压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确的是( )
A.平衡正移 B.(a+b)>(c+d)
C.Z的体积分数变小 D.X的转化率变大
C为g,A为s或l或aq
C
二、影响化学平衡移动的因素
3.温度
在其他条件不变的情况下:
【注意】温度
吸热反应对温度的变化更敏感!(阿伦尼乌斯)
V正 和 V逆都
但V(吸热反应方向)增加更多
升高温度使吸热反应的K 增大,向吸热反应方向移动,温度仍然升高
降低温度使放热反应的K 增大,向放热反应方向移动,温度仍然降低
【思考】用浓度商解释?
【判断】仅由温度或压强改变引起的平衡正向移动,反应物转化率一定增大?
√
mA(g)+nB (g) pC (g)+qD (g)
ΔH<0
V正
V逆
V正’
V逆’
0
V
t1
t
升高温度
平衡逆移
V正’ > V逆’
降低温度
平衡正移
V逆’>V正’
0
V正
V逆
V正’
V逆’
V
t1
t
mA(g)+nB (g) pC (g)+qD (g)
ΔH>0
V正
V逆
V正’
V逆’
0
V
t1
t
升高温度
平衡逆移
V正’ > V逆’
降低温度
平衡正移
V逆’>V正’
0
V正
V逆
V正’
V逆’
V
t1
t
二、影响化学平衡移动的因素
4.催化剂
0
V正
V逆
V正’
V逆’
V
t1
t
加入正催化剂
平衡不移动
V正’ = V逆’
催化剂同等程度改变化学反应速率,V’ (正)=V’ (逆)
因此不影响化学平衡,平衡不移动;
但可以改变反应到达平衡所需要的时间
【思考】用什么理论定量解释?
1.勒夏特列原理(定性)
【定义】在一个达到平衡的反应中,如果改变影响平衡的条件之一(c\P\T),平衡向着能够减弱这种改变的方向移动
【例】在1L 的密闭的烧瓶中发生反应,N2O4(g) 2NO2(g),
达到平衡后,加入1mol N2O4 ,平衡向 移动,
若再加入1molNO2,平衡向 移动
右
左
结果:抵抗不抵消,更不能扭转
三、平衡移动判断
经验视角
对着干,干不过
逆反心理
2.反应速率(定量)
三、平衡移动判断
①若V正>V逆 ,
正反应方向移动
不移动
②若V正=V逆 ,
逆反应方向移动
③若V正<V逆 ,
外界条件改变后
速率视角
Qc = K 化学平衡; Qc<K 正向进行; Qc>K 逆向进行
3.浓度商(定量)
恒温条件下,1L密闭容器中发生反应,该反应放热,现已经达到平衡,各物质的物质的量为:2mol、 1mol、 3mol
2SO2(g) + O2 (g) 2SO3 (g)
①再向容器中同时加入3mol O2和3mol SO3,平衡移动方向是?
不移动
②再对容器加热,平衡移动方向是?
逆向
③再对容器压缩体积,平衡移动方向是?
正向
④再向容器中充入氦气,保持体积不变,平衡移动方向是?
不移动
三、平衡移动判断
平衡视角
若将平衡体系Fe3++3SCN- Fe(SCN)3中Fe3+的浓度由1mol·L-1增加到2mol·L-1,平衡如何移动?并证明:在新平衡状态下,1 mol·L-1
在某温度下,将0.1 molN2和0.3mol H2的气态混合物充入10 L的密闭容器中,发生反应N2(g)+3H2(g) 2NH3(g),平衡时, c(N2)=0.0080 mol·L-1,加压,将容器压缩为原来的一半。 c(N2)在什么范围?
已知反应3A(g)+B(g) 2C(g)+2D(g) ΔH<0,下图中,a、b曲线分别表示在不同条件下,A与B反应时D的体积分数随时间t的变化情况。若想使曲线b(实线)变为曲线a(虚线),可采取的措施是?
①增大A的浓度
②升高温度
③增大D的浓度
④加入催化剂
⑤恒温下,缩小反应容器体积
⑥加入稀有气体,保持容器内压强不变
√
√
√
在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量):下列结论正确的是
A.反应Ⅰ:ΔH>0,p2>p1
B.反应Ⅱ:ΔH<0,T2>T1
C.反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2
C
【思考】温度对平衡常数的影响?
温度升高时,平衡向吸热方向移动
果不抵因
N2(g)+3H2(g) 2NH3(g) △H<0
恒容,升温至原来的两倍
恒温恒容
恒温,加压至原来的两倍
加催化剂
加N2至原来的两倍
加NH3至原来的两倍
抽NH3至原来的一半
Q =
c2(NH3)
c (N2) c3(H2)
平衡时刻浓度
任意时刻浓度
K =
c2(NH3)
c (N2) c3(H2)
N2(g)+3H2(g) 2NH3(g) △H<0
恒容,升温至原来的两倍
恒温恒容
恒温,加压至原来的两倍
加催化剂
加N2至原来的两倍
加NH3至原来的两倍
抽NH3至原来的一半
v = k cm(A) cn(B)
逆反应方向移动
①若v正> v逆 ,
正反应方向移动
不移动,仍然平衡
②若v正= v逆 ,
③若v正< v逆 ,
平衡移动方向:v正和v逆的相对大小决定
