新疆温州大学拜城实验高中人教版高一化学必修一课件:2-3 氧化还原反应(共19张PPT)
文档属性
| 名称 | 新疆温州大学拜城实验高中人教版高一化学必修一课件:2-3 氧化还原反应(共19张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 559.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-10-14 00:00:00 | ||
图片预览





文档简介
课件19张PPT。 初中我们学过氧化反应——有氧气参
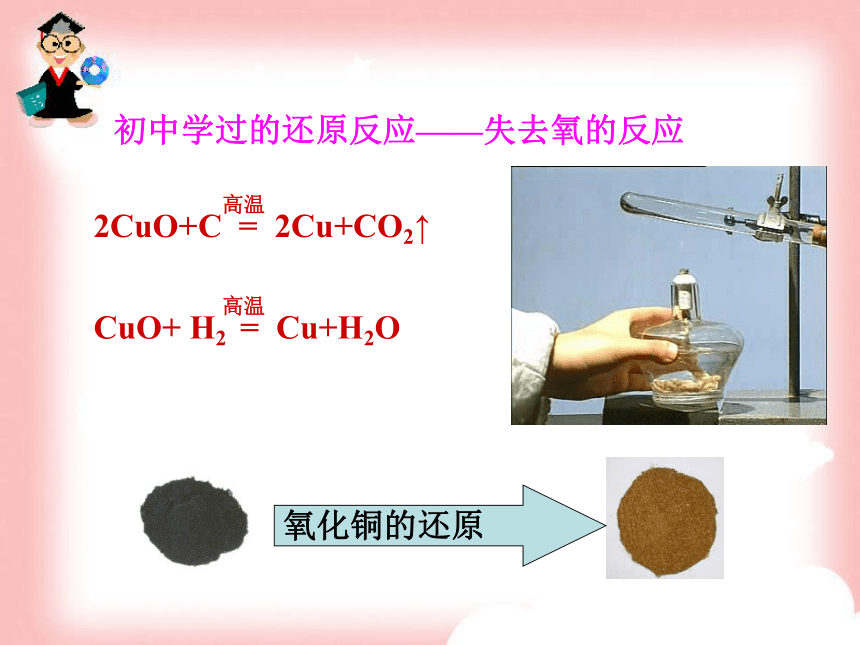
加的反应。初中学过的还原反应——失去氧的反应氧化铜的还原一、氧化还原反应第三节氧化还原反应授课人:玛丽亚木 一种物质被氧化,同时另一种物质被还原的
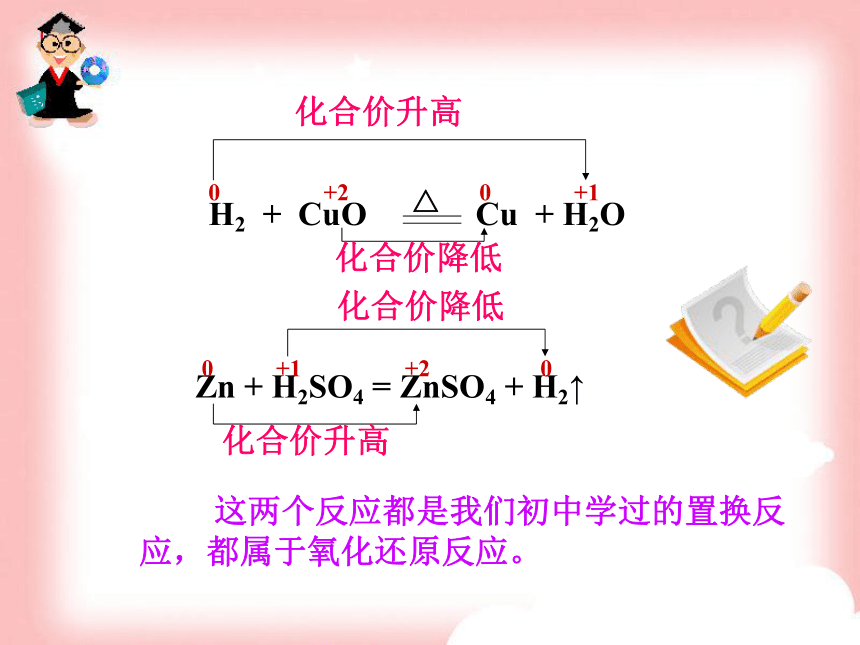
反应,这样的反应称为氧化还原反应。分析木炭还原氧化铜1.氧化铜失去氧变成单质铜2. 碳得到了氧变成了二氧化碳——还原反应——氧化反应一、氧化还原反应Fe + CuSO4 = FeSO4 + Cu分析这个反应的化合价升降变化?1.单质的化合价为0,在反应式中,Fe化合价为
0,生成Fe2+,化合价为+2。
2.CuSO4中的Cu2+化合价为+2,生成单质Cu的
化合价为0。0价→+2价,化合价升高+2价→0价,化合价降低? 像这种凡是有元素化合介升降的化学反应都是氧化还原反应。例如:以下反应中化合价的升降变化Zn + H2SO4 = ZnSO4 + H2↑S + O2 = SO2Zn + H2SO4 = ZnSO4 + H2↑000+2+10+1+2化合价降低化合价降低化合价升高化合价升高 这两个反应都是我们初中学过的置换反应,都属于氧化还原反应。那么是不是化合反应就是氧化还原反应呢?例如:Na2O+H2O=2NaOH这个反应说明了化合反应不一定是氧化还原反应初中学过的分解反应呢?化合价有变化,是氧化还原反应2. Ca(OH)2 = CaO+H2O加热化合价没有变化,不是氧化还原反应说明分解反应不一定是氧化还原反应氧化还原反应分解反应复分解反应置换反应化合反应四种基本反应与氧化还原反应的关系: 在我们学过的化学反应中,如果从反应物变为产物时元素的化合价是否发生了变化来分类,可以分为两类。化学反应一、元素化合价有变化的反应,即氧化还原反应。二、元素化合价没有变化的反应 如: CaCl2 + Na2CO3 = CaCO3 ↓+ 2NaCl化合价没有变化的反应化合价和电子得失原子结构的分析氧原子最外层为6,
易得到2 个电子,
达到稳定结构生成O2-钠原子最外层为1,
易失去1 个电子,
达到稳定结构生成Na+氧原子最外层为7,
易得到1 个电子,
达到稳定结构生成Cl-氧原子最外层为2,
易失到2 个电子,
达到稳定结构生成Mg2+ 说明原子变成离子的过程中,化合价的变化跟得到或失去电子的个数是有一定联系的。例如:钠与氯气的反应。 钠最外层1个电子,易失去一个电子,达到8个电子的稳定结构。 氯最外层7个电子,易得到一个电子,达到8个电子的稳定结构。0+10-1化合价升高,失去2xe-化合价降低,得到2xe-Na+Cl-氯化钠的形成示意图e- 在这个反应中,Na失去电子,被氧化;Cl得到电子,被还原。 通过以上例子分析,我们认识到有电子转移(得失或偏移)的反应,是氧化还原反应。0+10-1失去2 x e-得到2 x e-失去电子的反应就是氧化反应;得到电子的反应就是还原反应。课堂小结定义:并非得氧失氧的反应是氧化还原反应,凡是元素化合价发生变化的反应叫做氧化还原反应。
特征:发生元素化合价的升降变化
本质:电子的转移(或偏移)
练习题:氧化还原反应的实质是:()
A.元素化合价发生变化
B.反应中有氧原子的得失
C.反应中有电子得失或电子的转移
D.反应后生成新物质
加的反应。初中学过的还原反应——失去氧的反应氧化铜的还原一、氧化还原反应第三节氧化还原反应授课人:玛丽亚木 一种物质被氧化,同时另一种物质被还原的
反应,这样的反应称为氧化还原反应。分析木炭还原氧化铜1.氧化铜失去氧变成单质铜2. 碳得到了氧变成了二氧化碳——还原反应——氧化反应一、氧化还原反应Fe + CuSO4 = FeSO4 + Cu分析这个反应的化合价升降变化?1.单质的化合价为0,在反应式中,Fe化合价为
0,生成Fe2+,化合价为+2。
2.CuSO4中的Cu2+化合价为+2,生成单质Cu的
化合价为0。0价→+2价,化合价升高+2价→0价,化合价降低? 像这种凡是有元素化合介升降的化学反应都是氧化还原反应。例如:以下反应中化合价的升降变化Zn + H2SO4 = ZnSO4 + H2↑S + O2 = SO2Zn + H2SO4 = ZnSO4 + H2↑000+2+10+1+2化合价降低化合价降低化合价升高化合价升高 这两个反应都是我们初中学过的置换反应,都属于氧化还原反应。那么是不是化合反应就是氧化还原反应呢?例如:Na2O+H2O=2NaOH这个反应说明了化合反应不一定是氧化还原反应初中学过的分解反应呢?化合价有变化,是氧化还原反应2. Ca(OH)2 = CaO+H2O加热化合价没有变化,不是氧化还原反应说明分解反应不一定是氧化还原反应氧化还原反应分解反应复分解反应置换反应化合反应四种基本反应与氧化还原反应的关系: 在我们学过的化学反应中,如果从反应物变为产物时元素的化合价是否发生了变化来分类,可以分为两类。化学反应一、元素化合价有变化的反应,即氧化还原反应。二、元素化合价没有变化的反应 如: CaCl2 + Na2CO3 = CaCO3 ↓+ 2NaCl化合价没有变化的反应化合价和电子得失原子结构的分析氧原子最外层为6,
易得到2 个电子,
达到稳定结构生成O2-钠原子最外层为1,
易失去1 个电子,
达到稳定结构生成Na+氧原子最外层为7,
易得到1 个电子,
达到稳定结构生成Cl-氧原子最外层为2,
易失到2 个电子,
达到稳定结构生成Mg2+ 说明原子变成离子的过程中,化合价的变化跟得到或失去电子的个数是有一定联系的。例如:钠与氯气的反应。 钠最外层1个电子,易失去一个电子,达到8个电子的稳定结构。 氯最外层7个电子,易得到一个电子,达到8个电子的稳定结构。0+10-1化合价升高,失去2xe-化合价降低,得到2xe-Na+Cl-氯化钠的形成示意图e- 在这个反应中,Na失去电子,被氧化;Cl得到电子,被还原。 通过以上例子分析,我们认识到有电子转移(得失或偏移)的反应,是氧化还原反应。0+10-1失去2 x e-得到2 x e-失去电子的反应就是氧化反应;得到电子的反应就是还原反应。课堂小结定义:并非得氧失氧的反应是氧化还原反应,凡是元素化合价发生变化的反应叫做氧化还原反应。
特征:发生元素化合价的升降变化
本质:电子的转移(或偏移)
练习题:氧化还原反应的实质是:()
A.元素化合价发生变化
B.反应中有氧原子的得失
C.反应中有电子得失或电子的转移
D.反应后生成新物质
