5.2.3 铵盐 课件(共15张PPT) 高中化学人教版(2019)必修第二册
文档属性
| 名称 | 5.2.3 铵盐 课件(共15张PPT) 高中化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-09 08:41:06 | ||
图片预览






文档简介
(共15张PPT)
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
课时3 铵盐
如(NH4)2SO4、NH4HCO3、NH4NO3、 CO(NH2)2等。
2、物理性质:绝大多数铵盐是白色 或无色晶体,易溶于水,受热易分解。
1.概念:铵盐是由铵根离子()和酸根离子组成的化合物。
铵 盐
【情境】有一类氮肥,如图所示,碳酸铵、碳酸氢铵在太阳下放置,怎么越来越少 碳酸铵、碳酸氢铵不耐热是怎么回事
化学性质:
(1) 不稳定性——受热易分解
2NH4NO3==========2N2↑+O2↑+4H2O
高温或猛烈撞击
△
(NH4)2CO3 == 2NH3↑+ CO2↑+ H2O
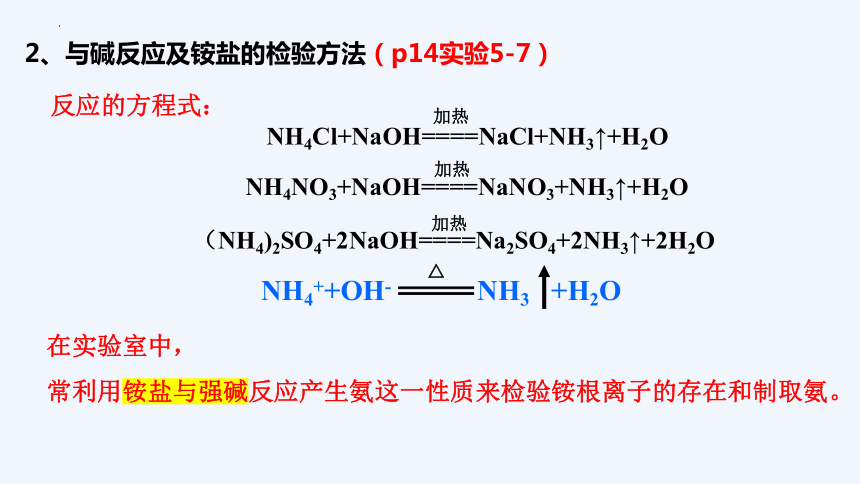
【实验5-7】向盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,分析现象产生的原因,写出反应的离子方程式。
(2)与碱反应及铵盐的检验方法
新课讲解
实验现象:
湿润的红色石蕊试纸均变蓝
实验结论:
都能和碱反应放出氨气
NH4Cl+NaOH====NaCl+NH3↑+H2O
加热
(NH4)2SO4+2NaOH====Na2SO4+2NH3↑+2H2O
加热
NH4NO3+NaOH====NaNO3+NH3↑+H2O
加热
反应的方程式:
在实验室中,
常利用铵盐与强碱反应产生氨这一性质来检验铵根离子的存在和制取氨。
NH4++OH- NH3 +H2O
△
2、与碱反应及铵盐的检验方法(p14实验5-7)
NH4+的检验
NH4+检验:
铵盐(NH4+)
无色气体(NH3)
试纸变蓝
蘸有浓盐酸
的玻璃棒
产生白烟
规范操作:
取少许样品于试管中,加入强碱后加热,将湿润的红色石蕊试纸靠近管口,若试纸变蓝/用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+ 。
N2+3H2 2NH3
高温高压
催化剂
1.氨气的工业制法
总结:氨气的制备
2、实验室制法
2NH4Cl+Ca(OH)2 = CaCl2+2NH3↑+2H2O
△
吸收水蒸气,干燥氨气
向下排空气
(1)反应原理:
(2)装置:
固+固加热型
(3)碱石灰的作用:
(4)收集:
(5)验满:
① 把湿润的红色石蕊试纸置于试管口,试纸变 ;
② 将蘸有浓盐酸的玻璃棒置于试管口,有 产生。
蓝色
白烟
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
氨气的制备
(6)尾气处理:
可在导管口放一团用 浸湿的棉花球。
水或稀硫酸
减少NH3与空气的对流;吸收多余的NH3,防止污染空气
(1)加热NH4Cl能制取NH3吗?
NH4Cl分解产生的NH3和HCl遇冷会再次化合为NH4Cl,不能用于制取NH3
(2) 能否采用其他铵盐与强碱反应制取氨气
思考与讨论
NH4NO3
受热分解,会爆炸,不安全
(NH4)2SO4
与反应时生成块状CaSO4,不利于NH3逸出,且反应后试管难清洗
(NH4)2CO3
NH4HCO3
受热分解产生CO2,使收集到的NH3不纯
NaOH/KOH
易吸水结块,且对玻璃腐蚀性较强
(3) 制取的氨气是否纯净?如何净化
不能用无水CaCl2,会反应产CaCl2 8NH3 ;
浓硫酸、P2O5等酸性干燥剂也不能干燥NH3
(4) 环保措施:
浓硫酸(或水)吸收多余的氨气
实验室快速制氨气的方法
方法一:
NH3·H2O == NH3↑+H2O
△
方法二:
加热浓氨水制氨气
浓氨水滴入生石灰(或NaOH)中制氨气
CaO + NH3·H2O = Ca(OH)2 + NH3↑
(1)NaOH溶于水放热,且OH-浓度的增大有利于NH3的放出
(2)CaO的作用:
①吸水后放热;
②增加溶液中OH-的浓度,
液氨 NH3·H2O
氨水
物质分类 纯净物 纯净物
混合物
粒子分类 NH3 NH3·H2O H2O、NH3、NH3·H2O、NH4+ 、OH-、H+ (极少)
主要性质 制冷剂 具有碱的通性
具有碱的通性
液氨、NH3·H2O、氨水的对比
铵盐及其性质
氨气的实验室制法
铵根离子的检验
易分解、能与碱反应放出氨气
归纳小结
第五章 化工生产中的重要非金属元素
第二节 氮及其化合物
课时3 铵盐
如(NH4)2SO4、NH4HCO3、NH4NO3、 CO(NH2)2等。
2、物理性质:绝大多数铵盐是白色 或无色晶体,易溶于水,受热易分解。
1.概念:铵盐是由铵根离子()和酸根离子组成的化合物。
铵 盐
【情境】有一类氮肥,如图所示,碳酸铵、碳酸氢铵在太阳下放置,怎么越来越少 碳酸铵、碳酸氢铵不耐热是怎么回事
化学性质:
(1) 不稳定性——受热易分解
2NH4NO3==========2N2↑+O2↑+4H2O
高温或猛烈撞击
△
(NH4)2CO3 == 2NH3↑+ CO2↑+ H2O
【实验5-7】向盛有少量NH4Cl溶液、NH4NO3溶液和(NH4)2SO4溶液的三支试管中分别加入NaOH溶液并加热(注意通风),用镊子夹住一片湿润的红色石蕊试纸放在试管口。观察现象,分析现象产生的原因,写出反应的离子方程式。
(2)与碱反应及铵盐的检验方法
新课讲解
实验现象:
湿润的红色石蕊试纸均变蓝
实验结论:
都能和碱反应放出氨气
NH4Cl+NaOH====NaCl+NH3↑+H2O
加热
(NH4)2SO4+2NaOH====Na2SO4+2NH3↑+2H2O
加热
NH4NO3+NaOH====NaNO3+NH3↑+H2O
加热
反应的方程式:
在实验室中,
常利用铵盐与强碱反应产生氨这一性质来检验铵根离子的存在和制取氨。
NH4++OH- NH3 +H2O
△
2、与碱反应及铵盐的检验方法(p14实验5-7)
NH4+的检验
NH4+检验:
铵盐(NH4+)
无色气体(NH3)
试纸变蓝
蘸有浓盐酸
的玻璃棒
产生白烟
规范操作:
取少许样品于试管中,加入强碱后加热,将湿润的红色石蕊试纸靠近管口,若试纸变蓝/用蘸有浓盐酸的玻璃棒靠近试管口,若有白烟产生,则证明样品中含有NH4+ 。
N2+3H2 2NH3
高温高压
催化剂
1.氨气的工业制法
总结:氨气的制备
2、实验室制法
2NH4Cl+Ca(OH)2 = CaCl2+2NH3↑+2H2O
△
吸收水蒸气,干燥氨气
向下排空气
(1)反应原理:
(2)装置:
固+固加热型
(3)碱石灰的作用:
(4)收集:
(5)验满:
① 把湿润的红色石蕊试纸置于试管口,试纸变 ;
② 将蘸有浓盐酸的玻璃棒置于试管口,有 产生。
蓝色
白烟
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
氨气的制备
(6)尾气处理:
可在导管口放一团用 浸湿的棉花球。
水或稀硫酸
减少NH3与空气的对流;吸收多余的NH3,防止污染空气
(1)加热NH4Cl能制取NH3吗?
NH4Cl分解产生的NH3和HCl遇冷会再次化合为NH4Cl,不能用于制取NH3
(2) 能否采用其他铵盐与强碱反应制取氨气
思考与讨论
NH4NO3
受热分解,会爆炸,不安全
(NH4)2SO4
与反应时生成块状CaSO4,不利于NH3逸出,且反应后试管难清洗
(NH4)2CO3
NH4HCO3
受热分解产生CO2,使收集到的NH3不纯
NaOH/KOH
易吸水结块,且对玻璃腐蚀性较强
(3) 制取的氨气是否纯净?如何净化
不能用无水CaCl2,会反应产CaCl2 8NH3 ;
浓硫酸、P2O5等酸性干燥剂也不能干燥NH3
(4) 环保措施:
浓硫酸(或水)吸收多余的氨气
实验室快速制氨气的方法
方法一:
NH3·H2O == NH3↑+H2O
△
方法二:
加热浓氨水制氨气
浓氨水滴入生石灰(或NaOH)中制氨气
CaO + NH3·H2O = Ca(OH)2 + NH3↑
(1)NaOH溶于水放热,且OH-浓度的增大有利于NH3的放出
(2)CaO的作用:
①吸水后放热;
②增加溶液中OH-的浓度,
液氨 NH3·H2O
氨水
物质分类 纯净物 纯净物
混合物
粒子分类 NH3 NH3·H2O H2O、NH3、NH3·H2O、NH4+ 、OH-、H+ (极少)
主要性质 制冷剂 具有碱的通性
具有碱的通性
液氨、NH3·H2O、氨水的对比
铵盐及其性质
氨气的实验室制法
铵根离子的检验
易分解、能与碱反应放出氨气
归纳小结
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
