1.1 第1课时 化学反应的焓变 学案(含答案) 2023-2024学年高二化学苏教版(2020)选择性必修第一册
文档属性
| 名称 | 1.1 第1课时 化学反应的焓变 学案(含答案) 2023-2024学年高二化学苏教版(2020)选择性必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 249.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-09 20:00:11 | ||
图片预览


文档简介
1.1 第1课时 化学反应的焓变
【学习目标】
1.通过交流讨论了解焓变、反应热等基本概念。
2.通过分析图像了解反应热与反应物及生成物能量大小的关系,学会根据能量变化图示判断吸热反应、放热反应,增强宏观辨识能力。
3.通过练习认识化学键的断裂和形成是化学反应中能量变化的主要原因,学会根据化学键的键能定量计算反应热,构建相关计算的思维模型。
【合作探究】
【学习情境】
2022年2月27日上午11时06分“长征八号遥二”运载火箭飞行试验在中国文昌航天发射场顺利实施,火箭飞行正常,试验取得圆满成功。此次任务共搭载22颗卫星,创下我国一箭多星任务的最高纪录。“长征八号遥二”运载火箭以液氧、液氢为推进剂,喷出来的是无毒的水蒸气,十分环保,发射时发生的反应可用热化学方程式H2(l)+O2(l)H2O(g) ΔH=-237.46 kJ·mol-1表示。
任务1 反应热与焓变
【新知生成】
1.反应热:在等温条件下,化学反应体系向环境 或从环境 的热量,称为化学反应的热效应,简称反应热。
2.内能:体系内物质的各种 的总和,受温度、压强和物质的聚集状态等影响。
3.焓变:在等压条件下进行的化学反应,反应热 反应的焓变。用符号ΔH表示,常用单位: 。放热反应的ΔH 0,吸热反应的ΔH 0。
4.化学反应中能量变化的主要原因: 。
【答案】1.释放 吸收 2.能量 3.等于 kJ·mol-1 < > 4.化学键断裂和形成时的能量变化
【核心突破】
典例1 已知化学反应X(g)+2Y(g)2Z(g)的能量变化如图所示,下列有关该反应的说法正确的是( )
A.该反应是放热反应
B.反应物的总键能大于生成物的总键能
C.Y的能量高于Z的能量
D.该反应的反应热ΔH>0
【解析】该反应中反应物X、Y的总能量高于生成物Z的总能量,反应物转化为生成物时能量降低,故该反应是放热反应,ΔH<0,A项正确,D项错误;破坏反应物中的化学键要吸收能量,形成生成物中的化学键要释放能量,放热反应中,反应物的总键能小于生成物的总键能,B项错误;该反应为放热反应,反应物X、Y的总能量高于生成物Z的总能量,无法比较Y、Z能量的高低,C项错误。
【答案】A
典例2 甲烷与CO2可用于制备合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)2CO(g)+2H2(g),1g CH4(g)完全反应吸收15.46kJ的热量,下图中能表示该反应过程中的能量变化的是( )
A B
C D
【解析】1 g CH4完全反应吸收15.46 kJ的热量,则1 mol CH4完全反应吸收的热量为247.36 kJ。
【答案】B
归纳总结:化学反应能量变化的原因
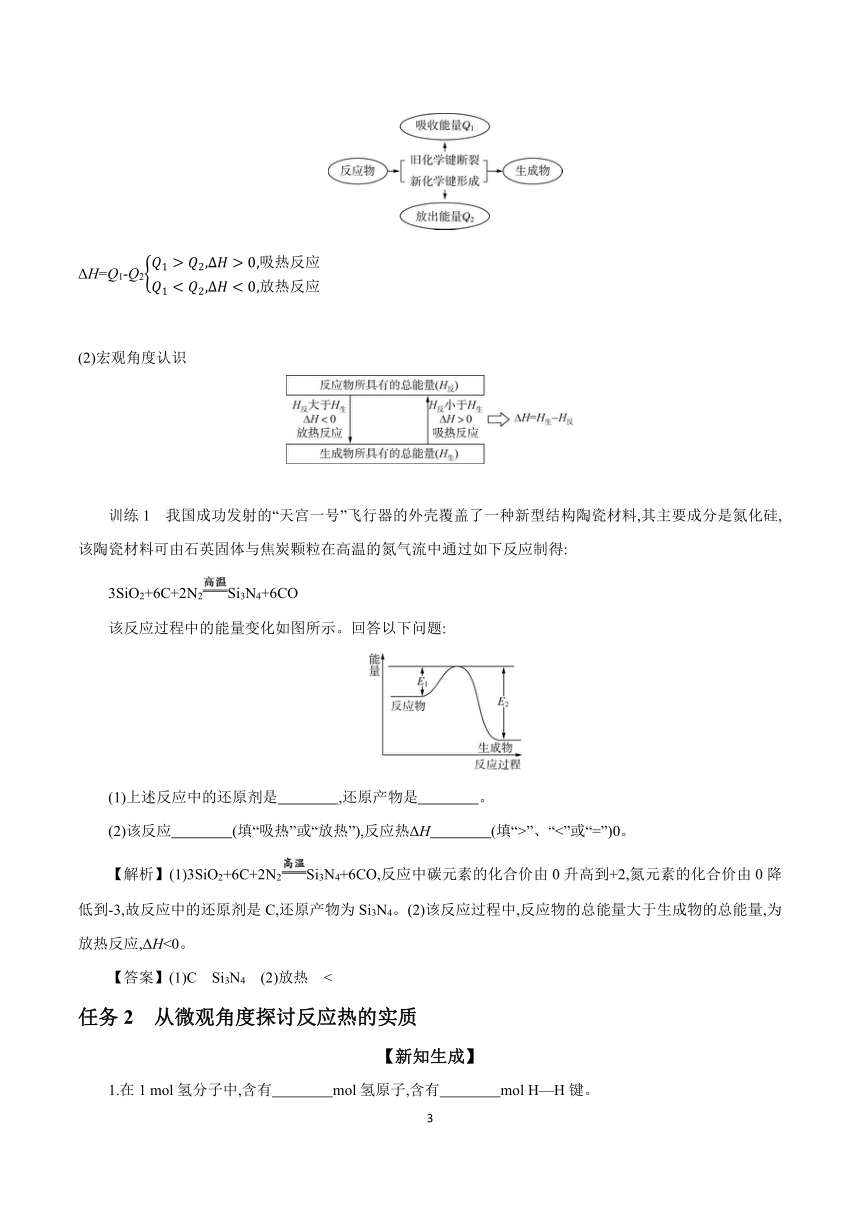
(1)微观角度认识
ΔH=Q1-Q2
(2)宏观角度认识
训练1 我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:
3SiO2+6C+2N2Si3N4+6CO
该反应过程中的能量变化如图所示。回答以下问题:
(1)上述反应中的还原剂是 ,还原产物是 。
(2)该反应 (填“吸热”或“放热”),反应热ΔH (填“>”、“<”或“=”)0。
【解析】(1)3SiO2+6C+2N2Si3N4+6CO,反应中碳元素的化合价由0升高到+2,氮元素的化合价由0降低到-3,故反应中的还原剂是C,还原产物为Si3N4。(2)该反应过程中,反应物的总能量大于生成物的总能量,为放热反应,ΔH<0。
【答案】(1)C Si3N4 (2)放热 <
任务2 从微观角度探讨反应热的实质
【新知生成】
1.在1 mol氢分子中,含有 mol氢原子,含有 mol H—H键。
2.已知在25℃和101kPa条件下,由2 mol H原子形成1 mol H—H键时,放出436kJ的能量。若要使1 mol 氢分子变为2 mol氢原子,需要断开1 mol H—H键,其能量变化是吸收 的能量。
3.在CH4中,断开1 mol C—H键要吸收415kJ的能量。若要形成1 mol CH4中的C—H键,其能量变化是放出 的能量。
【答案】1.2 1 2.436kJ 3.1660kJ
【核心突破】
典例3 根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
A.H2O分解为H2与O2时放出热量
B.生成1 mol H2O(g)时吸收热量245 kJ
C.物质所具有的总能量大小:乙>甲>丙
D.氢气和氧气的总能量小于水的能量
【解析】根据题示能量变化可知,1 mol H2与 mol O2断键时共吸收436 kJ+249 kJ=685 kJ能量,而生成1 mol H2O放出930 kJ能量,反应中放出的热量比吸收的热量多930 kJ-685 kJ=245 kJ,所以H2燃烧生成H2O的反应是放热反应,则H2O的分解反应是吸热反应,A项错误;生成1 mol H2O(g)时放出热量245 kJ,B项错误;甲吸收能量变为乙,则总能量:乙>甲,甲到丙的总反应是放热反应,则总能量:甲>丙,C项正确;H2和O2的总能量大于H2O的能量,D项错误。
【答案】C
疑难点拨:利用键能计算反应热的方法步骤
(1)明确反应物和生成物中的化学键数目。
(2)根据热化学方程式中各物质的化学计量数,计算反应物的总键能和生成物的总键能。
(3)依据“ΔH=反应物的总键能-生成物的总键能”计算反应热。
(4)注意ΔH的符号,计算结果为负值,则ΔH为“-”,反之为“+”(可省略)。
训练2 H2和I2在一定条件下发生反应:H2(g)+I2(g)2HI(g),反应生成2 mol HI(g)时放出a kJ热量。已知:
(a、b、c均大于零)
下列说法不正确的是( )
A.该反应中反应物的总能量高于生成物的总能量
B.断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C.断开2 mol H—I键所需能量约为(a+b+c) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
【解析】A项,ΔH=E(生成物)-E(反应物),该反应放热,ΔH<0,所以E(反应物)>E(生成物),正确;B项,从键能角度看,ΔH=反应物总键能-生成物总键能,所以反应物总键能小于生成物总键能,即断开1 mol H—H 键和1 mol I—I键所需能量小于断开2 mol H—I键所需能量,错误;C项,(b+c) kJ-生成物总键能=-a kJ,则生成物总键能=(a+b+c) kJ,正确;D项,由热化学方程式可知,2 mol H2和2 mol I2完全反应放出的热量为2a kJ,但该反应是可逆反应,反应不能完全进行,故放出的热量小于2a kJ,正确。
【答案】B
训练3 生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久。以下是几种物质中的化学键的键能:
化学键 N≡N F—F N—F
键能/(kJ·mol-1) 941.7 154.8 283.0
下列说法中正确的是( )
A.过程N2(g)2N(g)放出能量
B.过程N(g)+3F(g)NF3(g)放出能量
C.反应N2(g)+3F2(g)2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
【解析】N2(g)2N(g)是化学键断裂的过程,要吸收能量,A项错误;N(g)+3F(g)NF3(g)是形成化学键的过程,应放出能量,B项正确;反应的ΔH=反应物的键能之和-生成物的键能之和=941.7 kJ·mol-1+3×154.8 kJ·mol-1-6×283.0 kJ·mol-1=-291.9 kJ·mol-1,C项错误;化学反应过程中必然有化学键的断裂与生成,D项错误。
【答案】B
课堂小结:
【随堂检测】
1.下列变化过程需要吸收能量的是( )
A.2H2+O22H2O
B.Cl+ClCl2
C.CaO+H2OCa(OH)2
D.H2H+H
【解析】H2在O2中燃烧放出大量的热,生石灰溶于水放热,原子形成化学键放出能量,拆开H—H键则需吸收能量。
【答案】D
2.下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铝片和稀盐酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的木炭与二氧化碳的反应
D.铝和氧化铁在高温下的反应
【解析】铝片和稀盐酸的反应是放热反应,A项不符合题意;Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,但不是氧化还原反应,B项不符合题意;灼热的木炭与二氧化碳的反应属于吸热反应,也是氧化还原反应,C项符合题意;铝和氧化铁在高温下的反应为放热反应,D项不符合题意。
【答案】C
3.已知:1 mol H2(g)和1 mol F2(g)完全反应生成2 mol HF(g)时,放出546.6 kJ的热量,下列说法中不正确的是( )
A.44.8 L HF气体分解成22.4 L的H2和22.4 L的F2吸收546.6 kJ热量
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量大于546.6 kJ
C.相同条件下,1 mol H2与1 mol F2的能量总和高于2 mol HF气体的能量
D.2 mol H—F键的键能比1 mol H—H键和1 mol F—F键的键能之和多546.6 kJ
【解析】没明确是在标准状况下,无法通过气体体积计算反应的焓变,A项错误;在相同物质的量的条件下,H2与F2反应生成液态HF比生成气体HF放出更多的热量,B项正确;题给反应是放热反应,即反应物总能量高于生成物总能量,故相同条件下,1 mol H2与1 mol F2的能量总和高于2 mol HF气体的能量,C项正确;根据题给反应信息,反应物总键能-生成物总键能=ΔH,故生成物总键能大于反应物总键能,即2 mol H—F键的键能比1 mol H—H键和1 mol F—F键的键能之和多546.6 kJ,D项正确。
【答案】A
4.已知反应X+YM+N为放热反应。关于该反应的下列说法中,正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.X和Y的总能量一定低于M和N的总能量
【解析】反应X+YM+N为放热反应,说明X和Y的总能量高于M和N的总能量,但无法比较X与M以及Y与N的能量高低。
【答案】C
5.在25 ℃、101 kPa的条件下,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1 mol H—Cl键放出431 kJ能量。H2+Cl22HCl的化学反应可用下图表示:
请回答下列有关问题:
(1)反应物断键吸收的总能量为 。
(2)生成物成键放出的总能量为 。
(3)反应H2(g)+Cl2(g)2HCl(g) (填“吸收”或“放出”)能量。
(4)反应物的总能量 (填“>”、“=”或“<”)生成物的总能量。
【解析】反应物断键吸收的总能量是断裂1 mol H—H键与1 mol Cl—Cl键吸收的能量之和,即436 kJ+243 kJ=679 kJ;生成物成键放出的总能量为2×431 kJ=862 kJ。由于吸收的总能量小于放出的总能量,所以该反应放热即反应物的总能量大于生成物的总能量。
【答案】(1)679 kJ (2)862 kJ (3)放出 (4)>
2
【学习目标】
1.通过交流讨论了解焓变、反应热等基本概念。
2.通过分析图像了解反应热与反应物及生成物能量大小的关系,学会根据能量变化图示判断吸热反应、放热反应,增强宏观辨识能力。
3.通过练习认识化学键的断裂和形成是化学反应中能量变化的主要原因,学会根据化学键的键能定量计算反应热,构建相关计算的思维模型。
【合作探究】
【学习情境】
2022年2月27日上午11时06分“长征八号遥二”运载火箭飞行试验在中国文昌航天发射场顺利实施,火箭飞行正常,试验取得圆满成功。此次任务共搭载22颗卫星,创下我国一箭多星任务的最高纪录。“长征八号遥二”运载火箭以液氧、液氢为推进剂,喷出来的是无毒的水蒸气,十分环保,发射时发生的反应可用热化学方程式H2(l)+O2(l)H2O(g) ΔH=-237.46 kJ·mol-1表示。
任务1 反应热与焓变
【新知生成】
1.反应热:在等温条件下,化学反应体系向环境 或从环境 的热量,称为化学反应的热效应,简称反应热。
2.内能:体系内物质的各种 的总和,受温度、压强和物质的聚集状态等影响。
3.焓变:在等压条件下进行的化学反应,反应热 反应的焓变。用符号ΔH表示,常用单位: 。放热反应的ΔH 0,吸热反应的ΔH 0。
4.化学反应中能量变化的主要原因: 。
【答案】1.释放 吸收 2.能量 3.等于 kJ·mol-1 < > 4.化学键断裂和形成时的能量变化
【核心突破】
典例1 已知化学反应X(g)+2Y(g)2Z(g)的能量变化如图所示,下列有关该反应的说法正确的是( )
A.该反应是放热反应
B.反应物的总键能大于生成物的总键能
C.Y的能量高于Z的能量
D.该反应的反应热ΔH>0
【解析】该反应中反应物X、Y的总能量高于生成物Z的总能量,反应物转化为生成物时能量降低,故该反应是放热反应,ΔH<0,A项正确,D项错误;破坏反应物中的化学键要吸收能量,形成生成物中的化学键要释放能量,放热反应中,反应物的总键能小于生成物的总键能,B项错误;该反应为放热反应,反应物X、Y的总能量高于生成物Z的总能量,无法比较Y、Z能量的高低,C项错误。
【答案】A
典例2 甲烷与CO2可用于制备合成气(主要成分是一氧化碳和氢气):CH4(g)+CO2(g)2CO(g)+2H2(g),1g CH4(g)完全反应吸收15.46kJ的热量,下图中能表示该反应过程中的能量变化的是( )
A B
C D
【解析】1 g CH4完全反应吸收15.46 kJ的热量,则1 mol CH4完全反应吸收的热量为247.36 kJ。
【答案】B
归纳总结:化学反应能量变化的原因
(1)微观角度认识
ΔH=Q1-Q2
(2)宏观角度认识
训练1 我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:
3SiO2+6C+2N2Si3N4+6CO
该反应过程中的能量变化如图所示。回答以下问题:
(1)上述反应中的还原剂是 ,还原产物是 。
(2)该反应 (填“吸热”或“放热”),反应热ΔH (填“>”、“<”或“=”)0。
【解析】(1)3SiO2+6C+2N2Si3N4+6CO,反应中碳元素的化合价由0升高到+2,氮元素的化合价由0降低到-3,故反应中的还原剂是C,还原产物为Si3N4。(2)该反应过程中,反应物的总能量大于生成物的总能量,为放热反应,ΔH<0。
【答案】(1)C Si3N4 (2)放热 <
任务2 从微观角度探讨反应热的实质
【新知生成】
1.在1 mol氢分子中,含有 mol氢原子,含有 mol H—H键。
2.已知在25℃和101kPa条件下,由2 mol H原子形成1 mol H—H键时,放出436kJ的能量。若要使1 mol 氢分子变为2 mol氢原子,需要断开1 mol H—H键,其能量变化是吸收 的能量。
3.在CH4中,断开1 mol C—H键要吸收415kJ的能量。若要形成1 mol CH4中的C—H键,其能量变化是放出 的能量。
【答案】1.2 1 2.436kJ 3.1660kJ
【核心突破】
典例3 根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
A.H2O分解为H2与O2时放出热量
B.生成1 mol H2O(g)时吸收热量245 kJ
C.物质所具有的总能量大小:乙>甲>丙
D.氢气和氧气的总能量小于水的能量
【解析】根据题示能量变化可知,1 mol H2与 mol O2断键时共吸收436 kJ+249 kJ=685 kJ能量,而生成1 mol H2O放出930 kJ能量,反应中放出的热量比吸收的热量多930 kJ-685 kJ=245 kJ,所以H2燃烧生成H2O的反应是放热反应,则H2O的分解反应是吸热反应,A项错误;生成1 mol H2O(g)时放出热量245 kJ,B项错误;甲吸收能量变为乙,则总能量:乙>甲,甲到丙的总反应是放热反应,则总能量:甲>丙,C项正确;H2和O2的总能量大于H2O的能量,D项错误。
【答案】C
疑难点拨:利用键能计算反应热的方法步骤
(1)明确反应物和生成物中的化学键数目。
(2)根据热化学方程式中各物质的化学计量数,计算反应物的总键能和生成物的总键能。
(3)依据“ΔH=反应物的总键能-生成物的总键能”计算反应热。
(4)注意ΔH的符号,计算结果为负值,则ΔH为“-”,反之为“+”(可省略)。
训练2 H2和I2在一定条件下发生反应:H2(g)+I2(g)2HI(g),反应生成2 mol HI(g)时放出a kJ热量。已知:
(a、b、c均大于零)
下列说法不正确的是( )
A.该反应中反应物的总能量高于生成物的总能量
B.断开1 mol H—H键和1 mol I—I键所需能量大于断开2 mol H—I键所需能量
C.断开2 mol H—I键所需能量约为(a+b+c) kJ
D.向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
【解析】A项,ΔH=E(生成物)-E(反应物),该反应放热,ΔH<0,所以E(反应物)>E(生成物),正确;B项,从键能角度看,ΔH=反应物总键能-生成物总键能,所以反应物总键能小于生成物总键能,即断开1 mol H—H 键和1 mol I—I键所需能量小于断开2 mol H—I键所需能量,错误;C项,(b+c) kJ-生成物总键能=-a kJ,则生成物总键能=(a+b+c) kJ,正确;D项,由热化学方程式可知,2 mol H2和2 mol I2完全反应放出的热量为2a kJ,但该反应是可逆反应,反应不能完全进行,故放出的热量小于2a kJ,正确。
【答案】B
训练3 生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久。以下是几种物质中的化学键的键能:
化学键 N≡N F—F N—F
键能/(kJ·mol-1) 941.7 154.8 283.0
下列说法中正确的是( )
A.过程N2(g)2N(g)放出能量
B.过程N(g)+3F(g)NF3(g)放出能量
C.反应N2(g)+3F2(g)2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
【解析】N2(g)2N(g)是化学键断裂的过程,要吸收能量,A项错误;N(g)+3F(g)NF3(g)是形成化学键的过程,应放出能量,B项正确;反应的ΔH=反应物的键能之和-生成物的键能之和=941.7 kJ·mol-1+3×154.8 kJ·mol-1-6×283.0 kJ·mol-1=-291.9 kJ·mol-1,C项错误;化学反应过程中必然有化学键的断裂与生成,D项错误。
【答案】B
课堂小结:
【随堂检测】
1.下列变化过程需要吸收能量的是( )
A.2H2+O22H2O
B.Cl+ClCl2
C.CaO+H2OCa(OH)2
D.H2H+H
【解析】H2在O2中燃烧放出大量的热,生石灰溶于水放热,原子形成化学键放出能量,拆开H—H键则需吸收能量。
【答案】D
2.下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.铝片和稀盐酸的反应
B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的木炭与二氧化碳的反应
D.铝和氧化铁在高温下的反应
【解析】铝片和稀盐酸的反应是放热反应,A项不符合题意;Ba(OH)2·8H2O与NH4Cl的反应是吸热反应,但不是氧化还原反应,B项不符合题意;灼热的木炭与二氧化碳的反应属于吸热反应,也是氧化还原反应,C项符合题意;铝和氧化铁在高温下的反应为放热反应,D项不符合题意。
【答案】C
3.已知:1 mol H2(g)和1 mol F2(g)完全反应生成2 mol HF(g)时,放出546.6 kJ的热量,下列说法中不正确的是( )
A.44.8 L HF气体分解成22.4 L的H2和22.4 L的F2吸收546.6 kJ热量
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量大于546.6 kJ
C.相同条件下,1 mol H2与1 mol F2的能量总和高于2 mol HF气体的能量
D.2 mol H—F键的键能比1 mol H—H键和1 mol F—F键的键能之和多546.6 kJ
【解析】没明确是在标准状况下,无法通过气体体积计算反应的焓变,A项错误;在相同物质的量的条件下,H2与F2反应生成液态HF比生成气体HF放出更多的热量,B项正确;题给反应是放热反应,即反应物总能量高于生成物总能量,故相同条件下,1 mol H2与1 mol F2的能量总和高于2 mol HF气体的能量,C项正确;根据题给反应信息,反应物总键能-生成物总键能=ΔH,故生成物总键能大于反应物总键能,即2 mol H—F键的键能比1 mol H—H键和1 mol F—F键的键能之和多546.6 kJ,D项正确。
【答案】A
4.已知反应X+YM+N为放热反应。关于该反应的下列说法中,正确的是( )
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.X和Y的总能量一定低于M和N的总能量
【解析】反应X+YM+N为放热反应,说明X和Y的总能量高于M和N的总能量,但无法比较X与M以及Y与N的能量高低。
【答案】C
5.在25 ℃、101 kPa的条件下,断裂1 mol H—H键吸收436 kJ能量,断裂1 mol Cl—Cl键吸收243 kJ能量,形成1 mol H—Cl键放出431 kJ能量。H2+Cl22HCl的化学反应可用下图表示:
请回答下列有关问题:
(1)反应物断键吸收的总能量为 。
(2)生成物成键放出的总能量为 。
(3)反应H2(g)+Cl2(g)2HCl(g) (填“吸收”或“放出”)能量。
(4)反应物的总能量 (填“>”、“=”或“<”)生成物的总能量。
【解析】反应物断键吸收的总能量是断裂1 mol H—H键与1 mol Cl—Cl键吸收的能量之和,即436 kJ+243 kJ=679 kJ;生成物成键放出的总能量为2×431 kJ=862 kJ。由于吸收的总能量小于放出的总能量,所以该反应放热即反应物的总能量大于生成物的总能量。
【答案】(1)679 kJ (2)862 kJ (3)放出 (4)>
2
