1.2 第4课时 电解池的应用 学案 (含答案)2023-2024学年高二化学苏教版(2020)选择性必修第一册
文档属性
| 名称 | 1.2 第4课时 电解池的应用 学案 (含答案)2023-2024学年高二化学苏教版(2020)选择性必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 297.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-09 00:00:00 | ||
图片预览




文档简介
1.2 第4课时 电解池的应用
【学习目标】
1.通过对氯碱工业、电镀、电解精炼铜、电冶金等原理的分析,了解电解的应用,认识电能与化学能之间的能量转化。学会电极反应的书写。
2.通过探究电镀、电解精炼铜的实验,培养观察、分析、推理及归纳总结能力,建立有电极参与反应的电解原理的认知模型,形成科学的态度,感受电解的价值。
3.通过练习学会电解的有关计算,建立相关计算的思维模型,加深对电解原理的理解和应用,提升学生模型认知的核心素养。
【合作探究】
【学习情境】
历史上伏特发明电池以后,引起化学家利用电解方法研究元素的兴趣,由电解法分离的元素及利用新分离出的元素提纯其他元素层出不穷;那么电解原理有哪些应用呢
任务1 电解原理的应用
【新知生成】
1.氯碱工业——电解饱和食盐水
阳极反应: ( 反应)。
阴极反应: ( 反应)。
总反应方程: 。
2.电镀与电解精炼
(1)电镀铜
(2)电解精炼铜
3.电冶金:利用电解熔融盐或氧化物的方法来冶炼活泼金属Na、Ca、Mg、Al等。
总反应方程 阳极、阴极反应
冶炼钠 阳极:2Cl--2e-Cl2↑ 阴极:2Na++2e-2Na
冶炼镁 阳极:2Cl--2e-Cl2↑ 阴极:Mg2++2e-Mg
冶炼铝 阳极:6O2--12e-3O2↑ 阴极:4Al3++12e-4Al
【答案】1.2Cl--2e-Cl2↑ 氧化 2H2O+2e-H2↑+2OH- 还原 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 2.(1)纯铜 镀件 Cu2+ Cu-2e-Cu2+ Cu2++2e-Cu (2)粗铜 精铜 Zn-2e-Zn2+ Fe-2e-Fe2+ Cu-2e-Cu2+ Cu2++2e-Cu 3.2NaCl(熔融)2Na+Cl2↑ MgCl2(熔融)Mg+Cl2↑ 2Al2O3(熔融)4Al+3O2↑
【核心突破】
典例1 下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,有2 mol Na+通过离子交换膜
D.F电极材料为金属铁
【解析】根据Na+的移动方向可知,装置左边是阳极区、右边是阴极区,F是阳极,阳极上Cl-失电子,G是阴极,G电极的电极反应为2H2O+2e-H2↑+2OH-,从E口逸出的气体是H2,A项正确;离子浓度越大,溶液导电能力越强,所以从B口加入含少量NaOH的水溶液以增强导电性,B项正确;电解总反应为2NaCl+2H2O2NaOH+Cl2↑+H2↑,标准状况下每生成22.4L Cl2,转移2 mol电子,则有2 mol Na+通过离子交换膜,C项正确;阳极上Cl-失电子生成氯气,所以阳极不能是活性电极,即F电极材料不能是金属铁,D项错误。
【答案】D
典例2 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+A.阳极发生还原反应,其电极反应:Ni2++2e-Ni
B.电解过程中,阳极减少的质量与阴极增加的质量相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
【解析】已知氧化性:Fe2+Fe>Ni>Cu>Pt(惰性金属不放电),阴极的阳离子的放电顺序为Zn2+【答案】D
归纳总结:
1.氯碱工业生产法——离子交换膜法
(1)离子交换膜电解槽的组成
由阳极(金属钛网)、阴极(碳钢网)、离子交换膜、电解槽和导电铜棒等组成,每台电解槽由若干个单元槽串联或并联组成。下图表示一个单元槽的示意图。
特别提醒:离子交换膜法制烧碱的生产流程重在掌握化学反应原理,对生产设备及生产细节不做过多要求。
(2)阳离子交换膜的作用
电解饱和食盐水是氯碱工业的基础,能制得氯气、氢气、氢氧化钠等重要的化工原料。电解过程中,在电场的作用下,阳离子向阴极移动,而阴离子向阳极移动。由于在阳极氯离子失去电子生成氯气,若不采取措施,氢氧根离子会向阳极移动,从而与氯气发生反应,既减少了氯气的产量,又会使得到的氢氧化钠不纯。因此,必须阻止氢氧根离子向阳极移动。
目前,常用的隔膜有石棉隔膜和阳离子交换膜。石棉隔膜能阻止气体通过,但允许水分子及离子通过。由于氢氧根离子能透过隔膜,因此氯气会与氢氧根离子发生反应,导致制得的氢氧化钠不纯。阳离子交换膜只允许阳
离子通过,而不允许阴离子及气体通过,也就是说,只允许钠离子通过,氯离子、氢氧根离子和氢气、氯气均不能通过。这样既可以防止阴极产生的氢气与阳极产生的氯气相混合,在一定条件下引起爆炸,又能避免氯气与氢氧化钠作用生成次氯酸钠而影响烧碱的质量。
(3)原料的精制
①粗盐的成分:粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、S等杂质,不符合电解要求,因此必须经过精制。
②杂质的危害:Ca2+、Mg2+、Fe3+等金属离子在碱性环境中会产生沉淀,损坏离子交换膜,此外,杂质的存在会使得到的产品不纯。
③除杂质的过程:粗盐水依次加入过量BaCl2(除去S)、过量NaOH(除去Mg2+、Fe3+)、过量Na2CO3(除去Ca2+和过量Ba2+),过滤(除去泥沙及沉淀),加入适量盐酸(除去OH-、C)。
Ⅰ.除杂质时所加试剂的顺序要求:
a.Na2CO3必须在BaCl2之后;b.在过滤之后加盐酸。
Ⅱ.试剂加入顺序有多种选择,如:a.BaCl2、NaOH、Na2CO3、过滤、盐酸;b.BaCl2、Na2CO3、NaOH、过滤、盐酸;c.NaOH、BaCl2、Na2CO3、过滤、盐酸。
2.电镀和电解精炼铜
电镀 电解精炼铜
概念 电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法 运用电解的方法将粗铜提炼为纯铜
主要目的 使金属增强抗腐蚀能力、增大表面硬度等 将粗铜提炼为纯铜
示意图
阳极 镀层金属 粗铜
阴极 待镀金属 纯铜
电解质 含镀层金属阳离子 CuSO4溶液
电极 反应 (以铁 上镀 铜为 例) 阳极 Cu-2e-Cu2+ Zn-2e-Zn2+等,比铜活泼的金属杂质以阳离子形式残留在溶液中;Cu-2e-Cu2+,比铜不活泼的金属杂质形成阳极泥
阴极 Cu2++2e-Cu Cu2++2e-Cu
电解质溶 液的浓度 变化 CuSO4溶液的浓度不变 CuSO4溶液的浓度减小
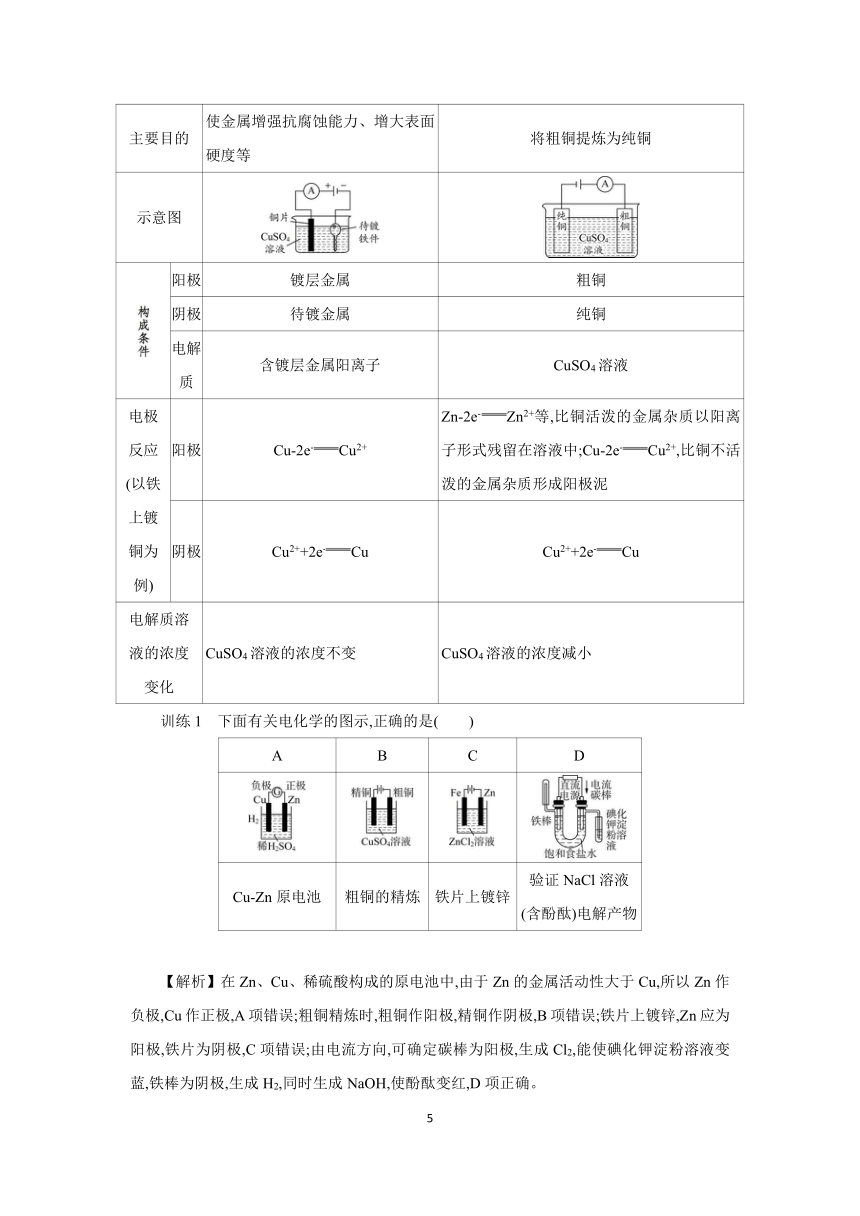
训练1 下面有关电化学的图示,正确的是( )
A B C D
Cu-Zn原电池 粗铜的精炼 铁片上镀锌 验证NaCl溶液 (含酚酞)电解产物
【解析】在Zn、Cu、稀硫酸构成的原电池中,由于Zn的金属活动性大于Cu,所以Zn作负极,Cu作正极,A项错误;粗铜精炼时,粗铜作阳极,精铜作阴极,B项错误;铁片上镀锌,Zn应为阳极,铁片为阴极,C项错误;由电流方向,可确定碳棒为阳极,生成Cl2,能使碘化钾淀粉溶液变蓝,铁棒为阴极,生成H2,同时生成NaOH,使酚酞变红,D项正确。
【答案】D
任务2 电化学的有关计算
【新知生成】
1.计算类型
原电池和电解池的计算包括两极产物的定量计算、溶液pH的计算、相对原子质量和阿伏加德罗常数的计算、产物的量与电量关系的计算等。
2.计算原则
电化学的反应是氧化还原反应,各电极上转移电子的物质的量相等,无论是单一电池还是串联电解池,均可抓住电子守恒计算。
【核心突破】
典例3 500 mL KNO3和Cu(NO3)2的混合溶液中c(N)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L(标准状况)气体,假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
【解析】石墨作电极电解KNO3和Cu(NO3)2的混合溶液,阳极反应为2H2O-4e-O2↑+4H+,阴极先后发生两个反应:Cu2++2e-Cu、2H++2e-H2↑;从收集到的O2为2.24L可推知上述电解过程中共转移0.4 mol电子,而在生成2.24L H2的过程中转移0.2 mol电子,所以Cu2+共得到0.4 mol-0.2 mol=0.2 mol电子,电解前Cu2+的物质的量和电解得到的Cu的物质的量都为0.1 mol;电解前后分别有以下守恒关系:c(K+)+2c(Cu2+)=c(N),c(K+)+c(H+)=c(N),则电解前c(K+)=0.2 mol·L-1,电解后c(H+)=0.4 mol·L-1。
【答案】A
典例4 1L 1 mol·L-1 AgNO3溶液在以银为阳极,铁为阴极的电解槽中电解,当阴极增重2.16g时,下列判断不正确的是( )
A.溶液浓度仍为1 mol·L-1
B.阳极上产生112 mL(标准状况)O2
C.转移的电子数是1.204×1022
D.反应中有0.02 mol金属被氧化
【解析】该过程是在铁上镀银,电镀过程中,溶液的浓度不变,A项正确;阳极反应为Ag-e-Ag+,阴极反应为Ag++e-Ag,阳极上无氧气生成,B项错误;2.16g Ag的物质的量为0.02 mol,阳极有0.02 mol银被氧化,转移的电子数是1.204×1022,C、D均正确。
【答案】B
归纳总结:电化学计算常用的三种方法
(1)根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
(2)根据电子守恒计算
①用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中通过的电子数相等。
②用于混合溶液中电解的分阶段计算。
(3)根据关系式计算
根据得失电子守恒关系建立起已知量与未知量之间的桥梁,构建计算所需的关系式。
通过4 mol e-为基准可构建电极产物之间的如下关系式:
训练2 某装置如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答:
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ;丁中X极附近的颜色变浅,Y极附近的颜色变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成,则对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙装置中溶液的pH是13时(此时乙装置中溶液体积为500 mL),丙装置中镀件上析出银的质量为 ,甲装置中溶液的pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲装置中发生反应的离子方程式是 。
【解析】(1)将直流电源接通后,F极附近呈红色,说明F极是阴极,E极是阳极,则A极为电源的正极,B极为电源的负极;甲装置中因Cu2+放电使溶液颜色变浅;丁装置中Y极附近颜色变深,说明Fe(OH)3胶体粒子向阴极移动,即 Fe(OH)3胶体粒子带正电荷。(2)C、D、E、F的电极产物分别为O2、Cu、Cl2、H2,由于电路中通过的电量相等,因此其物质的量之比为1∶2∶2∶2。(3)乙装置中溶液pH=13,生成 n(NaOH)=0.1 mol·L-1×0.5L=0.05 mol,电路中通过的电子的物质的量为0.05 mol,所以丙装置中镀件上析出银的质量为0.05 mol×108g·mol-1=5.4g。(4)当活泼金属作阳极时,金属先于溶液中的阴离子放电而溶解,故甲装置中发生总反应的离子方程式为Fe+Cu2+Fe2++Cu。
【答案】(1)负极 变浅 氢氧化铁胶体粒子带正电荷 (2)1∶2∶2∶2 (3)镀件 AgNO3 5.4g 变小 (4)Fe+Cu2+Cu+Fe2+
课堂小结
【随堂检测】
1.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产,下列说法中正确的是( )
A.Z是AgNO3溶液,X、Y均为Pt,Y电极上有O2产生
B.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
C.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4溶液
D.电镀工业中,X是待镀金属,Y是镀层金属
【解析】用惰性电极电解AgNO3溶液,阴极银离子得电子析出银,阳极氢氧根离子失电子生成O2,X电极上有O2产生,A项错误;用惰性电极电解饱和氯化钠溶液,阴极附近得到氢氧化钠,即Y附近能得到氢氧化钠,B项正确;铜的精炼中,阳极X为粗铜,阴极Y为纯铜,硫酸铜溶液作电解质溶液,C项错误;电镀工业中,阴极Y是待镀金属,阳极X是镀层金属,D项错误。
【答案】B
2.在铁制品表面镀上一定厚度的锌层,以下电镀方案中正确的是( )
A.锌作阳极,铁制品作阴极,溶液中含Fe2+
B.锌作阳极,铁制品作阴极,溶液中含Zn2+
C.锌作阴极,铁制品作阳极,溶液中含Fe3+
D.锌作阴极,铁制品作阳极,溶液中含Zn2+
【解析】电镀时,要求用镀层金属(锌)作阳极,待镀金属(铁制品)作阴极,含镀层金属离子(Zn2+)的溶液作电镀液。
【答案】B
3.如图所示装置,用惰性电极电解熔融氯化钠[2NaCl(熔融)2Na+Cl2↑],下列说法错误的是( )
A.通电时,Na+向铁电极移动
B.石墨电极发生还原反应
C.电解一段时间后,在两个电极上分别生成金属钠和氯气
D.石墨电极生成氯气的电极反应:2Cl--2e-Cl2↑
【解析】根据图示,石墨电极为阳极,铁电极为阴极,通电时,Na+向铁电极移动,A项正确;Cl-在石墨电极上失电子生成Cl2,发生氧化反应,B项错误;电解一段时间后,在石墨电极上生成氯气,铁电极上生成金属钠,C项正确;石墨电极上Cl-失电子生成Cl2,电极反应为2Cl--2e-Cl2↑,D项正确。
【答案】B
4.电解NaCl溶液的装置如图所示,下列说法不正确的是( )
A.铁电极上的电极反应为Fe-2e-Fe2+
B.溶液中Na+由石墨电极向铁电极移动
C.通电一段时间后,可看到铁电极附近溶液变红
D.通电一段时间后,可看到试管中溶液变蓝
【解析】A项,铁作阴极,溶液中的水放电生成H2:2H2O+2e-H2↑+2OH-,错误;B项,电解质溶液中的阳离子向阴极移动,即移向铁电极,正确;C项,水中H+放电生成H2,留下OH-,遇酚酞变红,正确;D项,石墨为阳极,阴离子Cl-放电生成Cl2,氧化I-生成I2,遇淀粉显蓝色,正确。
【答案】A
5.以石墨为电极电解KI溶液(含有少量酚酞和淀粉),下列有关说法错误的是( )
A.阴极附近溶液呈红色
B.阴极逸出气体
C.阳极附近溶液呈蓝色
D.溶液的pH变小
【解析】以石墨为电极电解KI溶液,发生的反应为2KI+2H2O2KOH+H2↑+I2,阴极产物是H2和KOH,阳极产物是I2。由于溶液中含有少量的酚酞和淀粉,所以阳极附近的溶液会变蓝,阴极附近的溶液会变红,A、B、C三项正确;因为电解时有KOH生成,所以溶液的pH逐渐增大,D项错误。
【答案】D
2
【学习目标】
1.通过对氯碱工业、电镀、电解精炼铜、电冶金等原理的分析,了解电解的应用,认识电能与化学能之间的能量转化。学会电极反应的书写。
2.通过探究电镀、电解精炼铜的实验,培养观察、分析、推理及归纳总结能力,建立有电极参与反应的电解原理的认知模型,形成科学的态度,感受电解的价值。
3.通过练习学会电解的有关计算,建立相关计算的思维模型,加深对电解原理的理解和应用,提升学生模型认知的核心素养。
【合作探究】
【学习情境】
历史上伏特发明电池以后,引起化学家利用电解方法研究元素的兴趣,由电解法分离的元素及利用新分离出的元素提纯其他元素层出不穷;那么电解原理有哪些应用呢
任务1 电解原理的应用
【新知生成】
1.氯碱工业——电解饱和食盐水
阳极反应: ( 反应)。
阴极反应: ( 反应)。
总反应方程: 。
2.电镀与电解精炼
(1)电镀铜
(2)电解精炼铜
3.电冶金:利用电解熔融盐或氧化物的方法来冶炼活泼金属Na、Ca、Mg、Al等。
总反应方程 阳极、阴极反应
冶炼钠 阳极:2Cl--2e-Cl2↑ 阴极:2Na++2e-2Na
冶炼镁 阳极:2Cl--2e-Cl2↑ 阴极:Mg2++2e-Mg
冶炼铝 阳极:6O2--12e-3O2↑ 阴极:4Al3++12e-4Al
【答案】1.2Cl--2e-Cl2↑ 氧化 2H2O+2e-H2↑+2OH- 还原 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 2.(1)纯铜 镀件 Cu2+ Cu-2e-Cu2+ Cu2++2e-Cu (2)粗铜 精铜 Zn-2e-Zn2+ Fe-2e-Fe2+ Cu-2e-Cu2+ Cu2++2e-Cu 3.2NaCl(熔融)2Na+Cl2↑ MgCl2(熔融)Mg+Cl2↑ 2Al2O3(熔融)4Al+3O2↑
【核心突破】
典例1 下图为阳离子交换膜法电解饱和食盐水原理示意图。下列说法不正确的是( )
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,有2 mol Na+通过离子交换膜
D.F电极材料为金属铁
【解析】根据Na+的移动方向可知,装置左边是阳极区、右边是阴极区,F是阳极,阳极上Cl-失电子,G是阴极,G电极的电极反应为2H2O+2e-H2↑+2OH-,从E口逸出的气体是H2,A项正确;离子浓度越大,溶液导电能力越强,所以从B口加入含少量NaOH的水溶液以增强导电性,B项正确;电解总反应为2NaCl+2H2O2NaOH+Cl2↑+H2↑,标准状况下每生成22.4L Cl2,转移2 mol电子,则有2 mol Na+通过离子交换膜,C项正确;阳极上Cl-失电子生成氯气,所以阳极不能是活性电极,即F电极材料不能是金属铁,D项错误。
【答案】D
典例2 金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+
B.电解过程中,阳极减少的质量与阴极增加的质量相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
【解析】已知氧化性:Fe2+
归纳总结:
1.氯碱工业生产法——离子交换膜法
(1)离子交换膜电解槽的组成
由阳极(金属钛网)、阴极(碳钢网)、离子交换膜、电解槽和导电铜棒等组成,每台电解槽由若干个单元槽串联或并联组成。下图表示一个单元槽的示意图。
特别提醒:离子交换膜法制烧碱的生产流程重在掌握化学反应原理,对生产设备及生产细节不做过多要求。
(2)阳离子交换膜的作用
电解饱和食盐水是氯碱工业的基础,能制得氯气、氢气、氢氧化钠等重要的化工原料。电解过程中,在电场的作用下,阳离子向阴极移动,而阴离子向阳极移动。由于在阳极氯离子失去电子生成氯气,若不采取措施,氢氧根离子会向阳极移动,从而与氯气发生反应,既减少了氯气的产量,又会使得到的氢氧化钠不纯。因此,必须阻止氢氧根离子向阳极移动。
目前,常用的隔膜有石棉隔膜和阳离子交换膜。石棉隔膜能阻止气体通过,但允许水分子及离子通过。由于氢氧根离子能透过隔膜,因此氯气会与氢氧根离子发生反应,导致制得的氢氧化钠不纯。阳离子交换膜只允许阳
离子通过,而不允许阴离子及气体通过,也就是说,只允许钠离子通过,氯离子、氢氧根离子和氢气、氯气均不能通过。这样既可以防止阴极产生的氢气与阳极产生的氯气相混合,在一定条件下引起爆炸,又能避免氯气与氢氧化钠作用生成次氯酸钠而影响烧碱的质量。
(3)原料的精制
①粗盐的成分:粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、S等杂质,不符合电解要求,因此必须经过精制。
②杂质的危害:Ca2+、Mg2+、Fe3+等金属离子在碱性环境中会产生沉淀,损坏离子交换膜,此外,杂质的存在会使得到的产品不纯。
③除杂质的过程:粗盐水依次加入过量BaCl2(除去S)、过量NaOH(除去Mg2+、Fe3+)、过量Na2CO3(除去Ca2+和过量Ba2+),过滤(除去泥沙及沉淀),加入适量盐酸(除去OH-、C)。
Ⅰ.除杂质时所加试剂的顺序要求:
a.Na2CO3必须在BaCl2之后;b.在过滤之后加盐酸。
Ⅱ.试剂加入顺序有多种选择,如:a.BaCl2、NaOH、Na2CO3、过滤、盐酸;b.BaCl2、Na2CO3、NaOH、过滤、盐酸;c.NaOH、BaCl2、Na2CO3、过滤、盐酸。
2.电镀和电解精炼铜
电镀 电解精炼铜
概念 电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法 运用电解的方法将粗铜提炼为纯铜
主要目的 使金属增强抗腐蚀能力、增大表面硬度等 将粗铜提炼为纯铜
示意图
阳极 镀层金属 粗铜
阴极 待镀金属 纯铜
电解质 含镀层金属阳离子 CuSO4溶液
电极 反应 (以铁 上镀 铜为 例) 阳极 Cu-2e-Cu2+ Zn-2e-Zn2+等,比铜活泼的金属杂质以阳离子形式残留在溶液中;Cu-2e-Cu2+,比铜不活泼的金属杂质形成阳极泥
阴极 Cu2++2e-Cu Cu2++2e-Cu
电解质溶 液的浓度 变化 CuSO4溶液的浓度不变 CuSO4溶液的浓度减小
训练1 下面有关电化学的图示,正确的是( )
A B C D
Cu-Zn原电池 粗铜的精炼 铁片上镀锌 验证NaCl溶液 (含酚酞)电解产物
【解析】在Zn、Cu、稀硫酸构成的原电池中,由于Zn的金属活动性大于Cu,所以Zn作负极,Cu作正极,A项错误;粗铜精炼时,粗铜作阳极,精铜作阴极,B项错误;铁片上镀锌,Zn应为阳极,铁片为阴极,C项错误;由电流方向,可确定碳棒为阳极,生成Cl2,能使碘化钾淀粉溶液变蓝,铁棒为阴极,生成H2,同时生成NaOH,使酚酞变红,D项正确。
【答案】D
任务2 电化学的有关计算
【新知生成】
1.计算类型
原电池和电解池的计算包括两极产物的定量计算、溶液pH的计算、相对原子质量和阿伏加德罗常数的计算、产物的量与电量关系的计算等。
2.计算原则
电化学的反应是氧化还原反应,各电极上转移电子的物质的量相等,无论是单一电池还是串联电解池,均可抓住电子守恒计算。
【核心突破】
典例3 500 mL KNO3和Cu(NO3)2的混合溶液中c(N)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L(标准状况)气体,假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
【解析】石墨作电极电解KNO3和Cu(NO3)2的混合溶液,阳极反应为2H2O-4e-O2↑+4H+,阴极先后发生两个反应:Cu2++2e-Cu、2H++2e-H2↑;从收集到的O2为2.24L可推知上述电解过程中共转移0.4 mol电子,而在生成2.24L H2的过程中转移0.2 mol电子,所以Cu2+共得到0.4 mol-0.2 mol=0.2 mol电子,电解前Cu2+的物质的量和电解得到的Cu的物质的量都为0.1 mol;电解前后分别有以下守恒关系:c(K+)+2c(Cu2+)=c(N),c(K+)+c(H+)=c(N),则电解前c(K+)=0.2 mol·L-1,电解后c(H+)=0.4 mol·L-1。
【答案】A
典例4 1L 1 mol·L-1 AgNO3溶液在以银为阳极,铁为阴极的电解槽中电解,当阴极增重2.16g时,下列判断不正确的是( )
A.溶液浓度仍为1 mol·L-1
B.阳极上产生112 mL(标准状况)O2
C.转移的电子数是1.204×1022
D.反应中有0.02 mol金属被氧化
【解析】该过程是在铁上镀银,电镀过程中,溶液的浓度不变,A项正确;阳极反应为Ag-e-Ag+,阴极反应为Ag++e-Ag,阳极上无氧气生成,B项错误;2.16g Ag的物质的量为0.02 mol,阳极有0.02 mol银被氧化,转移的电子数是1.204×1022,C、D均正确。
【答案】B
归纳总结:电化学计算常用的三种方法
(1)根据总反应式计算
先写出电极反应式,再写出总反应式,最后根据总反应式列出比例式计算。
(2)根据电子守恒计算
①用于串联电路中阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中通过的电子数相等。
②用于混合溶液中电解的分阶段计算。
(3)根据关系式计算
根据得失电子守恒关系建立起已知量与未知量之间的桥梁,构建计算所需的关系式。
通过4 mol e-为基准可构建电极产物之间的如下关系式:
训练2 某装置如图所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
请回答:
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ;丁中X极附近的颜色变浅,Y极附近的颜色变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成,则对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙装置中溶液的pH是13时(此时乙装置中溶液体积为500 mL),丙装置中镀件上析出银的质量为 ,甲装置中溶液的pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲装置中发生反应的离子方程式是 。
【解析】(1)将直流电源接通后,F极附近呈红色,说明F极是阴极,E极是阳极,则A极为电源的正极,B极为电源的负极;甲装置中因Cu2+放电使溶液颜色变浅;丁装置中Y极附近颜色变深,说明Fe(OH)3胶体粒子向阴极移动,即 Fe(OH)3胶体粒子带正电荷。(2)C、D、E、F的电极产物分别为O2、Cu、Cl2、H2,由于电路中通过的电量相等,因此其物质的量之比为1∶2∶2∶2。(3)乙装置中溶液pH=13,生成 n(NaOH)=0.1 mol·L-1×0.5L=0.05 mol,电路中通过的电子的物质的量为0.05 mol,所以丙装置中镀件上析出银的质量为0.05 mol×108g·mol-1=5.4g。(4)当活泼金属作阳极时,金属先于溶液中的阴离子放电而溶解,故甲装置中发生总反应的离子方程式为Fe+Cu2+Fe2++Cu。
【答案】(1)负极 变浅 氢氧化铁胶体粒子带正电荷 (2)1∶2∶2∶2 (3)镀件 AgNO3 5.4g 变小 (4)Fe+Cu2+Cu+Fe2+
课堂小结
【随堂检测】
1.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产,下列说法中正确的是( )
A.Z是AgNO3溶液,X、Y均为Pt,Y电极上有O2产生
B.氯碱工业中,X、Y均为石墨,Y附近能得到氢氧化钠
C.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4溶液
D.电镀工业中,X是待镀金属,Y是镀层金属
【解析】用惰性电极电解AgNO3溶液,阴极银离子得电子析出银,阳极氢氧根离子失电子生成O2,X电极上有O2产生,A项错误;用惰性电极电解饱和氯化钠溶液,阴极附近得到氢氧化钠,即Y附近能得到氢氧化钠,B项正确;铜的精炼中,阳极X为粗铜,阴极Y为纯铜,硫酸铜溶液作电解质溶液,C项错误;电镀工业中,阴极Y是待镀金属,阳极X是镀层金属,D项错误。
【答案】B
2.在铁制品表面镀上一定厚度的锌层,以下电镀方案中正确的是( )
A.锌作阳极,铁制品作阴极,溶液中含Fe2+
B.锌作阳极,铁制品作阴极,溶液中含Zn2+
C.锌作阴极,铁制品作阳极,溶液中含Fe3+
D.锌作阴极,铁制品作阳极,溶液中含Zn2+
【解析】电镀时,要求用镀层金属(锌)作阳极,待镀金属(铁制品)作阴极,含镀层金属离子(Zn2+)的溶液作电镀液。
【答案】B
3.如图所示装置,用惰性电极电解熔融氯化钠[2NaCl(熔融)2Na+Cl2↑],下列说法错误的是( )
A.通电时,Na+向铁电极移动
B.石墨电极发生还原反应
C.电解一段时间后,在两个电极上分别生成金属钠和氯气
D.石墨电极生成氯气的电极反应:2Cl--2e-Cl2↑
【解析】根据图示,石墨电极为阳极,铁电极为阴极,通电时,Na+向铁电极移动,A项正确;Cl-在石墨电极上失电子生成Cl2,发生氧化反应,B项错误;电解一段时间后,在石墨电极上生成氯气,铁电极上生成金属钠,C项正确;石墨电极上Cl-失电子生成Cl2,电极反应为2Cl--2e-Cl2↑,D项正确。
【答案】B
4.电解NaCl溶液的装置如图所示,下列说法不正确的是( )
A.铁电极上的电极反应为Fe-2e-Fe2+
B.溶液中Na+由石墨电极向铁电极移动
C.通电一段时间后,可看到铁电极附近溶液变红
D.通电一段时间后,可看到试管中溶液变蓝
【解析】A项,铁作阴极,溶液中的水放电生成H2:2H2O+2e-H2↑+2OH-,错误;B项,电解质溶液中的阳离子向阴极移动,即移向铁电极,正确;C项,水中H+放电生成H2,留下OH-,遇酚酞变红,正确;D项,石墨为阳极,阴离子Cl-放电生成Cl2,氧化I-生成I2,遇淀粉显蓝色,正确。
【答案】A
5.以石墨为电极电解KI溶液(含有少量酚酞和淀粉),下列有关说法错误的是( )
A.阴极附近溶液呈红色
B.阴极逸出气体
C.阳极附近溶液呈蓝色
D.溶液的pH变小
【解析】以石墨为电极电解KI溶液,发生的反应为2KI+2H2O2KOH+H2↑+I2,阴极产物是H2和KOH,阳极产物是I2。由于溶液中含有少量的酚酞和淀粉,所以阳极附近的溶液会变蓝,阴极附近的溶液会变红,A、B、C三项正确;因为电解时有KOH生成,所以溶液的pH逐渐增大,D项错误。
【答案】D
2
