2024年化学中考二轮复习精讲专项突破1 溶解度曲线及其应用课件(共29张PPT)
文档属性
| 名称 | 2024年化学中考二轮复习精讲专项突破1 溶解度曲线及其应用课件(共29张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-13 21:46:35 | ||
图片预览



文档简介
(共29张PPT)
专项突破1 溶解度及其应用
2024年中考二轮复习微专题
溶解度表的应用
类型六
饱和溶液与不饱和溶液的判断及相互转化
类型三
温度改变时,溶液中各种量的变化情况
类型二
根据溶解度曲线的升降情况判断提纯方法
类型四
溶质质量分数的计算与比较
类型五
溶解度大小的确定及比较
类型一
目录
溶解度大小的确定及比较
类型一
1.在确定物质的溶解度时必须指明温度,否则无意义,且溶解度需带单位。
2.溶解度曲线的意义:
方法指导
曲图中部位 表示的意义
曲线上的点 对应温度下物质的溶解度
两条曲线的交点 对应温度下两种物质的溶解度相等
线的走势 溶解度随着温度变化的趋势
线的倾斜程度 溶解度受温度变化的影响程度
曲线以上区域 溶液为该物质的饱和溶液
曲线以下区域 溶液为该物质的不饱和溶液
2
1
方法
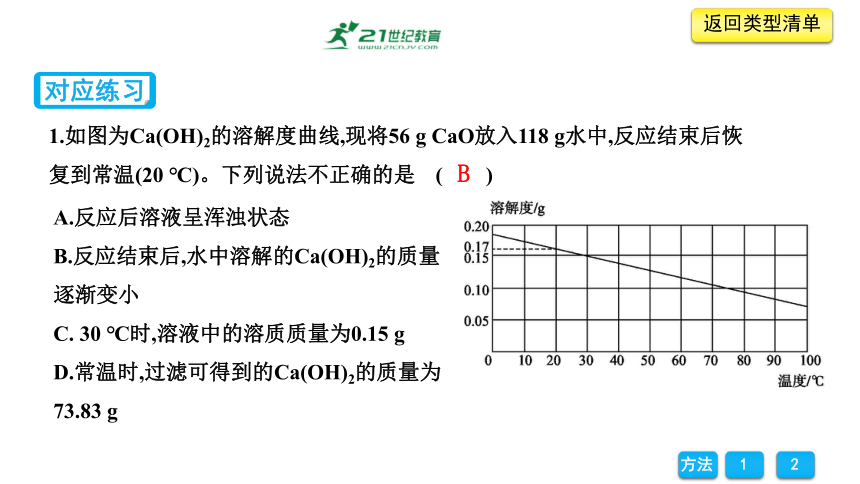
1.如图为Ca(OH)2的溶解度曲线,现将56 g CaO放入118 g水中,反应结束后恢复到常温(20 ℃)。下列说法不正确的是 ( )
B
g
对应练习
A.反应后溶液呈浑浊状态
B.反应结束后,水中溶解的Ca(OH)2的质量逐渐变小
C. 30 ℃时,溶液中的溶质质量为0.15 g
D.常温时,过滤可得到的Ca(OH)2的质量为73.83 g
2
1
方法
思路点拨
1.写出反应的化学方程式并列出各物质质量比。
CaO + H2O Ca(OH)2
56 18 74
2.根据质量守恒定律,已知CaO实际参与反应的质量为56 g,水过量。求出生成物Ca(OH)2的质量为74 g,消耗水的质量为18 g,剩余水(溶剂)的质量为100 g。
3.结合溶解度曲线进行具体分析。
2
1
方法
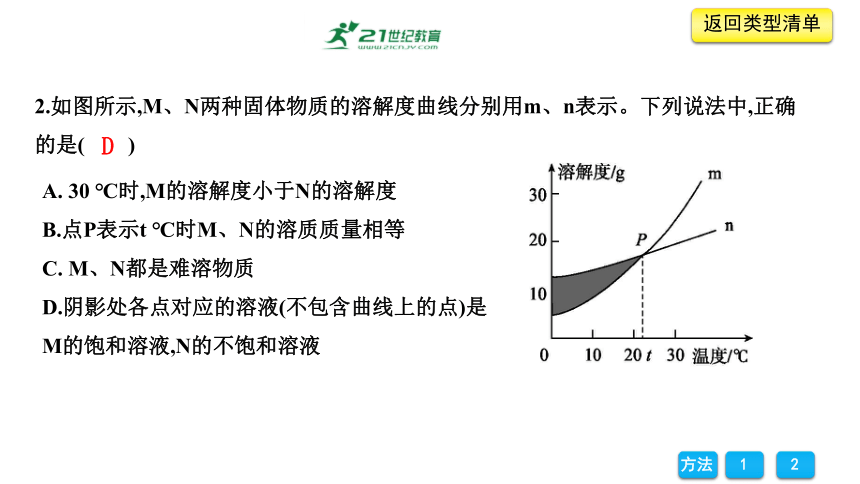
2.如图所示,M、N两种固体物质的溶解度曲线分别用m、n表示。下列说法中,正确的是( )
D
A. 30 ℃时,M的溶解度小于N的溶解度
B.点P表示t ℃时M、N的溶质质量相等
C. M、N都是难溶物质
D.阴影处各点对应的溶液(不包含曲线上的点)是M的饱和溶液,N的不饱和溶液
2
1
方法
题型讲解
温度改变时,溶液中各种量的变化情况
类型二
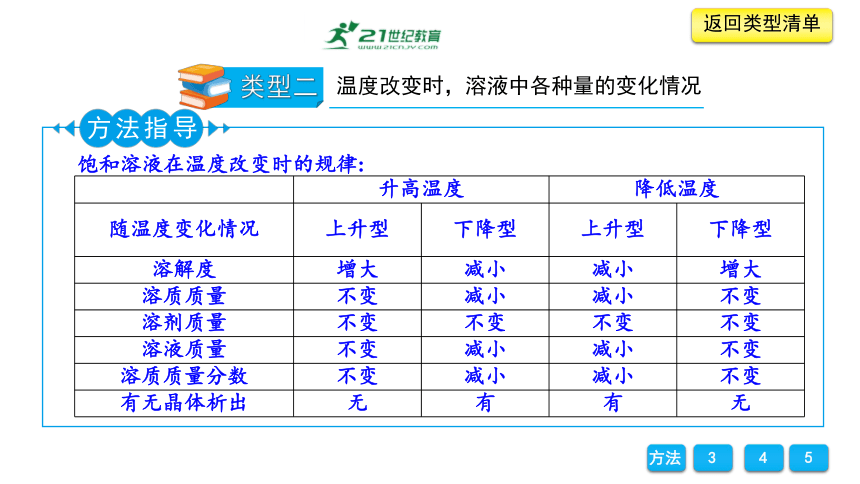
饱和溶液在温度改变时的规律:
方法指导
升高温度 降低温度 随温度变化情况 上升型 下降型 上升型 下降型
溶解度 增大 减小 减小 增大
溶质质量 不变 减小 减小 不变
溶剂质量 不变 不变 不变 不变
溶液质量 不变 减小 减小 不变
溶质质量分数 不变 减小 减小 不变
有无晶体析出 无 有 有 无
4
3
方法
5
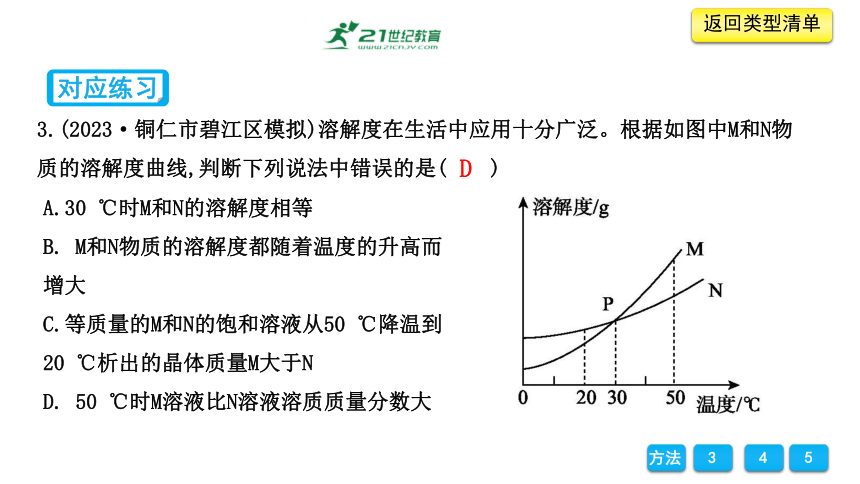
3.(2023·铜仁市碧江区模拟)溶解度在生活中应用十分广泛。根据如图中M和N物质的溶解度曲线,判断下列说法中错误的是( )
g
对应练习
A.30 ℃时M和N的溶解度相等
B. M和N物质的溶解度都随着温度的升高而增大
C.等质量的M和N的饱和溶液从50 ℃降温到20 ℃析出的晶体质量M大于N
D. 50 ℃时M溶液比N溶液溶质质量分数大
D
4
3
方法
5
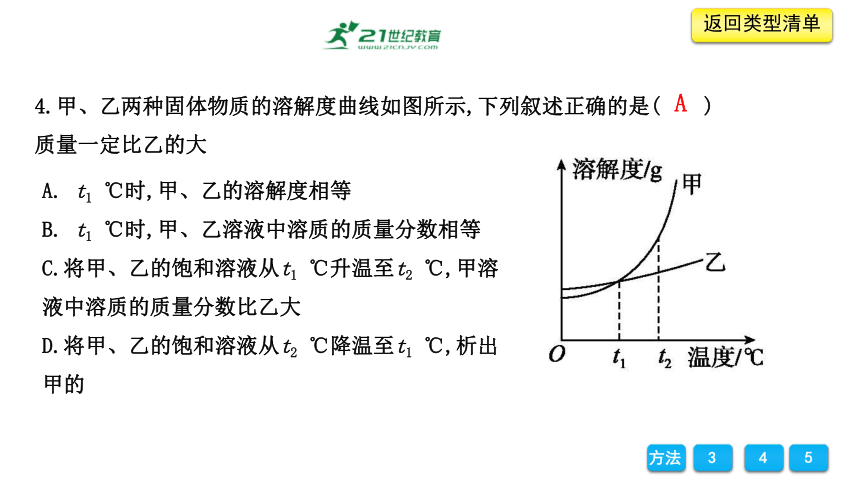
4.甲、乙两种固体物质的溶解度曲线如图所示,下列叙述正确的是( )
质量一定比乙的大
A
A. t1 ℃时,甲、乙的溶解度相等
B. t1 ℃时,甲、乙溶液中溶质的质量分数相等
C.将甲、乙的饱和溶液从t1 ℃升温至t2 ℃,甲溶液中溶质的质量分数比乙大
D.将甲、乙的饱和溶液从t2 ℃降温至t1 ℃,析出甲的
4
3
方法
5
5.A、B、C三种固体物质的溶解度曲线如图所示。
t2 ℃时,A、B、C三种物质的饱和溶液降温到t1 ℃,溶液中溶质质量分数由大到小的顺序是 。
B>A>C
4
3
方法
5
思路点拨
1.降温过程中,C物质溶解度增大,所以t1 ℃时为不饱和溶液,无溶质析出,溶质质量分数与t2 ℃时相同。
2.降温过程中,物质A、B溶解度减小,有溶质析出,所以t1 ℃时都为饱和溶液,溶质质量分数减小。
3.再比较t1 ℃时A、B的溶解度,A
4
3
方法
5
题型讲解
饱和溶液与不饱和溶液的判断及相互转化
类型三
1.饱和溶液的判断:在一定温度下,
①若=,则为饱和溶液;
②若<,则为不饱和溶液;
③若>,则为饱和溶液,且有固体未溶解。
方法指导
7
6
方法
8
题型讲解
2.饱和溶液与不饱和溶液的相互转化:
①上升型曲线
②下降型曲线
方法指导
7
6
方法
8
6.KNO3的溶解度曲线如图1所示。在50 ℃时向100 g水中加入一定量的KNO3形成KNO3溶液,再降温至20 ℃,析出固体质量的变化如图2所示。下列判断正确的是( )
A.加入的KNO3质量为51.6 g
B.蒸发溶剂可将M点的溶液转化到N点
C.降温过程中KNO3溶液始终为饱和溶液
D.20 ℃时,100 g KNO3饱和溶液中有溶质31.6 g
A
g
对应练习
7
6
方法
8
7.(2022 贵阳清镇市校级一模)如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
C
A.t1 ℃时,甲、乙两物质的溶解度大小关系:甲>乙
B.t2 ℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C.t3 ℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.将t1 ℃时甲、乙的饱和溶液升温至t2 ℃,所得甲、乙的溶液仍都是饱和溶液
7
6
方法
8
8.如图是甲、乙两种物质的溶解度曲线。
(1)将接近饱和的乙溶液变成饱和溶液可采
用 (填“升温”或“降温”)的方法。
(2)等质量甲、乙物质分别配成t2 ℃时的饱和溶液,所需溶剂质量更多的是 。
(3)N点是甲的不饱和溶液,若想使其变成M点的饱和溶液,方法是 。
降低温度
乙
升温
7
6
方法
8
题型讲解
根据溶解度曲线的升降情况判断提纯方法
类型四
通常可以根据溶解度曲线类型判断适用的提纯方法。
陡升型:降温结晶或冷却热饱和溶液。
缓升型:蒸发结晶。
下降型:升温结晶。
方法指导
10
9
方法
11
9.如图是硝酸钾和氯化钾的溶解度曲线。
t1 ℃时,配制相同质量的硝酸钾和氯化钾饱和溶液,需要水的质量为硝酸钾 氯化钾(填“>”“<”或“=”);若硝酸钾中含有少量的氯化钾,提纯方法为 。
<
g
对应练习
降温结晶(或冷却热饱和溶液)
10
9
方法
11
(2)现有含少量甲的乙固体,若要通过结晶法进行提纯乙(甲与乙不发生反应),现有下列实验步骤可供选择:
①取一定量的水将固体溶解 ②趁热过滤
③用少量水洗涤晶体并烘干 ④加热蒸发使大部分晶体析出
的操作顺序为 (按顺序填编号)。
10.如图是甲、乙、丙三种物质的溶解度曲线。
(1)将t1 ℃时丙的不饱和溶液变成丙的饱和溶液除了增加丙溶质和蒸发溶剂外,还可以 。
升高温度
①④②③
10
9
方法
11
思路点拨
当陡升型物质中混有少量缓升型的物质时,可以用降温结晶的方法提纯得到陡升型物质,当缓升型物质中混有陡升型物质,可以用蒸发结晶的方法提纯得到缓升型物质。
根据溶解度曲线图可看出,乙物质溶解度随温度变化不大,属于缓升型,提纯方法适合用蒸发结晶。
10
9
方法
11
11.如图为Na2CO3和NaCl的溶解度曲线。为提纯含少量NaCl的纯碱样品,将其浓溶液从t1 ℃冷却至t2 ℃,t1~t2的最优范围是 (填字母)。
A.40 ~ 10 B.60 ~ 30 C.70 ~ 40
A
10
9
方法
11
题型讲解
溶质质量分数的计算与比较
类型五
1.一定温度下,饱和溶液的溶质质量分数=×100%。
2.一定温度下,某物质的溶解度越大,其饱和溶液中溶质质量分数越大。
方法指引
13
12
方法
12.T ℃时,等质量的甲、乙、丙三种固体分别加入等质量的水中,加入固体的质量与溶液中溶质质量分数的关系如图所示,下列说法正确的是( )
B
g
对应练习
A.该温度下,甲的溶解度为20 g
B.乙溶液在B点属于饱和溶液
C.降低温度一定能将甲的不饱和溶液变为饱和溶液
D.该温度下,甲、乙、丙三种固体的溶解度由大到小的顺序是甲>乙>丙
13
12
方法
130 g
13.A、B、C三种固体物质的溶解度曲线如图所示,请回答问题。
t1 ℃时,将70 g B的饱和溶液稀释成10%的溶液,需加水 。
13
12
方法
题型讲解
溶解度表的应用
类型六
溶解度表格实际上是数据化的溶解度曲线,是溶解度曲线上部分点的具体数值的罗列。
溶解度表常考查的内容:
(1)比较两种物质受温度影响的大小:选定相距较大的两个温度下的溶解度求差,差值较大的,说明该物质受温度的影响越大。
方法指导
15
14
方法
题型讲解
(2)判断所加物质能否全部溶解,求形成溶液的质量,求形成溶液的溶质质量分数:根据溶解度概念判断溶质是否能全部溶解,当溶剂质量不为100 g时,注意要根据相应溶解度进行转化。
(3)两种物质溶解度相等的范围选择:某温度范围内,一种物质的溶解度包含另一种物质的溶解度,或两种物质的溶解度范围有交叉。
方法指导
15
14
方法
14.NaCl和KIO3的溶解度如下表,下列说法错误的是 ( )
D
g
对应练习
A.由表中数据可知,KIO3溶解度受温度的影响比NaCl更大
B.20 ℃时,NaCl饱和溶液的溶质质量分数小于36%
C.从含少量NaCl的KIO3混合物中提纯KIO3可采用降温结晶的方法
D.40 ℃时,10 g KIO3加入盛有50 g水的烧杯中搅拌,得到的溶液质量为60 g
温度/℃ 0 20 40 60 80 100
NaCl溶解度/g 35.7 36.0 36.6 37.3 38.4 39.8
KIO3溶解度/g 4.6 8.1 12.6 18.3 24.8 32.3
15
14
方法
(1)图中表示NaCl溶解度曲线的是 (填“A”或“B”)。
(2)20 ℃时,向盛有40 g NaCl的烧杯中加入100 g水,搅拌,充分溶解后,溶液的溶质质量分数为 (只列出计算表达式)。
15.下列是KNO3和NaCl在不同温度时的溶解度表及溶解度曲线。
×100%
温度/℃ 20 30 40 50 60 70
KNO3溶 解度/g 31.6 45.8 63.9 85.5 110 138
NaCl溶 解度/g 36.0 36.3 36.6 37.0 37.3 37.8
B
15
14
方法
D
(3)30 ℃时,向各盛有100 g水的两个烧杯中,分别加入50 g KNO3和50 g NaCl,所得KNO3溶液的质量 (填“>”“<”或“=”)NaCl溶液的质量。
(4)由表中数据分析可知,在某一温度时NaCl和KNO3具有相同的溶解度m g,则m的取值范围是 。
温度/℃ 20 30 40 50 60 70
KNO3溶 解度/g 31.6 45.8 63.9 85.5 110 138
NaCl溶 解度/g 36.0 36.3 36.6 37.0 37.3 37.8
36.0>
15
14
方法
专项突破1 溶解度及其应用
2024年中考二轮复习微专题
溶解度表的应用
类型六
饱和溶液与不饱和溶液的判断及相互转化
类型三
温度改变时,溶液中各种量的变化情况
类型二
根据溶解度曲线的升降情况判断提纯方法
类型四
溶质质量分数的计算与比较
类型五
溶解度大小的确定及比较
类型一
目录
溶解度大小的确定及比较
类型一
1.在确定物质的溶解度时必须指明温度,否则无意义,且溶解度需带单位。
2.溶解度曲线的意义:
方法指导
曲图中部位 表示的意义
曲线上的点 对应温度下物质的溶解度
两条曲线的交点 对应温度下两种物质的溶解度相等
线的走势 溶解度随着温度变化的趋势
线的倾斜程度 溶解度受温度变化的影响程度
曲线以上区域 溶液为该物质的饱和溶液
曲线以下区域 溶液为该物质的不饱和溶液
2
1
方法
1.如图为Ca(OH)2的溶解度曲线,现将56 g CaO放入118 g水中,反应结束后恢复到常温(20 ℃)。下列说法不正确的是 ( )
B
g
对应练习
A.反应后溶液呈浑浊状态
B.反应结束后,水中溶解的Ca(OH)2的质量逐渐变小
C. 30 ℃时,溶液中的溶质质量为0.15 g
D.常温时,过滤可得到的Ca(OH)2的质量为73.83 g
2
1
方法
思路点拨
1.写出反应的化学方程式并列出各物质质量比。
CaO + H2O Ca(OH)2
56 18 74
2.根据质量守恒定律,已知CaO实际参与反应的质量为56 g,水过量。求出生成物Ca(OH)2的质量为74 g,消耗水的质量为18 g,剩余水(溶剂)的质量为100 g。
3.结合溶解度曲线进行具体分析。
2
1
方法
2.如图所示,M、N两种固体物质的溶解度曲线分别用m、n表示。下列说法中,正确的是( )
D
A. 30 ℃时,M的溶解度小于N的溶解度
B.点P表示t ℃时M、N的溶质质量相等
C. M、N都是难溶物质
D.阴影处各点对应的溶液(不包含曲线上的点)是M的饱和溶液,N的不饱和溶液
2
1
方法
题型讲解
温度改变时,溶液中各种量的变化情况
类型二
饱和溶液在温度改变时的规律:
方法指导
升高温度 降低温度 随温度变化情况 上升型 下降型 上升型 下降型
溶解度 增大 减小 减小 增大
溶质质量 不变 减小 减小 不变
溶剂质量 不变 不变 不变 不变
溶液质量 不变 减小 减小 不变
溶质质量分数 不变 减小 减小 不变
有无晶体析出 无 有 有 无
4
3
方法
5
3.(2023·铜仁市碧江区模拟)溶解度在生活中应用十分广泛。根据如图中M和N物质的溶解度曲线,判断下列说法中错误的是( )
g
对应练习
A.30 ℃时M和N的溶解度相等
B. M和N物质的溶解度都随着温度的升高而增大
C.等质量的M和N的饱和溶液从50 ℃降温到20 ℃析出的晶体质量M大于N
D. 50 ℃时M溶液比N溶液溶质质量分数大
D
4
3
方法
5
4.甲、乙两种固体物质的溶解度曲线如图所示,下列叙述正确的是( )
质量一定比乙的大
A
A. t1 ℃时,甲、乙的溶解度相等
B. t1 ℃时,甲、乙溶液中溶质的质量分数相等
C.将甲、乙的饱和溶液从t1 ℃升温至t2 ℃,甲溶液中溶质的质量分数比乙大
D.将甲、乙的饱和溶液从t2 ℃降温至t1 ℃,析出甲的
4
3
方法
5
5.A、B、C三种固体物质的溶解度曲线如图所示。
t2 ℃时,A、B、C三种物质的饱和溶液降温到t1 ℃,溶液中溶质质量分数由大到小的顺序是 。
B>A>C
4
3
方法
5
思路点拨
1.降温过程中,C物质溶解度增大,所以t1 ℃时为不饱和溶液,无溶质析出,溶质质量分数与t2 ℃时相同。
2.降温过程中,物质A、B溶解度减小,有溶质析出,所以t1 ℃时都为饱和溶液,溶质质量分数减小。
3.再比较t1 ℃时A、B的溶解度,A
4
3
方法
5
题型讲解
饱和溶液与不饱和溶液的判断及相互转化
类型三
1.饱和溶液的判断:在一定温度下,
①若=,则为饱和溶液;
②若<,则为不饱和溶液;
③若>,则为饱和溶液,且有固体未溶解。
方法指导
7
6
方法
8
题型讲解
2.饱和溶液与不饱和溶液的相互转化:
①上升型曲线
②下降型曲线
方法指导
7
6
方法
8
6.KNO3的溶解度曲线如图1所示。在50 ℃时向100 g水中加入一定量的KNO3形成KNO3溶液,再降温至20 ℃,析出固体质量的变化如图2所示。下列判断正确的是( )
A.加入的KNO3质量为51.6 g
B.蒸发溶剂可将M点的溶液转化到N点
C.降温过程中KNO3溶液始终为饱和溶液
D.20 ℃时,100 g KNO3饱和溶液中有溶质31.6 g
A
g
对应练习
7
6
方法
8
7.(2022 贵阳清镇市校级一模)如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是( )
C
A.t1 ℃时,甲、乙两物质的溶解度大小关系:甲>乙
B.t2 ℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C.t3 ℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.将t1 ℃时甲、乙的饱和溶液升温至t2 ℃,所得甲、乙的溶液仍都是饱和溶液
7
6
方法
8
8.如图是甲、乙两种物质的溶解度曲线。
(1)将接近饱和的乙溶液变成饱和溶液可采
用 (填“升温”或“降温”)的方法。
(2)等质量甲、乙物质分别配成t2 ℃时的饱和溶液,所需溶剂质量更多的是 。
(3)N点是甲的不饱和溶液,若想使其变成M点的饱和溶液,方法是 。
降低温度
乙
升温
7
6
方法
8
题型讲解
根据溶解度曲线的升降情况判断提纯方法
类型四
通常可以根据溶解度曲线类型判断适用的提纯方法。
陡升型:降温结晶或冷却热饱和溶液。
缓升型:蒸发结晶。
下降型:升温结晶。
方法指导
10
9
方法
11
9.如图是硝酸钾和氯化钾的溶解度曲线。
t1 ℃时,配制相同质量的硝酸钾和氯化钾饱和溶液,需要水的质量为硝酸钾 氯化钾(填“>”“<”或“=”);若硝酸钾中含有少量的氯化钾,提纯方法为 。
<
g
对应练习
降温结晶(或冷却热饱和溶液)
10
9
方法
11
(2)现有含少量甲的乙固体,若要通过结晶法进行提纯乙(甲与乙不发生反应),现有下列实验步骤可供选择:
①取一定量的水将固体溶解 ②趁热过滤
③用少量水洗涤晶体并烘干 ④加热蒸发使大部分晶体析出
的操作顺序为 (按顺序填编号)。
10.如图是甲、乙、丙三种物质的溶解度曲线。
(1)将t1 ℃时丙的不饱和溶液变成丙的饱和溶液除了增加丙溶质和蒸发溶剂外,还可以 。
升高温度
①④②③
10
9
方法
11
思路点拨
当陡升型物质中混有少量缓升型的物质时,可以用降温结晶的方法提纯得到陡升型物质,当缓升型物质中混有陡升型物质,可以用蒸发结晶的方法提纯得到缓升型物质。
根据溶解度曲线图可看出,乙物质溶解度随温度变化不大,属于缓升型,提纯方法适合用蒸发结晶。
10
9
方法
11
11.如图为Na2CO3和NaCl的溶解度曲线。为提纯含少量NaCl的纯碱样品,将其浓溶液从t1 ℃冷却至t2 ℃,t1~t2的最优范围是 (填字母)。
A.40 ~ 10 B.60 ~ 30 C.70 ~ 40
A
10
9
方法
11
题型讲解
溶质质量分数的计算与比较
类型五
1.一定温度下,饱和溶液的溶质质量分数=×100%。
2.一定温度下,某物质的溶解度越大,其饱和溶液中溶质质量分数越大。
方法指引
13
12
方法
12.T ℃时,等质量的甲、乙、丙三种固体分别加入等质量的水中,加入固体的质量与溶液中溶质质量分数的关系如图所示,下列说法正确的是( )
B
g
对应练习
A.该温度下,甲的溶解度为20 g
B.乙溶液在B点属于饱和溶液
C.降低温度一定能将甲的不饱和溶液变为饱和溶液
D.该温度下,甲、乙、丙三种固体的溶解度由大到小的顺序是甲>乙>丙
13
12
方法
130 g
13.A、B、C三种固体物质的溶解度曲线如图所示,请回答问题。
t1 ℃时,将70 g B的饱和溶液稀释成10%的溶液,需加水 。
13
12
方法
题型讲解
溶解度表的应用
类型六
溶解度表格实际上是数据化的溶解度曲线,是溶解度曲线上部分点的具体数值的罗列。
溶解度表常考查的内容:
(1)比较两种物质受温度影响的大小:选定相距较大的两个温度下的溶解度求差,差值较大的,说明该物质受温度的影响越大。
方法指导
15
14
方法
题型讲解
(2)判断所加物质能否全部溶解,求形成溶液的质量,求形成溶液的溶质质量分数:根据溶解度概念判断溶质是否能全部溶解,当溶剂质量不为100 g时,注意要根据相应溶解度进行转化。
(3)两种物质溶解度相等的范围选择:某温度范围内,一种物质的溶解度包含另一种物质的溶解度,或两种物质的溶解度范围有交叉。
方法指导
15
14
方法
14.NaCl和KIO3的溶解度如下表,下列说法错误的是 ( )
D
g
对应练习
A.由表中数据可知,KIO3溶解度受温度的影响比NaCl更大
B.20 ℃时,NaCl饱和溶液的溶质质量分数小于36%
C.从含少量NaCl的KIO3混合物中提纯KIO3可采用降温结晶的方法
D.40 ℃时,10 g KIO3加入盛有50 g水的烧杯中搅拌,得到的溶液质量为60 g
温度/℃ 0 20 40 60 80 100
NaCl溶解度/g 35.7 36.0 36.6 37.3 38.4 39.8
KIO3溶解度/g 4.6 8.1 12.6 18.3 24.8 32.3
15
14
方法
(1)图中表示NaCl溶解度曲线的是 (填“A”或“B”)。
(2)20 ℃时,向盛有40 g NaCl的烧杯中加入100 g水,搅拌,充分溶解后,溶液的溶质质量分数为 (只列出计算表达式)。
15.下列是KNO3和NaCl在不同温度时的溶解度表及溶解度曲线。
×100%
温度/℃ 20 30 40 50 60 70
KNO3溶 解度/g 31.6 45.8 63.9 85.5 110 138
NaCl溶 解度/g 36.0 36.3 36.6 37.0 37.3 37.8
B
15
14
方法
D
(3)30 ℃时,向各盛有100 g水的两个烧杯中,分别加入50 g KNO3和50 g NaCl,所得KNO3溶液的质量 (填“>”“<”或“=”)NaCl溶液的质量。
(4)由表中数据分析可知,在某一温度时NaCl和KNO3具有相同的溶解度m g,则m的取值范围是 。
温度/℃ 20 30 40 50 60 70
KNO3溶 解度/g 31.6 45.8 63.9 85.5 110 138
NaCl溶 解度/g 36.0 36.3 36.6 37.0 37.3 37.8
36.0
15
14
方法
同课章节目录
