6.1 第2课时 化学反应速率影响化学反应速率的因素 学案(含解析) 2023-2024学年高一化学苏教版(2020)必修第二册
文档属性
| 名称 | 6.1 第2课时 化学反应速率影响化学反应速率的因素 学案(含解析) 2023-2024学年高一化学苏教版(2020)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 222.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-10 10:09:20 | ||
图片预览



文档简介
6.1第2课时 影响化学反应速率的因素
【学习目标】
1.了解影响化学反应速率的因素,初步了解控制化学反应速率的方法。
2.通过对影响化学反应速率因素的探究,培养学生科学探究与创新意识。
3.能从内因、外因两方面认识化学反应速率,学会运用控制变量的方法研究影响化学反应速率的因素。
【合作探究】
【学习情境】
对于反应:钢铁腐蚀、食物腐败、炼钢、合成氨,你是希望其反应速率越快越好还是越慢越好 调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。有哪些因素能够影响化学反应速率呢 是什么样的影响呢
任务1 实验探究影响化学反应速率的因素
【新知生成】
一、探究影响化学反应速率的因素
1.催化剂、温度、浓度对H2O2分解反应速率的影响
序号 实验方案 实验现象 实验结论
① 取两支试管,各加入5 mL 4%的H2O2溶液,用药匙取少量MnO2粉末,加入其中的一支试管内,观察并比较两支试管中气泡生成的快慢
② 取两支试管,各加入5 mL 12%的H2O2溶液,将其中一支试管水浴加热,观察并比较两支试管中气泡生成的快慢
③ 取两支试管,分别加入5 mL 4%、5 mL 12%的H2O2溶液,再各加入2滴0.2 mol·L-1 FeCl3溶液,观察并比较两支试管中气泡生成的快慢
2.反应物接触面积对反应速率的影响
实验方案 实验现象 实验结论
取两支试管,向其中一支加入5 g块状大理石,另一支加入5 g粉末状大理石,再各加入5 mL 4 mol·L-1盐酸,观察并记录实验现象
二、影响化学反应速率的因素
1.内因:化学反应速率的大小主要取决于 。
2.外因
一般来说,其他条件相同时:
(1)加入催化剂能显著地 反应速率;反应的温度越高,反应速率越 ;反应物的浓度越大,反应速率越 。
(2)对于有气体参加的反应,反应体系的压强越大,反应速率越 。
(3)增大反应物的接触面积,能 反应速率。此外,光照等条件对一些化学反应速率也有一定影响。
【答案】一、1.①加MnO2粉末的试管中气泡生成的速率快
催化剂能增大反应速率 ②水浴加热的试管中气泡生成的速率快 升高温度能增大反应速率 ③盛放12%的H2O2溶液的试管中气泡生成的速率快 增大反应物浓度能增大反应速率
2.粉末状的大理石与盐酸反应比块状的快 增大反应物的接触面积,能增大反应速率
二、1.反应物自身的性质 2.(1)增大 大 大 (2)大 (3)增大
【核心突破】
典例1 用质量为1.0 g的锌粉与10 mL 1.0 mol·L-1稀硫酸反应制备氢气,下列措施能加快制备氢气速率的是( )。
A.将锌粉换成铁片
B.对溶液适当加热
C.将稀硫酸换成98%的浓硫酸
D.增加稀硫酸的用量
【答案】B
【解析】金属锌比金属铁活泼,且金属粉末与酸的接触面积大于金属片与酸的接触面积,因此将锌粉换成铁片,会减慢制备氢气速率,A项错误;加热可提高反应温度,从而加快制备氢气速率,B项正确;浓硫酸属于强氧化性酸,与锌反应生成的是SO2,C项错误;增加稀硫酸的用量并不能增大其浓度,也就不会改变制备氢气速率,D项错误。
【归纳总结】
影响化学反应速率的因素
1.内因:反应物本身的性质,反应物的化学性质越活泼,化学反应速率越快;反之化学反应速率越慢。
2.外因
条件改变 反应速率变化
浓度 增大反应物浓度 加快
减小反应物浓度 减慢
温度 升高温度 加快
降低温度 减慢
压强 对气体物质 参加的反应 增大压强 加快
减小压强 减慢
催化剂 加入合适的催化剂 加快
接触面积 增大反应物间的接触面积 加快
训练1 下列有关描述正确的是( )。
A.Na、Mg、Al的金属性决定了它们与水反应的速率快慢
B.对一定条件下的反应C(s)+O2(g)CO2(g),增加C的量,其反应速率加快
C.用铁和稀硫酸反应制取氢气时,将稀硫酸换成浓硫酸,产生氢气的速率加快
D.改变压强,化学反应速率必然改变
【答案】A
【解析】Na、Mg、Al的金属性依次减弱,与水反应的速率依次减慢,A项正确;C是固体,浓度为常数,增加用量,几乎不影响反应速率,B项错误;常温下铁遇浓硫酸钝化,不产生氢气,C项错误;对于固体、液体参与的反应,改变压强,反应速率几乎不变,D项错误。
任务2 运用控制变量法研究影响化学反应速率的因素
【新知生成】
将 因素问题拆解为多个 因素问题分别开展研究,化繁为简,再进行综合分析,最后得出结论。这种方法称为 。
【答案】多 单 控制变量法
【核心突破】
典例2 某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表。
实验 序号 铁的质 量/g 铁的 形态 V(H2SO4) /mL c(H2SO4) /(mol·L-1) 反应前溶液 的温度/℃ 金属完全消 失的时间/s
1 0.10 片状 50 0.8 20 200
2 0.10 粉状 50 0.8 20 25
3 0.10 片状 50 1.0 20 125
4 0.10 片状 50 1.0 35 50
请分析上表信息,回答下列问题:
(1)实验1、2表明 对反应速率有影响。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1盐酸(其他条件不变),发现放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是 (忽略温度对反应速率的影响)。
【答案】(1)固体反应物的表面积 (2)1和3 (3)反应前溶液的温度 3和4 (4)Cl-对反应起促进作用(或S对反应起抑制作用)(或其他合理答案)
【归纳总结】
控制变量法:科学研究中,对于多因素(多变量)的问题,常常采用只改变其中的某一个因素,控制其他因素不变的研究方法,使多因素的问题变成几个单因素的问题分别加以研究,最后再将几个单因素问题的研究结果加以综合。
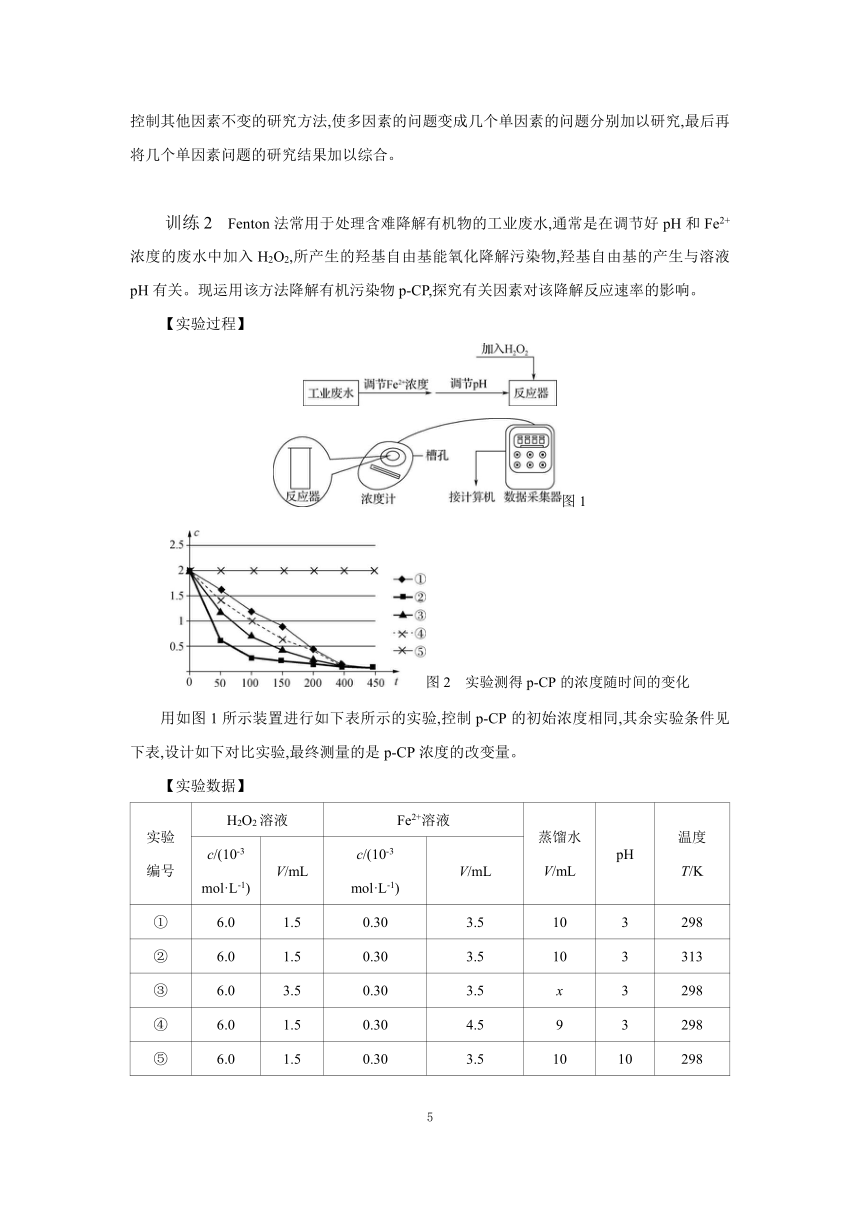
训练2 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH有关。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验过程】
图1
图2 实验测得p-CP的浓度随时间的变化
用如图1所示装置进行如下表所示的实验,控制p-CP的初始浓度相同,其余实验条件见下表,设计如下对比实验,最终测量的是p-CP浓度的改变量。
【实验数据】
实验 编号 H2O2溶液 Fe2+溶液 蒸馏水 V/mL pH 温度 T/K
c/(10-3 mol·L-1) V/mL c/(10-3 mol·L-1) V/mL
① 6.0 1.5 0.30 3.5 10 3 298
② 6.0 1.5 0.30 3.5 10 3 313
③ 6.0 3.5 0.30 3.5 x 3 298
④ 6.0 1.5 0.30 4.5 9 3 298
⑤ 6.0 1.5 0.30 3.5 10 10 298
【分析与解释】
(1)实验③中x= 。
(2)实验①⑤的目的是 。
(3)实验①②表明温度升高,降解反应速率增大。但温度过高反而导致降解反应速率减小,从Fenton法所用试剂H2O2性质的角度分析原因: (请用化学用语解答)。
(4)通过实验⑤可以得出的结论是pH等于10时,降解反应趋于停止,推测可能的原因: 。
【答案】(1)8 (2)探究pH对p-CP降解速率的影响 (3)温度高H2O2易分解:2H2O22H2O+O2↑ (4)pH=10时,Fe2+与H2O2反应生成Fe(OH)3,催化作用降低,抑制了羟基自由基的产生,进而无法氧化降解污染物
【解析】(1)实验①为对照组,实验②是探究温度对降解速率的影响,实验③是探究浓度对降解速率的影响,应保持单一变量,溶液总体积应为15 mL,则x=8。
(2)实验①⑤所加试剂的体积、浓度均相同,只有pH不同,故实验①⑤是探究pH对p-CP降解速率的影响。
(3)反应温度在较低范围时,随着温度升高,过氧化氢产生羟基自由基的速率增加,使p-CP降解速率提高;反应温度过高时,过氧化氢分解产生氧气,几乎不产生羟基自由基,导致p-CP降解速率减小。
(4)由图中曲线可以看出,在pH等于10时,p-CP的浓度几乎没有变化,说明pH=10时,该降解反应趋于停止,是因为在碱性较强的时候,Fe2+与H2O2反应生成了Fe(OH)3,催化作用降低,抑制了羟基自由基的产生。
【课堂小结】
【随堂检测】
1.已知FeCl3和MnO2都可作H2O2分解制O2反应的催化剂,为了探究温度对化学反应速率的影响,下列实验方案可行的是( )。
A.
B.
C.
D.
【答案】D
【解析】当探究温度对化学反应速率的影响时,必须保证是在其他条件相同的情况下,再改变温度观察反应速率的变化。
2.以反应5H2C2O4+2Mn+6H+10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 H2C2O4溶液 酸性KMnO4溶液 温度/℃
浓度/(mol·L-1) 体积/mL 浓度/(mol·L-1) 体积/mL
① 0.10 2.0 0.010 4.0 25
② 0.20 2.0 0.010 4.0 25
③ 0.20 2.0 0.010 4.0 50
下列说法错误的是( )。
A.实验①②③所加的H2C2O4溶液均要过量
B.实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内平均反应速率v(KMnO4)=2.5×10-4 mol·L-1·s-1
C.实验①和②是探究浓度对化学反应速率的影响,实验②和③是探究温度对化学反应速率的影响
D.实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
【答案】B
【解析】要通过测定溶液褪色所需时间来判断反应的快慢,则实验①②③所加的H2C2O4溶液均要过量,A项正确;40 s内的平均反应速率v(KMnO4)==1.67×10-4 mol·L-1·s-1,B项错误;探究温度对化学反应速率的影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验是②和③,探究反应物浓度对化学反应速率的影响,除了浓度不同,其他条件完全相同的实验是①和②,C项正确;由影响反应速率的因素可知,实验①和②起初反应速率很慢后突然增大,可能是Mn2+对反应起催化作用,D项正确。
3.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )。
甲 乙
丙 丁
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
【答案】D
【解析】图甲中溶液的pH相同,但H2O2浓度不同,浓度越大,相同时间内浓度的变化量越大,由此得出相同pH时,H2O2浓度越大,其分解速率越快,A项错误;图乙中H2O2浓度相同,但NaOH浓度不同,溶液的pH不同,NaOH浓度越大,相同时间内H2O2浓度变化量越大,故H2O2浓度相同时,pH越大H2O2分解速率越快,B项错误;图丙中少量Mn2+存在时,相同时间内H2O2浓度变化量:0.1 mol·L-1 NaOH溶液>1.0 mol·L-1 NaOH溶液>0 mol·L-1 NaOH溶液,故锰离子作催化剂时受溶液pH的影响,但并不是溶液碱性越强,H2O2分解速率越快,C项错误;图丁中pH相同,锰离子浓度越大,相同时间内H2O2浓度变化量越大,说明碱性溶液中,Mn2+对H2O2分解速率的影响大,D项正确。
4.研究影响化学反应速率的因素对实际生产、生活有重要意义。
(1)在日常的生活、生产中有许多外界条件对化学反应速率产生影响的例子,如冰箱保存食品、酸奶加酵母发酵快、空气中水蒸气含量越高铁越容易生锈等。在下列事实中,各是什么因素影响了化学反应速率
事实 影响因素
① 集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸
② 黄铁矿煅烧时要粉碎成矿粒
③ 熔化的KClO3放出气泡很慢,撒入少量MnO2则很快产生气体
④ 同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生气体有快有慢
⑤ 同样大小的石灰石分别与0.1 mol·L-1盐酸和1 mol·L-1盐酸反应,速率不同
⑥ 夏天食品容易变质,而冬天不易发生该现象
(2)为了研究MnO2对双氧水分解反应速率的影响,某学生将少许MnO2粉末加入50 mL密度为1.1 g·cm-3的双氧水中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示。请依图回答下列问题:
①实验时放出气体的总体积为 ;
②放出一半气体所需要的时间为 ;
③A、B、C、D四点化学反应速率由快到慢的顺序为 ;
④以上反应速率大小变化的原因是 ;
⑤在5 min后,收集到的气体体积不再增加,原因是 。
【答案】(1)①光 ②反应物的接触面积 ③催化剂 ④反应物本身的性质 ⑤反应物的浓度 ⑥反应温度
(2)①60 mL ②1 min ③D>C>B>A ④随着反应的进行,双氧水的浓度逐渐减小,反应速率也随之减小 ⑤此时双氧水已完全分解
【解析】(1)影响化学反应速率的因素除了浓度、温度、压强、催化剂以外,光、电磁波、超声波、反应物颗粒的大小、溶剂的性质等,也会对化学反应速率产生影响。
(2)从图示可知,生成气体的总体积为60 mL,生成一半气体即30 mL,需要的时间为1 min。图中曲线的斜率表示生成O2的反应速率,A、B、C、D四点的斜率依次减小,所以反应速率由快到慢的顺序为D>C>B>A。速率逐渐减慢的原因是随着反应的进行,双氧水的浓度逐渐减小。在5 min后,H2O2分解完全,所以气体的体积不再增加。
2
【学习目标】
1.了解影响化学反应速率的因素,初步了解控制化学反应速率的方法。
2.通过对影响化学反应速率因素的探究,培养学生科学探究与创新意识。
3.能从内因、外因两方面认识化学反应速率,学会运用控制变量的方法研究影响化学反应速率的因素。
【合作探究】
【学习情境】
对于反应:钢铁腐蚀、食物腐败、炼钢、合成氨,你是希望其反应速率越快越好还是越慢越好 调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。有哪些因素能够影响化学反应速率呢 是什么样的影响呢
任务1 实验探究影响化学反应速率的因素
【新知生成】
一、探究影响化学反应速率的因素
1.催化剂、温度、浓度对H2O2分解反应速率的影响
序号 实验方案 实验现象 实验结论
① 取两支试管,各加入5 mL 4%的H2O2溶液,用药匙取少量MnO2粉末,加入其中的一支试管内,观察并比较两支试管中气泡生成的快慢
② 取两支试管,各加入5 mL 12%的H2O2溶液,将其中一支试管水浴加热,观察并比较两支试管中气泡生成的快慢
③ 取两支试管,分别加入5 mL 4%、5 mL 12%的H2O2溶液,再各加入2滴0.2 mol·L-1 FeCl3溶液,观察并比较两支试管中气泡生成的快慢
2.反应物接触面积对反应速率的影响
实验方案 实验现象 实验结论
取两支试管,向其中一支加入5 g块状大理石,另一支加入5 g粉末状大理石,再各加入5 mL 4 mol·L-1盐酸,观察并记录实验现象
二、影响化学反应速率的因素
1.内因:化学反应速率的大小主要取决于 。
2.外因
一般来说,其他条件相同时:
(1)加入催化剂能显著地 反应速率;反应的温度越高,反应速率越 ;反应物的浓度越大,反应速率越 。
(2)对于有气体参加的反应,反应体系的压强越大,反应速率越 。
(3)增大反应物的接触面积,能 反应速率。此外,光照等条件对一些化学反应速率也有一定影响。
【答案】一、1.①加MnO2粉末的试管中气泡生成的速率快
催化剂能增大反应速率 ②水浴加热的试管中气泡生成的速率快 升高温度能增大反应速率 ③盛放12%的H2O2溶液的试管中气泡生成的速率快 增大反应物浓度能增大反应速率
2.粉末状的大理石与盐酸反应比块状的快 增大反应物的接触面积,能增大反应速率
二、1.反应物自身的性质 2.(1)增大 大 大 (2)大 (3)增大
【核心突破】
典例1 用质量为1.0 g的锌粉与10 mL 1.0 mol·L-1稀硫酸反应制备氢气,下列措施能加快制备氢气速率的是( )。
A.将锌粉换成铁片
B.对溶液适当加热
C.将稀硫酸换成98%的浓硫酸
D.增加稀硫酸的用量
【答案】B
【解析】金属锌比金属铁活泼,且金属粉末与酸的接触面积大于金属片与酸的接触面积,因此将锌粉换成铁片,会减慢制备氢气速率,A项错误;加热可提高反应温度,从而加快制备氢气速率,B项正确;浓硫酸属于强氧化性酸,与锌反应生成的是SO2,C项错误;增加稀硫酸的用量并不能增大其浓度,也就不会改变制备氢气速率,D项错误。
【归纳总结】
影响化学反应速率的因素
1.内因:反应物本身的性质,反应物的化学性质越活泼,化学反应速率越快;反之化学反应速率越慢。
2.外因
条件改变 反应速率变化
浓度 增大反应物浓度 加快
减小反应物浓度 减慢
温度 升高温度 加快
降低温度 减慢
压强 对气体物质 参加的反应 增大压强 加快
减小压强 减慢
催化剂 加入合适的催化剂 加快
接触面积 增大反应物间的接触面积 加快
训练1 下列有关描述正确的是( )。
A.Na、Mg、Al的金属性决定了它们与水反应的速率快慢
B.对一定条件下的反应C(s)+O2(g)CO2(g),增加C的量,其反应速率加快
C.用铁和稀硫酸反应制取氢气时,将稀硫酸换成浓硫酸,产生氢气的速率加快
D.改变压强,化学反应速率必然改变
【答案】A
【解析】Na、Mg、Al的金属性依次减弱,与水反应的速率依次减慢,A项正确;C是固体,浓度为常数,增加用量,几乎不影响反应速率,B项错误;常温下铁遇浓硫酸钝化,不产生氢气,C项错误;对于固体、液体参与的反应,改变压强,反应速率几乎不变,D项错误。
任务2 运用控制变量法研究影响化学反应速率的因素
【新知生成】
将 因素问题拆解为多个 因素问题分别开展研究,化繁为简,再进行综合分析,最后得出结论。这种方法称为 。
【答案】多 单 控制变量法
【核心突破】
典例2 某学习小组利用铁与稀硫酸的反应,进行“探究影响化学反应速率因素”的实验。结果如下表。
实验 序号 铁的质 量/g 铁的 形态 V(H2SO4) /mL c(H2SO4) /(mol·L-1) 反应前溶液 的温度/℃ 金属完全消 失的时间/s
1 0.10 片状 50 0.8 20 200
2 0.10 粉状 50 0.8 20 25
3 0.10 片状 50 1.0 20 125
4 0.10 片状 50 1.0 35 50
请分析上表信息,回答下列问题:
(1)实验1、2表明 对反应速率有影响。
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号)。
(3)该探究实验中,影响反应速率的因素还有 ,体现该影响因素的实验有 (填实验序号)。
(4)进行实验3时,若将稀硫酸改为50 mL 2.0 mol·L-1盐酸(其他条件不变),发现放出气泡的速率,盐酸明显比硫酸快。你认为可能的原因是 (忽略温度对反应速率的影响)。
【答案】(1)固体反应物的表面积 (2)1和3 (3)反应前溶液的温度 3和4 (4)Cl-对反应起促进作用(或S对反应起抑制作用)(或其他合理答案)
【归纳总结】
控制变量法:科学研究中,对于多因素(多变量)的问题,常常采用只改变其中的某一个因素,控制其他因素不变的研究方法,使多因素的问题变成几个单因素的问题分别加以研究,最后再将几个单因素问题的研究结果加以综合。
训练2 Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物,羟基自由基的产生与溶液pH有关。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
【实验过程】
图1
图2 实验测得p-CP的浓度随时间的变化
用如图1所示装置进行如下表所示的实验,控制p-CP的初始浓度相同,其余实验条件见下表,设计如下对比实验,最终测量的是p-CP浓度的改变量。
【实验数据】
实验 编号 H2O2溶液 Fe2+溶液 蒸馏水 V/mL pH 温度 T/K
c/(10-3 mol·L-1) V/mL c/(10-3 mol·L-1) V/mL
① 6.0 1.5 0.30 3.5 10 3 298
② 6.0 1.5 0.30 3.5 10 3 313
③ 6.0 3.5 0.30 3.5 x 3 298
④ 6.0 1.5 0.30 4.5 9 3 298
⑤ 6.0 1.5 0.30 3.5 10 10 298
【分析与解释】
(1)实验③中x= 。
(2)实验①⑤的目的是 。
(3)实验①②表明温度升高,降解反应速率增大。但温度过高反而导致降解反应速率减小,从Fenton法所用试剂H2O2性质的角度分析原因: (请用化学用语解答)。
(4)通过实验⑤可以得出的结论是pH等于10时,降解反应趋于停止,推测可能的原因: 。
【答案】(1)8 (2)探究pH对p-CP降解速率的影响 (3)温度高H2O2易分解:2H2O22H2O+O2↑ (4)pH=10时,Fe2+与H2O2反应生成Fe(OH)3,催化作用降低,抑制了羟基自由基的产生,进而无法氧化降解污染物
【解析】(1)实验①为对照组,实验②是探究温度对降解速率的影响,实验③是探究浓度对降解速率的影响,应保持单一变量,溶液总体积应为15 mL,则x=8。
(2)实验①⑤所加试剂的体积、浓度均相同,只有pH不同,故实验①⑤是探究pH对p-CP降解速率的影响。
(3)反应温度在较低范围时,随着温度升高,过氧化氢产生羟基自由基的速率增加,使p-CP降解速率提高;反应温度过高时,过氧化氢分解产生氧气,几乎不产生羟基自由基,导致p-CP降解速率减小。
(4)由图中曲线可以看出,在pH等于10时,p-CP的浓度几乎没有变化,说明pH=10时,该降解反应趋于停止,是因为在碱性较强的时候,Fe2+与H2O2反应生成了Fe(OH)3,催化作用降低,抑制了羟基自由基的产生。
【课堂小结】
【随堂检测】
1.已知FeCl3和MnO2都可作H2O2分解制O2反应的催化剂,为了探究温度对化学反应速率的影响,下列实验方案可行的是( )。
A.
B.
C.
D.
【答案】D
【解析】当探究温度对化学反应速率的影响时,必须保证是在其他条件相同的情况下,再改变温度观察反应速率的变化。
2.以反应5H2C2O4+2Mn+6H+10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KMnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号 H2C2O4溶液 酸性KMnO4溶液 温度/℃
浓度/(mol·L-1) 体积/mL 浓度/(mol·L-1) 体积/mL
① 0.10 2.0 0.010 4.0 25
② 0.20 2.0 0.010 4.0 25
③ 0.20 2.0 0.010 4.0 50
下列说法错误的是( )。
A.实验①②③所加的H2C2O4溶液均要过量
B.实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内平均反应速率v(KMnO4)=2.5×10-4 mol·L-1·s-1
C.实验①和②是探究浓度对化学反应速率的影响,实验②和③是探究温度对化学反应速率的影响
D.实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn2+对反应起催化作用
【答案】B
【解析】要通过测定溶液褪色所需时间来判断反应的快慢,则实验①②③所加的H2C2O4溶液均要过量,A项正确;40 s内的平均反应速率v(KMnO4)==1.67×10-4 mol·L-1·s-1,B项错误;探究温度对化学反应速率的影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验是②和③,探究反应物浓度对化学反应速率的影响,除了浓度不同,其他条件完全相同的实验是①和②,C项正确;由影响反应速率的因素可知,实验①和②起初反应速率很慢后突然增大,可能是Mn2+对反应起催化作用,D项正确。
3.H2O2分解速率受多种因素影响。实验测得70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是( )。
甲 乙
丙 丁
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
【答案】D
【解析】图甲中溶液的pH相同,但H2O2浓度不同,浓度越大,相同时间内浓度的变化量越大,由此得出相同pH时,H2O2浓度越大,其分解速率越快,A项错误;图乙中H2O2浓度相同,但NaOH浓度不同,溶液的pH不同,NaOH浓度越大,相同时间内H2O2浓度变化量越大,故H2O2浓度相同时,pH越大H2O2分解速率越快,B项错误;图丙中少量Mn2+存在时,相同时间内H2O2浓度变化量:0.1 mol·L-1 NaOH溶液>1.0 mol·L-1 NaOH溶液>0 mol·L-1 NaOH溶液,故锰离子作催化剂时受溶液pH的影响,但并不是溶液碱性越强,H2O2分解速率越快,C项错误;图丁中pH相同,锰离子浓度越大,相同时间内H2O2浓度变化量越大,说明碱性溶液中,Mn2+对H2O2分解速率的影响大,D项正确。
4.研究影响化学反应速率的因素对实际生产、生活有重要意义。
(1)在日常的生活、生产中有许多外界条件对化学反应速率产生影响的例子,如冰箱保存食品、酸奶加酵母发酵快、空气中水蒸气含量越高铁越容易生锈等。在下列事实中,各是什么因素影响了化学反应速率
事实 影响因素
① 集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸
② 黄铁矿煅烧时要粉碎成矿粒
③ 熔化的KClO3放出气泡很慢,撒入少量MnO2则很快产生气体
④ 同浓度、同体积的盐酸放入同样大小的锌粒和镁条,产生气体有快有慢
⑤ 同样大小的石灰石分别与0.1 mol·L-1盐酸和1 mol·L-1盐酸反应,速率不同
⑥ 夏天食品容易变质,而冬天不易发生该现象
(2)为了研究MnO2对双氧水分解反应速率的影响,某学生将少许MnO2粉末加入50 mL密度为1.1 g·cm-3的双氧水中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示。请依图回答下列问题:
①实验时放出气体的总体积为 ;
②放出一半气体所需要的时间为 ;
③A、B、C、D四点化学反应速率由快到慢的顺序为 ;
④以上反应速率大小变化的原因是 ;
⑤在5 min后,收集到的气体体积不再增加,原因是 。
【答案】(1)①光 ②反应物的接触面积 ③催化剂 ④反应物本身的性质 ⑤反应物的浓度 ⑥反应温度
(2)①60 mL ②1 min ③D>C>B>A ④随着反应的进行,双氧水的浓度逐渐减小,反应速率也随之减小 ⑤此时双氧水已完全分解
【解析】(1)影响化学反应速率的因素除了浓度、温度、压强、催化剂以外,光、电磁波、超声波、反应物颗粒的大小、溶剂的性质等,也会对化学反应速率产生影响。
(2)从图示可知,生成气体的总体积为60 mL,生成一半气体即30 mL,需要的时间为1 min。图中曲线的斜率表示生成O2的反应速率,A、B、C、D四点的斜率依次减小,所以反应速率由快到慢的顺序为D>C>B>A。速率逐渐减慢的原因是随着反应的进行,双氧水的浓度逐渐减小。在5 min后,H2O2分解完全,所以气体的体积不再增加。
2
