6.3 第1课时 化学能转化为电能 学案(含答案) 2023-2024学年高一化学苏教版(2020)必修第二册
文档属性
| 名称 | 6.3 第1课时 化学能转化为电能 学案(含答案) 2023-2024学年高一化学苏教版(2020)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 325.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-10 10:12:44 | ||
图片预览



文档简介
6.3第1课时 化学能转化为电能
【学习目标】
1.通过实验探究认识化学能与电能之间转化的实质。
2.认识构成原电池的条件及其原理,学会判断原电池的正负极,掌握书写电极反应式和总反应式的方法。
3.了解化学能与其他形式能量的转化,认识化学能转化为电能的实际应用,形成化学有助于提高人类生活质量的观念。
【合作探究】
【学习情境】
现代生活中,化学电源发挥着越来越重要的作用。大到人造卫星、飞机、新能源汽车,小到手机、电子表,都离不开化学电源。尤其是电子产品的日趋丰富,化学电源与人类生活的关系越来越密切。化学电源是根据原电池原理制成的,原电池是一种利用氧化还原反应将化学能直接转化为电能的装置。那么,原电池是由哪些部分组成的 原电池的工作原理是怎样的呢
任务1 原电池装置及其工作原理
【新知生成】
一、探究原电池的工作原理
序号 实验步骤 现象 解释或说明
① 锌片 ,表面 铜片表面
② 锌片 铜片表面
③ 锌片 铜片表面 电流计指针
二、原电池
1.概念:将 能转变为 能的装置。
2.工作原理
电极名称: ,电极反应式: ,
电极反应类型: 。
电极名称: ,电极反应式: ,
电极反应类型: 。
原电池总反应方程式为 ,
原电池反应的本质是 。
电子的转移方向是 → → 。
溶液中离子转移的方向是阴离子→ ,阳离子→ 。
总结:还原剂在 极 电子,发生氧化反应;电子通过 由原电池的 极流向 极;氧化剂在 极 电子,发生还原反应。
【答案】一、①逐渐溶解 有气泡 无气泡 锌与稀硫酸反应产生H2,而铜则不能 ②逐渐溶解 有气泡 锌与稀硫酸反应,但氢气在铜片上产生 ③逐渐溶解 有气泡 发生偏转 锌与稀硫酸反应,但氢气在铜片上产生,导线中有电流产生
二、1.化学 电 2.负极 Zn-2e-Zn2+ 氧化反应
正极 2H++2e-H2↑ 还原反应 Zn+2H+Zn2++H2↑ 氧化还原反应 负极 导线 正极 负极 正极 负 失去 导线 负 正 正 得到
【核心突破】
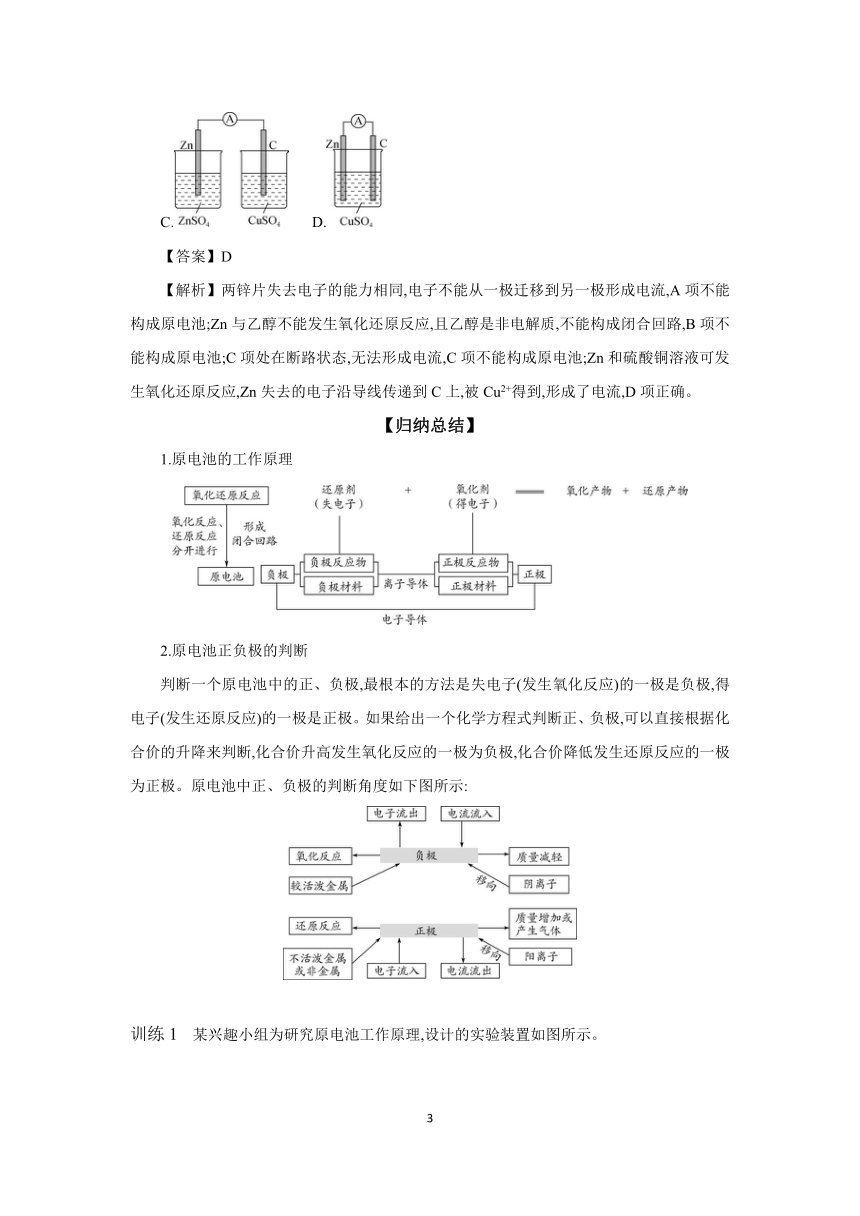
典例1 下列装置可以构成原电池的是( )。
A. B.
C. D.
【答案】D
【解析】两锌片失去电子的能力相同,电子不能从一极迁移到另一极形成电流,A项不能构成原电池;Zn与乙醇不能发生氧化还原反应,且乙醇是非电解质,不能构成闭合回路,B项不能构成原电池;C项处在断路状态,无法形成电流,C项不能构成原电池;Zn和硫酸铜溶液可发生氧化还原反应,Zn失去的电子沿导线传递到C上,被Cu2+得到,形成了电流,D项正确。
【归纳总结】
1.原电池的工作原理
2.原电池正负极的判断
判断一个原电池中的正、负极,最根本的方法是失电子(发生氧化反应)的一极是负极,得电子(发生还原反应)的一极是正极。如果给出一个化学方程式判断正、负极,可以直接根据化合价的升降来判断,化合价升高发生氧化反应的一极为负极,化合价降低发生还原反应的一极为正极。原电池中正、负极的判断角度如下图所示:
训练1 某兴趣小组为研究原电池工作原理,设计的实验装置如图所示。
(1)a和b不连接时,烧杯中发生反应的离子方程式为 。
(2)a和b用导线连接,Cu极为原电池 极(填“正”或“负”),电极反应是 。Zn极发生 (填“氧化”或“还原”)反应。溶液中H+移向 (填“Cu”或“Zn”)极。
(3)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2 mol电子,则理论上Zn片质量减轻 g。
【答案】(1)Zn+2H+Zn2++H2↑ (2)正 2H++2e-H2↑ 氧化 Cu (3)6.5
【解析】a和b不连接时,装置不能构成原电池,Zn直接和稀硫酸反应生成氢气。a和b用导线连接,装置构成原电池,锌是负极,铜是正极,溶液中H+移向正极发生还原反应。若转移了0.2 mol电子,则有0.1 mol Zn被氧化,其质量为6.5 g。
任务2 原电池原理的应用
【新知生成】
一、比较金属活动性
原电池中,作 极的金属活动性一般比作 极的金属活动性强。
二、探究原电池原理对反应速率的影响
向两支试管中加入相同体积相同浓度的稀硫酸,其中一支试管滴加几滴CuSO4溶液,然后分别投入大小相同的锌片,对比产生H2的速率,试分析其原因。
三、钢铁的电化学腐蚀
1.概念:不纯的金属与电解质溶液接触,发生 反应, 的金属失去电子被 ,这种腐蚀叫作电化学腐蚀。
2.电极反应与总反应
①负极(铁)反应: ;
②正极(碳)反应: ;
③总反应: ;
④后续变化:Fe(OH)2→ → (铁锈)
用化学方程式表示为 , 。
【答案】一、负 正
三、1.原电池 比较活泼 氧化 2.①2Fe-4e-2Fe2+ ②O2+2H2O+4e-4OH- ③2Fe+O2+2H2O2Fe(OH)2 ④Fe(OH)3 Fe2O3·xH2O 4Fe(OH)2+O2+2H2O4Fe(OH)3 2Fe(OH)3 Fe2O3·xH2O +(3-x)H2O
【核心突破】
典例2 X、Y、Z、W四种金属片浸在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示。
甲 乙 丙 丁
则四种金属的活动性顺序为( )。
A.Z>Y>X>W B.Z>X>Y>W
C.Z>Y>W>X D.Y>Z>X>W
【答案】A
典例3 下列有关钢铁锈蚀说法正确的是( )。
A.锈蚀过程中构成原电池,电池总反应为2Fe+O2+2H2O2Fe(OH)2,将化学能完全转化为电能
B.在海水中,钢铁的锈蚀速率会比在淡水中快
C.负极的电极反应:Fe-3e-Fe3+
D.最终产生的铁锈的主要成分是Fe(OH)3
【答案】B
【解析】钢铁锈蚀过程是电化学腐蚀,构成了原电池,会将部分化学能转化为电能、热能等,A项错误;海水中所含的离子浓度高于淡水,电阻小,加快铁锈蚀速率,B项正确;Fe作负极,失去两个电子,转化为Fe2+, C项错误;铁锈的主要成分是Fe2O3·xH2O,D项错误。
【归纳总结】
原电池工作原理的应用
1.加快氧化还原反应的反应速率
自发进行的氧化还原反应,形成原电池时反应速率增大。
2.比较金属的活动性强弱
两种金属分别作原电池的两极时,绝大多数情况下,作负极的金属比作正极的金属活动性强。
训练2 银具有白色光泽、较高的化学稳定性,深受人们的青睐,广泛用于饰品、银器、礼品、奖章和纪念币。但银制品久用后表面会生成Ag2S而逐渐变黑。根据电化学原理,某同学设计用如图方法除去银制品表面的黑色Ag2S,使其恢复如初。下列说法正确的是( )。
A.用酒精代替NaCl溶液也同样有效
B.Fe盆一极发生还原反应
C.处理后Ag手镯质量增大
D.电子流向Ag手镯一极
【答案】D
【解析】酒精是非电解质,其水溶液不能导电,不能用酒精代替NaCl溶液, A项错误;Fe盆一极发生氧化反应生成Fe2+,B项错误;Ag手镯发生的反应为Ag2S+2e-2Ag+S2-,S2-进入溶液中使Ag手镯质量减小,C项错误;铁作负极,银作正极,电子由负极铁经过外电路流向银手镯一极,D项正确。
训练3 等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如图,其中正确的是( )。
A B
C D
【答案】D
【解析】a和b中,均有反应Zn+2H+Zn2++H2↑,Zn的质量相等,都是H2SO4过量。但a中还发生Zn+Cu2+Zn2++Cu,消耗了一部分Zn,故生成H2的体积小,生成的Cu和剩余的Zn在稀硫酸中形成了原电池,故生成H2的速率大。
【课堂小结】
【随堂检测】
1.(2021年江苏学测)某兴趣小组模拟纸电池进行实验(如图),有关说法正确的是( )。
A.Zn为正极
B.工作时Cu电极发生氧化反应
C.工作时电子经外电路由Cu流向Zn
D.工作一段时间后Cu电极质量增加
【答案】D
【解析】由于Zn比Cu更活泼,故Zn为负极,A项错误;电池工作时Cu电极作正极,发生还原反应,电极反应为Cu2++2e-Cu,B项错误;电池工作时电子由负极Zn经外电路流向正极Cu,C项错误;电解质溶液为硫酸铜溶液,工作时Cu2+在铜电极得电子生成Cu,电极反应为Cu2++2e-Cu,工作一段时间后Cu电极质量增加,D项正确。
2.研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )。
A.若d为石墨,铁片腐蚀加快
B.若d为石墨,发生的电极反应为2H2O+O2+4e-4OH-
C.若d为锌块,铁片不易被腐蚀
D.若d为锌块,铁片上发生的电极反应为2H++2e-H2↑
【答案】D
【解析】锌的金属活动性大于铁的金属活动性,当d为锌块时,锌块为负极,铁片为正极,电子从锌经过导线流向铁,由于海水中氢离子浓度很小,得电子的是溶解在海水中的氧气,故此时铁片上电极反应为2H2O+O2+4e-4OH-。
3.某化学兴趣小组设计了如图所示的发光二极管连接的柠檬电池。下列说法不正确的是( )。
A.该装置的能量转化形式主要为化学能→电能
B.电子的流向:Zn→导线→Cu→柠檬液→Zn
C.锌片是该电池的负极,质量不断减小
D.铜片上的电极反应为2H++2e-H2↑
【答案】B
【解析】原电池的能量转化形式主要为化学能→电能,A项正确;电子的流向:Zn→导线→Cu,电子不能进入柠檬液中,B项错误;负极上Zn失去电子,则锌片是负极,质量不断减小,C项正确;Cu为正极,正极上H+得到电子,正极反应为2H++2e-H2↑,D项正确。
4.现有A、B、C、D四种金属片,进行以下实验:①把A、B用导线连接后同时放入稀硫酸溶液中,A上有气泡产生;②把C、D用导线连接后同时放入稀硫酸溶液中,D上发生还原反应;③把A、C用导线连接后同时放入稀硫酸溶液中,电子流动方向为A→导线→C。根据上述情况,回答下列问题:
(1)在实验①中,金属片 发生氧化反应。
(2)在实验②中,金属片 作负极。
(3)如果把B、D用导线连接后同时放入稀硫酸溶液中,则金属片 上有气泡产生。
(4)上述四种金属的活动性顺序是 。
(5)将A、B直接放入稀硫酸中,不用导线连接,化学能主要转化为 。
【答案】(1)B (2)C (3)D (4)B>A>C>D (5)热能
【解析】根据原电池原理可知,H+在正极上被还原生成H2,故①中金属活动性:B>A,②中金属活动性:C>D。又因为电子从负极经导线流到正极,故③中金属活动性:A>C。综上所述,可知四种金属活动性顺序为B>A>C>D。
2
【学习目标】
1.通过实验探究认识化学能与电能之间转化的实质。
2.认识构成原电池的条件及其原理,学会判断原电池的正负极,掌握书写电极反应式和总反应式的方法。
3.了解化学能与其他形式能量的转化,认识化学能转化为电能的实际应用,形成化学有助于提高人类生活质量的观念。
【合作探究】
【学习情境】
现代生活中,化学电源发挥着越来越重要的作用。大到人造卫星、飞机、新能源汽车,小到手机、电子表,都离不开化学电源。尤其是电子产品的日趋丰富,化学电源与人类生活的关系越来越密切。化学电源是根据原电池原理制成的,原电池是一种利用氧化还原反应将化学能直接转化为电能的装置。那么,原电池是由哪些部分组成的 原电池的工作原理是怎样的呢
任务1 原电池装置及其工作原理
【新知生成】
一、探究原电池的工作原理
序号 实验步骤 现象 解释或说明
① 锌片 ,表面 铜片表面
② 锌片 铜片表面
③ 锌片 铜片表面 电流计指针
二、原电池
1.概念:将 能转变为 能的装置。
2.工作原理
电极名称: ,电极反应式: ,
电极反应类型: 。
电极名称: ,电极反应式: ,
电极反应类型: 。
原电池总反应方程式为 ,
原电池反应的本质是 。
电子的转移方向是 → → 。
溶液中离子转移的方向是阴离子→ ,阳离子→ 。
总结:还原剂在 极 电子,发生氧化反应;电子通过 由原电池的 极流向 极;氧化剂在 极 电子,发生还原反应。
【答案】一、①逐渐溶解 有气泡 无气泡 锌与稀硫酸反应产生H2,而铜则不能 ②逐渐溶解 有气泡 锌与稀硫酸反应,但氢气在铜片上产生 ③逐渐溶解 有气泡 发生偏转 锌与稀硫酸反应,但氢气在铜片上产生,导线中有电流产生
二、1.化学 电 2.负极 Zn-2e-Zn2+ 氧化反应
正极 2H++2e-H2↑ 还原反应 Zn+2H+Zn2++H2↑ 氧化还原反应 负极 导线 正极 负极 正极 负 失去 导线 负 正 正 得到
【核心突破】
典例1 下列装置可以构成原电池的是( )。
A. B.
C. D.
【答案】D
【解析】两锌片失去电子的能力相同,电子不能从一极迁移到另一极形成电流,A项不能构成原电池;Zn与乙醇不能发生氧化还原反应,且乙醇是非电解质,不能构成闭合回路,B项不能构成原电池;C项处在断路状态,无法形成电流,C项不能构成原电池;Zn和硫酸铜溶液可发生氧化还原反应,Zn失去的电子沿导线传递到C上,被Cu2+得到,形成了电流,D项正确。
【归纳总结】
1.原电池的工作原理
2.原电池正负极的判断
判断一个原电池中的正、负极,最根本的方法是失电子(发生氧化反应)的一极是负极,得电子(发生还原反应)的一极是正极。如果给出一个化学方程式判断正、负极,可以直接根据化合价的升降来判断,化合价升高发生氧化反应的一极为负极,化合价降低发生还原反应的一极为正极。原电池中正、负极的判断角度如下图所示:
训练1 某兴趣小组为研究原电池工作原理,设计的实验装置如图所示。
(1)a和b不连接时,烧杯中发生反应的离子方程式为 。
(2)a和b用导线连接,Cu极为原电池 极(填“正”或“负”),电极反应是 。Zn极发生 (填“氧化”或“还原”)反应。溶液中H+移向 (填“Cu”或“Zn”)极。
(3)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2 mol电子,则理论上Zn片质量减轻 g。
【答案】(1)Zn+2H+Zn2++H2↑ (2)正 2H++2e-H2↑ 氧化 Cu (3)6.5
【解析】a和b不连接时,装置不能构成原电池,Zn直接和稀硫酸反应生成氢气。a和b用导线连接,装置构成原电池,锌是负极,铜是正极,溶液中H+移向正极发生还原反应。若转移了0.2 mol电子,则有0.1 mol Zn被氧化,其质量为6.5 g。
任务2 原电池原理的应用
【新知生成】
一、比较金属活动性
原电池中,作 极的金属活动性一般比作 极的金属活动性强。
二、探究原电池原理对反应速率的影响
向两支试管中加入相同体积相同浓度的稀硫酸,其中一支试管滴加几滴CuSO4溶液,然后分别投入大小相同的锌片,对比产生H2的速率,试分析其原因。
三、钢铁的电化学腐蚀
1.概念:不纯的金属与电解质溶液接触,发生 反应, 的金属失去电子被 ,这种腐蚀叫作电化学腐蚀。
2.电极反应与总反应
①负极(铁)反应: ;
②正极(碳)反应: ;
③总反应: ;
④后续变化:Fe(OH)2→ → (铁锈)
用化学方程式表示为 , 。
【答案】一、负 正
三、1.原电池 比较活泼 氧化 2.①2Fe-4e-2Fe2+ ②O2+2H2O+4e-4OH- ③2Fe+O2+2H2O2Fe(OH)2 ④Fe(OH)3 Fe2O3·xH2O 4Fe(OH)2+O2+2H2O4Fe(OH)3 2Fe(OH)3 Fe2O3·xH2O +(3-x)H2O
【核心突破】
典例2 X、Y、Z、W四种金属片浸在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示。
甲 乙 丙 丁
则四种金属的活动性顺序为( )。
A.Z>Y>X>W B.Z>X>Y>W
C.Z>Y>W>X D.Y>Z>X>W
【答案】A
典例3 下列有关钢铁锈蚀说法正确的是( )。
A.锈蚀过程中构成原电池,电池总反应为2Fe+O2+2H2O2Fe(OH)2,将化学能完全转化为电能
B.在海水中,钢铁的锈蚀速率会比在淡水中快
C.负极的电极反应:Fe-3e-Fe3+
D.最终产生的铁锈的主要成分是Fe(OH)3
【答案】B
【解析】钢铁锈蚀过程是电化学腐蚀,构成了原电池,会将部分化学能转化为电能、热能等,A项错误;海水中所含的离子浓度高于淡水,电阻小,加快铁锈蚀速率,B项正确;Fe作负极,失去两个电子,转化为Fe2+, C项错误;铁锈的主要成分是Fe2O3·xH2O,D项错误。
【归纳总结】
原电池工作原理的应用
1.加快氧化还原反应的反应速率
自发进行的氧化还原反应,形成原电池时反应速率增大。
2.比较金属的活动性强弱
两种金属分别作原电池的两极时,绝大多数情况下,作负极的金属比作正极的金属活动性强。
训练2 银具有白色光泽、较高的化学稳定性,深受人们的青睐,广泛用于饰品、银器、礼品、奖章和纪念币。但银制品久用后表面会生成Ag2S而逐渐变黑。根据电化学原理,某同学设计用如图方法除去银制品表面的黑色Ag2S,使其恢复如初。下列说法正确的是( )。
A.用酒精代替NaCl溶液也同样有效
B.Fe盆一极发生还原反应
C.处理后Ag手镯质量增大
D.电子流向Ag手镯一极
【答案】D
【解析】酒精是非电解质,其水溶液不能导电,不能用酒精代替NaCl溶液, A项错误;Fe盆一极发生氧化反应生成Fe2+,B项错误;Ag手镯发生的反应为Ag2S+2e-2Ag+S2-,S2-进入溶液中使Ag手镯质量减小,C项错误;铁作负极,银作正极,电子由负极铁经过外电路流向银手镯一极,D项正确。
训练3 等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如图,其中正确的是( )。
A B
C D
【答案】D
【解析】a和b中,均有反应Zn+2H+Zn2++H2↑,Zn的质量相等,都是H2SO4过量。但a中还发生Zn+Cu2+Zn2++Cu,消耗了一部分Zn,故生成H2的体积小,生成的Cu和剩余的Zn在稀硫酸中形成了原电池,故生成H2的速率大。
【课堂小结】
【随堂检测】
1.(2021年江苏学测)某兴趣小组模拟纸电池进行实验(如图),有关说法正确的是( )。
A.Zn为正极
B.工作时Cu电极发生氧化反应
C.工作时电子经外电路由Cu流向Zn
D.工作一段时间后Cu电极质量增加
【答案】D
【解析】由于Zn比Cu更活泼,故Zn为负极,A项错误;电池工作时Cu电极作正极,发生还原反应,电极反应为Cu2++2e-Cu,B项错误;电池工作时电子由负极Zn经外电路流向正极Cu,C项错误;电解质溶液为硫酸铜溶液,工作时Cu2+在铜电极得电子生成Cu,电极反应为Cu2++2e-Cu,工作一段时间后Cu电极质量增加,D项正确。
2.研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是( )。
A.若d为石墨,铁片腐蚀加快
B.若d为石墨,发生的电极反应为2H2O+O2+4e-4OH-
C.若d为锌块,铁片不易被腐蚀
D.若d为锌块,铁片上发生的电极反应为2H++2e-H2↑
【答案】D
【解析】锌的金属活动性大于铁的金属活动性,当d为锌块时,锌块为负极,铁片为正极,电子从锌经过导线流向铁,由于海水中氢离子浓度很小,得电子的是溶解在海水中的氧气,故此时铁片上电极反应为2H2O+O2+4e-4OH-。
3.某化学兴趣小组设计了如图所示的发光二极管连接的柠檬电池。下列说法不正确的是( )。
A.该装置的能量转化形式主要为化学能→电能
B.电子的流向:Zn→导线→Cu→柠檬液→Zn
C.锌片是该电池的负极,质量不断减小
D.铜片上的电极反应为2H++2e-H2↑
【答案】B
【解析】原电池的能量转化形式主要为化学能→电能,A项正确;电子的流向:Zn→导线→Cu,电子不能进入柠檬液中,B项错误;负极上Zn失去电子,则锌片是负极,质量不断减小,C项正确;Cu为正极,正极上H+得到电子,正极反应为2H++2e-H2↑,D项正确。
4.现有A、B、C、D四种金属片,进行以下实验:①把A、B用导线连接后同时放入稀硫酸溶液中,A上有气泡产生;②把C、D用导线连接后同时放入稀硫酸溶液中,D上发生还原反应;③把A、C用导线连接后同时放入稀硫酸溶液中,电子流动方向为A→导线→C。根据上述情况,回答下列问题:
(1)在实验①中,金属片 发生氧化反应。
(2)在实验②中,金属片 作负极。
(3)如果把B、D用导线连接后同时放入稀硫酸溶液中,则金属片 上有气泡产生。
(4)上述四种金属的活动性顺序是 。
(5)将A、B直接放入稀硫酸中,不用导线连接,化学能主要转化为 。
【答案】(1)B (2)C (3)D (4)B>A>C>D (5)热能
【解析】根据原电池原理可知,H+在正极上被还原生成H2,故①中金属活动性:B>A,②中金属活动性:C>D。又因为电子从负极经导线流到正极,故③中金属活动性:A>C。综上所述,可知四种金属活动性顺序为B>A>C>D。
2
