7.2 第1课时 氨气 学案(含答案) 2023-2024学年高一化学苏教版(2020)必修第二册
文档属性
| 名称 | 7.2 第1课时 氨气 学案(含答案) 2023-2024学年高一化学苏教版(2020)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 228.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-18 00:00:00 | ||
图片预览

文档简介
7.2第1课时 氨气
【学习目标】
1.了解NH3的物理性质。
2.掌握NH3的化学性质。
【合作探究】
【学习情境】
2019年4月25日,美国伊利诺伊州莱克郡的海滩公园镇发生液氨泄漏事故,这起事故是由槽罐车发生氨气泄漏导致。泄漏使得海滩公园镇北部被有毒气体笼罩,空气中弥漫着刺鼻的气味,37人因受到毒气影响,被送往医院治疗,其中7人情况危急。同学们,你知道氨气具有哪些性质
任务1 氨气的物理性质与喷泉实验
【新知生成】
一、物理性质
1.氨气在通常状况下是 色、具有 气味的 体。
2.氨气容易被 ,形成的液氨在工业上常用来作 剂。
二、喷泉实验
实验装置 操作及现象 结论
(1)打开止水夹,并挤压胶头滴管的胶头 (2)烧杯中的溶液由玻璃管进入烧瓶,形成 , 瓶内液体呈 1.氨气 溶于水(常温常压下,1体积水大约可溶解 体积氨气) 2.氨水(氨气溶于水形成的水溶液)呈 性: NH3+H2O NH3·H2O
【答案】一、 1.无 刺激性 气 2.液化 制冷 二、 喷泉
红色 1.极易 700 2.碱 N+OH-
【核心突破】
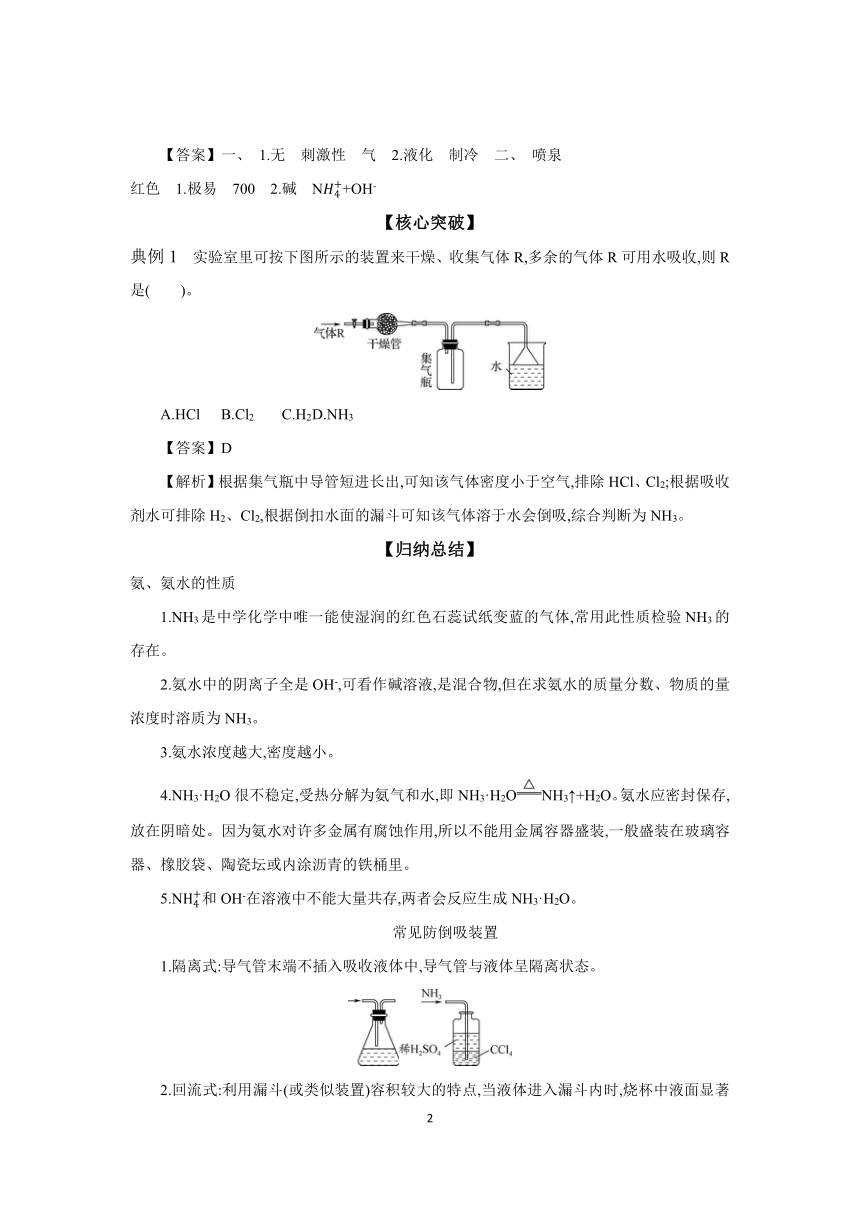
典例1 实验室里可按下图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是( )。
A.HCl B.Cl2 C.H2 D.NH3
【答案】D
【解析】根据集气瓶中导管短进长出,可知该气体密度小于空气,排除HCl、Cl2;根据吸收剂水可排除H2、Cl2,根据倒扣水面的漏斗可知该气体溶于水会倒吸,综合判断为NH3。
【归纳总结】
氨、氨水的性质
1.NH3是中学化学中唯一能使湿润的红色石蕊试纸变蓝的气体,常用此性质检验NH3的存在。
2.氨水中的阴离子全是OH-,可看作碱溶液,是混合物,但在求氨水的质量分数、物质的量浓度时溶质为NH3。
3.氨水浓度越大,密度越小。
4.NH3·H2O很不稳定,受热分解为氨气和水,即NH3·H2ONH3↑+H2O。氨水应密封保存,放在阴暗处。因为氨水对许多金属有腐蚀作用,所以不能用金属容器盛装,一般盛装在玻璃容器、橡胶袋、陶瓷坛或内涂沥青的铁桶里。
5.N和OH-在溶液中不能大量共存,两者会反应生成NH3·H2O。
常见防倒吸装置
1.隔离式:导气管末端不插入吸收液体中,导气管与液体呈隔离状态。
2.回流式:利用漏斗(或类似装置)容积较大的特点,当液体进入漏斗内时,烧杯中液面显著下降而低于漏斗口,液体又流落到烧杯中。
3.蓄液式:使用较大容积的容器将可能倒吸来的液体接收,防止进入前端装置(气体发生装置等)。
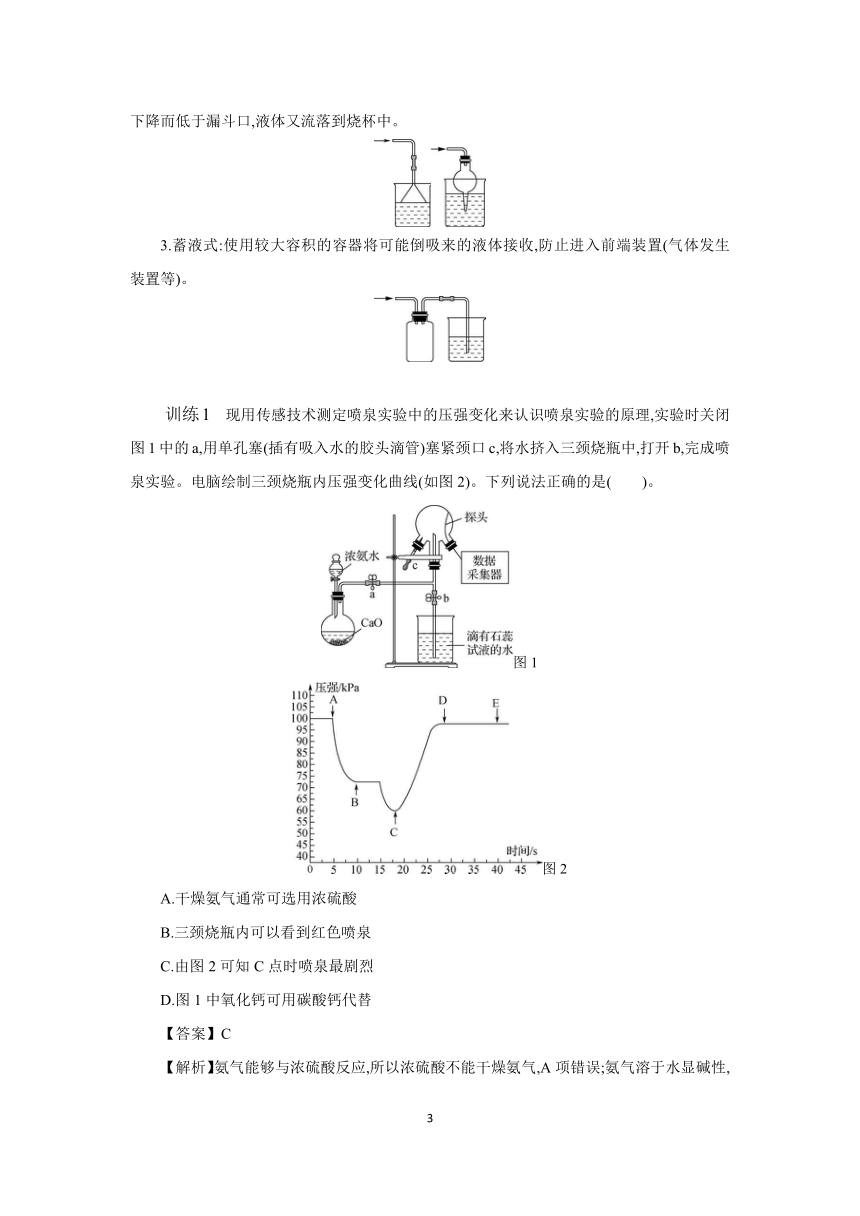
训练1 现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理,实验时关闭图1中的a,用单孔塞(插有吸入水的胶头滴管)塞紧颈口c,将水挤入三颈烧瓶中,打开b,完成喷泉实验。电脑绘制三颈烧瓶内压强变化曲线(如图2)。下列说法正确的是( )。
图1
图2
A.干燥氨气通常可选用浓硫酸
B.三颈烧瓶内可以看到红色喷泉
C.由图2可知C点时喷泉最剧烈
D.图1中氧化钙可用碳酸钙代替
【答案】C
【解析】氨气能够与浓硫酸反应,所以浓硫酸不能干燥氨气,A项错误;氨气溶于水显碱性,遇到石蕊溶液显蓝色,所以三颈烧瓶内可以看到蓝色喷泉,B项错误;C点时压强最小,此时内外压强差最大,C点时喷泉最剧烈,C项正确;氧化钙与水反应提高氨水的浓度,同时该反应放热促进氨气的挥发,而碳酸钙既不和水反应也不能促进氨气的挥发,D项错误。
任务2 氨气的化学性质
【新知生成】
一、碱性
NH4Cl, (NH4)2SO4
二、还原性
(氨的催化氧化)
【答案】NH3+HCl 2NH3+H2SO4 4NH3+5O24NO+6H2O
【核心突破】
典例2 氨气的部分用途如图所示,下列有关叙述错误的是( )。
NH3—
A.NH4NO3是常用化肥
B.在硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5
C.NH3和NO2在一定条件下发生氧化还原反应,其化学方程式为8NH3+6NO27N2+12H2O
D.NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化
【答案】D
【解析】NH4NO3含有农作物生长需要的营养元素氮元素,是常用的氮肥,A项正确;硝酸工业中:NH3→NO→NO2→HNO3,含氮化合物中氮元素化合价分别是:-3→+2→+4→+5,B项正确;氨气与二氧化氮发生归中反应生成氮气和水,其化学方程式为8NH3+6NO27N2+12H2O,C项正确;氨气与硝酸反应生成硝酸铵,没有化合价变化,属于非氧化还原反应,D项错误。
【归纳总结】
氨气的化学性质及重要应用
1.碱性
(1)侯氏制碱:NaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl
(2)制铵盐:NH3+HNO3NH4NO3
2.还原性
(1)工业制硝酸:4NH3+5O24NO+6H2O,2NO+O22NO2,3NO2+H2O2HNO3+NO
(2)去除氮氧化物:4xNH3+6NOx6xH2O+(2x+3)N2
(3)实验室制氮气:2NH3+3CuON2+3Cu+3H2O
训练2 用Pt-Rh合金催化氧化NH3制NO,其反应的微观模型如图①,含氮生成物产率随温度的变化曲线如图②,下列说法正确的是( )。
图①
图②
A.800 ℃以上时,可能发生反应:2NO(g)O2(g)+N2(g)
B.400 ℃时,生成的产物只有N2、NO
C.可用湿润的蓝色石蕊试纸检验NH3是否反应完全
D.Pt-Rh合金催化氧化NH3制NO,适宜的温度为400 ℃
【答案】A
【解析】800 ℃以上,N2的产率上升、NO的产率下降,说明发生了反应:2NO(g)O2(g)+N2(g),A项正确;根据图②知,400 ℃时,生成的含有N元素的产物有N2、NO,且N2产率大于NO,同时产物中还有水,B项错误;用湿润的红色石蕊试纸检验氨气,试纸变蓝,C项错误;800 ℃时,生成的含有N元素的产物主要是NO,接近100%,D项错误。
【课堂小结】
【随堂检测】
1.下列关于氨气性质的叙述中,错误的是( )。
A.无色、有刺激性气味气体
B.极易溶于水
C.相同条件下,密度比空气的大
D.能与水反应生成碱性物质
【答案】C
2.氨水显弱碱性的主要原因是( )。
A.通常状况下,氨的溶解度不大
B.氨水中的一水合氨少量电离
C.溶于水的氨分子只有少量发生电离
D.氨本身的碱性弱
【答案】B
3.下图是NH3的两个性质实验,下列有关说法中正确的是( )。
Ⅰ Ⅱ
A.两个实验均表现了NH3易溶于水
B.两个实验均表现了NH3易挥发
C.两个实验均表现了NH3是碱性气体
D.两个实验均表现了NH3是还原性气体
【答案】C
【解析】实验Ⅰ体现了NH3易溶于水,且水溶液呈碱性,实验Ⅱ体现了NH3易挥发,挥发出的氨分子和浓盐酸挥发出的氯化氢分子结合生成白色氯化铵固体小颗粒,也能证明氨是碱性气体,所以两个实验均体现了NH3是碱性气体,A、B两项错误,C项正确;两个实验中都未发生氧化还原反应,所以无氧化性和还原性的体现,D项错误。
4.管道工人可用浓氨水检查氯气管道是否漏气,发生反应8NH3+3Cl26NH4Cl+N2。下列叙述正确的是( )。
A.NH3的电子式为H
B.每转移3 mol电子时,有4 mol NH3被氧化
C.该检验过程有共价键、离子键的断裂与生成
D.用该方法检验管道泄漏处会产生白烟
【答案】D
【解析】NH3的电子式为H,A项错误;转移3 mol电子时,被氧化的NH3为1 mol,B项错误;该检验过程有共价键的断裂与生成,有离子键的形成,没有离子键的断裂,C项错误;用该方法检验管道泄漏处会产生氯化铵白烟,D项正确。
2
【学习目标】
1.了解NH3的物理性质。
2.掌握NH3的化学性质。
【合作探究】
【学习情境】
2019年4月25日,美国伊利诺伊州莱克郡的海滩公园镇发生液氨泄漏事故,这起事故是由槽罐车发生氨气泄漏导致。泄漏使得海滩公园镇北部被有毒气体笼罩,空气中弥漫着刺鼻的气味,37人因受到毒气影响,被送往医院治疗,其中7人情况危急。同学们,你知道氨气具有哪些性质
任务1 氨气的物理性质与喷泉实验
【新知生成】
一、物理性质
1.氨气在通常状况下是 色、具有 气味的 体。
2.氨气容易被 ,形成的液氨在工业上常用来作 剂。
二、喷泉实验
实验装置 操作及现象 结论
(1)打开止水夹,并挤压胶头滴管的胶头 (2)烧杯中的溶液由玻璃管进入烧瓶,形成 , 瓶内液体呈 1.氨气 溶于水(常温常压下,1体积水大约可溶解 体积氨气) 2.氨水(氨气溶于水形成的水溶液)呈 性: NH3+H2O NH3·H2O
【答案】一、 1.无 刺激性 气 2.液化 制冷 二、 喷泉
红色 1.极易 700 2.碱 N+OH-
【核心突破】
典例1 实验室里可按下图所示的装置来干燥、收集气体R,多余的气体R可用水吸收,则R是( )。
A.HCl B.Cl2 C.H2 D.NH3
【答案】D
【解析】根据集气瓶中导管短进长出,可知该气体密度小于空气,排除HCl、Cl2;根据吸收剂水可排除H2、Cl2,根据倒扣水面的漏斗可知该气体溶于水会倒吸,综合判断为NH3。
【归纳总结】
氨、氨水的性质
1.NH3是中学化学中唯一能使湿润的红色石蕊试纸变蓝的气体,常用此性质检验NH3的存在。
2.氨水中的阴离子全是OH-,可看作碱溶液,是混合物,但在求氨水的质量分数、物质的量浓度时溶质为NH3。
3.氨水浓度越大,密度越小。
4.NH3·H2O很不稳定,受热分解为氨气和水,即NH3·H2ONH3↑+H2O。氨水应密封保存,放在阴暗处。因为氨水对许多金属有腐蚀作用,所以不能用金属容器盛装,一般盛装在玻璃容器、橡胶袋、陶瓷坛或内涂沥青的铁桶里。
5.N和OH-在溶液中不能大量共存,两者会反应生成NH3·H2O。
常见防倒吸装置
1.隔离式:导气管末端不插入吸收液体中,导气管与液体呈隔离状态。
2.回流式:利用漏斗(或类似装置)容积较大的特点,当液体进入漏斗内时,烧杯中液面显著下降而低于漏斗口,液体又流落到烧杯中。
3.蓄液式:使用较大容积的容器将可能倒吸来的液体接收,防止进入前端装置(气体发生装置等)。
训练1 现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理,实验时关闭图1中的a,用单孔塞(插有吸入水的胶头滴管)塞紧颈口c,将水挤入三颈烧瓶中,打开b,完成喷泉实验。电脑绘制三颈烧瓶内压强变化曲线(如图2)。下列说法正确的是( )。
图1
图2
A.干燥氨气通常可选用浓硫酸
B.三颈烧瓶内可以看到红色喷泉
C.由图2可知C点时喷泉最剧烈
D.图1中氧化钙可用碳酸钙代替
【答案】C
【解析】氨气能够与浓硫酸反应,所以浓硫酸不能干燥氨气,A项错误;氨气溶于水显碱性,遇到石蕊溶液显蓝色,所以三颈烧瓶内可以看到蓝色喷泉,B项错误;C点时压强最小,此时内外压强差最大,C点时喷泉最剧烈,C项正确;氧化钙与水反应提高氨水的浓度,同时该反应放热促进氨气的挥发,而碳酸钙既不和水反应也不能促进氨气的挥发,D项错误。
任务2 氨气的化学性质
【新知生成】
一、碱性
NH4Cl, (NH4)2SO4
二、还原性
(氨的催化氧化)
【答案】NH3+HCl 2NH3+H2SO4 4NH3+5O24NO+6H2O
【核心突破】
典例2 氨气的部分用途如图所示,下列有关叙述错误的是( )。
NH3—
A.NH4NO3是常用化肥
B.在硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5
C.NH3和NO2在一定条件下发生氧化还原反应,其化学方程式为8NH3+6NO27N2+12H2O
D.NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化
【答案】D
【解析】NH4NO3含有农作物生长需要的营养元素氮元素,是常用的氮肥,A项正确;硝酸工业中:NH3→NO→NO2→HNO3,含氮化合物中氮元素化合价分别是:-3→+2→+4→+5,B项正确;氨气与二氧化氮发生归中反应生成氮气和水,其化学方程式为8NH3+6NO27N2+12H2O,C项正确;氨气与硝酸反应生成硝酸铵,没有化合价变化,属于非氧化还原反应,D项错误。
【归纳总结】
氨气的化学性质及重要应用
1.碱性
(1)侯氏制碱:NaCl+NH3+CO2+H2ONaHCO3↓+NH4Cl
(2)制铵盐:NH3+HNO3NH4NO3
2.还原性
(1)工业制硝酸:4NH3+5O24NO+6H2O,2NO+O22NO2,3NO2+H2O2HNO3+NO
(2)去除氮氧化物:4xNH3+6NOx6xH2O+(2x+3)N2
(3)实验室制氮气:2NH3+3CuON2+3Cu+3H2O
训练2 用Pt-Rh合金催化氧化NH3制NO,其反应的微观模型如图①,含氮生成物产率随温度的变化曲线如图②,下列说法正确的是( )。
图①
图②
A.800 ℃以上时,可能发生反应:2NO(g)O2(g)+N2(g)
B.400 ℃时,生成的产物只有N2、NO
C.可用湿润的蓝色石蕊试纸检验NH3是否反应完全
D.Pt-Rh合金催化氧化NH3制NO,适宜的温度为400 ℃
【答案】A
【解析】800 ℃以上,N2的产率上升、NO的产率下降,说明发生了反应:2NO(g)O2(g)+N2(g),A项正确;根据图②知,400 ℃时,生成的含有N元素的产物有N2、NO,且N2产率大于NO,同时产物中还有水,B项错误;用湿润的红色石蕊试纸检验氨气,试纸变蓝,C项错误;800 ℃时,生成的含有N元素的产物主要是NO,接近100%,D项错误。
【课堂小结】
【随堂检测】
1.下列关于氨气性质的叙述中,错误的是( )。
A.无色、有刺激性气味气体
B.极易溶于水
C.相同条件下,密度比空气的大
D.能与水反应生成碱性物质
【答案】C
2.氨水显弱碱性的主要原因是( )。
A.通常状况下,氨的溶解度不大
B.氨水中的一水合氨少量电离
C.溶于水的氨分子只有少量发生电离
D.氨本身的碱性弱
【答案】B
3.下图是NH3的两个性质实验,下列有关说法中正确的是( )。
Ⅰ Ⅱ
A.两个实验均表现了NH3易溶于水
B.两个实验均表现了NH3易挥发
C.两个实验均表现了NH3是碱性气体
D.两个实验均表现了NH3是还原性气体
【答案】C
【解析】实验Ⅰ体现了NH3易溶于水,且水溶液呈碱性,实验Ⅱ体现了NH3易挥发,挥发出的氨分子和浓盐酸挥发出的氯化氢分子结合生成白色氯化铵固体小颗粒,也能证明氨是碱性气体,所以两个实验均体现了NH3是碱性气体,A、B两项错误,C项正确;两个实验中都未发生氧化还原反应,所以无氧化性和还原性的体现,D项错误。
4.管道工人可用浓氨水检查氯气管道是否漏气,发生反应8NH3+3Cl26NH4Cl+N2。下列叙述正确的是( )。
A.NH3的电子式为H
B.每转移3 mol电子时,有4 mol NH3被氧化
C.该检验过程有共价键、离子键的断裂与生成
D.用该方法检验管道泄漏处会产生白烟
【答案】D
【解析】NH3的电子式为H,A项错误;转移3 mol电子时,被氧化的NH3为1 mol,B项错误;该检验过程有共价键的断裂与生成,有离子键的形成,没有离子键的断裂,C项错误;用该方法检验管道泄漏处会产生氯化铵白烟,D项正确。
2
