7.2 第2课时 硝酸 学案(含答案) 2023-2024学年高一化学苏教版(2020)必修第二册
文档属性
| 名称 | 7.2 第2课时 硝酸 学案(含答案) 2023-2024学年高一化学苏教版(2020)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 130.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-18 00:00:00 | ||
图片预览



文档简介
7.2第2课时 硝酸
【学习目标】
1.了解硝酸的物理性质及重要用途。
2.掌握硝酸的化学性质:不稳定性、酸性和强氧化性。
3.了解硝酸的工业制法。
4.通过观察浓、稀硝酸与铜的反应实验,培养观察、分析和比较的能力。
【合作探究】
【学习情境】
硝酸不仅是工农业生产的重要化工原料,还是制造炸药的重要战争物资。最初制造硝酸的方法是普通硝石法,利用硝石与硫酸来制取硝酸。因为硝石的贮量有限,所以硝酸的产量受到限制。早在1913年之前,人们就发现德国有发动世界大战的意图,便开始限制德国进口硝石,觉得这样世界就会太平无事了。可是在1914年德国最终发动了第一次世界大战,人们又错误地预计,战争顶多只会打半年,原因是德国的硝酸不多,火药生产受到限制,正是由于各种错误的估计,使得第一次世界大战打了四年多。这场战争德国为什么能坚持这么久呢 原来早在1908年,德国化学家哈伯首先在实验室里用氢气和氮气合成了氨,设计了合成氨的工艺流程并将此方法交给德国一个最大的化工企业进行生产。1913年,一个日产30 t的合成氨工厂建成并投入生产,再利用氨生产硝酸制造炸药。这就揭开了第一次世界大战中的一个谜。
任务1 硝酸的不稳定性
【新知生成】
1.硝酸受热或见光发生分解: 。
2.硝酸应密封贮存在 、 处。
【答案】4HNO34NO2↑+O2↑+2H2O 低温 避光
【核心突破】
典例1 下列关于硝酸的说法错误的是( )。
A.浓硝酸是一种易挥发的液体混合物
B.浓硝酸在空气中敞口放置,因吸收水蒸气而浓度减小
C.浓硝酸不稳定,易分解生成二氧化氮、氧气和水
D.常温下,浓硝酸常保存在棕色细口试剂瓶中
【答案】B
【归纳总结】
试剂存放要点
1.防挥发:需要密封保存,液溴还需要使用“水封”减少挥发。
2.防潮解:需要密封保存,同时保持环境的干燥,如漂白粉、生石灰等。
3.防变质:a.防氧化,如Na、P4等;b.防分解,如氯水、AgCl、HNO3等。
试剂瓶的选择原则
1.固体广口瓶,液体细口瓶。
2.碱性软木塞,其他玻璃塞。
3.怕光棕色瓶,其他无色瓶。
训练1 实验室常利用难挥发性酸制备易挥发性酸的原理,用浓硫酸与硝石(NaNO3)反应制备HNO3,反应装置如图所示(夹持装置未画出),下列说法不正确的是( )。
A.如果反应温度过高,制得的HNO3可能会呈现黄色
B.反应的化学方程式为NaNO3+H2SO4(浓)NaHSO4+HNO3↑
C.可从实验室中选无色透明洁净的试剂瓶盛装制得的硝酸
D.曲颈瓶不适宜制备沸点过低的物质
【答案】C
【解析】浓硝酸受热易分解,产生的二氧化氮溶解在硝酸中会呈现黄色,A项正确;硫酸是高沸点酸,硝酸是低沸点的酸,NaNO3和浓硫酸反应可以生成硝酸和硫酸氢钠,反应的化学方程式为NaNO3+H2SO4(浓)NaHSO4+HNO3↑,B项正确;硝酸见光易分解,所以应避光保存,应存放在棕色试剂瓶中,C项错误;该装置是一种原始蒸馏器,它利用空气冷却,因此不适宜制备沸点过低的物质,D项正确。
任务2 硝酸的强氧化性
【新知生成】
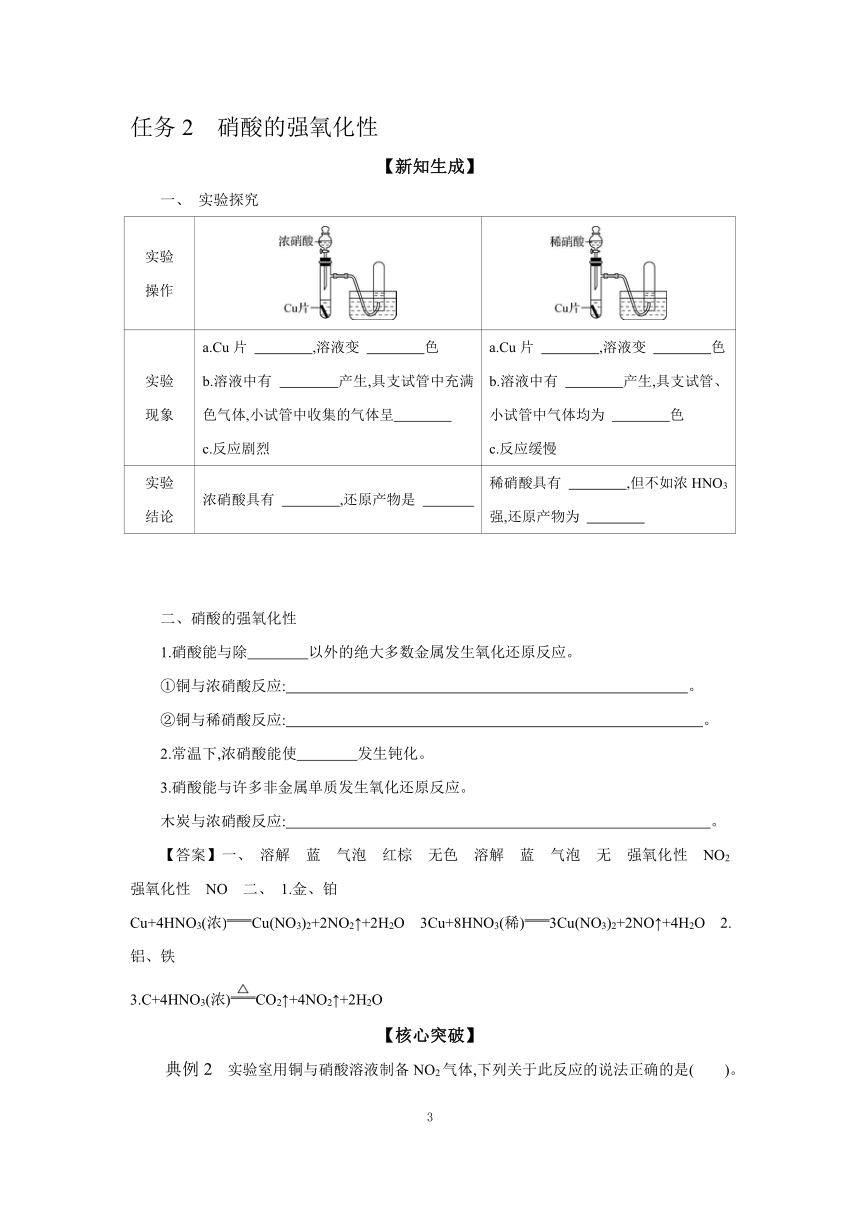
一、 实验探究
实验 操作
实验 现象 a.Cu片 ,溶液变 色 b.溶液中有 产生,具支试管中充满 色气体,小试管中收集的气体呈 c.反应剧烈 a.Cu片 ,溶液变 色 b.溶液中有 产生,具支试管、小试管中气体均为 色 c.反应缓慢
实验 结论 浓硝酸具有 ,还原产物是 稀硝酸具有 ,但不如浓HNO3强,还原产物为
二、硝酸的强氧化性
1.硝酸能与除 以外的绝大多数金属发生氧化还原反应。
①铜与浓硝酸反应: 。
②铜与稀硝酸反应: 。
2.常温下,浓硝酸能使 发生钝化。
3.硝酸能与许多非金属单质发生氧化还原反应。
木炭与浓硝酸反应: 。
【答案】一、 溶解 蓝 气泡 红棕 无色 溶解 蓝 气泡 无 强氧化性 NO2 强氧化性 NO 二、 1.金、铂
Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O 2.铝、铁
3.C+4HNO3(浓)CO2↑+4NO2↑+2H2O
【核心突破】
典例2 实验室用铜与硝酸溶液制备NO2气体,下列关于此反应的说法正确的是( )。
A.该反应中的硝酸溶液为稀溶液
B.该反应中氧化剂与还原剂的物质的量之比为1∶2
C.由于NO2会污染空气,因此用排水法收集NO2气体
D.该反应中硝酸既表现出氧化性,又表现出酸性
【答案】D
【解析】铜与浓硝酸反应:Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O,反应中HNO3被还原为NO2表现氧化性,同时生成Cu(NO3)2,表现酸性,反应中氧化剂与还原剂的物质的量之比为2∶1。
【归纳总结】
硝酸的强氧化性
1.规律
(1)HNO3参与的氧化还原反应中,一般浓硝酸被还原为NO2,稀硝酸被还原为NO。
(2)浓度越高,温度越高,HNO3的氧化性越强。
(3)还原剂一般被氧化成最高价态。
2.表现
(1)对酸的通性的影响
①浓硝酸能使石蕊试液先变红,后褪色。
②与活泼金属(如Mg、Zn)反应不产生H2,随着HNO3浓度的降低,HNO3被还原的产物有NO、N2O或N2等,当HNO3浓度很低时,还会生成NH4NO3。
③能溶解除Pt、Au以外的大多数金属,活动性在H以后的Cu、Ag常温下也能与HNO3反应,且随HNO3浓度的降低,往往会得到混合气体,如NO2、NO等。
④常温下,Al、Fe等在浓硝酸中钝化。
⑤浓硝酸与浓盐酸按体积比1∶3混合成的“王水”能溶解Pt、Au等金属。
(2)浓硝酸与非金属单质(如C、S、P等)在加热条件下反应,非金属单质被氧化成最高价氧化物或含氧酸。如:
S(s)+6HNO3(浓)H2SO4+6NO2↑+2H2O
P(s)+5HNO3(浓)H3PO4+5NO2↑+H2O
(3)与还原性物质(如I-、S2-、S、Fe2+、H2S、HBr、HI、Na2SO3等)反应。
3Fe2++4H++N3Fe3++NO↑+2H2O
6I-+8H++2N3I2+2NO↑+4H2O
【特别提醒】
1.HNO3氧化性是由HNO3中+5价N元素表现的。
2.在有关硝酸参与的反应中,当有低价态含氮产物生成时,表现硝酸的氧化性;当有硝酸盐生成时,表现硝酸的酸性。
3.在应用硝酸的氧化性分析离子是否共存时,要注意溶液中H+和N的组合,它们相当于HNO3,能够氧化具有强还原性的离子,而单独的N不能氧化这些离子。
训练2 某同学为探究铜与稀硝酸反应产生的气体主要是NO,设计下列实验装置(加热、固定装置已略去)。图中K为止水夹,d是存有一半空气的注射器。下列说法错误的是( )。
A.装置a的作用是生成CO2气体赶尽装置中的空气
B.装置a中稀硝酸仅体现酸性,装置b中稀硝酸仅体现强氧化性
C.将d中空气推入c中,若气体变为红棕色则说明b中有NO生成
D.该装置存在缺陷,缺少尾气处理装置
【答案】B
任务3 硝酸与金属反应的有关计算
【新知生成】
消耗硝酸总的物质的量=体现酸性的硝酸的物质的量+体现 的硝酸的物质的量
体现酸性的硝酸的物质的量=硝酸盐中 的物质的量=金属 的物质的量
体现氧化性的硝酸的物质的量=n(NO)+
【答案】氧化性 硝酸根离子(或N) 失去电子 n(NO2)
【核心突破】
典例3 将1.92 g铜跟适量的浓硝酸反应,铜全部作用后,共收集到1.12 L标准状况下的气体(假设只有NO2、NO),则反应消耗的硝酸的物质的量为( )。
A.0.110 mol
B.0.100 mol
C.0.0900 mol
D.0.0800 mol
【答案】A
【解析】n(HNO3)酸性=2n[Cu(NO3)2]=2n(Cu)=2×=0.06 mol;n(HNO3)氧化性=n(NO)+n(NO2)==0.05 mol;反应消耗的硝酸的物质的量=n(HNO3)酸性+=0.06 mol+0.05 mol=0.11 mol。
【归纳总结】
硝酸与金属反应的几个规律
(1)n(被还原的硝酸)=n(生成的气体)(NO、NO2)。
(2)n(参加反应的硝酸)=n(被还原的硝酸)+n(呈酸性的硝酸)。
(3)n(未参加反应的HNO3)=n(反应后H+)。
(4)反应后溶液中,n(N)=n(HNO3)+n(金属)×该金属的化合价。
训练3 将2.56 g铜粉加入100 mL 0.4 mol·L-1稀HNO3溶液中,加热充分反应后再加入100 mL 0.2 mol·L-1 H2SO4溶液,继续加热,待充分反应后,所得溶液中Cu2+的物质的量浓度是(忽略溶液体积变化)( )。
A.0.15 mol·L-1 B.0.2 mol·L-1
C.0.075 mol·L-1 D.0.45 mol·L-1
【答案】A
【解析】2.56 g铜粉的物质的量为0.04 mol,硝酸根离子物质的量为0.1 L×0.4 mol·L-1=0.04 mol,氢离子物质的量为0.4 mol·L-1×0.1 L+0.2 mol·L-1×2×0.1 L=0.08 mol。
3Cu+8H++2N3Cu2++2NO↑+4H2O
3 8 2
0.04 0.08 0.04
由此可知Cu、N均过量,0.08 mol氢离子完全反应,生成0.03 mol铜离子,则铜离子物质的量浓度为=0.15 mol·L-1。
【课堂小结】
【随堂检测】
1.下列反应中,硝酸既表现酸性,又表现氧化性的是( )。
A.Fe(OH)2与稀硝酸反应
B.Fe2O3与稀硝酸反应
C.CuO与稀硝酸反应
D.Al(OH)3与稀硝酸反应
【答案】A
【解析】A项,硝酸具有强氧化性,Fe(OH)2具有还原性,因此Fe(OH)2与稀硝酸反应后生成硝酸铁和一氧化氮,硝酸既表现酸性,又表现氧化性;B项,Fe2O3与稀硝酸不能发生氧化还原反应;C项,CuO与稀硝酸不能发生氧化还原反应;D项,Al(OH)3与稀硝酸不能发生氧化还原反应。
2.下列对硝酸的认识,错误的是( )。
A.浓硝酸和稀硝酸都具有氧化性
B.铜与硝酸的反应属于置换反应
C.金属与硝酸反应一般不产生氢气
D.常温下可用铁或铝制容器盛装浓硝酸
【答案】B
3.常温下,能溶于浓硝酸的单质是( )。
A.Al B.Fe C.Cu D.Au
【答案】C
4.为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( )。
A.关闭活塞1,加入稀硝酸至液面a处
B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率
C.通过关闭或开启活塞1可以控制反应的进行
D.反应开始后,胶塞下方有无色气体生成,但不能证明该气体为NO
【答案】A
【解析】关闭活塞1,将无法加液体到液面a,A项错误;加热可以加快稀硝酸与铜的反应速率,B项正确;关闭活塞1,生成的NO气体把稀硝酸压向右边,使铜丝与稀硝酸分离,C项正确;想证明该气体为NO,必须使NO与O2接触,生成红棕色的NO2,D项正确。
5.将Mg、Cu组成的m g混合物投入适量稀硝酸中恰好完全反应,固体完全溶解时收集到0.896 L(标准状况)NO气体,向反应后的溶液中加入60 mL 2 mol·L-1NaOH溶液时,金属离子恰好沉淀完全,则形成的沉淀的质量为( )。
A.(m+2.28) g B.(m+2.04) g
C.(m+3.32) g D.(m+4.34) g
【答案】B
【解析】当金属离子恰好沉淀完全时,m(沉淀)=m(金属)+m(OH-),n(OH-)=n(金属失去的电子)=n(HNO3→NO得到的电子)=3×=0.12 mol,m(沉淀)=m(金属)+m(OH-)=m g+0.12 mol×17 g·mol-1=(m+2.04) g,B项正确。
2
【学习目标】
1.了解硝酸的物理性质及重要用途。
2.掌握硝酸的化学性质:不稳定性、酸性和强氧化性。
3.了解硝酸的工业制法。
4.通过观察浓、稀硝酸与铜的反应实验,培养观察、分析和比较的能力。
【合作探究】
【学习情境】
硝酸不仅是工农业生产的重要化工原料,还是制造炸药的重要战争物资。最初制造硝酸的方法是普通硝石法,利用硝石与硫酸来制取硝酸。因为硝石的贮量有限,所以硝酸的产量受到限制。早在1913年之前,人们就发现德国有发动世界大战的意图,便开始限制德国进口硝石,觉得这样世界就会太平无事了。可是在1914年德国最终发动了第一次世界大战,人们又错误地预计,战争顶多只会打半年,原因是德国的硝酸不多,火药生产受到限制,正是由于各种错误的估计,使得第一次世界大战打了四年多。这场战争德国为什么能坚持这么久呢 原来早在1908年,德国化学家哈伯首先在实验室里用氢气和氮气合成了氨,设计了合成氨的工艺流程并将此方法交给德国一个最大的化工企业进行生产。1913年,一个日产30 t的合成氨工厂建成并投入生产,再利用氨生产硝酸制造炸药。这就揭开了第一次世界大战中的一个谜。
任务1 硝酸的不稳定性
【新知生成】
1.硝酸受热或见光发生分解: 。
2.硝酸应密封贮存在 、 处。
【答案】4HNO34NO2↑+O2↑+2H2O 低温 避光
【核心突破】
典例1 下列关于硝酸的说法错误的是( )。
A.浓硝酸是一种易挥发的液体混合物
B.浓硝酸在空气中敞口放置,因吸收水蒸气而浓度减小
C.浓硝酸不稳定,易分解生成二氧化氮、氧气和水
D.常温下,浓硝酸常保存在棕色细口试剂瓶中
【答案】B
【归纳总结】
试剂存放要点
1.防挥发:需要密封保存,液溴还需要使用“水封”减少挥发。
2.防潮解:需要密封保存,同时保持环境的干燥,如漂白粉、生石灰等。
3.防变质:a.防氧化,如Na、P4等;b.防分解,如氯水、AgCl、HNO3等。
试剂瓶的选择原则
1.固体广口瓶,液体细口瓶。
2.碱性软木塞,其他玻璃塞。
3.怕光棕色瓶,其他无色瓶。
训练1 实验室常利用难挥发性酸制备易挥发性酸的原理,用浓硫酸与硝石(NaNO3)反应制备HNO3,反应装置如图所示(夹持装置未画出),下列说法不正确的是( )。
A.如果反应温度过高,制得的HNO3可能会呈现黄色
B.反应的化学方程式为NaNO3+H2SO4(浓)NaHSO4+HNO3↑
C.可从实验室中选无色透明洁净的试剂瓶盛装制得的硝酸
D.曲颈瓶不适宜制备沸点过低的物质
【答案】C
【解析】浓硝酸受热易分解,产生的二氧化氮溶解在硝酸中会呈现黄色,A项正确;硫酸是高沸点酸,硝酸是低沸点的酸,NaNO3和浓硫酸反应可以生成硝酸和硫酸氢钠,反应的化学方程式为NaNO3+H2SO4(浓)NaHSO4+HNO3↑,B项正确;硝酸见光易分解,所以应避光保存,应存放在棕色试剂瓶中,C项错误;该装置是一种原始蒸馏器,它利用空气冷却,因此不适宜制备沸点过低的物质,D项正确。
任务2 硝酸的强氧化性
【新知生成】
一、 实验探究
实验 操作
实验 现象 a.Cu片 ,溶液变 色 b.溶液中有 产生,具支试管中充满 色气体,小试管中收集的气体呈 c.反应剧烈 a.Cu片 ,溶液变 色 b.溶液中有 产生,具支试管、小试管中气体均为 色 c.反应缓慢
实验 结论 浓硝酸具有 ,还原产物是 稀硝酸具有 ,但不如浓HNO3强,还原产物为
二、硝酸的强氧化性
1.硝酸能与除 以外的绝大多数金属发生氧化还原反应。
①铜与浓硝酸反应: 。
②铜与稀硝酸反应: 。
2.常温下,浓硝酸能使 发生钝化。
3.硝酸能与许多非金属单质发生氧化还原反应。
木炭与浓硝酸反应: 。
【答案】一、 溶解 蓝 气泡 红棕 无色 溶解 蓝 气泡 无 强氧化性 NO2 强氧化性 NO 二、 1.金、铂
Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O 2.铝、铁
3.C+4HNO3(浓)CO2↑+4NO2↑+2H2O
【核心突破】
典例2 实验室用铜与硝酸溶液制备NO2气体,下列关于此反应的说法正确的是( )。
A.该反应中的硝酸溶液为稀溶液
B.该反应中氧化剂与还原剂的物质的量之比为1∶2
C.由于NO2会污染空气,因此用排水法收集NO2气体
D.该反应中硝酸既表现出氧化性,又表现出酸性
【答案】D
【解析】铜与浓硝酸反应:Cu+4HNO3(浓)Cu(NO3)2+2NO2↑+2H2O,反应中HNO3被还原为NO2表现氧化性,同时生成Cu(NO3)2,表现酸性,反应中氧化剂与还原剂的物质的量之比为2∶1。
【归纳总结】
硝酸的强氧化性
1.规律
(1)HNO3参与的氧化还原反应中,一般浓硝酸被还原为NO2,稀硝酸被还原为NO。
(2)浓度越高,温度越高,HNO3的氧化性越强。
(3)还原剂一般被氧化成最高价态。
2.表现
(1)对酸的通性的影响
①浓硝酸能使石蕊试液先变红,后褪色。
②与活泼金属(如Mg、Zn)反应不产生H2,随着HNO3浓度的降低,HNO3被还原的产物有NO、N2O或N2等,当HNO3浓度很低时,还会生成NH4NO3。
③能溶解除Pt、Au以外的大多数金属,活动性在H以后的Cu、Ag常温下也能与HNO3反应,且随HNO3浓度的降低,往往会得到混合气体,如NO2、NO等。
④常温下,Al、Fe等在浓硝酸中钝化。
⑤浓硝酸与浓盐酸按体积比1∶3混合成的“王水”能溶解Pt、Au等金属。
(2)浓硝酸与非金属单质(如C、S、P等)在加热条件下反应,非金属单质被氧化成最高价氧化物或含氧酸。如:
S(s)+6HNO3(浓)H2SO4+6NO2↑+2H2O
P(s)+5HNO3(浓)H3PO4+5NO2↑+H2O
(3)与还原性物质(如I-、S2-、S、Fe2+、H2S、HBr、HI、Na2SO3等)反应。
3Fe2++4H++N3Fe3++NO↑+2H2O
6I-+8H++2N3I2+2NO↑+4H2O
【特别提醒】
1.HNO3氧化性是由HNO3中+5价N元素表现的。
2.在有关硝酸参与的反应中,当有低价态含氮产物生成时,表现硝酸的氧化性;当有硝酸盐生成时,表现硝酸的酸性。
3.在应用硝酸的氧化性分析离子是否共存时,要注意溶液中H+和N的组合,它们相当于HNO3,能够氧化具有强还原性的离子,而单独的N不能氧化这些离子。
训练2 某同学为探究铜与稀硝酸反应产生的气体主要是NO,设计下列实验装置(加热、固定装置已略去)。图中K为止水夹,d是存有一半空气的注射器。下列说法错误的是( )。
A.装置a的作用是生成CO2气体赶尽装置中的空气
B.装置a中稀硝酸仅体现酸性,装置b中稀硝酸仅体现强氧化性
C.将d中空气推入c中,若气体变为红棕色则说明b中有NO生成
D.该装置存在缺陷,缺少尾气处理装置
【答案】B
任务3 硝酸与金属反应的有关计算
【新知生成】
消耗硝酸总的物质的量=体现酸性的硝酸的物质的量+体现 的硝酸的物质的量
体现酸性的硝酸的物质的量=硝酸盐中 的物质的量=金属 的物质的量
体现氧化性的硝酸的物质的量=n(NO)+
【答案】氧化性 硝酸根离子(或N) 失去电子 n(NO2)
【核心突破】
典例3 将1.92 g铜跟适量的浓硝酸反应,铜全部作用后,共收集到1.12 L标准状况下的气体(假设只有NO2、NO),则反应消耗的硝酸的物质的量为( )。
A.0.110 mol
B.0.100 mol
C.0.0900 mol
D.0.0800 mol
【答案】A
【解析】n(HNO3)酸性=2n[Cu(NO3)2]=2n(Cu)=2×=0.06 mol;n(HNO3)氧化性=n(NO)+n(NO2)==0.05 mol;反应消耗的硝酸的物质的量=n(HNO3)酸性+=0.06 mol+0.05 mol=0.11 mol。
【归纳总结】
硝酸与金属反应的几个规律
(1)n(被还原的硝酸)=n(生成的气体)(NO、NO2)。
(2)n(参加反应的硝酸)=n(被还原的硝酸)+n(呈酸性的硝酸)。
(3)n(未参加反应的HNO3)=n(反应后H+)。
(4)反应后溶液中,n(N)=n(HNO3)+n(金属)×该金属的化合价。
训练3 将2.56 g铜粉加入100 mL 0.4 mol·L-1稀HNO3溶液中,加热充分反应后再加入100 mL 0.2 mol·L-1 H2SO4溶液,继续加热,待充分反应后,所得溶液中Cu2+的物质的量浓度是(忽略溶液体积变化)( )。
A.0.15 mol·L-1 B.0.2 mol·L-1
C.0.075 mol·L-1 D.0.45 mol·L-1
【答案】A
【解析】2.56 g铜粉的物质的量为0.04 mol,硝酸根离子物质的量为0.1 L×0.4 mol·L-1=0.04 mol,氢离子物质的量为0.4 mol·L-1×0.1 L+0.2 mol·L-1×2×0.1 L=0.08 mol。
3Cu+8H++2N3Cu2++2NO↑+4H2O
3 8 2
0.04 0.08 0.04
由此可知Cu、N均过量,0.08 mol氢离子完全反应,生成0.03 mol铜离子,则铜离子物质的量浓度为=0.15 mol·L-1。
【课堂小结】
【随堂检测】
1.下列反应中,硝酸既表现酸性,又表现氧化性的是( )。
A.Fe(OH)2与稀硝酸反应
B.Fe2O3与稀硝酸反应
C.CuO与稀硝酸反应
D.Al(OH)3与稀硝酸反应
【答案】A
【解析】A项,硝酸具有强氧化性,Fe(OH)2具有还原性,因此Fe(OH)2与稀硝酸反应后生成硝酸铁和一氧化氮,硝酸既表现酸性,又表现氧化性;B项,Fe2O3与稀硝酸不能发生氧化还原反应;C项,CuO与稀硝酸不能发生氧化还原反应;D项,Al(OH)3与稀硝酸不能发生氧化还原反应。
2.下列对硝酸的认识,错误的是( )。
A.浓硝酸和稀硝酸都具有氧化性
B.铜与硝酸的反应属于置换反应
C.金属与硝酸反应一般不产生氢气
D.常温下可用铁或铝制容器盛装浓硝酸
【答案】B
3.常温下,能溶于浓硝酸的单质是( )。
A.Al B.Fe C.Cu D.Au
【答案】C
4.为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是( )。
A.关闭活塞1,加入稀硝酸至液面a处
B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率
C.通过关闭或开启活塞1可以控制反应的进行
D.反应开始后,胶塞下方有无色气体生成,但不能证明该气体为NO
【答案】A
【解析】关闭活塞1,将无法加液体到液面a,A项错误;加热可以加快稀硝酸与铜的反应速率,B项正确;关闭活塞1,生成的NO气体把稀硝酸压向右边,使铜丝与稀硝酸分离,C项正确;想证明该气体为NO,必须使NO与O2接触,生成红棕色的NO2,D项正确。
5.将Mg、Cu组成的m g混合物投入适量稀硝酸中恰好完全反应,固体完全溶解时收集到0.896 L(标准状况)NO气体,向反应后的溶液中加入60 mL 2 mol·L-1NaOH溶液时,金属离子恰好沉淀完全,则形成的沉淀的质量为( )。
A.(m+2.28) g B.(m+2.04) g
C.(m+3.32) g D.(m+4.34) g
【答案】B
【解析】当金属离子恰好沉淀完全时,m(沉淀)=m(金属)+m(OH-),n(OH-)=n(金属失去的电子)=n(HNO3→NO得到的电子)=3×=0.12 mol,m(沉淀)=m(金属)+m(OH-)=m g+0.12 mol×17 g·mol-1=(m+2.04) g,B项正确。
2
