5.1 第2课时 元素周期表 学案(含答案) 2023-2024学年高一化学苏教版(2020)必修第一册
文档属性
| 名称 | 5.1 第2课时 元素周期表 学案(含答案) 2023-2024学年高一化学苏教版(2020)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 198.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-10 12:40:29 | ||
图片预览



文档简介
5.1 第2课时 元素周期表
【学习目标】
1.知道元素周期表的编排原则,了解周期、族的概念。
2.认识元素周期表是元素周期律的具体表现形式。
【合作探究】
【学习情境】
门捷列夫抓住化学家研究元素分类的历史脉络,夜以继日地分析思考。他剪了很多张卡片,并在每一张卡片上都写上了元素名称、相对原子质量和主要性质等。一天,他又坐到桌前摆弄这些卡片,突然像触电似的站了起来,眼前呈现出完全没有预料到的现象:每一行元素的性质都按照相对原子质量的增大而逐渐变化着。门捷列夫兴奋地在室内踱着步子,然后迅速地抓起记事簿,在上面写道:“根据元素原子相对原子质量及其化学性质的近似性试排元素表。”就这样制作出了第一张元素周期表。
任务1 元素周期表的结构
【新知生成】
人们把已经发现的元素按一定的规则排列成 ,它直观地反映了元素的性质随着 的递增呈现周期性变化的规律。
1.编排原则
(1)横行:把 相同的元素,按 递增的顺序从左到右排成行。
(2)纵列:将 相同的元素,按 递增的顺序由上到下排成列。
2.基本结构
(1)周期:元素周期表有 个横行,每一横行称为一个周期。周期序数=该行元素原子的 ,第一、二、三周期称为 ;其他周期均为 。
(2)族:元素周期表有 列,分为 个族。
①第1、2列和第13、14、15、16、17列为 族,符号分别为 (其中的金属元素被称为 )、 、 、 、 、 、 (统称为 )。
②第3、4、5、6、7列和第11、12列为 族,符号分别为 、 、 、 、 、 、 。
③第8、9、10列为 族。
④第18列为 族。
【答案】元素周期表 核电荷数 1.(1)原子核外电子层数 原子序数 (2)原子核外最外层电子数 电子层数 2.(1)7 电子层数 短周期 长周期 (2)18
16 ①主 ⅠA 碱金属 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 卤素 ②副 ⅢB ⅣB ⅤB ⅥB ⅦB
ⅠB ⅡB ③Ⅷ ④0
【核心突破】
典例1 据国外有关资料报道,在“独居石(一种共生矿,化学成分为Ce、La、Nd等的磷酸盐)”中含有第116号元素。试判断116号元素在周期表中的位置。
【答案】第七周期ⅥA族
【解析】根据原子序数确定元素在周期表中位置的方法——稀有气体定位法:
(1)明确0族元素信息
0族元素 He Ne Ar Kr Xe Rn Og
所在周期序数 1 2 3 4 5 6 7
原子序数 2 10 18 36 54 86 118
(2)比大小定周期
比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的0族元素,那么该元素就和原子序数大的0族元素处于同一周期。
(3)求差值定族数
①若某元素原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的ⅠA族或ⅡA族。
②若比相应的0族元素少5~1,则应处在同周期的ⅢA~ⅦA族。
③若差其他数,则由相应差数找出相应的族。
第七周期若排满,118号元素应为0族元素,则116号元素位于从0族开始向左第三纵行,故应在第七周期ⅥA族。
归纳总结
1.元素周期表的结构
周 期 短周期 第一周期 2种元素 电子层数相同的元素,按原子序数递增的顺序,从左到右排成行,形成周期
第二周期 8种元素
第三周期 8种元素
长周期 第四周期 18种元素
第五周期 18种元素
第六周期 32种元素
第七周期 32种元素
周期序数=该周期元素的电子层数
族 主族 ⅠA~ⅦA族 由长周期和短周期元素共同组成 不同横行中原子最外层电子数相同的元素,按电子层数递增的顺序自上而下排成列,形成族
0族 第18列的元素
副族 ⅠB~ⅦB族 完全由长周期元素组成
Ⅷ族 有三列元素(8、9、10三列)
主族序数=该元素原子的最外层电子数
2.元素周期表中的几个特殊区域
(1)过渡元素:元素周期表中从ⅢB族到ⅡB族共10列,均为过渡元素,这些元素都是金属元素,又被称为过渡金属元素。
(2)镧系元素:元素周期表中,第六周期ⅢB族中,57号元素镧到71号元素镥共15种元素统称为镧系元素,它们的化学性质相似。
(3)锕系元素:元素周期表中,第七周期ⅢB族中,89号元素锕到103号元素铹共15种元素统称为锕系元素,它们的化学性质相似。
训练1 俄罗斯科学家用含20个质子的钙的一种原子轰击含95个质子的镅原子,结果4次成功合成4个第115号元素的原子。这4个原子生成数微秒后衰变成第113号元素。下列有关叙述正确的是( )。
A.115号元素在第六周期
B.113号元素在第七周期ⅢA族
C.115号和113号元素都是非金属元素
D.镅元素和115号元素不在同一周期
【答案】B
【解析】95号元素镅、115号元素、113号元素,原子序数都大于86而小于118,所以都在第七周期;115号元素原子序数比118号元素少3,应在ⅤA族,113号元素在ⅢA族;113号元素和115号元素都是金属元素。
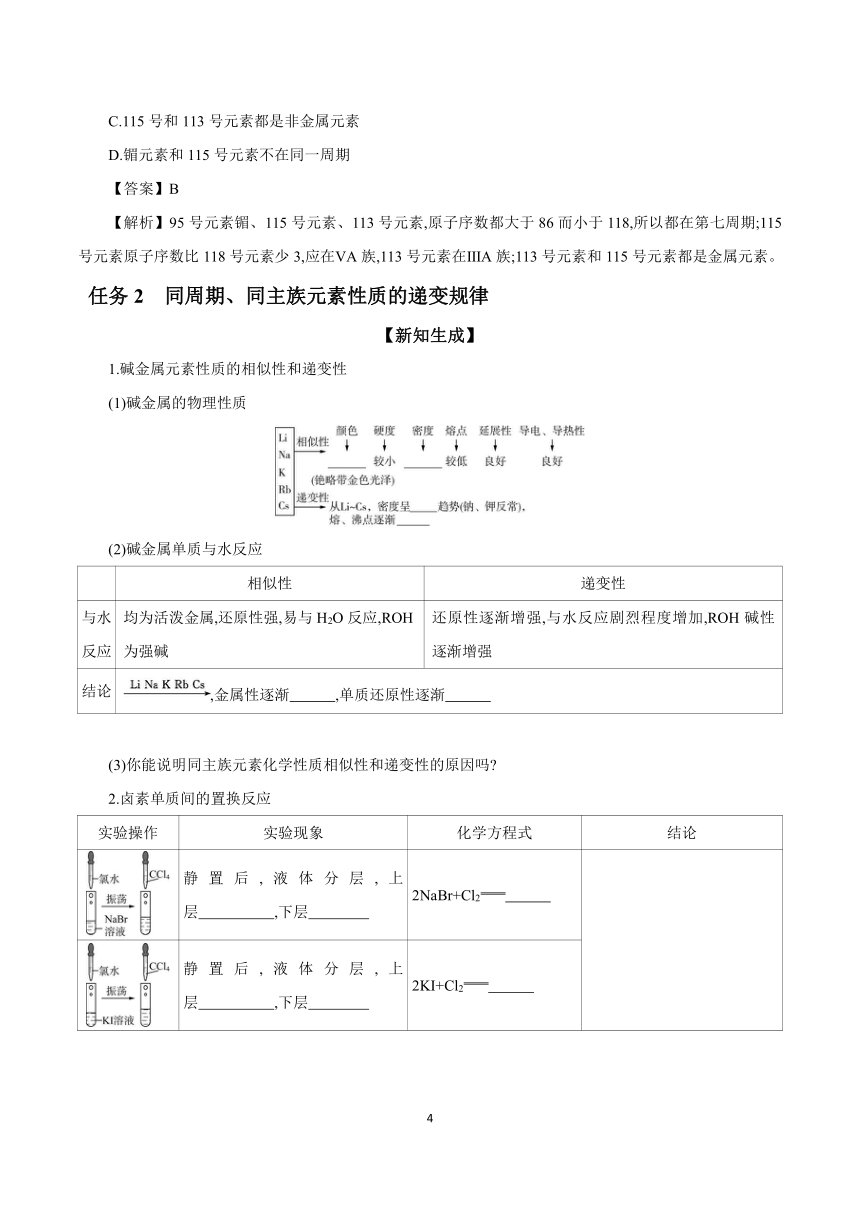
任务2 同周期、同主族元素性质的递变规律
【新知生成】
1.碱金属元素性质的相似性和递变性
(1)碱金属的物理性质
(2)碱金属单质与水反应
相似性 递变性
与水 反应 均为活泼金属,还原性强,易与H2O反应,ROH为强碱 还原性逐渐增强,与水反应剧烈程度增加,ROH碱性逐渐增强
结论 ,金属性逐渐 ,单质还原性逐渐
(3)你能说明同主族元素化学性质相似性和递变性的原因吗
2.卤素单质间的置换反应
实验操作 实验现象 化学方程式 结论
静置后,液体分层,上层 ,下层 2NaBr+Cl2
静置后,液体分层,上层 ,下层 2KI+Cl2
(续表)
实验操作 实验现象 化学方程式 结论
静置后液体分层,上层 ,下层 2KI+Br22KBr+I2 Cl2、Br2、 I2的氧化性逐渐
3.元素的金属性、非金属性变化规律
(1)元素金属性、非金属性递变与元素在周期表中的位置关系
(2)元素的金属性和非金属性 (填“有”或“没有”)严格的界限。上图中的分界线附近的元素 。
【答案】1.(1)银白色 较小 增大 降低 (2)增强
增强 (3)同主族元素原子的最外层电子数相同,所以同主族元素化学性质具有相似性。同主族元素原子的电子层数从上到下逐渐增多,原子半径逐渐增大,所以元素原子失电子能力逐渐增强,得电子能力逐渐减弱,元素的金属性逐渐增强,非金属性逐渐减弱。 2.接近无色 橙红色 2NaCl+Br2 接近无色 紫红色 2KCl+I2 接近无色 紫红色 减弱 3.(1)①增强 ②减弱 ③增强 ④增强 ⑤Al ⑥Si ⑦金属 ⑧非金属 (2)没有 既表现一定的金属性又表现一定的非金属性
【核心突破】
典例2 根据元素性质的递变性分析下面的推断,其中正确的是( )。
A.已知Ca是第四周期ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱
B.已知As是第四周期ⅤA族元素,故AsH3的稳定性比NH3的稳定性强
C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈
D.已知Cl的核电荷数比F的核电荷数大,故Cl的原子半径比F的原子半径大
【答案】D
【解析】同主族元素从上到下金属性逐渐增强,非金属性逐渐减弱,最高价氧化物对应水化物的碱性增强,气态氢化物的稳定性减弱,A、B、C三项错误;同主族元素随核电荷数增大,原子半径增大,D项正确。
归纳总结
同周期、同主族元素性质递变规律(稀有气体除外)
内容 同周期(左→右) 同主族(上→下)
原子 结构 电子层数 相同 增多
最外层电子数 1→8(第一周期1→2) 相同
原子半径 逐渐减小 逐渐增大
原子得电子能力 逐渐增强 逐渐减弱
原子失电子能力 逐渐减弱 逐渐增强
元素 性质 元素的金属性 逐渐减弱 逐渐增强
元素的非金属性 逐渐增强 逐渐减弱
金属单质还原性 逐渐减弱 逐渐增强
非金属单质氧化性 逐渐增强 逐渐减弱
元素的主要化合价 最高正价由+1→+7(O、F除外),最低负价由-4→-1 最高正价数=主族序数(O、F除外)
非金属气态氢化物 形成 难→易 易→难
稳定性 逐渐增强 逐渐减弱
还原性 逐渐减弱 逐渐增强
元素 性质 最高价氧 化物对应 的水化物 (O、F除外) 酸性 逐渐增强 逐渐减弱
碱性 逐渐减弱 逐渐增强
金属阳离子氧化性 逐渐增强 逐渐减弱
非金属阴离子还原性 逐渐减弱 逐渐增强
训练2 英国研究人员认为,全球将有1.4亿人因为用水受到砷中毒之害,导致更多的人患癌症。下列对砷(As)的有关判断正确的是( )。
A.砷原子序数为33,它与铝同主族
B.砷的原子半径小于磷的原子半径
C.砷酸的酸性比硫酸的强
D.砷化氢的稳定性比溴化氢的弱
【答案】D
【解析】砷原子序数为33,位于ⅤA族,A项错误;砷、磷同主族,砷的原子半径大于磷的原子半径,B项错误;由于非金属性:S>P>As,因此砷酸的酸性比硫酸的弱,C项错误;砷、溴同周期,砷的非金属性比溴弱,因此砷化氢的稳定性比溴化氢的弱,D项正确。
课堂小结
【随堂检测】
1. 下列关于元素周期表的说法正确的是( )。
A.元素周期表有8个主族
B.ⅠA族的元素全部是金属元素
C.元素周期表有7个周期
D.短周期是指第一、二周期
【答案】C
【解析】元素周期表有7个主族,A项错误;ⅠA族中的氢元素是非金属元素,B项错误;短周期是指第一、二、三周期,D项错误。
2.Se、Br两种元素的部分信息如图所示,下列说法正确的是( )。
A.原子半径:Br>Se>P
B.Se、Br位于同一主族
C.还原性:S2->Se2->Br-
D.Se在元素周期表中位于第四周期ⅥA族
【答案】D
【解析】由图示信息可知,Se为34号元素,Br为35号元素,Se和Br位于同一周期且Se位于Br的左侧,原子半径:Se>Br,A、B两项错误;Se和S位于同一主族,且Se位于S的下一周期,故还原性:Se2->S2-,C项错误;由图示信息可知Se位于第四周期ⅥA族,D项正确。
3.下列关于卤族元素由上到下性质递变的叙述,正确的是( )。
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④ C.②④⑤ D.①④⑤
【答案】C
【解析】
卤族元素从上到下
4.A、B、C为短周期元素,它们在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B元素原子的质子数。
(1)分别写出A、B元素的名称:A ,B 。
(2)B位于元素周期表中第 周期 族。
(3)C的原子结构示意图为 。
【答案】(1)氮 硫
(2)三 ⅥA
(3)
2
【学习目标】
1.知道元素周期表的编排原则,了解周期、族的概念。
2.认识元素周期表是元素周期律的具体表现形式。
【合作探究】
【学习情境】
门捷列夫抓住化学家研究元素分类的历史脉络,夜以继日地分析思考。他剪了很多张卡片,并在每一张卡片上都写上了元素名称、相对原子质量和主要性质等。一天,他又坐到桌前摆弄这些卡片,突然像触电似的站了起来,眼前呈现出完全没有预料到的现象:每一行元素的性质都按照相对原子质量的增大而逐渐变化着。门捷列夫兴奋地在室内踱着步子,然后迅速地抓起记事簿,在上面写道:“根据元素原子相对原子质量及其化学性质的近似性试排元素表。”就这样制作出了第一张元素周期表。
任务1 元素周期表的结构
【新知生成】
人们把已经发现的元素按一定的规则排列成 ,它直观地反映了元素的性质随着 的递增呈现周期性变化的规律。
1.编排原则
(1)横行:把 相同的元素,按 递增的顺序从左到右排成行。
(2)纵列:将 相同的元素,按 递增的顺序由上到下排成列。
2.基本结构
(1)周期:元素周期表有 个横行,每一横行称为一个周期。周期序数=该行元素原子的 ,第一、二、三周期称为 ;其他周期均为 。
(2)族:元素周期表有 列,分为 个族。
①第1、2列和第13、14、15、16、17列为 族,符号分别为 (其中的金属元素被称为 )、 、 、 、 、 、 (统称为 )。
②第3、4、5、6、7列和第11、12列为 族,符号分别为 、 、 、 、 、 、 。
③第8、9、10列为 族。
④第18列为 族。
【答案】元素周期表 核电荷数 1.(1)原子核外电子层数 原子序数 (2)原子核外最外层电子数 电子层数 2.(1)7 电子层数 短周期 长周期 (2)18
16 ①主 ⅠA 碱金属 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 卤素 ②副 ⅢB ⅣB ⅤB ⅥB ⅦB
ⅠB ⅡB ③Ⅷ ④0
【核心突破】
典例1 据国外有关资料报道,在“独居石(一种共生矿,化学成分为Ce、La、Nd等的磷酸盐)”中含有第116号元素。试判断116号元素在周期表中的位置。
【答案】第七周期ⅥA族
【解析】根据原子序数确定元素在周期表中位置的方法——稀有气体定位法:
(1)明确0族元素信息
0族元素 He Ne Ar Kr Xe Rn Og
所在周期序数 1 2 3 4 5 6 7
原子序数 2 10 18 36 54 86 118
(2)比大小定周期
比较该元素的原子序数与0族元素的原子序数大小,找出与其相邻近的0族元素,那么该元素就和原子序数大的0族元素处于同一周期。
(3)求差值定族数
①若某元素原子序数比相应的0族元素多1或2,则该元素应处在该0族元素所在周期的下一个周期的ⅠA族或ⅡA族。
②若比相应的0族元素少5~1,则应处在同周期的ⅢA~ⅦA族。
③若差其他数,则由相应差数找出相应的族。
第七周期若排满,118号元素应为0族元素,则116号元素位于从0族开始向左第三纵行,故应在第七周期ⅥA族。
归纳总结
1.元素周期表的结构
周 期 短周期 第一周期 2种元素 电子层数相同的元素,按原子序数递增的顺序,从左到右排成行,形成周期
第二周期 8种元素
第三周期 8种元素
长周期 第四周期 18种元素
第五周期 18种元素
第六周期 32种元素
第七周期 32种元素
周期序数=该周期元素的电子层数
族 主族 ⅠA~ⅦA族 由长周期和短周期元素共同组成 不同横行中原子最外层电子数相同的元素,按电子层数递增的顺序自上而下排成列,形成族
0族 第18列的元素
副族 ⅠB~ⅦB族 完全由长周期元素组成
Ⅷ族 有三列元素(8、9、10三列)
主族序数=该元素原子的最外层电子数
2.元素周期表中的几个特殊区域
(1)过渡元素:元素周期表中从ⅢB族到ⅡB族共10列,均为过渡元素,这些元素都是金属元素,又被称为过渡金属元素。
(2)镧系元素:元素周期表中,第六周期ⅢB族中,57号元素镧到71号元素镥共15种元素统称为镧系元素,它们的化学性质相似。
(3)锕系元素:元素周期表中,第七周期ⅢB族中,89号元素锕到103号元素铹共15种元素统称为锕系元素,它们的化学性质相似。
训练1 俄罗斯科学家用含20个质子的钙的一种原子轰击含95个质子的镅原子,结果4次成功合成4个第115号元素的原子。这4个原子生成数微秒后衰变成第113号元素。下列有关叙述正确的是( )。
A.115号元素在第六周期
B.113号元素在第七周期ⅢA族
C.115号和113号元素都是非金属元素
D.镅元素和115号元素不在同一周期
【答案】B
【解析】95号元素镅、115号元素、113号元素,原子序数都大于86而小于118,所以都在第七周期;115号元素原子序数比118号元素少3,应在ⅤA族,113号元素在ⅢA族;113号元素和115号元素都是金属元素。
任务2 同周期、同主族元素性质的递变规律
【新知生成】
1.碱金属元素性质的相似性和递变性
(1)碱金属的物理性质
(2)碱金属单质与水反应
相似性 递变性
与水 反应 均为活泼金属,还原性强,易与H2O反应,ROH为强碱 还原性逐渐增强,与水反应剧烈程度增加,ROH碱性逐渐增强
结论 ,金属性逐渐 ,单质还原性逐渐
(3)你能说明同主族元素化学性质相似性和递变性的原因吗
2.卤素单质间的置换反应
实验操作 实验现象 化学方程式 结论
静置后,液体分层,上层 ,下层 2NaBr+Cl2
静置后,液体分层,上层 ,下层 2KI+Cl2
(续表)
实验操作 实验现象 化学方程式 结论
静置后液体分层,上层 ,下层 2KI+Br22KBr+I2 Cl2、Br2、 I2的氧化性逐渐
3.元素的金属性、非金属性变化规律
(1)元素金属性、非金属性递变与元素在周期表中的位置关系
(2)元素的金属性和非金属性 (填“有”或“没有”)严格的界限。上图中的分界线附近的元素 。
【答案】1.(1)银白色 较小 增大 降低 (2)增强
增强 (3)同主族元素原子的最外层电子数相同,所以同主族元素化学性质具有相似性。同主族元素原子的电子层数从上到下逐渐增多,原子半径逐渐增大,所以元素原子失电子能力逐渐增强,得电子能力逐渐减弱,元素的金属性逐渐增强,非金属性逐渐减弱。 2.接近无色 橙红色 2NaCl+Br2 接近无色 紫红色 2KCl+I2 接近无色 紫红色 减弱 3.(1)①增强 ②减弱 ③增强 ④增强 ⑤Al ⑥Si ⑦金属 ⑧非金属 (2)没有 既表现一定的金属性又表现一定的非金属性
【核心突破】
典例2 根据元素性质的递变性分析下面的推断,其中正确的是( )。
A.已知Ca是第四周期ⅡA族元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱
B.已知As是第四周期ⅤA族元素,故AsH3的稳定性比NH3的稳定性强
C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈
D.已知Cl的核电荷数比F的核电荷数大,故Cl的原子半径比F的原子半径大
【答案】D
【解析】同主族元素从上到下金属性逐渐增强,非金属性逐渐减弱,最高价氧化物对应水化物的碱性增强,气态氢化物的稳定性减弱,A、B、C三项错误;同主族元素随核电荷数增大,原子半径增大,D项正确。
归纳总结
同周期、同主族元素性质递变规律(稀有气体除外)
内容 同周期(左→右) 同主族(上→下)
原子 结构 电子层数 相同 增多
最外层电子数 1→8(第一周期1→2) 相同
原子半径 逐渐减小 逐渐增大
原子得电子能力 逐渐增强 逐渐减弱
原子失电子能力 逐渐减弱 逐渐增强
元素 性质 元素的金属性 逐渐减弱 逐渐增强
元素的非金属性 逐渐增强 逐渐减弱
金属单质还原性 逐渐减弱 逐渐增强
非金属单质氧化性 逐渐增强 逐渐减弱
元素的主要化合价 最高正价由+1→+7(O、F除外),最低负价由-4→-1 最高正价数=主族序数(O、F除外)
非金属气态氢化物 形成 难→易 易→难
稳定性 逐渐增强 逐渐减弱
还原性 逐渐减弱 逐渐增强
元素 性质 最高价氧 化物对应 的水化物 (O、F除外) 酸性 逐渐增强 逐渐减弱
碱性 逐渐减弱 逐渐增强
金属阳离子氧化性 逐渐增强 逐渐减弱
非金属阴离子还原性 逐渐减弱 逐渐增强
训练2 英国研究人员认为,全球将有1.4亿人因为用水受到砷中毒之害,导致更多的人患癌症。下列对砷(As)的有关判断正确的是( )。
A.砷原子序数为33,它与铝同主族
B.砷的原子半径小于磷的原子半径
C.砷酸的酸性比硫酸的强
D.砷化氢的稳定性比溴化氢的弱
【答案】D
【解析】砷原子序数为33,位于ⅤA族,A项错误;砷、磷同主族,砷的原子半径大于磷的原子半径,B项错误;由于非金属性:S>P>As,因此砷酸的酸性比硫酸的弱,C项错误;砷、溴同周期,砷的非金属性比溴弱,因此砷化氢的稳定性比溴化氢的弱,D项正确。
课堂小结
【随堂检测】
1. 下列关于元素周期表的说法正确的是( )。
A.元素周期表有8个主族
B.ⅠA族的元素全部是金属元素
C.元素周期表有7个周期
D.短周期是指第一、二周期
【答案】C
【解析】元素周期表有7个主族,A项错误;ⅠA族中的氢元素是非金属元素,B项错误;短周期是指第一、二、三周期,D项错误。
2.Se、Br两种元素的部分信息如图所示,下列说法正确的是( )。
A.原子半径:Br>Se>P
B.Se、Br位于同一主族
C.还原性:S2->Se2->Br-
D.Se在元素周期表中位于第四周期ⅥA族
【答案】D
【解析】由图示信息可知,Se为34号元素,Br为35号元素,Se和Br位于同一周期且Se位于Br的左侧,原子半径:Se>Br,A、B两项错误;Se和S位于同一主族,且Se位于S的下一周期,故还原性:Se2->S2-,C项错误;由图示信息可知Se位于第四周期ⅥA族,D项正确。
3.下列关于卤族元素由上到下性质递变的叙述,正确的是( )。
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④ C.②④⑤ D.①④⑤
【答案】C
【解析】
卤族元素从上到下
4.A、B、C为短周期元素,它们在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B元素原子的质子数。
(1)分别写出A、B元素的名称:A ,B 。
(2)B位于元素周期表中第 周期 族。
(3)C的原子结构示意图为 。
【答案】(1)氮 硫
(2)三 ⅥA
(3)
2
