5.2 第2课时 共价键 分子间作用力 学案(含答案) 2023-2024学年高一化学苏教版(2020)必修第一册
文档属性
| 名称 | 5.2 第2课时 共价键 分子间作用力 学案(含答案) 2023-2024学年高一化学苏教版(2020)必修第一册 |

|
|
| 格式 | docx | ||
| 文件大小 | 177.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-07-23 09:12:41 | ||
图片预览


文档简介
5.2 第2课时 共价键 分子间作用力
【学习目标】
1.知道共价键及其形成,知道共价化合物。
2.了解有机化合物中碳原子的成键特点和成键方式。
3.学会用电子式表示共价键以及共价分子,会用结构式表示共价键以及共价分子;了解用球棍模型、空间填充模型表示分子结构。
4.知道构成物质的微粒之间存在不同的作用,认识分子间作用力。
【合作探究】
任务1 共价键
【学习情境】
元素是怎样形成化合物的呢 这是化学家们共同关心的问题。最早的时候,化学家假设原子与原子之间是用一个神秘的钩钩住的,这种设想至今仍留下了痕迹,化学键的“键”字就有钩的意思。1916年,德国科学家柯赛尔在考察大量的事实后得出结论:任何元素的原子都要使最外层满足8电子稳定结构。1923年,美国化学家路易斯提出了共价键的电子理论:两种元素的原子可以相互共用一对或多对电子,以便达到稀有气体原子的稳定结构,这样形成的化学键叫作共价键。
【新知生成】
1.共价键:原子间通过 形成的 的相互作用。
2.共价化合物:全部由 形成的化合物。
3.共价分子
①概念:原子之间全部以 结合的 。
②表示方法:电子式、 式、 模型和 填充模型。
【答案】共用电子对 强烈 共价键 共价键 分子 结构 球棍 空间
【核心突破】
典例1 下列物质只含有共价键的是( )。
A.NaOH B.NH4Cl C.SiO2 D.He
【答案】C
【解析】NaOH中含有共价键和离子键,NH4Cl中含有共价键和离子键,SiO2中只存在Si—O共价键,He是单原子分子,不含有化学键。
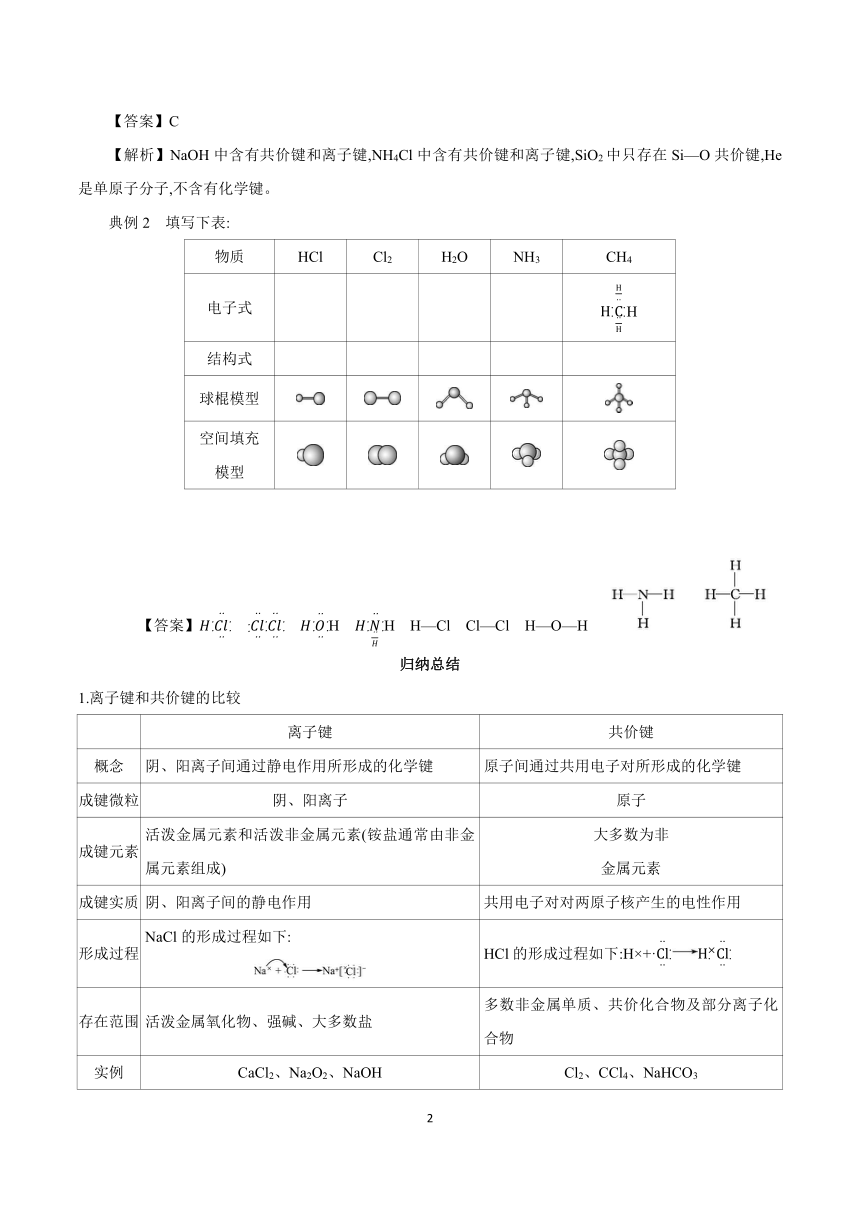
典例2 填写下表:
物质 HCl Cl2 H2O NH3 CH4
电子式 H
结构式
球棍模型
空间填充 模型
【答案】 H H H—Cl Cl—Cl H—O—H
归纳总结
1.离子键和共价键的比较
离子键 共价键
概念 阴、阳离子间通过静电作用所形成的化学键 原子间通过共用电子对所形成的化学键
成键微粒 阴、阳离子 原子
成键元素 活泼金属元素和活泼非金属元素(铵盐通常由非金属元素组成) 大多数为非 金属元素
成键实质 阴、阳离子间的静电作用 共用电子对对两原子核产生的电性作用
形成过程 NaCl的形成过程如下: HCl的形成过程如下:H×+·
存在范围 活泼金属氧化物、强碱、大多数盐 多数非金属单质、共价化合物及部分离子化合物
实例 CaCl2、Na2O2、NaOH Cl2、CCl4、NaHCO3
2.离子化合物与共价化合物的比较
离子化合物 共价化合物
构成微粒 阴、阳离子 分子或原子
微粒间的 作用 离子键 原子之间存 在共价键
熔、沸点 较高 一般较低,少部分很高(如SiO2)
导电性 熔融态或水溶液导电 熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
熔化时破 坏的作用力 一定破坏离子键,可能破坏共价键(如NaHCO3) 一般不破坏共价键,极少部分破坏共价键(如SiO2)
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属氢化物、非金属氧化物、大多数有机物
3.判断离子化合物和共价化合物的方法
训练1 下列反应过程中,同时有离子键和共价键的断裂和形成的是( )。
A.2H2+O22H2O
B.NH3+HClNH4Cl
C.2Mg+CO22MgO+C
D.2Na2O2+2H2O4NaOH+O2↑
【答案】D
【解析】A项,所有物质均不存在离子键;B、C两项,反应物中不存在离子键;D项,反应物Na2O2既有离子键,又有共价键,反应物H2O中有共价键,生成物NaOH既有离子键,又有共价键,生成物O2中有共价键。
训练2 下列电子式书写不正确的是 ( )。
A.Mg2+
B.H]-
C.
D.H+]2-H+
【答案】D
【解析】H2S为共价化合物,不存在阴、阳离子,其电子式应为H。
任务2 分子间作用力
【学习情境】
壁虎为什么可以在墙壁上自由行走呢 通过显微镜观察壁虎的脚掌就可以知道,它的每只脚底部长着数百万根极细的刚毛,而每根刚毛末端又有400~1000根更细的分支。这种精细结构使得刚毛与物体表面分子间的距离非常近,从而产生分子间作用力。虽然每根刚毛产生的力量微不足道,但累积起来就很可观。根据计算,一根刚毛能够提起一只蚂蚁的重量,而100万根刚毛虽然占地不到一个小硬币的面积,但可以提起20公斤的重量,如果壁虎同时使用全部刚毛,就能够提起125公斤的重量。那么什么是分子间作用力呢
【新知生成】
分子间作用力
(1)概念: 间存在着将 聚集在一起的作用力。
(2)强度:分子间作用力比化学键 得多。
(3)作用:影响由 构成的物质的 和溶解性。
【答案】分子 分子 弱 分子 熔、沸点
【核心突破】
典例3 共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,存在分子间作用力和共价键的是( )。
A.干冰 B.氯化钠 C.氢氧化钠 D.金刚石
【答案】A
【解析】干冰是由分子构成的物质,分子间存在着分子间作用力,分子内存在共价键。氯化钠是离子化合物,只存在离子键。氢氧化钠是离子化合物,它不仅存在离子键,其OH-中还存在共价键。金刚石是由原子构成的物质,只存在共价键。
归纳总结
1.化学键与分子间的作用力的比较
微粒间作用力 组成微粒 存在 作用力 影响范围
化学键 离子键 阴、阳离子 离子化合物 强 离子化合物的化学性质及熔点、沸点、硬度等物理性质
共价键 原子 共价化合物、离子化合物、非金属单质 强 单质、化合物的化学性质
分子间的 作用力 分子间作用力 分子 分子间 弱 熔点、沸点、溶解度等物理性质
氢键 分子 分子间 比化学键弱得多,比分子间作用力强 熔点、沸点、溶解度等物理性质
2.物质变化过程中化学键的变化
(1)化学反应过程
①化学反应过程中反应物中化学键被破坏,产物中有新化学键的形成,如H2与Cl2反应生成HCl,H2、Cl2中的化学键被破坏,形成HCl中的化学键。
②化学反应时,并不是反应物中所有的化学键都被破坏,如反应Na2SO4+BaCl2BaSO4↓+2NaCl中,Na2SO4、BaCl2中的离子键被破坏,但S中共价键未被破坏。
(2)离子化合物的溶解或熔化过程
离子化合物电离阴、阳离子
(3)共价化合物的溶解或熔化过程
①溶解过程
能与水反应的共价化合物共价键被破坏
属于共价化合物的电解质共价键断裂生成阴、阳离子
部分非电解质共价键不被破坏
②熔化
(4)单质的熔化或溶解过程
①由分子构成的固体单质,如I2的升华、P4的熔化,只破坏分子间作用力,而不破坏化学键。
②由原子构成的单质,如金刚石、晶体硅,熔化时破坏共价键。
③对于某些活泼的非金属单质,溶于水后能与水反应,其分子内共价键被破坏,如Cl2、F2等。
训练3 下列变化过程克服了分子间作用力的是( )。
A.KNO3熔化 B.NaCl溶解 C.干冰升华 D.NH3分解
【答案】C
【解析】KNO3是离子化合物,熔化时破坏了离子键,NaCl是离子化合物,溶解时电离出Na+和Cl-,破坏了离子键,干冰升华,克服的是分子间作用力,氨气分解产生氮气和氢气,破坏的是共价键。
课堂小结
【随堂检测】
1.下列说法不正确的是( )。
A.共价化合物中没有离子键
B.离子化合物中不一定没有共价键
C.共价化合物中可以有离子键
D.离子键只能存在于离子化合物中
【答案】C
【解析】离子键只能存在于离子化合物中,共价化合物中只能有共价键。
2.下列各组物质中,化学键类型完全相同的是( )。
A.MgCl2和Na2O2 B.H2O和Na2O C.CaF2和CsCl D.NaCl和HNO3
【答案】C
【解析】A项,MgCl2只含有离子键,Na2O2既含有离子键又含有共价键;B项,H2O只含有共价键,Na2O只含有离子键;C项,CaF2和CsCl均只含有离子键;D项,NaCl只含有离子键,HNO3只含有共价键。
3.当干冰汽化时,下列所述各项中发生变化的是( )。
①分子间距离 ②分子间作用力 ③氢键 ④分子内共价键 ⑤化学性质 ⑥物理性质
A.①②⑥ B.①③⑤ C.①④⑥ D.②④⑥
【答案】A
【解析】干冰汽化为物理变化,是分子间距离改变引起的,此过程中,分子间作用力被破坏,但共价键仍保持不变,CO2分子间不存在氢键。
4.现有下列物质:CO2、N2、CaCl2、NH4Cl、NaOH、H2O2、Na2O2。
(1)属于共价化合物的有 ;含有共价键的离子化合物有 。
(2)已知N2、CO2的结构式分别为、,则N2、CO2的电子式分别为 、 。
(3)分别写出NaOH、H2O2、Na2O2的电子式:
NaOH ;H2O2 ;Na2O2 。
【答案】(1)CO2、H2O2 NH4Cl、NaOH、Na2O2
(2N
(3)Na+H]- H
Na+]2-Na+
2
【学习目标】
1.知道共价键及其形成,知道共价化合物。
2.了解有机化合物中碳原子的成键特点和成键方式。
3.学会用电子式表示共价键以及共价分子,会用结构式表示共价键以及共价分子;了解用球棍模型、空间填充模型表示分子结构。
4.知道构成物质的微粒之间存在不同的作用,认识分子间作用力。
【合作探究】
任务1 共价键
【学习情境】
元素是怎样形成化合物的呢 这是化学家们共同关心的问题。最早的时候,化学家假设原子与原子之间是用一个神秘的钩钩住的,这种设想至今仍留下了痕迹,化学键的“键”字就有钩的意思。1916年,德国科学家柯赛尔在考察大量的事实后得出结论:任何元素的原子都要使最外层满足8电子稳定结构。1923年,美国化学家路易斯提出了共价键的电子理论:两种元素的原子可以相互共用一对或多对电子,以便达到稀有气体原子的稳定结构,这样形成的化学键叫作共价键。
【新知生成】
1.共价键:原子间通过 形成的 的相互作用。
2.共价化合物:全部由 形成的化合物。
3.共价分子
①概念:原子之间全部以 结合的 。
②表示方法:电子式、 式、 模型和 填充模型。
【答案】共用电子对 强烈 共价键 共价键 分子 结构 球棍 空间
【核心突破】
典例1 下列物质只含有共价键的是( )。
A.NaOH B.NH4Cl C.SiO2 D.He
【答案】C
【解析】NaOH中含有共价键和离子键,NH4Cl中含有共价键和离子键,SiO2中只存在Si—O共价键,He是单原子分子,不含有化学键。
典例2 填写下表:
物质 HCl Cl2 H2O NH3 CH4
电子式 H
结构式
球棍模型
空间填充 模型
【答案】 H H H—Cl Cl—Cl H—O—H
归纳总结
1.离子键和共价键的比较
离子键 共价键
概念 阴、阳离子间通过静电作用所形成的化学键 原子间通过共用电子对所形成的化学键
成键微粒 阴、阳离子 原子
成键元素 活泼金属元素和活泼非金属元素(铵盐通常由非金属元素组成) 大多数为非 金属元素
成键实质 阴、阳离子间的静电作用 共用电子对对两原子核产生的电性作用
形成过程 NaCl的形成过程如下: HCl的形成过程如下:H×+·
存在范围 活泼金属氧化物、强碱、大多数盐 多数非金属单质、共价化合物及部分离子化合物
实例 CaCl2、Na2O2、NaOH Cl2、CCl4、NaHCO3
2.离子化合物与共价化合物的比较
离子化合物 共价化合物
构成微粒 阴、阳离子 分子或原子
微粒间的 作用 离子键 原子之间存 在共价键
熔、沸点 较高 一般较低,少部分很高(如SiO2)
导电性 熔融态或水溶液导电 熔融态不导电,溶于水有的导电(如硫酸),有的不导电(如蔗糖)
熔化时破 坏的作用力 一定破坏离子键,可能破坏共价键(如NaHCO3) 一般不破坏共价键,极少部分破坏共价键(如SiO2)
实例 强碱、大多数盐、活泼金属的氧化物 酸、非金属氢化物、非金属氧化物、大多数有机物
3.判断离子化合物和共价化合物的方法
训练1 下列反应过程中,同时有离子键和共价键的断裂和形成的是( )。
A.2H2+O22H2O
B.NH3+HClNH4Cl
C.2Mg+CO22MgO+C
D.2Na2O2+2H2O4NaOH+O2↑
【答案】D
【解析】A项,所有物质均不存在离子键;B、C两项,反应物中不存在离子键;D项,反应物Na2O2既有离子键,又有共价键,反应物H2O中有共价键,生成物NaOH既有离子键,又有共价键,生成物O2中有共价键。
训练2 下列电子式书写不正确的是 ( )。
A.Mg2+
B.H]-
C.
D.H+]2-H+
【答案】D
【解析】H2S为共价化合物,不存在阴、阳离子,其电子式应为H。
任务2 分子间作用力
【学习情境】
壁虎为什么可以在墙壁上自由行走呢 通过显微镜观察壁虎的脚掌就可以知道,它的每只脚底部长着数百万根极细的刚毛,而每根刚毛末端又有400~1000根更细的分支。这种精细结构使得刚毛与物体表面分子间的距离非常近,从而产生分子间作用力。虽然每根刚毛产生的力量微不足道,但累积起来就很可观。根据计算,一根刚毛能够提起一只蚂蚁的重量,而100万根刚毛虽然占地不到一个小硬币的面积,但可以提起20公斤的重量,如果壁虎同时使用全部刚毛,就能够提起125公斤的重量。那么什么是分子间作用力呢
【新知生成】
分子间作用力
(1)概念: 间存在着将 聚集在一起的作用力。
(2)强度:分子间作用力比化学键 得多。
(3)作用:影响由 构成的物质的 和溶解性。
【答案】分子 分子 弱 分子 熔、沸点
【核心突破】
典例3 共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,存在分子间作用力和共价键的是( )。
A.干冰 B.氯化钠 C.氢氧化钠 D.金刚石
【答案】A
【解析】干冰是由分子构成的物质,分子间存在着分子间作用力,分子内存在共价键。氯化钠是离子化合物,只存在离子键。氢氧化钠是离子化合物,它不仅存在离子键,其OH-中还存在共价键。金刚石是由原子构成的物质,只存在共价键。
归纳总结
1.化学键与分子间的作用力的比较
微粒间作用力 组成微粒 存在 作用力 影响范围
化学键 离子键 阴、阳离子 离子化合物 强 离子化合物的化学性质及熔点、沸点、硬度等物理性质
共价键 原子 共价化合物、离子化合物、非金属单质 强 单质、化合物的化学性质
分子间的 作用力 分子间作用力 分子 分子间 弱 熔点、沸点、溶解度等物理性质
氢键 分子 分子间 比化学键弱得多,比分子间作用力强 熔点、沸点、溶解度等物理性质
2.物质变化过程中化学键的变化
(1)化学反应过程
①化学反应过程中反应物中化学键被破坏,产物中有新化学键的形成,如H2与Cl2反应生成HCl,H2、Cl2中的化学键被破坏,形成HCl中的化学键。
②化学反应时,并不是反应物中所有的化学键都被破坏,如反应Na2SO4+BaCl2BaSO4↓+2NaCl中,Na2SO4、BaCl2中的离子键被破坏,但S中共价键未被破坏。
(2)离子化合物的溶解或熔化过程
离子化合物电离阴、阳离子
(3)共价化合物的溶解或熔化过程
①溶解过程
能与水反应的共价化合物共价键被破坏
属于共价化合物的电解质共价键断裂生成阴、阳离子
部分非电解质共价键不被破坏
②熔化
(4)单质的熔化或溶解过程
①由分子构成的固体单质,如I2的升华、P4的熔化,只破坏分子间作用力,而不破坏化学键。
②由原子构成的单质,如金刚石、晶体硅,熔化时破坏共价键。
③对于某些活泼的非金属单质,溶于水后能与水反应,其分子内共价键被破坏,如Cl2、F2等。
训练3 下列变化过程克服了分子间作用力的是( )。
A.KNO3熔化 B.NaCl溶解 C.干冰升华 D.NH3分解
【答案】C
【解析】KNO3是离子化合物,熔化时破坏了离子键,NaCl是离子化合物,溶解时电离出Na+和Cl-,破坏了离子键,干冰升华,克服的是分子间作用力,氨气分解产生氮气和氢气,破坏的是共价键。
课堂小结
【随堂检测】
1.下列说法不正确的是( )。
A.共价化合物中没有离子键
B.离子化合物中不一定没有共价键
C.共价化合物中可以有离子键
D.离子键只能存在于离子化合物中
【答案】C
【解析】离子键只能存在于离子化合物中,共价化合物中只能有共价键。
2.下列各组物质中,化学键类型完全相同的是( )。
A.MgCl2和Na2O2 B.H2O和Na2O C.CaF2和CsCl D.NaCl和HNO3
【答案】C
【解析】A项,MgCl2只含有离子键,Na2O2既含有离子键又含有共价键;B项,H2O只含有共价键,Na2O只含有离子键;C项,CaF2和CsCl均只含有离子键;D项,NaCl只含有离子键,HNO3只含有共价键。
3.当干冰汽化时,下列所述各项中发生变化的是( )。
①分子间距离 ②分子间作用力 ③氢键 ④分子内共价键 ⑤化学性质 ⑥物理性质
A.①②⑥ B.①③⑤ C.①④⑥ D.②④⑥
【答案】A
【解析】干冰汽化为物理变化,是分子间距离改变引起的,此过程中,分子间作用力被破坏,但共价键仍保持不变,CO2分子间不存在氢键。
4.现有下列物质:CO2、N2、CaCl2、NH4Cl、NaOH、H2O2、Na2O2。
(1)属于共价化合物的有 ;含有共价键的离子化合物有 。
(2)已知N2、CO2的结构式分别为、,则N2、CO2的电子式分别为 、 。
(3)分别写出NaOH、H2O2、Na2O2的电子式:
NaOH ;H2O2 ;Na2O2 。
【答案】(1)CO2、H2O2 NH4Cl、NaOH、Na2O2
(2N
(3)Na+H]- H
Na+]2-Na+
2
