广东省湛江市廉江市良垌镇第三初级中学2023-2024学年九年级学业水平考试模拟检测化学试卷(含答案)
文档属性
| 名称 | 广东省湛江市廉江市良垌镇第三初级中学2023-2024学年九年级学业水平考试模拟检测化学试卷(含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 363.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-10 16:36:27 | ||
图片预览



文档简介
广东省湛江市廉江市良垌镇第三初级中学2023-2024学年九年级学业水平考试模拟检测化学试卷
一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.每年3月22日为“世界水日”。下列图标表示节水标志的是( )
2.下列作用不属于化学变化的是( )
A.植物的光合作用 B.动物呼吸作用
C.氯气的氧化作用 D.活性碳的吸附作用
3.人体健康与体内化学元素含量的多少息息相关、对于14-18岁人群,因摄入不足而引起食欲不振,发育不良的元素是( )
A.硒 B.锌 C.钾 D.氟
4蛋白质能维持人体的生长发育和组织更新。下列食物富含蛋白质的是( )
A.菠菜 B.馒头 C.牛肉 D.苹果
5.青少年的健康问题日益引起人们重视。某学校中考时同学中午的食谱为:米饭、回锅肉、炸鸡块、牛奶,从营养均衡的角度分析,还需要补充的食物是工( )
A.炒蛋 B.清蒸鱼 C.炒西红柿 D.蒸馒头
6.“安全重于泰山”,下列有关化学与安全的说法不正确的是( )
A. 救火时不能贸然打开门窗,以免空气对流火势蔓延
B. 不能向下水道扔烟花爆竹,以防沼气爆炸
C. 进入面粉厂时应严禁烟火,以防粉尘爆炸
D. 液化石油罐泄漏时,要迅速打开排风扇
7.规范的实验操作是安全进行化学实验的保障。下列实验操作中正确的是( )
A.稀释浓硫酸 B.点燃酒精灯 C.倾倒溶液 D.蒸发食盐水
8.下列硫元素的化合价最低的是( )
A.S B.SO2 C.H2SO4 D.H2S
9.下列化学用语中,数字“2”表示的意义正确的是( )
A.2O:2个氧元素
B.O2-:1个氧离子带2个单位负电荷
C.NO2:二氧化氮分子中含有1个氧分子
D.O2:2个氧原子
10.天宫课堂中,航天员王亚平视频展示了在无容器材料实验柜中进行的“锆金属熔化与凝固”实验。下图是锆元素在元素周期表中的信息及原子结构示意图。下列说法错误的是( )
A.锆原子的质子数为40
B.氯化锆的化学式可能为ZrCl2
C.锆元素的相对原子质量为91.22g
D.锆原子在化学反应中容易失去2个电子
选择题组:金属活动性顺序在人类活动中有着广泛的应用,回答11~12题。
11.下列金属中,金属活动性最强的是( )
A.Zn B.Cu C.Fe D.Ag
12.为证明Fe、Cu、Ag三种金属的活动性强弱,下列实验方案能达到目的的是( )
A.将Fe、Cu、Ag分别放入稀盐酸中
B.将Cu分别放入FeCl2、AgNO3溶液中
C.将Cu、Ag分别放入FeSO4溶液中
D.将Fe放入稀盐酸、Cu放入AgNO3溶液中
13.下列各物质的用途与性质对应关系不正确的是 ( )
选项 物质 用途 性质
A 金属铁 制作铁锅 导热性
B 熟石灰 改良酸性土壤 能与一些金属氧化物反应
C 小苏打 治疗胃酸过多 小苏打能与盐酸发生反应
D 稀有气体 制造多种用途的电光源 通电时可以发出不同颜色的光
A.A B.B C.C D.D
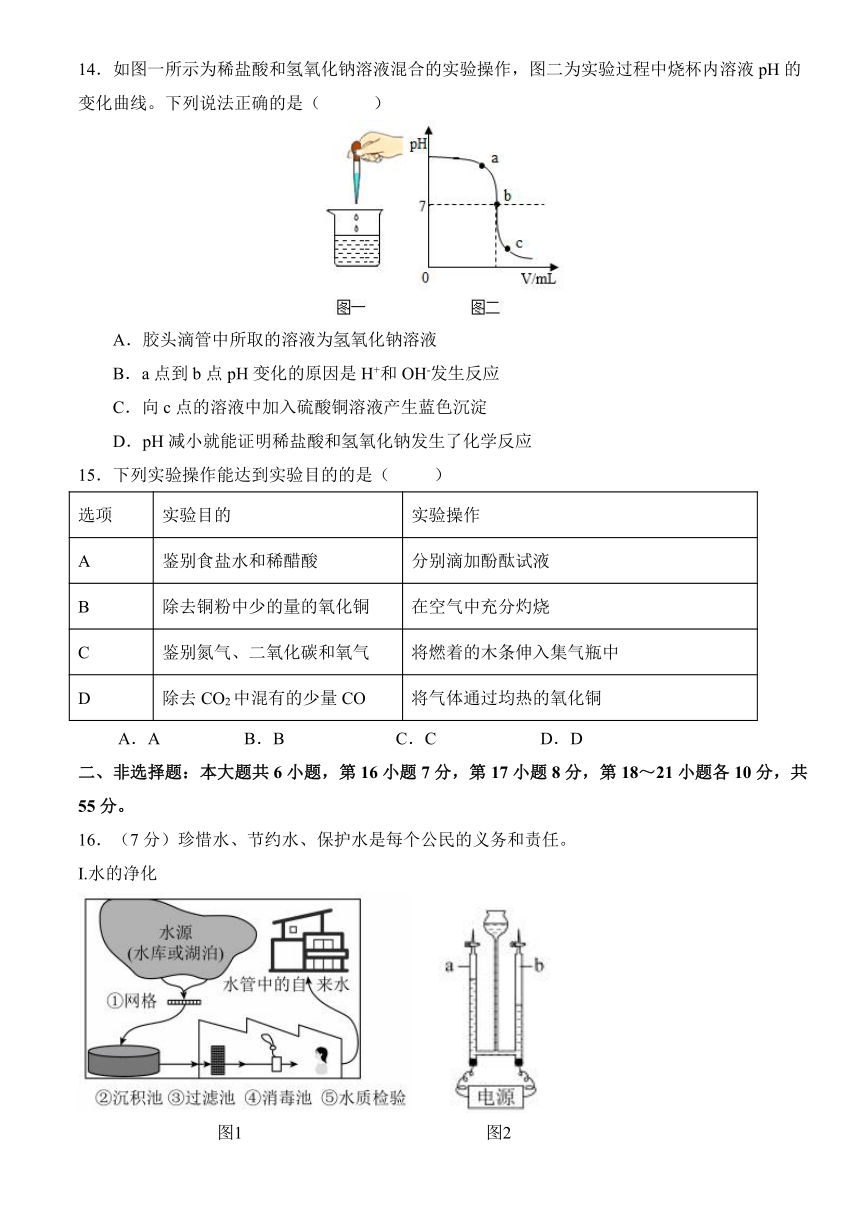
14.如图一所示为稀盐酸和氢氧化钠溶液混合的实验操作,图二为实验过程中烧杯内溶液pH的变化曲线。下列说法正确的是( )
A.胶头滴管中所取的溶液为氢氧化钠溶液
B.a点到b点pH变化的原因是H+和OH-发生反应
C.向c点的溶液中加入硫酸铜溶液产生蓝色沉淀
D.pH减小就能证明稀盐酸和氢氧化钠发生了化学反应
15.下列实验操作能达到实验目的的是( )
选项 实验目的 实验操作
A 鉴别食盐水和稀醋酸 分别滴加酚酞试液
B 除去铜粉中少的量的氧化铜 在空气中充分灼烧
C 鉴别氮气、二氧化碳和氧气 将燃着的木条伸入集气瓶中
D 除去CO2中混有的少量CO 将气体通过均热的氧化铜
A.A B.B C.C D.D
二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
16.(7分)珍惜水、节约水、保护水是每个公民的义务和责任。
I.水的净化
图1 图2
(1)居民饮用水的处理过程如图1所示:步骤①网格净水原理类似于步骤 (填“②”或“③”或“④”序号)。
(2)净水器中含有大量的活性炭可去除异味和余氯,是因为活性炭具有良好的 性。
Ⅱ.水的分解
(3)电解法:宇航员一部分生活用氧可通过电解水制得,如图2是电解水的实验示意图,玻璃管 (填“a”或“b”)中的气体能使带火星的木条复燃。该实验说明水是由 组成的。
(4)光解法:图3为水在一种新型复合光催化剂(C3N4/CQDs)和太阳光作用下分解的原理图。反应I的化学方程式为 。
图3
(5)对比以上两种水的分解方法,图3方案的优点有 (填一个即可)。
17.(8分)【科昔阅读】。
镁在自然界中分布广泛,存在于光卤石(主要成分KCl·MgCl2·6H2O)、菱镁矿(主要成MgCO3)、白云石【主要成分CaMg(CO3)2】等矿石中,海水中也含镁盐。工亚上电解熔融MgC12制取金属镁。镁化学性质比较活泼,与N2、CO2或水都能反应,当镁等活泼金属着火时,不能使用CO2或水扑救。
镁合金被称作21世纪的绿色工程材料,在增强交通工具的架构强度、减轻质量、节药能源、抗冲击与振动等方面具有优势,已大量应用于自行车组件的制造。
镁元素对人体健康有着重要作用,通过对心脏的调节,使心脏的节律和兴奋传导减弱,从而有利于心脏的舒张,还可以保护心血管、防止经脉硬化。人体缺镁可能会出现眩晕、出汗过多、记记力下降等症状。轻度缺镁时,可由饮食或口服补充镁剂,给予氧化镁或用氢氧化镁,为避免腹泻可与氢氧化铝胶联用。
回答下列问题:
(1)下列矿物的主要成分不含镁元素的是 (填标号)。
A.菱镁矿 B.白云石
C.光卤石 D.赤铁矿
(2)如遇镁引起失火,可用 的方法灭火。
(3)镁在CO2中燃烧生成氧化镁和一种黑色单质,该反应的化学方程式为
(4)镁合金在增强交通工具的架构强度、 、节约能源、抗冲击与振动等方面具有优势,可用于制造自行车组件。
(5)人体缺镁可能会出现 (填标号)等症状。
A.眩晕 B.水俣病
C.记忆力下降 D.贫血
(6)写出口服补充镁剂时发生的化学反应的化学方程式 (任写一个)。
18.(10分)【基础实验与跨学科实践】
(1)实验室用装置Ⅰ制取CO2。请你回答有关问题。
(装置I) (装置II)
实验室常用装置Ⅰ中的A和 (填药品名称)制取CO2,其若使用装置Ⅰ中的B作为制取CO2的发生装置。与装置Ⅰ中的A比较,除了充分利用废物的优点外,请写出其他一个优点 ,该装置使用铜丝网面不使用铁丝网盛放固体的原因是 (用化学方程式表示)。若用(装置Ⅰ)中的C来干燥制取的二氧化碳,则气体应从 (填“a”或“b”)口进入。
(2)绿色植物的呼吸作用会产生二氧化碳。小明猜想种子的萌发过程可能也会产生二氧化碳,他设计了如图(装置Ⅱ)的实验装置,打开D装置中的阀门,水位下降,空气就会依次进入装置。
①A装置的作用是 。
②若C装置中观察到 ,则小明的猜想是正确的,该装置中发生反应的化学方程式为 。
③请写出D装置的一个优点 。
19.(10分)【科学探究】松花蛋是我国特有的一种传统美食。课外活动小组的同学对“松花蛋制作”进行了探究。
【探究一】松花蛋的酸碱性
同学们取少量松花蛋粉(用于制作松花蛋泥的原料),加入足量水,搅拌、过滤。在滤液中滴入 ,滤液变红色,证明滤液中含有碱性物质。
【探究二】滤液的碱性物质。
【提出问题】滤液中的碱性物质是什么?
【查阅资料】松花蛋粉中主要含有生石灰、食盐、纯碱(Na2CO3)等。
【分析推理】松花蛋粉加水调和时发生如下反应:
①生石灰与水反应 ,属于 (填“吸热”或“放热”)反应;
② (写化学方程式)。
【提出猜想】
猜想一:只有NaOH;猜想二:有NaOH和Ca(OH)2;猜想三:有 。
【实验探究】
操作 现象 结论
取滤液少许,向其中加入过量的稀盐酸 无明显现象 猜想 不成立
另取滤液少许,向其中加入 溶液 猜想 成立
【项目拓展】为了使松花蛋产生美丽的松花,传统工艺中加入密陀僧(主要成分为氧化铅),目前密陀僧已逐渐被硫酸锌取代,制得无铅松花蛋。从人体健康角度分析这一工艺改进的原因是
。
20.(10分)白云岩矿(含 CaO、MgO)常用于生产 K2SO4 及氮钾复合肥。其流程如下:(10分)
(1)将白云岩矿石粉碎的目的是 ;
(2)操作 a 需要用到的玻璃仪器有:漏斗、玻璃棒、 ,玻璃棒的作用是 。
(3)请你补充完成反应②的化学方程式:CaSO4·2H2O+2NH4HCO3=CaCO3↓+(NH4)2SO4+CO2↑+ ,该反应温度需控制在 60 ℃左右,原因是 。
(4)操作b 步骤是经 、降温结晶、过滤,可得到氮钾复合肥。小明怀疑氮钾复合肥中还含有(NH4)2SO4,于是他取少量该复合肥加入熟石灰研磨,如果产生 ,说明含有 NH4+;往另一份中滴加适量 溶液和稀硝酸,观察到有白色沉淀生成,说明含有 SO42-,写出反应的化学方程式
21.(10分)在研究“酸与碱之间发生中和反应”过程中,取一洁净的锥形瓶,往其中加入25克氢氧化钠溶液,然后逐滴滴入质量分数为7.3%的稀盐酸。
(1)为了获取酸能与碱反应的证据,滴加稀盐酸前,锥形瓶中还需加入的是 。
(2)酸碱发生中和反应的实质就是 。
(2)滴加稀盐酸至ag时恰好完全反应,锥形瓶及溶液总质量随加入稀盐酸质量的变化关系如图所示。
①a的值是 。
②求氢氧化钠溶液中溶质的质量分数。
参考答案
一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
C D B C C D D D B C A B B B D
二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
16. ③ 吸附 a 氢元素和氧元素 2H2O2H2↑+O2↑ 节省能源
17. D 水降低温度 2Mg+CO22MgO + C 减轻质量
AC Mg(OH)2+2HCl=MgCl2+2H2O
18. 块状石灰石、稀盐酸 可以控制反应的发生和停止 Fe+2HCl=FeCl2+H2↑
B 除去空气中的二氧化碳 澄清石灰水变浑浊 CO2+Ca(OH)2=CaCO3↓+H20
可以通过控制水流的速度来控制空气通入的速度
19. 无色酚酞 放热 Ca(OH)2+Na2CO3===CaCO3↓+2NaOH NaOH和Na2CO3 三 碳酸钠
产生白色沉淀 二 既能防止铅中毒,又能补充人体所需的微量元素锌
20.增大接触面积,加快反应速率 烧杯 引流 3H2O 防止NH4HCO3受热分解或加快反应速率
蒸发浓缩 刺激性气味气体或氨臭味 Ba(NO3)2 (NH4)2SO4+ Ba(NO3)2 =BaSO4↓+2NH4NO3
21. 无色酚酞试液 1分 H+和OH﹣结合生成H2O(或H++OH﹣=H2O)1分 20 1分
一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.每年3月22日为“世界水日”。下列图标表示节水标志的是( )
2.下列作用不属于化学变化的是( )
A.植物的光合作用 B.动物呼吸作用
C.氯气的氧化作用 D.活性碳的吸附作用
3.人体健康与体内化学元素含量的多少息息相关、对于14-18岁人群,因摄入不足而引起食欲不振,发育不良的元素是( )
A.硒 B.锌 C.钾 D.氟
4蛋白质能维持人体的生长发育和组织更新。下列食物富含蛋白质的是( )
A.菠菜 B.馒头 C.牛肉 D.苹果
5.青少年的健康问题日益引起人们重视。某学校中考时同学中午的食谱为:米饭、回锅肉、炸鸡块、牛奶,从营养均衡的角度分析,还需要补充的食物是工( )
A.炒蛋 B.清蒸鱼 C.炒西红柿 D.蒸馒头
6.“安全重于泰山”,下列有关化学与安全的说法不正确的是( )
A. 救火时不能贸然打开门窗,以免空气对流火势蔓延
B. 不能向下水道扔烟花爆竹,以防沼气爆炸
C. 进入面粉厂时应严禁烟火,以防粉尘爆炸
D. 液化石油罐泄漏时,要迅速打开排风扇
7.规范的实验操作是安全进行化学实验的保障。下列实验操作中正确的是( )
A.稀释浓硫酸 B.点燃酒精灯 C.倾倒溶液 D.蒸发食盐水
8.下列硫元素的化合价最低的是( )
A.S B.SO2 C.H2SO4 D.H2S
9.下列化学用语中,数字“2”表示的意义正确的是( )
A.2O:2个氧元素
B.O2-:1个氧离子带2个单位负电荷
C.NO2:二氧化氮分子中含有1个氧分子
D.O2:2个氧原子
10.天宫课堂中,航天员王亚平视频展示了在无容器材料实验柜中进行的“锆金属熔化与凝固”实验。下图是锆元素在元素周期表中的信息及原子结构示意图。下列说法错误的是( )
A.锆原子的质子数为40
B.氯化锆的化学式可能为ZrCl2
C.锆元素的相对原子质量为91.22g
D.锆原子在化学反应中容易失去2个电子
选择题组:金属活动性顺序在人类活动中有着广泛的应用,回答11~12题。
11.下列金属中,金属活动性最强的是( )
A.Zn B.Cu C.Fe D.Ag
12.为证明Fe、Cu、Ag三种金属的活动性强弱,下列实验方案能达到目的的是( )
A.将Fe、Cu、Ag分别放入稀盐酸中
B.将Cu分别放入FeCl2、AgNO3溶液中
C.将Cu、Ag分别放入FeSO4溶液中
D.将Fe放入稀盐酸、Cu放入AgNO3溶液中
13.下列各物质的用途与性质对应关系不正确的是 ( )
选项 物质 用途 性质
A 金属铁 制作铁锅 导热性
B 熟石灰 改良酸性土壤 能与一些金属氧化物反应
C 小苏打 治疗胃酸过多 小苏打能与盐酸发生反应
D 稀有气体 制造多种用途的电光源 通电时可以发出不同颜色的光
A.A B.B C.C D.D
14.如图一所示为稀盐酸和氢氧化钠溶液混合的实验操作,图二为实验过程中烧杯内溶液pH的变化曲线。下列说法正确的是( )
A.胶头滴管中所取的溶液为氢氧化钠溶液
B.a点到b点pH变化的原因是H+和OH-发生反应
C.向c点的溶液中加入硫酸铜溶液产生蓝色沉淀
D.pH减小就能证明稀盐酸和氢氧化钠发生了化学反应
15.下列实验操作能达到实验目的的是( )
选项 实验目的 实验操作
A 鉴别食盐水和稀醋酸 分别滴加酚酞试液
B 除去铜粉中少的量的氧化铜 在空气中充分灼烧
C 鉴别氮气、二氧化碳和氧气 将燃着的木条伸入集气瓶中
D 除去CO2中混有的少量CO 将气体通过均热的氧化铜
A.A B.B C.C D.D
二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
16.(7分)珍惜水、节约水、保护水是每个公民的义务和责任。
I.水的净化
图1 图2
(1)居民饮用水的处理过程如图1所示:步骤①网格净水原理类似于步骤 (填“②”或“③”或“④”序号)。
(2)净水器中含有大量的活性炭可去除异味和余氯,是因为活性炭具有良好的 性。
Ⅱ.水的分解
(3)电解法:宇航员一部分生活用氧可通过电解水制得,如图2是电解水的实验示意图,玻璃管 (填“a”或“b”)中的气体能使带火星的木条复燃。该实验说明水是由 组成的。
(4)光解法:图3为水在一种新型复合光催化剂(C3N4/CQDs)和太阳光作用下分解的原理图。反应I的化学方程式为 。
图3
(5)对比以上两种水的分解方法,图3方案的优点有 (填一个即可)。
17.(8分)【科昔阅读】。
镁在自然界中分布广泛,存在于光卤石(主要成分KCl·MgCl2·6H2O)、菱镁矿(主要成MgCO3)、白云石【主要成分CaMg(CO3)2】等矿石中,海水中也含镁盐。工亚上电解熔融MgC12制取金属镁。镁化学性质比较活泼,与N2、CO2或水都能反应,当镁等活泼金属着火时,不能使用CO2或水扑救。
镁合金被称作21世纪的绿色工程材料,在增强交通工具的架构强度、减轻质量、节药能源、抗冲击与振动等方面具有优势,已大量应用于自行车组件的制造。
镁元素对人体健康有着重要作用,通过对心脏的调节,使心脏的节律和兴奋传导减弱,从而有利于心脏的舒张,还可以保护心血管、防止经脉硬化。人体缺镁可能会出现眩晕、出汗过多、记记力下降等症状。轻度缺镁时,可由饮食或口服补充镁剂,给予氧化镁或用氢氧化镁,为避免腹泻可与氢氧化铝胶联用。
回答下列问题:
(1)下列矿物的主要成分不含镁元素的是 (填标号)。
A.菱镁矿 B.白云石
C.光卤石 D.赤铁矿
(2)如遇镁引起失火,可用 的方法灭火。
(3)镁在CO2中燃烧生成氧化镁和一种黑色单质,该反应的化学方程式为
(4)镁合金在增强交通工具的架构强度、 、节约能源、抗冲击与振动等方面具有优势,可用于制造自行车组件。
(5)人体缺镁可能会出现 (填标号)等症状。
A.眩晕 B.水俣病
C.记忆力下降 D.贫血
(6)写出口服补充镁剂时发生的化学反应的化学方程式 (任写一个)。
18.(10分)【基础实验与跨学科实践】
(1)实验室用装置Ⅰ制取CO2。请你回答有关问题。
(装置I) (装置II)
实验室常用装置Ⅰ中的A和 (填药品名称)制取CO2,其若使用装置Ⅰ中的B作为制取CO2的发生装置。与装置Ⅰ中的A比较,除了充分利用废物的优点外,请写出其他一个优点 ,该装置使用铜丝网面不使用铁丝网盛放固体的原因是 (用化学方程式表示)。若用(装置Ⅰ)中的C来干燥制取的二氧化碳,则气体应从 (填“a”或“b”)口进入。
(2)绿色植物的呼吸作用会产生二氧化碳。小明猜想种子的萌发过程可能也会产生二氧化碳,他设计了如图(装置Ⅱ)的实验装置,打开D装置中的阀门,水位下降,空气就会依次进入装置。
①A装置的作用是 。
②若C装置中观察到 ,则小明的猜想是正确的,该装置中发生反应的化学方程式为 。
③请写出D装置的一个优点 。
19.(10分)【科学探究】松花蛋是我国特有的一种传统美食。课外活动小组的同学对“松花蛋制作”进行了探究。
【探究一】松花蛋的酸碱性
同学们取少量松花蛋粉(用于制作松花蛋泥的原料),加入足量水,搅拌、过滤。在滤液中滴入 ,滤液变红色,证明滤液中含有碱性物质。
【探究二】滤液的碱性物质。
【提出问题】滤液中的碱性物质是什么?
【查阅资料】松花蛋粉中主要含有生石灰、食盐、纯碱(Na2CO3)等。
【分析推理】松花蛋粉加水调和时发生如下反应:
①生石灰与水反应 ,属于 (填“吸热”或“放热”)反应;
② (写化学方程式)。
【提出猜想】
猜想一:只有NaOH;猜想二:有NaOH和Ca(OH)2;猜想三:有 。
【实验探究】
操作 现象 结论
取滤液少许,向其中加入过量的稀盐酸 无明显现象 猜想 不成立
另取滤液少许,向其中加入 溶液 猜想 成立
【项目拓展】为了使松花蛋产生美丽的松花,传统工艺中加入密陀僧(主要成分为氧化铅),目前密陀僧已逐渐被硫酸锌取代,制得无铅松花蛋。从人体健康角度分析这一工艺改进的原因是
。
20.(10分)白云岩矿(含 CaO、MgO)常用于生产 K2SO4 及氮钾复合肥。其流程如下:(10分)
(1)将白云岩矿石粉碎的目的是 ;
(2)操作 a 需要用到的玻璃仪器有:漏斗、玻璃棒、 ,玻璃棒的作用是 。
(3)请你补充完成反应②的化学方程式:CaSO4·2H2O+2NH4HCO3=CaCO3↓+(NH4)2SO4+CO2↑+ ,该反应温度需控制在 60 ℃左右,原因是 。
(4)操作b 步骤是经 、降温结晶、过滤,可得到氮钾复合肥。小明怀疑氮钾复合肥中还含有(NH4)2SO4,于是他取少量该复合肥加入熟石灰研磨,如果产生 ,说明含有 NH4+;往另一份中滴加适量 溶液和稀硝酸,观察到有白色沉淀生成,说明含有 SO42-,写出反应的化学方程式
21.(10分)在研究“酸与碱之间发生中和反应”过程中,取一洁净的锥形瓶,往其中加入25克氢氧化钠溶液,然后逐滴滴入质量分数为7.3%的稀盐酸。
(1)为了获取酸能与碱反应的证据,滴加稀盐酸前,锥形瓶中还需加入的是 。
(2)酸碱发生中和反应的实质就是 。
(2)滴加稀盐酸至ag时恰好完全反应,锥形瓶及溶液总质量随加入稀盐酸质量的变化关系如图所示。
①a的值是 。
②求氢氧化钠溶液中溶质的质量分数。
参考答案
一、选择题:本大题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
C D B C C D D D B C A B B B D
二、非选择题:本大题共6小题,第16小题7分,第17小题8分,第18~21小题各10分,共55分。
16. ③ 吸附 a 氢元素和氧元素 2H2O2H2↑+O2↑ 节省能源
17. D 水降低温度 2Mg+CO22MgO + C 减轻质量
AC Mg(OH)2+2HCl=MgCl2+2H2O
18. 块状石灰石、稀盐酸 可以控制反应的发生和停止 Fe+2HCl=FeCl2+H2↑
B 除去空气中的二氧化碳 澄清石灰水变浑浊 CO2+Ca(OH)2=CaCO3↓+H20
可以通过控制水流的速度来控制空气通入的速度
19. 无色酚酞 放热 Ca(OH)2+Na2CO3===CaCO3↓+2NaOH NaOH和Na2CO3 三 碳酸钠
产生白色沉淀 二 既能防止铅中毒,又能补充人体所需的微量元素锌
20.增大接触面积,加快反应速率 烧杯 引流 3H2O 防止NH4HCO3受热分解或加快反应速率
蒸发浓缩 刺激性气味气体或氨臭味 Ba(NO3)2 (NH4)2SO4+ Ba(NO3)2 =BaSO4↓+2NH4NO3
21. 无色酚酞试液 1分 H+和OH﹣结合生成H2O(或H++OH﹣=H2O)1分 20 1分
同课章节目录
