重庆市乌江新高考协作体2023-2024学年高一下学期4月月考试题 化学 (含答案)
文档属性
| 名称 | 重庆市乌江新高考协作体2023-2024学年高一下学期4月月考试题 化学 (含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-10 16:21:14 | ||
图片预览

文档简介
2023-2024学年(下)第一阶段性学业质量联合调研抽测
高一化学试题
(分数:100分,时间:75分钟)
一、单选题
1.下列物质一般情况下不能由单质直接化合而制得的是
A.Cu2S B.FeCl3 C.NO2 D.NH3
2.下列气体中,无色、有毒的是
A.NO2 B.CO C.Cl2 D.CO2
3.具备基本的化学实验技能是进行科学探究的基本保证。下列实验操作中正确的是
A.称取食盐 B.稀释浓硫酸
C.检查气密性 D.点燃酒精灯
4.原电池的正极一定是
A.电子流出的极 B.电子流入的极
C.发生氧化反应的极 D.电极自身参与反应的极
5.在N2+3H2 2NH3的反应中,经一段时间后,NH3的物质的量浓度增加了0.6mol L-1,在此时间内用H2物质的量浓度表示的平均速率为0.45mol/(L s),则反应所经过的时间为
A.0.2s B.1.0s C.1.5s D.2.0s
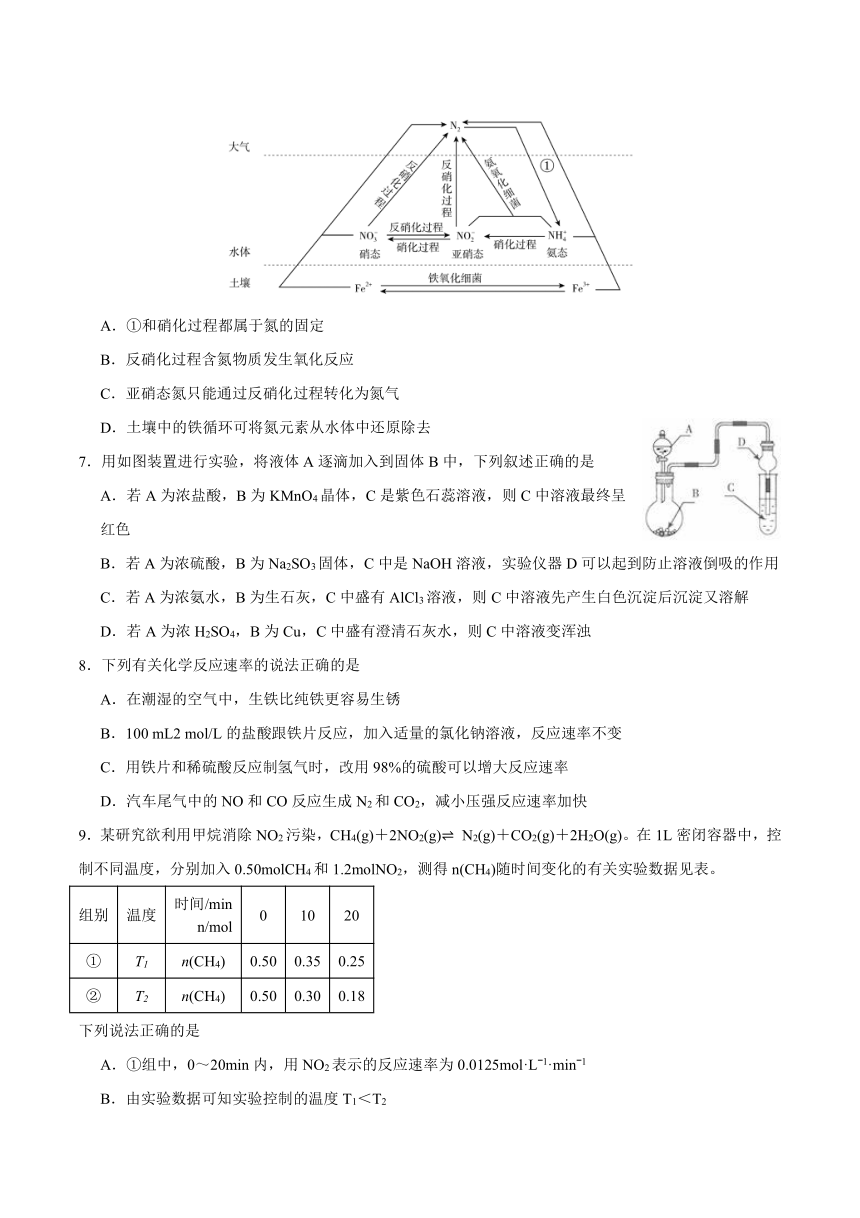
6.细菌可以促使含铁、氮的物质发生氧化还原反应,实现铁、氮两种元素的循环。部分转化如图,下列说法正确的是
A.①和硝化过程都属于氮的固定
B.反硝化过程含氮物质发生氧化反应
C.亚硝态氮只能通过反硝化过程转化为氮气
D.土壤中的铁循环可将氮元素从水体中还原除去
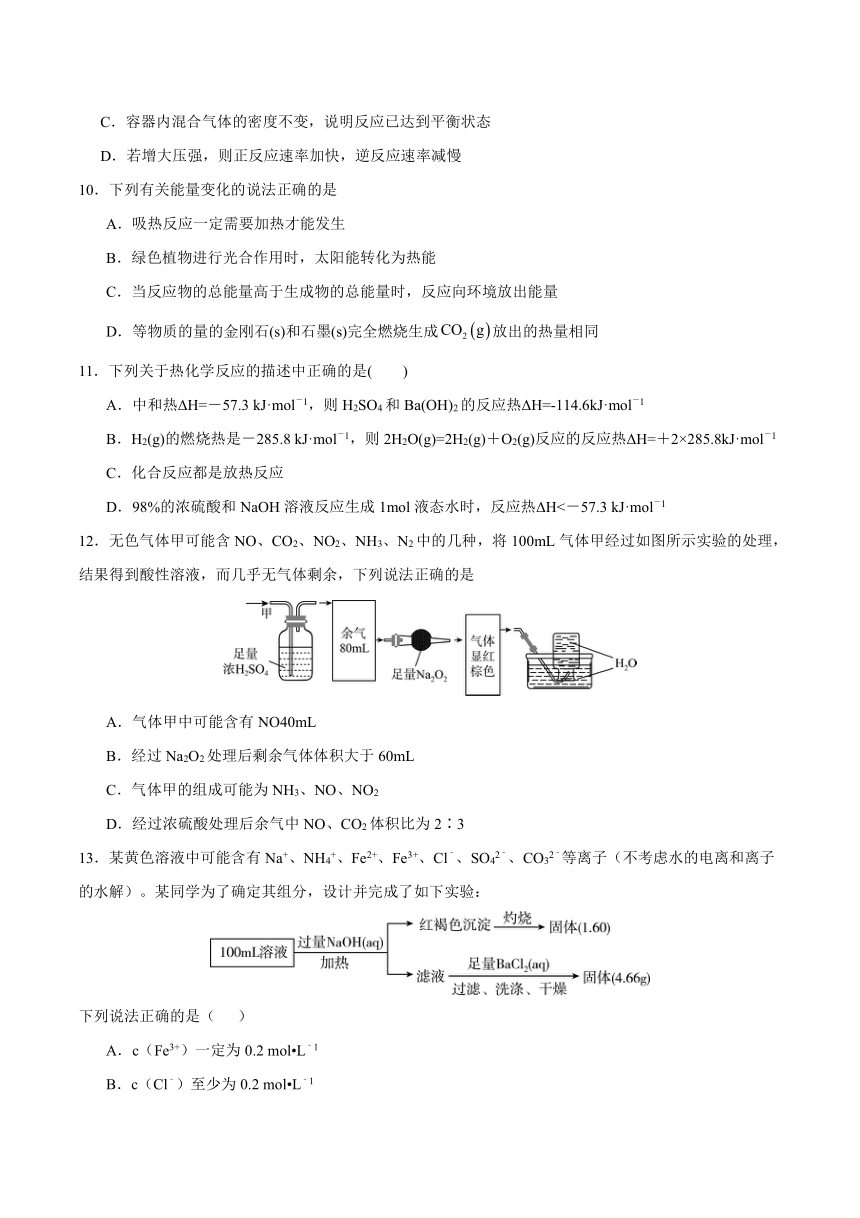
7.用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
A.若A为浓盐酸,B为KMnO4晶体,C是紫色石蕊溶液,则C中溶液最终呈红色
B.若A为浓硫酸,B为Na2SO3固体,C中是NaOH溶液,实验仪器D可以起到防止溶液倒吸的作用
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
8.下列有关化学反应速率的说法正确的是
A.在潮湿的空气中,生铁比纯铁更容易生锈
B.100 mL2 mol/L的盐酸跟铁片反应,加入适量的氯化钠溶液,反应速率不变
C.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以增大反应速率
D.汽车尾气中的NO和CO反应生成N2和CO2,减小压强反应速率加快
9.某研究欲利用甲烷消除NO2污染,CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
组别 温度 时间/min n/mol 0 10 20
① T1 n(CH4) 0.50 0.35 0.25
② T2 n(CH4) 0.50 0.30 0.18
下列说法正确的是
A.①组中,0~20min内,用NO2表示的反应速率为0.0125mol·Lˉ1·minˉ1
B.由实验数据可知实验控制的温度T1<T2
C.容器内混合气体的密度不变,说明反应已达到平衡状态
D.若增大压强,则正反应速率加快,逆反应速率减慢
10.下列有关能量变化的说法正确的是
A.吸热反应一定需要加热才能发生
B.绿色植物进行光合作用时,太阳能转化为热能
C.当反应物的总能量高于生成物的总能量时,反应向环境放出能量
D.等物质的量的金刚石(s)和石墨(s)完全燃烧生成放出的热量相同
11.下列关于热化学反应的描述中正确的是( )
A.中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2的反应热ΔH=-114.6kJ·mol-1
B.H2(g)的燃烧热是-285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)反应的反应热ΔH=+2×285.8kJ·mol-1
C.化合反应都是放热反应
D.98%的浓硫酸和NaOH溶液反应生成1mol液态水时,反应热ΔH<-57.3 kJ·mol-1
12.无色气体甲可能含NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,下列说法正确的是
A.气体甲中可能含有NO40mL
B.经过Na2O2处理后剩余气体体积大于60mL
C.气体甲的组成可能为NH3、NO、NO2
D.经过浓硫酸处理后余气中NO、CO2体积比为2∶3
13.某黄色溶液中可能含有Na+、NH4+、Fe2+、Fe3+、Cl﹣、SO42﹣、CO32﹣等离子(不考虑水的电离和离子的水解)。某同学为了确定其组分,设计并完成了如下实验:
下列说法正确的是( )
A.c(Fe3+)一定为0.2 mol L﹣1
B.c(Cl﹣)至少为0.2 mol L﹣1
C.Na+'、SO42﹣一定存在,NH4+一定不存在
D.Na+、Fe2+可能存在,CO32﹣一定不存在
14.下列溶液中,加入(或通入)某物质后,发生反应的先后顺序正确的是
A.在含等浓度的Fe3+、H+、Cu2+的溶液中加入铁粉: Fe3+、H+、Cu2+
B.在含等浓度的I-、S2-、Br-的溶液中不断通入氯气:I-、Br-、S2-
C.在含等浓度的AlO、CO、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO、CO
D.在含等浓度的Mg2+、H+、NH的溶液中逐渐加入烧碱溶液:Mg2+、NH、H+
二、非选择题
15.绿矾(FeSO4 7H2O)是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为Fe,此外还含有少量Cu、Al,Al2O3和Fe2O3)制备磁性Fe3O4胶体粒子、绿矾和净水剂Na2FeO4的实验流程如图:
请回答下列问题:
(1)试剂X化学式为 。写出加入过量试剂X时所有发生反应的离子方程式 。
(2)铁元素位于元素周期表 。
(3)固体C化学名称为 。溶液D中加入KSCN溶液,无血红色产生,原因是 (用化学方程式表示)。
(4)为得到绿矾晶体需要将溶液D进行 (“蒸发结晶”或“降温结晶”)。
(5)D中加入适量H2O2生成E的离子方程式 。若D中含amolFe2+,则理论上加入 molH2O2可使溶液E中铁元素恰好转化为Fe3O4胶体。
(6)由固体G生成Na2FeO4的离子方程式为 。
16.甲醇(CH3OH)是一种基本的有机化工原料,主要用于塑料、医药、农药、合成蛋白质等工业,工业上常用一氧化碳(CO)和氢气(H2)合成甲醇。一定温度下,在容积为2 L的某恒容密闭容器中充入一氧化碳和氢气两种气体进行反应,反应过程中各成分的相关数据如图所示。
回答下列问题:
(1)该反应的化学方程式为 。
(2)从反应开始至恰好达平衡时间内,CO的消耗速率为 。
(3)反应达平衡时,H2的转化率为 ,容器内CH3OH 与CO的物质的量之比n(CH3OH):n(CO)= 。
(4)下列能说明该反应已达平衡状态的是 (填字母标号)。
a.容器内压强不变 b.v(CO)=v(CH3OH)
c.容器内气体密度不变 d.容器内气体平均相对分子质量不变
17.X、Y、Z、P、Q是原子序数依次增大的短周期主族元素,其中X的一种核素没有中子,Y的单质是空气的主要成分,Z和Q同主族且Q的原子序数是Z的二倍,在短周期元素中P的金属性最强。回答下列问题:
(1)X、Y、Z三种元素的原子半径从大到小的顺序为 (用元素符号表示)。
(2)Y、Z的简单氢化物中较不稳定的是 (填化学式),P和Q的最高价氧化物对应水化物的化学方程式为 。
(3)M是由X、Z两种元素组成的含有10个电子的分子,M的电子式为 ,M分解反应过程中,反应物中化学键断裂吸收的总能量 生成物中化学键形成放出的能量(填“大于”、“小于”或“等于”)。
(4)已知化合物PX与水反应生成氢气,因此可将其用作野外生存的生氢剂。
①该反应的化学方程式为 。
②该反应中的氧化剂是 还原剂是 。
③反应中涉及到化学键的断裂和形成,其中包括 填序号)
a.离子键 b.极性共价键 c.非极性共价键 d.氢键
(5)Z、P、Q三种元素可形成多种盐,实验室预配制460mL2的溶液,需用托盘天平称量固体 g;如下图所示的实验操作的先后顺序为 。
18.物质类别和元素化合价是研究物质性质的两个重要角度。回答下列问题:
Ⅰ.S在不同价态之间的转化:SO2Na2SO3溶液Na2S2O3溶液
(1)反应①的转化说明SO2的类别属于 ;欲制备Na2S2O3溶液,从化合价的角度分析,反应②合理的是 (填标号)。
a.Na2SO3+Na2SO4 b.Na2SO3+S c.Na2SO3+Na2S2O5
Ⅱ.某兴趣小组模拟工业制取Na2S2O3的装置(夹持和加热装置略)如图所示。
(2)装置A中发生反应的化学方程式为 ;装置B的作用为 。
(3)装置C发生的反应有①Na2CO3+SO2 =Na2SO3+CO2;② ……;③Na2SO3+SNa2S2O3,反应②的离子方程式为 ;已知反应③相对较慢,当观察到装置C中出现 的现象,说明反应已完全。为制得纯净的Na2S2O3,应使三颈烧瓶中Na2S和Na2CO3恰好完全反应,则三颈烧瓶中Na2S和Na2CO3物质的量之比应为 。
(4)工业上常用Na2S2O3溶液吸收尾气中的Cl2,氧化产物为SO,发生反应的离子方程式为 ;临床上Na2S2O3可用于氰化物解毒,解毒原理为S2O+CN- = SCN-+SO。体外模拟该解毒实验,检验该转化有SCN-生成的实验操作是 。
2023-2024学年(下)第一阶段性学业质量联合调研抽测
高一化学答案
(分数:100分,时间:75分钟)
1.C 2.B 3.C 4.B 5.D
6.D 7.B 8.A 9.B 10.C
11.D 12.D 13.D 14.C
15.(1) NaOH 2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑、Al(OH)3+OH-=[Al(OH)4]-
(2)第四周期第Ⅷ族
(3) 铜 Fe+Fe2(SO4)3=3FeSO4
(4)降温结晶
(5) 2Fe2++H2O2+2H+=2Fe3++2H2O
(6)2Fe(OH)3+3ClO-+4OH-=2+3Cl-+5H2O
16. CO+2H2CH3OH 0.03mol·L﹣1·min﹣1 60% 3:7 ad
17.(1)N>O>H
(2) NH3 2NaOH+H2SO4=Na2SO4+2H2O
(3) 大于
(4) NaH+H2O=NaOH+H2↑ H2O NaH abc
(5) 142.0 ④⑥②⑤③①
18.(1) 酸性氧化物 b
(2) Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑ 安全瓶,防止倒吸
(3) 2S2-+3SO2 = 2SO+3S↓ 溶液变澄清(或浑浊消失) 2:1
高一化学试题
(分数:100分,时间:75分钟)
一、单选题
1.下列物质一般情况下不能由单质直接化合而制得的是
A.Cu2S B.FeCl3 C.NO2 D.NH3
2.下列气体中,无色、有毒的是
A.NO2 B.CO C.Cl2 D.CO2
3.具备基本的化学实验技能是进行科学探究的基本保证。下列实验操作中正确的是
A.称取食盐 B.稀释浓硫酸
C.检查气密性 D.点燃酒精灯
4.原电池的正极一定是
A.电子流出的极 B.电子流入的极
C.发生氧化反应的极 D.电极自身参与反应的极
5.在N2+3H2 2NH3的反应中,经一段时间后,NH3的物质的量浓度增加了0.6mol L-1,在此时间内用H2物质的量浓度表示的平均速率为0.45mol/(L s),则反应所经过的时间为
A.0.2s B.1.0s C.1.5s D.2.0s
6.细菌可以促使含铁、氮的物质发生氧化还原反应,实现铁、氮两种元素的循环。部分转化如图,下列说法正确的是
A.①和硝化过程都属于氮的固定
B.反硝化过程含氮物质发生氧化反应
C.亚硝态氮只能通过反硝化过程转化为氮气
D.土壤中的铁循环可将氮元素从水体中还原除去
7.用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是
A.若A为浓盐酸,B为KMnO4晶体,C是紫色石蕊溶液,则C中溶液最终呈红色
B.若A为浓硫酸,B为Na2SO3固体,C中是NaOH溶液,实验仪器D可以起到防止溶液倒吸的作用
C.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀后沉淀又溶解
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
8.下列有关化学反应速率的说法正确的是
A.在潮湿的空气中,生铁比纯铁更容易生锈
B.100 mL2 mol/L的盐酸跟铁片反应,加入适量的氯化钠溶液,反应速率不变
C.用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以增大反应速率
D.汽车尾气中的NO和CO反应生成N2和CO2,减小压强反应速率加快
9.某研究欲利用甲烷消除NO2污染,CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g)。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见表。
组别 温度 时间/min n/mol 0 10 20
① T1 n(CH4) 0.50 0.35 0.25
② T2 n(CH4) 0.50 0.30 0.18
下列说法正确的是
A.①组中,0~20min内,用NO2表示的反应速率为0.0125mol·Lˉ1·minˉ1
B.由实验数据可知实验控制的温度T1<T2
C.容器内混合气体的密度不变,说明反应已达到平衡状态
D.若增大压强,则正反应速率加快,逆反应速率减慢
10.下列有关能量变化的说法正确的是
A.吸热反应一定需要加热才能发生
B.绿色植物进行光合作用时,太阳能转化为热能
C.当反应物的总能量高于生成物的总能量时,反应向环境放出能量
D.等物质的量的金刚石(s)和石墨(s)完全燃烧生成放出的热量相同
11.下列关于热化学反应的描述中正确的是( )
A.中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2的反应热ΔH=-114.6kJ·mol-1
B.H2(g)的燃烧热是-285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g)反应的反应热ΔH=+2×285.8kJ·mol-1
C.化合反应都是放热反应
D.98%的浓硫酸和NaOH溶液反应生成1mol液态水时,反应热ΔH<-57.3 kJ·mol-1
12.无色气体甲可能含NO、CO2、NO2、NH3、N2中的几种,将100mL气体甲经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,下列说法正确的是
A.气体甲中可能含有NO40mL
B.经过Na2O2处理后剩余气体体积大于60mL
C.气体甲的组成可能为NH3、NO、NO2
D.经过浓硫酸处理后余气中NO、CO2体积比为2∶3
13.某黄色溶液中可能含有Na+、NH4+、Fe2+、Fe3+、Cl﹣、SO42﹣、CO32﹣等离子(不考虑水的电离和离子的水解)。某同学为了确定其组分,设计并完成了如下实验:
下列说法正确的是( )
A.c(Fe3+)一定为0.2 mol L﹣1
B.c(Cl﹣)至少为0.2 mol L﹣1
C.Na+'、SO42﹣一定存在,NH4+一定不存在
D.Na+、Fe2+可能存在,CO32﹣一定不存在
14.下列溶液中,加入(或通入)某物质后,发生反应的先后顺序正确的是
A.在含等浓度的Fe3+、H+、Cu2+的溶液中加入铁粉: Fe3+、H+、Cu2+
B.在含等浓度的I-、S2-、Br-的溶液中不断通入氯气:I-、Br-、S2-
C.在含等浓度的AlO、CO、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO、CO
D.在含等浓度的Mg2+、H+、NH的溶液中逐渐加入烧碱溶液:Mg2+、NH、H+
二、非选择题
15.绿矾(FeSO4 7H2O)是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为Fe,此外还含有少量Cu、Al,Al2O3和Fe2O3)制备磁性Fe3O4胶体粒子、绿矾和净水剂Na2FeO4的实验流程如图:
请回答下列问题:
(1)试剂X化学式为 。写出加入过量试剂X时所有发生反应的离子方程式 。
(2)铁元素位于元素周期表 。
(3)固体C化学名称为 。溶液D中加入KSCN溶液,无血红色产生,原因是 (用化学方程式表示)。
(4)为得到绿矾晶体需要将溶液D进行 (“蒸发结晶”或“降温结晶”)。
(5)D中加入适量H2O2生成E的离子方程式 。若D中含amolFe2+,则理论上加入 molH2O2可使溶液E中铁元素恰好转化为Fe3O4胶体。
(6)由固体G生成Na2FeO4的离子方程式为 。
16.甲醇(CH3OH)是一种基本的有机化工原料,主要用于塑料、医药、农药、合成蛋白质等工业,工业上常用一氧化碳(CO)和氢气(H2)合成甲醇。一定温度下,在容积为2 L的某恒容密闭容器中充入一氧化碳和氢气两种气体进行反应,反应过程中各成分的相关数据如图所示。
回答下列问题:
(1)该反应的化学方程式为 。
(2)从反应开始至恰好达平衡时间内,CO的消耗速率为 。
(3)反应达平衡时,H2的转化率为 ,容器内CH3OH 与CO的物质的量之比n(CH3OH):n(CO)= 。
(4)下列能说明该反应已达平衡状态的是 (填字母标号)。
a.容器内压强不变 b.v(CO)=v(CH3OH)
c.容器内气体密度不变 d.容器内气体平均相对分子质量不变
17.X、Y、Z、P、Q是原子序数依次增大的短周期主族元素,其中X的一种核素没有中子,Y的单质是空气的主要成分,Z和Q同主族且Q的原子序数是Z的二倍,在短周期元素中P的金属性最强。回答下列问题:
(1)X、Y、Z三种元素的原子半径从大到小的顺序为 (用元素符号表示)。
(2)Y、Z的简单氢化物中较不稳定的是 (填化学式),P和Q的最高价氧化物对应水化物的化学方程式为 。
(3)M是由X、Z两种元素组成的含有10个电子的分子,M的电子式为 ,M分解反应过程中,反应物中化学键断裂吸收的总能量 生成物中化学键形成放出的能量(填“大于”、“小于”或“等于”)。
(4)已知化合物PX与水反应生成氢气,因此可将其用作野外生存的生氢剂。
①该反应的化学方程式为 。
②该反应中的氧化剂是 还原剂是 。
③反应中涉及到化学键的断裂和形成,其中包括 填序号)
a.离子键 b.极性共价键 c.非极性共价键 d.氢键
(5)Z、P、Q三种元素可形成多种盐,实验室预配制460mL2的溶液,需用托盘天平称量固体 g;如下图所示的实验操作的先后顺序为 。
18.物质类别和元素化合价是研究物质性质的两个重要角度。回答下列问题:
Ⅰ.S在不同价态之间的转化:SO2Na2SO3溶液Na2S2O3溶液
(1)反应①的转化说明SO2的类别属于 ;欲制备Na2S2O3溶液,从化合价的角度分析,反应②合理的是 (填标号)。
a.Na2SO3+Na2SO4 b.Na2SO3+S c.Na2SO3+Na2S2O5
Ⅱ.某兴趣小组模拟工业制取Na2S2O3的装置(夹持和加热装置略)如图所示。
(2)装置A中发生反应的化学方程式为 ;装置B的作用为 。
(3)装置C发生的反应有①Na2CO3+SO2 =Na2SO3+CO2;② ……;③Na2SO3+SNa2S2O3,反应②的离子方程式为 ;已知反应③相对较慢,当观察到装置C中出现 的现象,说明反应已完全。为制得纯净的Na2S2O3,应使三颈烧瓶中Na2S和Na2CO3恰好完全反应,则三颈烧瓶中Na2S和Na2CO3物质的量之比应为 。
(4)工业上常用Na2S2O3溶液吸收尾气中的Cl2,氧化产物为SO,发生反应的离子方程式为 ;临床上Na2S2O3可用于氰化物解毒,解毒原理为S2O+CN- = SCN-+SO。体外模拟该解毒实验,检验该转化有SCN-生成的实验操作是 。
2023-2024学年(下)第一阶段性学业质量联合调研抽测
高一化学答案
(分数:100分,时间:75分钟)
1.C 2.B 3.C 4.B 5.D
6.D 7.B 8.A 9.B 10.C
11.D 12.D 13.D 14.C
15.(1) NaOH 2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑、Al(OH)3+OH-=[Al(OH)4]-
(2)第四周期第Ⅷ族
(3) 铜 Fe+Fe2(SO4)3=3FeSO4
(4)降温结晶
(5) 2Fe2++H2O2+2H+=2Fe3++2H2O
(6)2Fe(OH)3+3ClO-+4OH-=2+3Cl-+5H2O
16. CO+2H2CH3OH 0.03mol·L﹣1·min﹣1 60% 3:7 ad
17.(1)N>O>H
(2) NH3 2NaOH+H2SO4=Na2SO4+2H2O
(3) 大于
(4) NaH+H2O=NaOH+H2↑ H2O NaH abc
(5) 142.0 ④⑥②⑤③①
18.(1) 酸性氧化物 b
(2) Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑ 安全瓶,防止倒吸
(3) 2S2-+3SO2 = 2SO+3S↓ 溶液变澄清(或浑浊消失) 2:1
同课章节目录
