实验活动 简单配合物的形成 学案 (含答案)2023-2024学年高二化学人教版(2019)选择性必修第二册
文档属性
| 名称 | 实验活动 简单配合物的形成 学案 (含答案)2023-2024学年高二化学人教版(2019)选择性必修第二册 |
|
|
| 格式 | docx | ||
| 文件大小 | 79.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-10 00:00:00 | ||
图片预览


文档简介
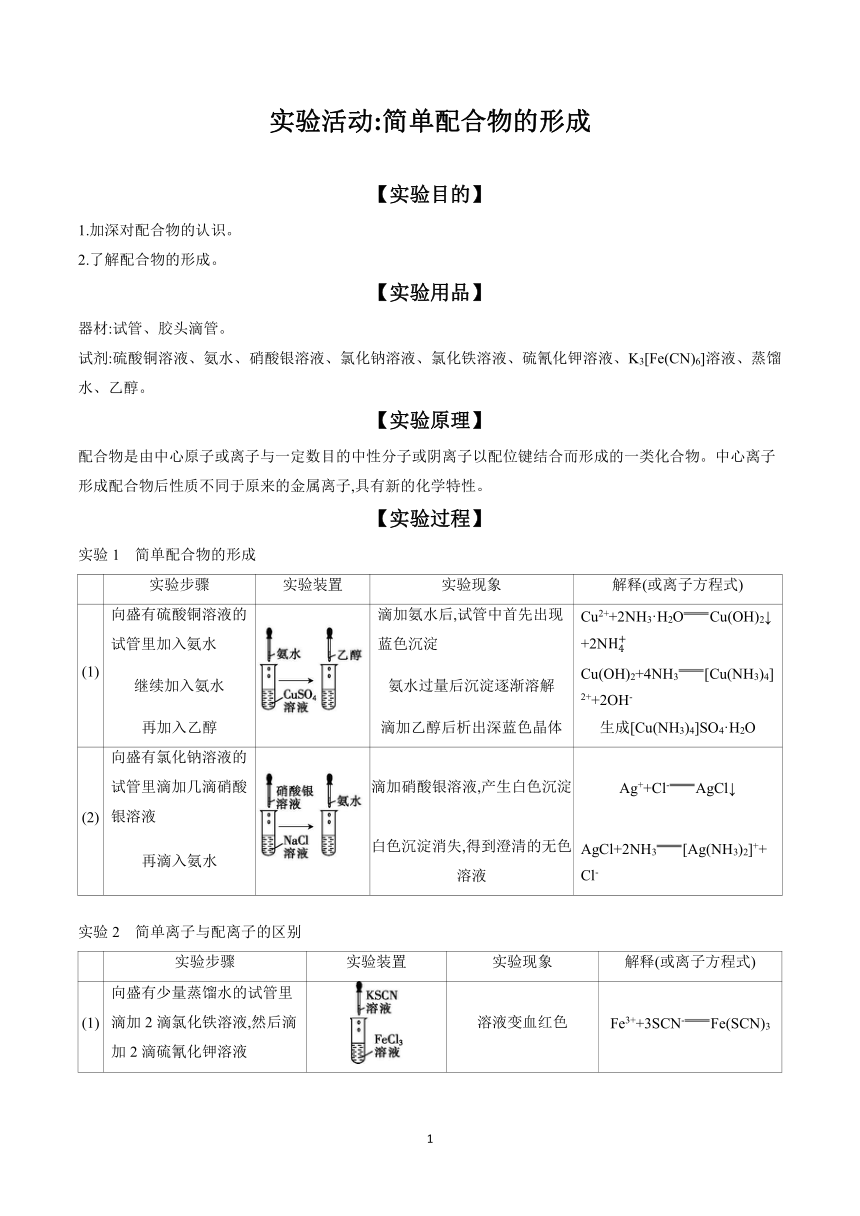
实验活动:简单配合物的形成
【实验目的】
1.加深对配合物的认识。
2.了解配合物的形成。
【实验用品】
器材:试管、胶头滴管。
试剂:硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯化铁溶液、硫氰化钾溶液、K3[Fe(CN)6]溶液、蒸馏水、乙醇。
【实验原理】
配合物是由中心原子或离子与一定数目的中性分子或阴离子以配位键结合而形成的一类化合物。中心离子形成配合物后性质不同于原来的金属离子,具有新的化学特性。
【实验过程】
实验1 简单配合物的形成
实验步骤 实验装置 实验现象 解释(或离子方程式)
(1) 向盛有硫酸铜溶液的试管里加入氨水 滴加氨水后,试管中首先出现蓝色沉淀 Cu2++2NH3·H2OCu(OH)2↓+2N
继续加入氨水 氨水过量后沉淀逐渐溶解 Cu(OH)2+4NH3[Cu(NH3)4]2++2OH-
再加入乙醇 滴加乙醇后析出深蓝色晶体 生成[Cu(NH3)4]SO4·H2O
(2) 向盛有氯化钠溶液的试管里滴加几滴硝酸银溶液 滴加硝酸银溶液,产生白色沉淀 Ag++Cl-AgCl↓
再滴入氨水 白色沉淀消失,得到澄清的无色溶液 AgCl+2NH3[Ag(NH3)2]++Cl-
实验2 简单离子与配离子的区别
实验步骤 实验装置 实验现象 解释(或离子方程式)
(1) 向盛有少量蒸馏水的试管里滴加2滴氯化铁溶液,然后滴加2滴硫氰化钾溶液 溶液变血红色 Fe3++3SCN-Fe(SCN)3
(2) 向盛有少量蒸馏水的试管里滴加2滴K3[Fe(CN)6]溶液,然后滴加2滴硫氰化钾溶液 溶液不变色 —
【问题讨论】
1.K3[Fe(CN)6]在水中可以电离出配离子[Fe(CN)6]3-,该配离子的中心离子、配体是什么 配位数是多少
【答案】配离子[Fe(CN)6]3-的中心离子为Fe3+,配体是CN-,配位数是6。
2.K3[Fe(CN)6]和Fe3+的性质一样吗
【答案】不一样。配离子是由多个离子、原子或中性物质通过配位键形成的,它不是单一的一种离子,和简单离子有区别。
3.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因。
【答案】可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成[Zn(NH3)4]2+,氨水的用量不易控制。
注意事项:配离子与简单离子的区别
1.配离子很少电离,而简单离子可以大量存在于溶液中,由于配离子无法电离出大量简单离子,所以离子的性质显现不出来。
2.物理性质的区别:比如铜离子本身无色,但是水合铜离子显蓝色,氨合铜离子显深蓝色,其化学性质基本保持不变。
3.组成元素不同:配离子由多种元素组成,简单离子则是由单一元素组成。
4.元素之间的连接键不同:配离子是由中心离子或原子与配体键合形成的,而简单离子则没有配体。
5.构成不同:配离子由中心离子或原子和配体构成,简单离子则由原子失去或得到电子形成。
【迁移应用】
1.下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是( )。
A.配体为水分子,外界为Br-
B.中心离子的配位数为6
C.中心离子Cr3+提供孤电子对
D.中心离子的化合价为+2
【答案】B
【解析】[Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-,Cr3+提供空轨道。
2.Co(NH3)5BrSO4可形成两种配位数为6的钴的配合物。在第一种配合物的溶液中加入BaCl2溶液时,有白色沉淀产生,则该配合物的化学式为 ,反应的离子方程式为 ;
在第二种配合物的溶液中加入BaCl2溶液时,没有明显现象,若加入AgNO3溶液时,有淡黄色沉淀生成,则该配合物的化学式为 ,反应的离子方程式为 。
【答案】[Co(NH3)5Br]SO4 S+Ba2+BaSO4↓ [Co(SO4)(NH3)5]Br Ag++Br-AgBr↓
【解析】在第一种配合物的溶液中加入BaCl2溶液时,产生的白色沉淀是BaSO4,说明S处于该配合物的外界;在第二种配合物的溶液中加入BaCl2溶液时,没有明显现象,加入AgNO3溶液生成AgBr沉淀,说明S在内界,Br-在外界。
3.(1)在配合物[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ,画出配合物离子[Cu(NH3)4]2+中的配位键: 。
(2)H3O+的空间结构为 ,BCl3的空间结构为 。
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种):正四面体形分子 ,三角锥形分子 ,V形分子 。
【答案】(1)Fe3+
(2)三角锥形 平面三角形
(3)CH4(或CF4) NH3(或NF3) H2O
【解析】(1)在配合物[Fe(SCN)]2+中,Fe3+提供空轨道,SCN-提供孤电子对;在配合物[Cu(NH3)4]2+中,Cu2+提供空轨道,NH3提供孤电子对,其成键情况为。(2)H3O+的中心原子O以sp3方式杂化,但有一对孤电子对,故H3O+呈三角锥形。BCl3中心原子B以sp2方式杂化,没有孤电子对,故BCl3分子呈平面三角形。
4.配位键是一种特殊的共价键,即共用电子对由某原子单方面提供并与另一缺电子的微粒结合。如N就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列微粒中可能存在配位键的是 (填字母)。
A.CO2 B.H3O+ C.CH4 D.NH3
(2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式: 。
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了两种观点:
甲:O 乙:H—O—O—H
式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应,生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中反应的化学方程式为 。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:
。
【答案】(1)B
(2)H3BO3+H2OH++[B(OH)4]-
(3)①+H2C2H5OC2H5+H2O
②用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)
【解析】(1)配位键形成的条件是一方提供孤电子对,另一方提供空轨道,在H3O+中,H2O分子提供孤电子对时,H+提供空轨道,两者形成配位键。(2)硼原子为缺电子原子,H3BO3的电离是B原子和水中的OH-形成配位键,水产生的H+表现出酸性。(3)根据题中所含配位键的物质的反应特点分析。
2
【实验目的】
1.加深对配合物的认识。
2.了解配合物的形成。
【实验用品】
器材:试管、胶头滴管。
试剂:硫酸铜溶液、氨水、硝酸银溶液、氯化钠溶液、氯化铁溶液、硫氰化钾溶液、K3[Fe(CN)6]溶液、蒸馏水、乙醇。
【实验原理】
配合物是由中心原子或离子与一定数目的中性分子或阴离子以配位键结合而形成的一类化合物。中心离子形成配合物后性质不同于原来的金属离子,具有新的化学特性。
【实验过程】
实验1 简单配合物的形成
实验步骤 实验装置 实验现象 解释(或离子方程式)
(1) 向盛有硫酸铜溶液的试管里加入氨水 滴加氨水后,试管中首先出现蓝色沉淀 Cu2++2NH3·H2OCu(OH)2↓+2N
继续加入氨水 氨水过量后沉淀逐渐溶解 Cu(OH)2+4NH3[Cu(NH3)4]2++2OH-
再加入乙醇 滴加乙醇后析出深蓝色晶体 生成[Cu(NH3)4]SO4·H2O
(2) 向盛有氯化钠溶液的试管里滴加几滴硝酸银溶液 滴加硝酸银溶液,产生白色沉淀 Ag++Cl-AgCl↓
再滴入氨水 白色沉淀消失,得到澄清的无色溶液 AgCl+2NH3[Ag(NH3)2]++Cl-
实验2 简单离子与配离子的区别
实验步骤 实验装置 实验现象 解释(或离子方程式)
(1) 向盛有少量蒸馏水的试管里滴加2滴氯化铁溶液,然后滴加2滴硫氰化钾溶液 溶液变血红色 Fe3++3SCN-Fe(SCN)3
(2) 向盛有少量蒸馏水的试管里滴加2滴K3[Fe(CN)6]溶液,然后滴加2滴硫氰化钾溶液 溶液不变色 —
【问题讨论】
1.K3[Fe(CN)6]在水中可以电离出配离子[Fe(CN)6]3-,该配离子的中心离子、配体是什么 配位数是多少
【答案】配离子[Fe(CN)6]3-的中心离子为Fe3+,配体是CN-,配位数是6。
2.K3[Fe(CN)6]和Fe3+的性质一样吗
【答案】不一样。配离子是由多个离子、原子或中性物质通过配位键形成的,它不是单一的一种离子,和简单离子有区别。
3.锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因。
【答案】可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中,生成[Zn(NH3)4]2+,氨水的用量不易控制。
注意事项:配离子与简单离子的区别
1.配离子很少电离,而简单离子可以大量存在于溶液中,由于配离子无法电离出大量简单离子,所以离子的性质显现不出来。
2.物理性质的区别:比如铜离子本身无色,但是水合铜离子显蓝色,氨合铜离子显深蓝色,其化学性质基本保持不变。
3.组成元素不同:配离子由多种元素组成,简单离子则是由单一元素组成。
4.元素之间的连接键不同:配离子是由中心离子或原子与配体键合形成的,而简单离子则没有配体。
5.构成不同:配离子由中心离子或原子和配体构成,简单离子则由原子失去或得到电子形成。
【迁移应用】
1.下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是( )。
A.配体为水分子,外界为Br-
B.中心离子的配位数为6
C.中心离子Cr3+提供孤电子对
D.中心离子的化合价为+2
【答案】B
【解析】[Cr(H2O)4Br2]Br·2H2O中内界为[Cr(H2O)4Br2]+,Cr3+为中心离子,配体为H2O、Br-,配位数为6,外界为Br-,Cr3+提供空轨道。
2.Co(NH3)5BrSO4可形成两种配位数为6的钴的配合物。在第一种配合物的溶液中加入BaCl2溶液时,有白色沉淀产生,则该配合物的化学式为 ,反应的离子方程式为 ;
在第二种配合物的溶液中加入BaCl2溶液时,没有明显现象,若加入AgNO3溶液时,有淡黄色沉淀生成,则该配合物的化学式为 ,反应的离子方程式为 。
【答案】[Co(NH3)5Br]SO4 S+Ba2+BaSO4↓ [Co(SO4)(NH3)5]Br Ag++Br-AgBr↓
【解析】在第一种配合物的溶液中加入BaCl2溶液时,产生的白色沉淀是BaSO4,说明S处于该配合物的外界;在第二种配合物的溶液中加入BaCl2溶液时,没有明显现象,加入AgNO3溶液生成AgBr沉淀,说明S在内界,Br-在外界。
3.(1)在配合物[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ,画出配合物离子[Cu(NH3)4]2+中的配位键: 。
(2)H3O+的空间结构为 ,BCl3的空间结构为 。
(3)按要求写出由第二周期元素为中心原子,通过sp3杂化形成中性分子的化学式(各写一种):正四面体形分子 ,三角锥形分子 ,V形分子 。
【答案】(1)Fe3+
(2)三角锥形 平面三角形
(3)CH4(或CF4) NH3(或NF3) H2O
【解析】(1)在配合物[Fe(SCN)]2+中,Fe3+提供空轨道,SCN-提供孤电子对;在配合物[Cu(NH3)4]2+中,Cu2+提供空轨道,NH3提供孤电子对,其成键情况为。(2)H3O+的中心原子O以sp3方式杂化,但有一对孤电子对,故H3O+呈三角锥形。BCl3中心原子B以sp2方式杂化,没有孤电子对,故BCl3分子呈平面三角形。
4.配位键是一种特殊的共价键,即共用电子对由某原子单方面提供并与另一缺电子的微粒结合。如N就是由NH3(氮原子提供电子对)和H+(缺电子)通过配位键形成的。据此,回答下列问题:
(1)下列微粒中可能存在配位键的是 (填字母)。
A.CO2 B.H3O+ C.CH4 D.NH3
(2)硼酸(H3BO3)溶液呈酸性,试写出其电离方程式: 。
(3)科学家对H2O2结构的认识经历了较为漫长的过程,最初,科学家提出了两种观点:
甲:O 乙:H—O—O—H
式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂。化学家为研究H2O2的结构,设计并完成了下列实验:
a.将C2H5OH与浓H2SO4反应,生成(C2H5)2SO4和水;
b.将制得的(C2H5)2SO4与H2O2反应,只生成A和H2SO4;
c.将生成的A与H2反应(已知该反应中H2作还原剂)。
①如果H2O2的结构如甲所示,实验c中反应的化学方程式为 。
②为了进一步确定H2O2的结构,还需要在实验c后添加一步实验d,请设计d的实验方案:
。
【答案】(1)B
(2)H3BO3+H2OH++[B(OH)4]-
(3)①+H2C2H5OC2H5+H2O
②用无水硫酸铜检验c的反应产物中有没有水(或其他合理答案)
【解析】(1)配位键形成的条件是一方提供孤电子对,另一方提供空轨道,在H3O+中,H2O分子提供孤电子对时,H+提供空轨道,两者形成配位键。(2)硼原子为缺电子原子,H3BO3的电离是B原子和水中的OH-形成配位键,水产生的H+表现出酸性。(3)根据题中所含配位键的物质的反应特点分析。
2
