化学人教版(2019)必修第一册1.3.2氧化剂和还原剂(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.2氧化剂和还原剂(共27张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 581.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-10 22:39:36 | ||
图片预览






文档简介
(共27张PPT)
第2课时 氧化剂和还原剂
第三节 氧化还原反应
红酒中添加SO2具有抗氧化的作用
食品包装中的脱氧剂——还原铁粉
课前导入
为什么?
二氧化硫是一种空气污染物,为什么要在红酒中添加呢?二氧化硫在红酒中起到什么作用呢?
H2 + CuO === H2O + Cu
+2
0
0
+1
氧化反应
化合价升高
化合价降低
失电子
得电子
还原剂
氧化剂
氧化产物
还原产物
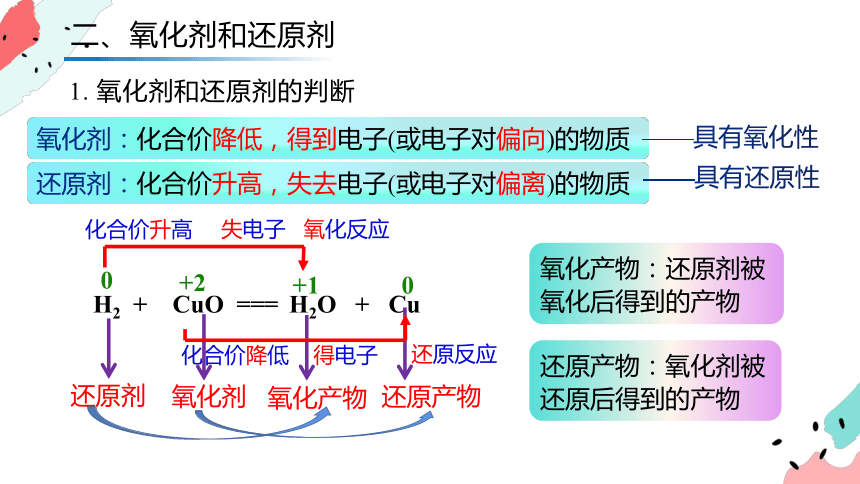
氧化剂:化合价降低,得到电子(或电子对偏向)的物质
还原剂:化合价升高,失去电子(或电子对偏离)的物质
氧化产物:还原剂被氧化后得到的产物
还原产物:氧化剂被还原后得到的产物
二、氧化剂和还原剂
1. 氧化剂和还原剂的判断
——具有氧化性
——具有还原性
还原反应
(1)2H2+O2 === 2H2O
(2)4P+5O2 === 2P2O5
(3)Fe+H2SO4 === FeSO4+H2↑
(4)2HgO === 2Hg+O2↑
点燃
加热
点燃
氧化剂:O2 还原剂:H2 氧化产物和还原产物都是H2O
氧化剂:O2 还原剂:P 氧化产物和还原产物都是P2O5
氧化剂:H2SO4 还原剂:Fe
氧化产物:FeSO4 还原产物:H2
氧化剂、还原剂都是HgO 氧化产物:O2 还原产物:Hg
练一练:分析下列氧化还原反应中元素化合价的变化情况,指出氧化剂和还原剂,氧化产物和还原产物。
某种物质有两种“身份”
(5)MnO2 + 4HCl === MnCl2+Cl2↑+2H2O
△
(6)2KMnO4 === K2MnO4+MnO2+O2↑
△
(氧化剂:MnO2,还原剂:HCl,氧化产物:Cl2,还原产物:MnCl2)
某种物质没有“身份”
(氧化剂:KMnO4,还原剂:KMnO4,氧化产物:O2,
还原产物:K2MnO4和MnO2)
某些物质“身份”相同
氧化剂 + 还原剂 === 还原产物 + 氧化产物
化合价降低,得电子,被还原(发生还原反应)
化合价升高,失电子,被氧化(发生氧化反应)
构建氧化还原反应概念模型:
升失氧化——还原剂
降得还原——氧化剂
口诀:
元素被氧化,物质发生氧化反应,得到氧化产物
元素被还原,物质发生还原反应,得到还原产物
(氧化性)
(还原性)
2. 氧化性与还原性
(1)氧化性与还原性
氧化性:氧化剂表现出的得电子的性质
还原性:还原剂表现出的失电子的性质
(2)氧化性、还原性与化合价的关系
元素处于最高价态时,只有氧化性;
元素处于中间价态时,既有氧化性又有还原性;
元素处于最低价态时,只有还原性。
然而,化合价只能判断氧化性、还原性的有无,无法判断其强弱。
3. 常见氧化剂与还原剂
(1)常见氧化剂
活泼非金属单质
如:O2,Cl2,F2,Br2,I2 ,S等
高价金属阳离子
如:Fe3+,Cu2+等
高价态含氧酸
如:HNO3,浓H2SO4
高价或较高价的其他含氧化合物
如:MnO2,K2Cr2O7,KMnO4等
过氧化物
如:H2O2,Na2O2 等
(2)常见还原剂
金属单质
如:Na、Mg、Al、Fe、Zn 等
部分非金属单质
如:H2,C,S 等
低价态金属阳离子
如:Cu+、Fe2+ 等
含低价态元素的
化合物
如:HCl,H2S,HI ,CO,SO2 ,SO32-等
对点练习1. 下列变化中需要加入还原剂才能实现的是( )
A.MnSO4→KMnO4 B.NaCl→AgCl
C.NO2→HNO3 D.Fe2O3→Fe
D
B
对点练习2. 我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe + CuSO4 === Cu + FeSO4。说法正确的是( )
A.Fe被还原 B.Fe是还原剂
C.CuSO4发生氧化反应 D.CuSO4失去电子
氧化性、还原性的强弱与得失电子的数目有关吗?
[思考]
氧化性、还原性的强弱在于得失电子能力的强弱,而不在于得失电子数目的多少
4. 氧化性与还原性的比较
氧化性:物质得电子的能力
还原性:物质失电子的能力
(1)根据氧化还原反应判断
氧化剂 + 还原剂 === 还原产物 + 氧化产物
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
Fe + Cu2+ === Fe2+ + Cu
氧化性:Cu2+ > Fe2+
还原性:Fe> Cu
核心:从氧化还原反应关系判断,两剂大于两产物
(2)根据反应条件判断
MnO2 + 4HCl(浓) === MnCl2 + 2H2O + Cl2↑
△
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
反应简单程度:不加热 > 加热
氧化性: KMnO4 > MnO2
一般来说,反应条件越容易,反应程度越激烈,则得失电子越容易,其对应的性质越强。
(3)根据被氧化或被还原的程度判断
2Fe + 3Cl2 === 2FeCl3
点燃
Fe + S === FeS
△
0 → +3
0 → +2
铁元素被氧化程度:Cl2> S
氧化性: Cl2> S
HCl + H2SO4(浓) = 不反应
2HBr + H2SO4(浓)== Br2 + SO2↑ + 2H2O
8HI + H2SO4(浓)== 4I2 + H2S↑ + 4H2O
+6 → +4
+6 → -2
硫元素被还原的程度:HI > HBr>HCl
还原性: HI > HBr>HCl
不同氧化剂和同一还原剂反应,氧化产物价态高,该氧化剂氧化性强;
不同还原剂和同一氧化剂反应,还原产物价态低,该还原剂还原性强。
失电子能力逐渐减弱,还原性逐渐减弱
其对应阳离子得电子能力逐渐增强,氧化性逐渐增强
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+(Fe3+) Hg2+ Ag+
(4)根据元素的活动性顺序判断
① 根据金属活动顺序判断
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
F2 Cl2 Br2 I2 S
F- Cl- Br- I- S2-
氧化性逐渐减弱
对应阴离子的还原性逐渐增强
② 根据非金属活动顺序判断
(5)根据外界条件判断
①浓度:一般而言,同一种物质浓度越大,氧化性(或还原性)越强。
如氧化性浓H2SO4>稀 H2SO4,浓HNO3>稀HNO3,还原性浓HCl>稀HCl。
②温度:同一种物质温度越高,其氧化性(还原性)越强。
如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
③酸碱性: 如酸性条件2MnO4-+6H++5SO32- == 2Mn2++5SO42- +3H2O
中性条件2MnO4-+H2O+3SO32- ==2MnO2↓+3SO42- +2OH-
碱性条件2MnO4-+2OH-+SO32- == 2MnO42-+SO42- +H2O
其氧化性为KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)。
对点练习3. 已知H2能与Cl2、Br2发生反应,前者反应的条件是点燃或光照,后者反应的条件是高温,Cl2和Br2的氧化性强弱关系是________。
Cl2>Br2
对点练习4. 把少量铁粉加入硝酸铜和硝酸银的混合溶液中,结果只有银白色物质析出,Ag+和Cu2+的氧化性强弱关系为________________。
Ag+>Cu2+
5. 氧化还原反应的基本规律及应用
(1)守恒规律:
(2)强弱规律:
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
化合价升高数目=失去电子数
化合价降低数目=得到电子数
得失电子守恒:在任何氧化还原反应中,还原剂失电子总数 = 氧化剂得电子总数 (化合价升降总数相等)
(3) 价态规律:
元素处于最高价,只有氧化性;最低价,只有还原性;中间价,既有氧化性又有还原性。
② 归中规律:
① 氧化性和还原性的确定:
同种元素不同价态之间发生氧化还原反应时,元素的化合价只靠拢,不交叉。
如 KClO3+6HCl = KCl+3Cl2↑+3H2O还原产物的判断
在氧化还原反应中,若氧化和还原发生在同一物质中的同一元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。
③ 歧化规律:
如 Cl2 + 2NaOH = NaCl + NaClO + H2O
多种氧化剂和一种还原剂的反应,氧化性强的优先反应;
多种还原剂和一种氧化剂的反应,还原性强的优先反应。
(4)先后规律:
如:在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性Fe3+>Cu2+>H+,所以铁粉依次与Fe3+、Cu2+、H+反应。
三、氧化还原反应方程式的配平
1. 一般配平:得失电子守恒法
配平步骤:
(1)写出反应物和生成物的化学式,标出价态发生变化的元素的化合价;
(2)标出反应前后元素化合价的变化;
(3)依据得失电子守恒,使化合价升降总数相等,并确定相应物质的化学计量数;
(4)用观察法配平其他物质;
(5)检查质量是否守恒,电荷是否守恒。
配平后,单线变等号。
例:
(1)KMnO4+H2O2+H2SO4 -- MnSO4+K2SO4+H2O+O2
(2)Cl2+KOH – KCl+KClO3+H2O
(3)MnO4-+SO32-+H+ -- Mn2++SO42-+H2O
2.缺项配平:
例:Mn2++S2O82- +H2O—SO42- +MnO4- +_____
答案:2、5、8、10、2、16H+
课堂小结:
1. 氧化剂与还原剂
氧化剂:得电子,化合价升高,发生还原反应,被还原的物质
还原剂:失电子,化合价降低,发生氧化反应,被氧化的物质
2. 氧化性与还原性
氧化性:得电子的能力
还原性:失电子的能力
3. 氧化性与还原性的比较
核心:从氧化还原反应关系判断,两剂大于两产物
规律:反应条件、反应结果、物质活泼性规律
4. 氧化还原反应的基本规律及应用
1. 在下列反应中,二氧化碳作氧化剂的是 ( )
A. Ca(OH)2+CO2 === CaCO3↓+H2O
B. CO2+C 2CO
C. 2Fe2O3+3C 4Fe+3CO2↑
D. C+2H2O(g) 2H2+CO2
B
随堂演练
高温
高温
高温
2.下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O === H2SO4 B.3NO2+H2O === 2HNO3+NO
C.2F2+2H2O === 4HF+O2 D.2Na+2H2O === 2NaOH+H2↑
B
4.已知常温下,在溶液中可发生如下反应:
Ce4++Fe2+ === Fe3++Ce3+,Sn2++2Fe3+ === 2Fe2++Sn4+。
由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Fe2+、Ce3+、Sn2+
C.Fe2+、Sn2+、Ce3+ D.Ce3+、Fe2+、Sn2+
A
3.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4 === 3N2+4H2O,反应温度可高达2700 ℃,对于该反应,下列说法中正确的是( )
A.该反应属于置换反应 B.N2H4是氧化剂
C.N2O4是还原剂 D.N2既是氧化产物又是还原产物
D
再见
第2课时 氧化剂和还原剂
第三节 氧化还原反应
红酒中添加SO2具有抗氧化的作用
食品包装中的脱氧剂——还原铁粉
课前导入
为什么?
二氧化硫是一种空气污染物,为什么要在红酒中添加呢?二氧化硫在红酒中起到什么作用呢?
H2 + CuO === H2O + Cu
+2
0
0
+1
氧化反应
化合价升高
化合价降低
失电子
得电子
还原剂
氧化剂
氧化产物
还原产物
氧化剂:化合价降低,得到电子(或电子对偏向)的物质
还原剂:化合价升高,失去电子(或电子对偏离)的物质
氧化产物:还原剂被氧化后得到的产物
还原产物:氧化剂被还原后得到的产物
二、氧化剂和还原剂
1. 氧化剂和还原剂的判断
——具有氧化性
——具有还原性
还原反应
(1)2H2+O2 === 2H2O
(2)4P+5O2 === 2P2O5
(3)Fe+H2SO4 === FeSO4+H2↑
(4)2HgO === 2Hg+O2↑
点燃
加热
点燃
氧化剂:O2 还原剂:H2 氧化产物和还原产物都是H2O
氧化剂:O2 还原剂:P 氧化产物和还原产物都是P2O5
氧化剂:H2SO4 还原剂:Fe
氧化产物:FeSO4 还原产物:H2
氧化剂、还原剂都是HgO 氧化产物:O2 还原产物:Hg
练一练:分析下列氧化还原反应中元素化合价的变化情况,指出氧化剂和还原剂,氧化产物和还原产物。
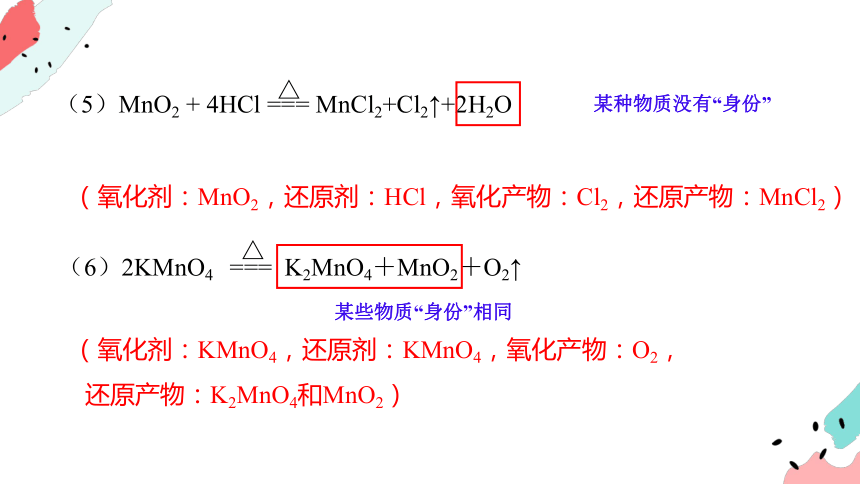
某种物质有两种“身份”
(5)MnO2 + 4HCl === MnCl2+Cl2↑+2H2O
△
(6)2KMnO4 === K2MnO4+MnO2+O2↑
△
(氧化剂:MnO2,还原剂:HCl,氧化产物:Cl2,还原产物:MnCl2)
某种物质没有“身份”
(氧化剂:KMnO4,还原剂:KMnO4,氧化产物:O2,
还原产物:K2MnO4和MnO2)
某些物质“身份”相同
氧化剂 + 还原剂 === 还原产物 + 氧化产物
化合价降低,得电子,被还原(发生还原反应)
化合价升高,失电子,被氧化(发生氧化反应)
构建氧化还原反应概念模型:
升失氧化——还原剂
降得还原——氧化剂
口诀:
元素被氧化,物质发生氧化反应,得到氧化产物
元素被还原,物质发生还原反应,得到还原产物
(氧化性)
(还原性)
2. 氧化性与还原性
(1)氧化性与还原性
氧化性:氧化剂表现出的得电子的性质
还原性:还原剂表现出的失电子的性质
(2)氧化性、还原性与化合价的关系
元素处于最高价态时,只有氧化性;
元素处于中间价态时,既有氧化性又有还原性;
元素处于最低价态时,只有还原性。
然而,化合价只能判断氧化性、还原性的有无,无法判断其强弱。
3. 常见氧化剂与还原剂
(1)常见氧化剂
活泼非金属单质
如:O2,Cl2,F2,Br2,I2 ,S等
高价金属阳离子
如:Fe3+,Cu2+等
高价态含氧酸
如:HNO3,浓H2SO4
高价或较高价的其他含氧化合物
如:MnO2,K2Cr2O7,KMnO4等
过氧化物
如:H2O2,Na2O2 等
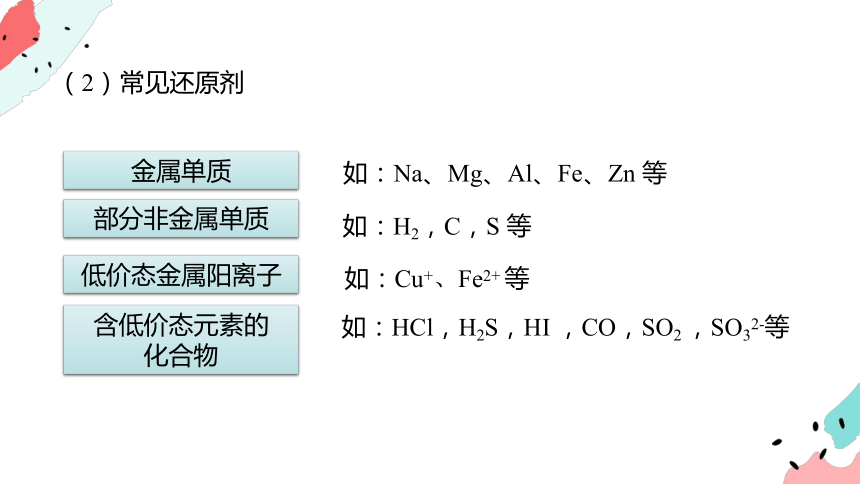
(2)常见还原剂
金属单质
如:Na、Mg、Al、Fe、Zn 等
部分非金属单质
如:H2,C,S 等
低价态金属阳离子
如:Cu+、Fe2+ 等
含低价态元素的
化合物
如:HCl,H2S,HI ,CO,SO2 ,SO32-等
对点练习1. 下列变化中需要加入还原剂才能实现的是( )
A.MnSO4→KMnO4 B.NaCl→AgCl
C.NO2→HNO3 D.Fe2O3→Fe
D
B
对点练习2. 我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe + CuSO4 === Cu + FeSO4。说法正确的是( )
A.Fe被还原 B.Fe是还原剂
C.CuSO4发生氧化反应 D.CuSO4失去电子
氧化性、还原性的强弱与得失电子的数目有关吗?
[思考]
氧化性、还原性的强弱在于得失电子能力的强弱,而不在于得失电子数目的多少
4. 氧化性与还原性的比较
氧化性:物质得电子的能力
还原性:物质失电子的能力
(1)根据氧化还原反应判断
氧化剂 + 还原剂 === 还原产物 + 氧化产物
氧化性:氧化剂 > 氧化产物
还原性:还原剂 > 还原产物
Fe + Cu2+ === Fe2+ + Cu
氧化性:Cu2+ > Fe2+
还原性:Fe> Cu
核心:从氧化还原反应关系判断,两剂大于两产物
(2)根据反应条件判断
MnO2 + 4HCl(浓) === MnCl2 + 2H2O + Cl2↑
△
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
反应简单程度:不加热 > 加热
氧化性: KMnO4 > MnO2
一般来说,反应条件越容易,反应程度越激烈,则得失电子越容易,其对应的性质越强。
(3)根据被氧化或被还原的程度判断
2Fe + 3Cl2 === 2FeCl3
点燃
Fe + S === FeS
△
0 → +3
0 → +2
铁元素被氧化程度:Cl2> S
氧化性: Cl2> S
HCl + H2SO4(浓) = 不反应
2HBr + H2SO4(浓)== Br2 + SO2↑ + 2H2O
8HI + H2SO4(浓)== 4I2 + H2S↑ + 4H2O
+6 → +4
+6 → -2
硫元素被还原的程度:HI > HBr>HCl
还原性: HI > HBr>HCl
不同氧化剂和同一还原剂反应,氧化产物价态高,该氧化剂氧化性强;
不同还原剂和同一氧化剂反应,还原产物价态低,该还原剂还原性强。
失电子能力逐渐减弱,还原性逐渐减弱
其对应阳离子得电子能力逐渐增强,氧化性逐渐增强
K+ Ca2+ Na+ Mg2+ Al3+ Zn2+ Fe2+ Sn2+ Pb2+ (H+) Cu2+(Fe3+) Hg2+ Ag+
(4)根据元素的活动性顺序判断
① 根据金属活动顺序判断
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
F2 Cl2 Br2 I2 S
F- Cl- Br- I- S2-
氧化性逐渐减弱
对应阴离子的还原性逐渐增强
② 根据非金属活动顺序判断
(5)根据外界条件判断
①浓度:一般而言,同一种物质浓度越大,氧化性(或还原性)越强。
如氧化性浓H2SO4>稀 H2SO4,浓HNO3>稀HNO3,还原性浓HCl>稀HCl。
②温度:同一种物质温度越高,其氧化性(还原性)越强。
如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
③酸碱性: 如酸性条件2MnO4-+6H++5SO32- == 2Mn2++5SO42- +3H2O
中性条件2MnO4-+H2O+3SO32- ==2MnO2↓+3SO42- +2OH-
碱性条件2MnO4-+2OH-+SO32- == 2MnO42-+SO42- +H2O
其氧化性为KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)。
对点练习3. 已知H2能与Cl2、Br2发生反应,前者反应的条件是点燃或光照,后者反应的条件是高温,Cl2和Br2的氧化性强弱关系是________。
Cl2>Br2
对点练习4. 把少量铁粉加入硝酸铜和硝酸银的混合溶液中,结果只有银白色物质析出,Ag+和Cu2+的氧化性强弱关系为________________。
Ag+>Cu2+
5. 氧化还原反应的基本规律及应用
(1)守恒规律:
(2)强弱规律:
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
化合价升高数目=失去电子数
化合价降低数目=得到电子数
得失电子守恒:在任何氧化还原反应中,还原剂失电子总数 = 氧化剂得电子总数 (化合价升降总数相等)
(3) 价态规律:
元素处于最高价,只有氧化性;最低价,只有还原性;中间价,既有氧化性又有还原性。
② 归中规律:
① 氧化性和还原性的确定:
同种元素不同价态之间发生氧化还原反应时,元素的化合价只靠拢,不交叉。
如 KClO3+6HCl = KCl+3Cl2↑+3H2O还原产物的判断
在氧化还原反应中,若氧化和还原发生在同一物质中的同一元素上,使该元素的原子(或离子)一部分被氧化,另一部分被还原。这种自身的氧化还原反应称为歧化反应。
③ 歧化规律:
如 Cl2 + 2NaOH = NaCl + NaClO + H2O
多种氧化剂和一种还原剂的反应,氧化性强的优先反应;
多种还原剂和一种氧化剂的反应,还原性强的优先反应。
(4)先后规律:
如:在含有Fe3+、Cu2+、H+的溶液中加入铁粉,因为氧化性Fe3+>Cu2+>H+,所以铁粉依次与Fe3+、Cu2+、H+反应。
三、氧化还原反应方程式的配平
1. 一般配平:得失电子守恒法
配平步骤:
(1)写出反应物和生成物的化学式,标出价态发生变化的元素的化合价;
(2)标出反应前后元素化合价的变化;
(3)依据得失电子守恒,使化合价升降总数相等,并确定相应物质的化学计量数;
(4)用观察法配平其他物质;
(5)检查质量是否守恒,电荷是否守恒。
配平后,单线变等号。
例:
(1)KMnO4+H2O2+H2SO4 -- MnSO4+K2SO4+H2O+O2
(2)Cl2+KOH – KCl+KClO3+H2O
(3)MnO4-+SO32-+H+ -- Mn2++SO42-+H2O
2.缺项配平:
例:Mn2++S2O82- +H2O—SO42- +MnO4- +_____
答案:2、5、8、10、2、16H+
课堂小结:
1. 氧化剂与还原剂
氧化剂:得电子,化合价升高,发生还原反应,被还原的物质
还原剂:失电子,化合价降低,发生氧化反应,被氧化的物质
2. 氧化性与还原性
氧化性:得电子的能力
还原性:失电子的能力
3. 氧化性与还原性的比较
核心:从氧化还原反应关系判断,两剂大于两产物
规律:反应条件、反应结果、物质活泼性规律
4. 氧化还原反应的基本规律及应用
1. 在下列反应中,二氧化碳作氧化剂的是 ( )
A. Ca(OH)2+CO2 === CaCO3↓+H2O
B. CO2+C 2CO
C. 2Fe2O3+3C 4Fe+3CO2↑
D. C+2H2O(g) 2H2+CO2
B
随堂演练
高温
高温
高温
2.下列反应中,属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.SO3+H2O === H2SO4 B.3NO2+H2O === 2HNO3+NO
C.2F2+2H2O === 4HF+O2 D.2Na+2H2O === 2NaOH+H2↑
B
4.已知常温下,在溶液中可发生如下反应:
Ce4++Fe2+ === Fe3++Ce3+,Sn2++2Fe3+ === 2Fe2++Sn4+。
由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是( )
A.Sn2+、Fe2+、Ce3+ B.Fe2+、Ce3+、Sn2+
C.Fe2+、Sn2+、Ce3+ D.Ce3+、Fe2+、Sn2+
A
3.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4 === 3N2+4H2O,反应温度可高达2700 ℃,对于该反应,下列说法中正确的是( )
A.该反应属于置换反应 B.N2H4是氧化剂
C.N2O4是还原剂 D.N2既是氧化产物又是还原产物
D
再见
