化学人教版(2019)必修第一册1.3.1氧化还原反应(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.1氧化还原反应(共24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-10 22:40:38 | ||
图片预览



文档简介
(共24张PPT)
第1课时 氧化还原反应
第三节 氧化还原反应
铁链为什么生锈?
这些生活中常见的现象属于什么反应呢?
课前思考
苹果削完皮放置30分钟以后
喝红酒之前要先把红酒倒入醒酒器中,敞口放置一段时间,喝起来更加绵柔滑润,更加可口
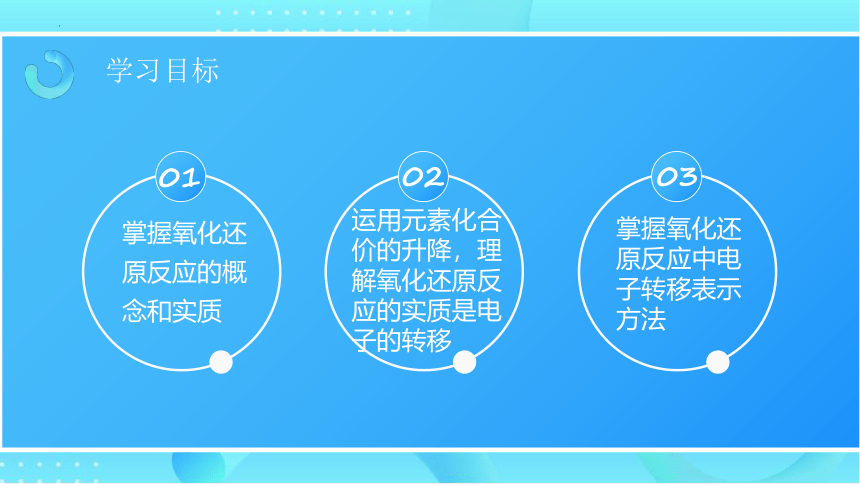
学习目标
01
02
03
掌握氧化还原反应的概念和实质
运用元素化合价的升降,理解氧化还原反应的实质是电子的转移
掌握氧化还原反应中电子转移表示方法
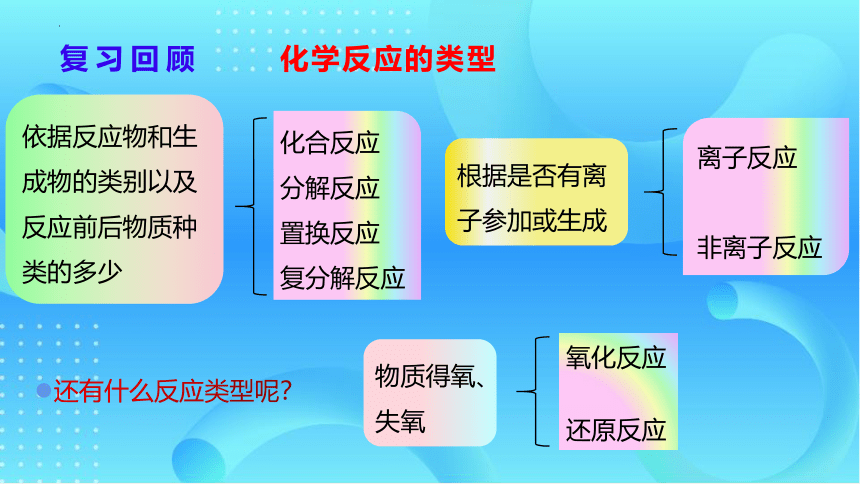
化合反应
分解反应
置换反应
复分解反应
依据反应物和生成物的类别以及反应前后物质种类的多少
离子反应
非离子反应
根据是否有离
子参加或生成
氧化反应
还原反应
物质得氧、失氧
复习回顾
化学反应的类型
还有什么反应类型呢?
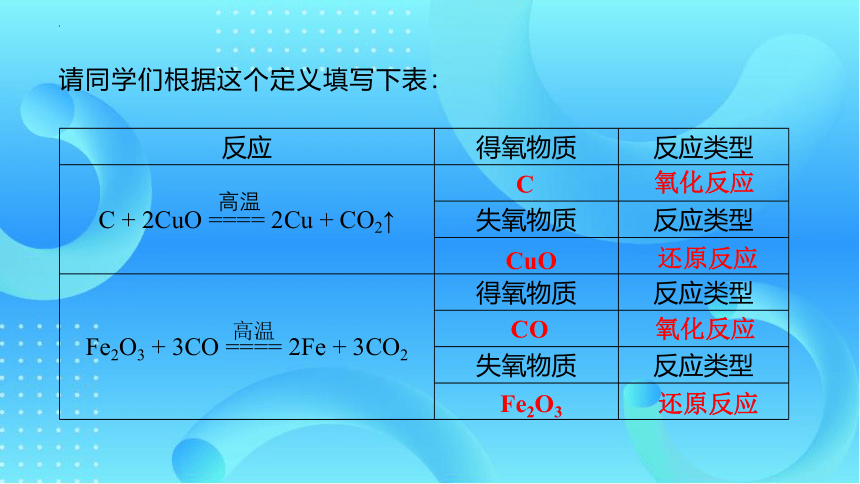
反应 得氧物质 反应类型
C + 2CuO ==== 2Cu + CO2↑
失氧物质 反应类型
Fe2O3 + 3CO ==== 2Fe + 3CO2 得氧物质 反应类型
失氧物质 反应类型
C
氧化反应
CuO
还原反应
CO
氧化反应
Fe2O3
还原反应
请同学们根据这个定义填写下表:
高温
高温
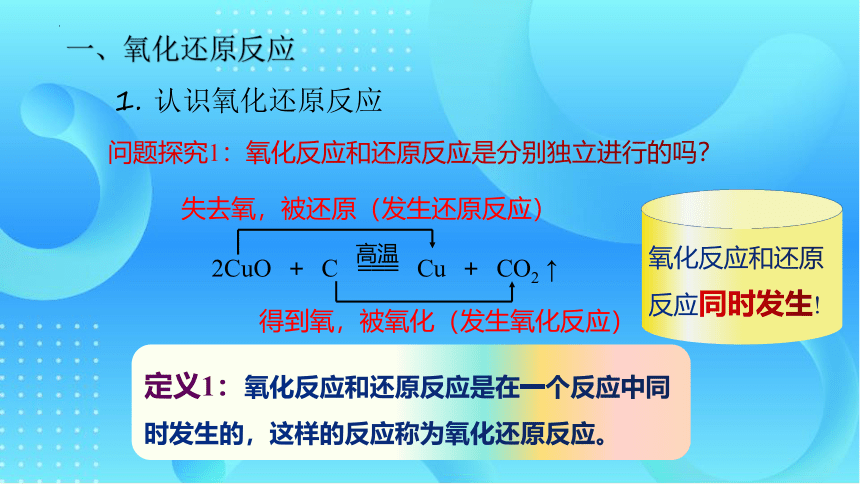
一、氧化还原反应
1. 认识氧化还原反应
得到氧,被氧化(发生氧化反应)
失去氧,被还原(发生还原反应)
2CuO + C === Cu + CO2 ↑
高温
问题探究1:氧化反应和还原反应是分别独立进行的吗?
氧化反应和还原反应同时发生!
定义1:氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
问题探究2:怎样判断一个反应是不是氧化还原反应?
2CuO + C === 2Cu + CO2↑
高温
Fe2O3 + 3CO === 2Fe + 3CO2
高温
+2
0
0
+4
+3
+2
0
+4
得到氧,化合价升高,被氧化(发生氧化反应)
失去氧,化合价降低,被还原(发生还原反应)
氧化还原反应的特征: 反应前后有元素的化合价发生变化
(判断依据)
定义2:反应前后有元素化合价升降的化学反应称为氧化还原反应
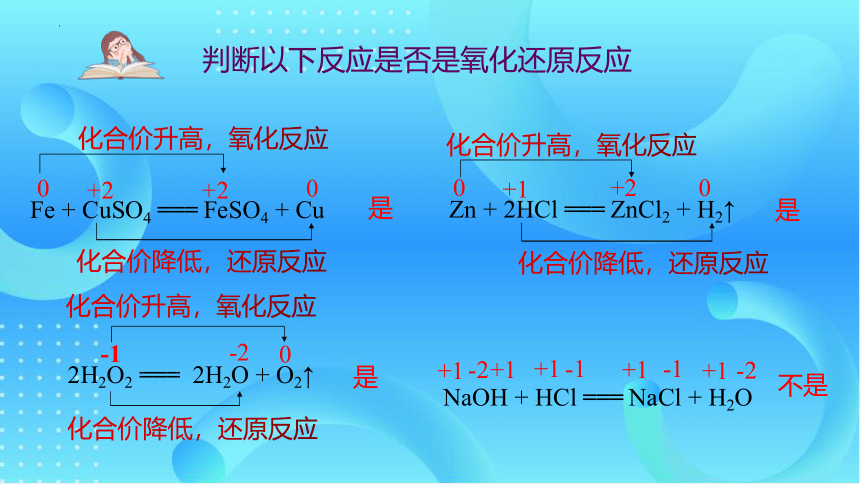
判断以下反应是否是氧化还原反应
Fe + CuSO4 === FeSO4 + Cu
Zn + 2HCl === ZnCl2 + H2↑
+2
0
+2
0
0
0
+2
+1
是
是
化合价升高,氧化反应
化合价升高,氧化反应
化合价降低,还原反应
化合价降低,还原反应
2H2O2 === 2H2O + O2↑
-1
-2
0
化合价升高,氧化反应
化合价降低,还原反应
是
NaOH + HCl === NaCl + H2O
-1
-1
+1
+1
+1
+1
+1
-2
-2
不是
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
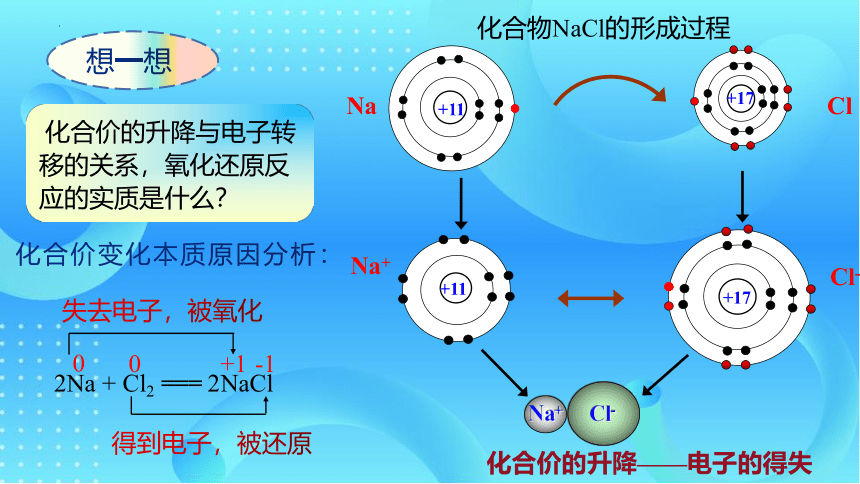
化合价的升降——电子的得失
化合价变化本质原因分析:
化合物NaCl的形成过程
失去电子,被氧化
得到电子,被还原
2Na + Cl2 === 2NaCl
+1
-1
0
0
化合价的升降与电子转移的关系,氧化还原反应的实质是什么?
想一想
H Cl
+17
+1
+1
+17
H2 + Cl2 === 2HCl
H
Cl
HCl
化合价的升降 —— 共用电子对的偏移
点燃
共用电子对
偏离H
偏向Cl
+1
-1
0
0
共用电子对偏离,被氧化
共用电子对偏向,被还原
化合物HCl的形成过程
定义3:有电子转移(电子的得失或共用电子对偏移)的反应都是氧化还原反应
氧化还原反应的实质: 有电子转移(电子的得失或共用电子对偏移)
化合价升高
化合价降低
失电子或电子对偏离
得电子或电子对偏向
氧化反应
还原反应
整体认知氧化还原反应
升 失 氧;降 得 还
(本质判据)
( 特征判据)
1. 判断下列反应属于四大基本反应类型的哪一种?
2.判断下列反应是否为氧化还原反应?
3.思考四大基本反应与氧化还原反应的关系?
⑧BaCl2 + Na2SO4 = 2NaCl +BaSO4↓
⑦NaCl +AgNO3= NaNO3 + AgCl ↓
⑷
①2Fe + 3Cl2 === 2FeCl3
点燃
②H2O+ CaO === Ca(OH)2
⑴
③CaCO3 === CaO + CO2↑
高温
④2HgO === 2Hg + O2 ↑
△
⑵
·
是
否
是
是
否
否
化合反应
分解反应
置换反应
复分解
反应
否
是
思考·交流
⑥C + 2CuO === 2Cu + CO2 ↑
高温
⑤Zn + H2SO4 == ZnSO4 + H2↑
⑶
置换反应
复分解反应
化合反应
分解反应
2. 氧化还原反应与四大基本反应的关系
氧化还原反应
非氧化还原反应
思考:有单质参加或生成的化学反应一定是氧化还原反应吗?
有单质参加的化合反应一定是氧化还原反应; 有单质生成的分解反应一定是氧化还原反应。
3O2 ==== 2O3
放电
(非氧化还原反应)
思 考:我们能否方便直观的显示出氧化还原反应中的电子转移情况呢?
3. 氧化还原反应中的电子转移情况表示方法
(1)“双线桥”法
CuO + H2 === Cu + H2O
△
+2
0
0
+1
化合价降低,被还原, 得1×2e-
化合价升高,被氧化 ,失去2×e-
方法总结:
① 标出变化了的元素的化合价; ②两根线桥; ③箭头总是从反应物指向生成物(箭头方向不代表电子转移方向); ④箭头起止于同种元素; ⑤在“桥”上标出电子的“得”与“失”及相应的电子数,且得失电子总数相等。
现学现用:用双线桥法标出下列反应电子转移的方向和数目:
①MnO2+4HCl === MnCl2+Cl2↑+2H2O
②Cl2+2NaOH === NaCl+NaClO+H2O
△
①MnO2+4HCl === MnCl2+Cl2↑+2H2O
②Cl2+2NaOH === NaCl+NaClO+H2O
失1×e-
得1×e-
失2×e-
得1×2e-
△
(2)“单线桥”法
CuO + H2 === Cu + H2O
△
2e-
2KClO3 === 2KCl + 3O2 ↑
△
12e-
方法总结:
① 标出变化了的元素化合价; ② 箭头总是从失电子的元素指向得电子的元素,(箭头方向表示电子转移的方向); ③ 在箭桥上标出转移电子总数目,不写“得” “ 失”。
现学现用:用单线桥法标出下列反应电子转移的方向和数目:
②Cu + 4HNO3(浓) === Cu(NO3)2+ 2 NO2↑+ 2H2O
2e-
①Fe + 2HCl === FeCl2+ H2↑
2e-
跟踪训练
1.下列关于化学反应的说法中正确的是 ( )
A .化合反应一定是氧化还原反应;
B .有单质生成的分解反应一定是氧化还原反应;
C .置换反应有可能是氧化还原反应;
D .复分解反应不一定是氧化还原反应。
B
2.下列各式中,当左边物质生成右边物质时,画横线的元素是被氧化还是被还原?
(1)NaCl→Cl2 (2)KMnO4→MnCl2
(3)Fe2O3→Fe (4)CO→CO2
被氧化
被还原
被还原
被氧化
3.下列反应中,不属于氧化还原反应的是( )
A.3CuS+8HNO3(稀) ==3Cu(NO3)2+2NO↑+3S↓+4H2O
B.6KOH+3Cl2==5KCl+KClO3+3H2O
C.Ba(OH)2+Na2SO4==BaSO4↓+2NaOH
D.Fe2O3 +2Al==Al2O3 + 2Fe
C
4 .下列哪个反应表示二氧化硫被还原 ( )
A . SO2+2H2O+Cl2 == H2SO4+2HCl
B . SO2+2H2S == 2H2O+3S↓
C . SO2+2NaOH == Na2SO3+H2O
D . SO2+Na2CO3 == Na2SO3+CO2↑
B
5 .当化合物中的元素被转化成单质中的元素时,该元素( )
A. 一定被氧化
B. 一定被还原
C. 可能被氧化,也可能被还原
D. 化合价降低为0
C
THANK YOU
第1课时 氧化还原反应
第三节 氧化还原反应
铁链为什么生锈?
这些生活中常见的现象属于什么反应呢?
课前思考
苹果削完皮放置30分钟以后
喝红酒之前要先把红酒倒入醒酒器中,敞口放置一段时间,喝起来更加绵柔滑润,更加可口
学习目标
01
02
03
掌握氧化还原反应的概念和实质
运用元素化合价的升降,理解氧化还原反应的实质是电子的转移
掌握氧化还原反应中电子转移表示方法
化合反应
分解反应
置换反应
复分解反应
依据反应物和生成物的类别以及反应前后物质种类的多少
离子反应
非离子反应
根据是否有离
子参加或生成
氧化反应
还原反应
物质得氧、失氧
复习回顾
化学反应的类型
还有什么反应类型呢?
反应 得氧物质 反应类型
C + 2CuO ==== 2Cu + CO2↑
失氧物质 反应类型
Fe2O3 + 3CO ==== 2Fe + 3CO2 得氧物质 反应类型
失氧物质 反应类型
C
氧化反应
CuO
还原反应
CO
氧化反应
Fe2O3
还原反应
请同学们根据这个定义填写下表:
高温
高温
一、氧化还原反应
1. 认识氧化还原反应
得到氧,被氧化(发生氧化反应)
失去氧,被还原(发生还原反应)
2CuO + C === Cu + CO2 ↑
高温
问题探究1:氧化反应和还原反应是分别独立进行的吗?
氧化反应和还原反应同时发生!
定义1:氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
问题探究2:怎样判断一个反应是不是氧化还原反应?
2CuO + C === 2Cu + CO2↑
高温
Fe2O3 + 3CO === 2Fe + 3CO2
高温
+2
0
0
+4
+3
+2
0
+4
得到氧,化合价升高,被氧化(发生氧化反应)
失去氧,化合价降低,被还原(发生还原反应)
氧化还原反应的特征: 反应前后有元素的化合价发生变化
(判断依据)
定义2:反应前后有元素化合价升降的化学反应称为氧化还原反应
判断以下反应是否是氧化还原反应
Fe + CuSO4 === FeSO4 + Cu
Zn + 2HCl === ZnCl2 + H2↑
+2
0
+2
0
0
0
+2
+1
是
是
化合价升高,氧化反应
化合价升高,氧化反应
化合价降低,还原反应
化合价降低,还原反应
2H2O2 === 2H2O + O2↑
-1
-2
0
化合价升高,氧化反应
化合价降低,还原反应
是
NaOH + HCl === NaCl + H2O
-1
-1
+1
+1
+1
+1
+1
-2
-2
不是
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
化合价的升降——电子的得失
化合价变化本质原因分析:
化合物NaCl的形成过程
失去电子,被氧化
得到电子,被还原
2Na + Cl2 === 2NaCl
+1
-1
0
0
化合价的升降与电子转移的关系,氧化还原反应的实质是什么?
想一想
H Cl
+17
+1
+1
+17
H2 + Cl2 === 2HCl
H
Cl
HCl
化合价的升降 —— 共用电子对的偏移
点燃
共用电子对
偏离H
偏向Cl
+1
-1
0
0
共用电子对偏离,被氧化
共用电子对偏向,被还原
化合物HCl的形成过程
定义3:有电子转移(电子的得失或共用电子对偏移)的反应都是氧化还原反应
氧化还原反应的实质: 有电子转移(电子的得失或共用电子对偏移)
化合价升高
化合价降低
失电子或电子对偏离
得电子或电子对偏向
氧化反应
还原反应
整体认知氧化还原反应
升 失 氧;降 得 还
(本质判据)
( 特征判据)
1. 判断下列反应属于四大基本反应类型的哪一种?
2.判断下列反应是否为氧化还原反应?
3.思考四大基本反应与氧化还原反应的关系?
⑧BaCl2 + Na2SO4 = 2NaCl +BaSO4↓
⑦NaCl +AgNO3= NaNO3 + AgCl ↓
⑷
①2Fe + 3Cl2 === 2FeCl3
点燃
②H2O+ CaO === Ca(OH)2
⑴
③CaCO3 === CaO + CO2↑
高温
④2HgO === 2Hg + O2 ↑
△
⑵
·
是
否
是
是
否
否
化合反应
分解反应
置换反应
复分解
反应
否
是
思考·交流
⑥C + 2CuO === 2Cu + CO2 ↑
高温
⑤Zn + H2SO4 == ZnSO4 + H2↑
⑶
置换反应
复分解反应
化合反应
分解反应
2. 氧化还原反应与四大基本反应的关系
氧化还原反应
非氧化还原反应
思考:有单质参加或生成的化学反应一定是氧化还原反应吗?
有单质参加的化合反应一定是氧化还原反应; 有单质生成的分解反应一定是氧化还原反应。
3O2 ==== 2O3
放电
(非氧化还原反应)
思 考:我们能否方便直观的显示出氧化还原反应中的电子转移情况呢?
3. 氧化还原反应中的电子转移情况表示方法
(1)“双线桥”法
CuO + H2 === Cu + H2O
△
+2
0
0
+1
化合价降低,被还原, 得1×2e-
化合价升高,被氧化 ,失去2×e-
方法总结:
① 标出变化了的元素的化合价; ②两根线桥; ③箭头总是从反应物指向生成物(箭头方向不代表电子转移方向); ④箭头起止于同种元素; ⑤在“桥”上标出电子的“得”与“失”及相应的电子数,且得失电子总数相等。
现学现用:用双线桥法标出下列反应电子转移的方向和数目:
①MnO2+4HCl === MnCl2+Cl2↑+2H2O
②Cl2+2NaOH === NaCl+NaClO+H2O
△
①MnO2+4HCl === MnCl2+Cl2↑+2H2O
②Cl2+2NaOH === NaCl+NaClO+H2O
失1×e-
得1×e-
失2×e-
得1×2e-
△
(2)“单线桥”法
CuO + H2 === Cu + H2O
△
2e-
2KClO3 === 2KCl + 3O2 ↑
△
12e-
方法总结:
① 标出变化了的元素化合价; ② 箭头总是从失电子的元素指向得电子的元素,(箭头方向表示电子转移的方向); ③ 在箭桥上标出转移电子总数目,不写“得” “ 失”。
现学现用:用单线桥法标出下列反应电子转移的方向和数目:
②Cu + 4HNO3(浓) === Cu(NO3)2+ 2 NO2↑+ 2H2O
2e-
①Fe + 2HCl === FeCl2+ H2↑
2e-
跟踪训练
1.下列关于化学反应的说法中正确的是 ( )
A .化合反应一定是氧化还原反应;
B .有单质生成的分解反应一定是氧化还原反应;
C .置换反应有可能是氧化还原反应;
D .复分解反应不一定是氧化还原反应。
B
2.下列各式中,当左边物质生成右边物质时,画横线的元素是被氧化还是被还原?
(1)NaCl→Cl2 (2)KMnO4→MnCl2
(3)Fe2O3→Fe (4)CO→CO2
被氧化
被还原
被还原
被氧化
3.下列反应中,不属于氧化还原反应的是( )
A.3CuS+8HNO3(稀) ==3Cu(NO3)2+2NO↑+3S↓+4H2O
B.6KOH+3Cl2==5KCl+KClO3+3H2O
C.Ba(OH)2+Na2SO4==BaSO4↓+2NaOH
D.Fe2O3 +2Al==Al2O3 + 2Fe
C
4 .下列哪个反应表示二氧化硫被还原 ( )
A . SO2+2H2O+Cl2 == H2SO4+2HCl
B . SO2+2H2S == 2H2O+3S↓
C . SO2+2NaOH == Na2SO3+H2O
D . SO2+Na2CO3 == Na2SO3+CO2↑
B
5 .当化合物中的元素被转化成单质中的元素时,该元素( )
A. 一定被氧化
B. 一定被还原
C. 可能被氧化,也可能被还原
D. 化合价降低为0
C
THANK YOU
