1.1 第1课时 反应热 焓变 学案 (含答案)2023-2024学年高二化学人教版(2019)选择性必修1
文档属性
| 名称 | 1.1 第1课时 反应热 焓变 学案 (含答案)2023-2024学年高二化学人教版(2019)选择性必修1 |

|
|
| 格式 | docx | ||
| 文件大小 | 320.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-11 00:00:00 | ||
图片预览




文档简介
1.1 第1课时 反应热 焓变
【学习目标】
1.通过交流讨论了解反应热、内能、焓变等基本概念。
2.通过分析图像了解反应热与反应物及生成物能量大小的关系,学会根据能量变化图示判断吸热反应、放热反应,提高宏观辨识能力。
3.通过练习实践认识化学键的断裂和形成是化学反应中能量变化的主要原因,学会根据化学键的键能数值定量计算反应热的大小,形成相关计算的思维模型。
4.通过实验了解定量测定反应热的基本原理和实验方法,能正确分析误差产生的原因并能采取适当措施减小误差,培养科学探究能力。
【自主预习】
一、反应热 焓变
1.体系(系统)及环境
(1)体系(系统):试管中的溶液及发生的反应等(包括反应物、生成物、发生的反应)。
(2)环境:与 相互影响的其他部分(如试管、空气等)。
2.反应热
在等温条件下,化学反应体系向环境 或从环境 的 ,称为化学反应的热效应,简称反应热。
3.放热反应和吸热反应
(1)放热反应:由于各物质所具有的能量不同,如果反应物所具有的总能量 生成物所具有的总能量,那么在发生化学反应时,有一部分能量就会变成热能等形式 出来。
表示:ΔH为“-”或“ΔH 0”,单位:kJ·mol-1。
(2)吸热反应:如果反应物所具有的总能量 生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收 才能转化为生成物。
表示:ΔH为“+”或“ΔH 0”,单位:kJ·mol-1。
4.焓与焓变 内能
(1)“焓”是用于描述物质所具有能量的物理量,常用符号 表示。不同的物质所具有的能量不同,其焓也不同。“焓变”是用于描述反应热(恒压条件下)的物理量,常用符号 表示。
(2)内能(符号为U):体系内物质的各种 的总和,受温度、压强和物质聚集状态等影响。
二、中和反应与中和反应反应热
1.中和反应
中和反应即酸和碱相互作用生成盐和水的反应,其实质是酸电离产生的 和碱电离产生的 结合生成难电离的水。强酸、强碱之间的中和反应一般都可用离子方程式 表示。
2.中和反应反应热
(1)概念:在稀溶液中,酸跟碱发生中和反应生成 mol H2O时的反应热(所放出的热量)。
(2)表示方法: 。
3.中和反应反应热的测定
(1)测定仪器: 。
(2)测定数据:盐酸、NaOH溶液的初始温度,反应后体系的 。
(3)计算公式: 。
【参考答案】一、1.体系 2.释放 吸收 热量 3.(1)大于
释放 < (2)小于 能量 > 4.(1)H ΔH (2)能量
二、1.H+ OH- H++OH-H2O
2.(1)1 (2)H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1
3.(1)简易量热计 (2)最高温度 (3)ΔH=-
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)放热反应不需要加热就能进行,吸热反应不加热就不能进行。 ( )
(2)物质发生化学变化都伴有能量的变化。 ( )
(3)伴有能量变化的物质变化都是化学变化。 ( )
(4)Na转化为Na+时,吸收的能量就是该过程的反应热。 ( )
(5)水蒸气变为液态水时放出的能量就是该变化的反应热。 ( )
(6)准确测量中和反应反应热的实验过程中,至少需测定温度4次。 ( )
(7)若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL 0.50 mol·L-1的硝酸充分反应,两中和反应的反应热不相等。 ( )
(8)已知中和反应反应热ΔH=-57.3 kJ·mol-1,则H2SO4(aq)+Ba(OH)2(aq)2H2O(l) +BaSO4(s) ΔH=2×(-57.3) kJ·mol-1。 ( )
【答案】(1)× (2)√ (3)× (4)× (5)× (6)×
(7)× (8)×
2.物质在化学反应中发生能量变化的主要原因是什么
【答案】化学键断裂和形成时伴随着能量变化。
3.化学反应中焓变可能为零吗 为什么
【答案】不可能。因为焓变即生成物的焓与反应物的焓的差值,生成物的焓与反应物的焓不可能完全相等,即焓变不可能为零。
4.反应热定义中,“在等温条件下”是什么意思
【答案】等温条件下,指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度相等。
5.中和反应反应热测定过程中,提高测定反应热准确度的措施有哪些
【答案】①实验中用温度计先后测量酸溶液、碱溶液及混合溶液的温度时,使用同一支温度计可减小实验误差,且测量完一种溶液后,温度计必须用水冲洗干净并用滤纸擦干。温度计的水银球要完全浸入溶液中,且要稳定一段时间后再记下读数。②反应物应一次性迅速加入,且避免有液体溅出。③实验操作时动作要快,尽量减少热量的损失。④重复实验3次,取3次实验数据的平均值。
【合作探究】
任务1:反应热与焓变
情境导入 长征五号B运载火箭是我国目前近地轨道运载能力最大的火箭,它的起飞质量约849 t,而其中90%以上的质量为“肚子”里装满的深低温液氢、液氧燃料的质量,它周身冰冷,由此得名“冰箭”。氢气在氧气中燃烧的化学方程式为2H2(l)+O2(l)2H2O(g) ΔH=-474.92 kJ·mol-1,燃烧时火箭向下喷出强大气流,推进火箭向上运动。
问题生成
1.液氢与液氧的反应是吸热反应还是放热反应 在等压条件下,该反应的焓变是多少
【答案】放热反应;-474.92kJ·mol-1。
2.火箭在飞行时,发动机中能量如何转化 同质量的液氢和氢气在纯氧中燃烧生成液态水,哪一个放出的热量多
【答案】化学能转化为动能、内能、光能、声能等;同质量的氢气放出的热量多。
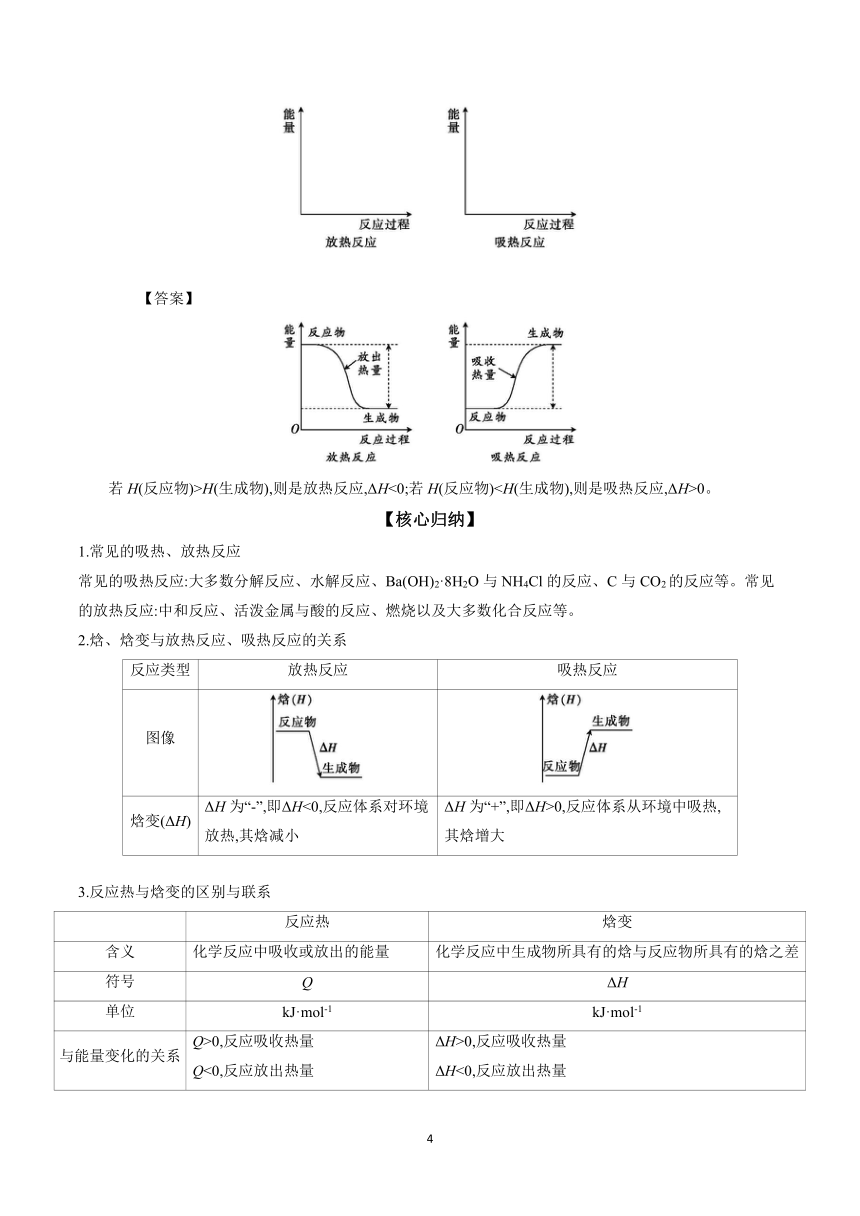
3.根据你的认识,请在下面画出反应物及生成物的能量变化示意图,并总结反应物、生成物总能量的相对大小与反应热的关系。
【答案】
若H(反应物)>H(生成物),则是放热反应,ΔH<0;若H(反应物)0。
【核心归纳】
1.常见的吸热、放热反应
常见的吸热反应:大多数分解反应、水解反应、Ba(OH)2·8H2O与NH4Cl的反应、C与CO2的反应等。常见的放热反应:中和反应、活泼金属与酸的反应、燃烧以及大多数化合反应等。
2.焓、焓变与放热反应、吸热反应的关系
反应类型 放热反应 吸热反应
图像
焓变(ΔH) ΔH为“-”,即ΔH<0,反应体系对环境放热,其焓减小 ΔH为“+”,即ΔH>0,反应体系从环境中吸热,其焓增大
3.反应热与焓变的区别与联系
反应热 焓变
含义 化学反应中吸收或放出的能量 化学反应中生成物所具有的焓与反应物所具有的焓之差
符号 Q ΔH
单位 kJ·mol-1 kJ·mol-1
与能量变化的关系 Q>0,反应吸收热量 Q<0,反应放出热量 ΔH>0,反应吸收热量 ΔH<0,反应放出热量
二者的相互联系 ΔH 是化学反应在恒定压强下(敞口容器中进行的化学反应)且不与外界进行电能、光能等其他能量的转化时的反应热,即恒压条件下进行的反应热Q与焓变的绝对值相等
【典型例题】
【例1】由图分析,下列说法正确的是( )。
A.XY+Z和Y+ZX两个反应吸收或放出的能量不等
B.XY+Z ΔH<0
C.X具有的焓高于Y和Z具有的焓的总和
D.XY+Z ΔH>0,则Y+ZX ΔH<0
【答案】D
【解析】由图可看出,Y和Z的焓之和高于X的焓,则反应Y+ZX一定是放热反应,ΔH<0;反之,XY+Z的反应一定是吸热反应,ΔH>0。根据能量守恒定律,两反应吸收和放出的能量一定相等。
【例2】某反应由两步反应ABC构成,它的反应能量曲线如图所示。下列有关叙述正确的是( )。
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应的ΔH=E1-E2
【答案】B
【解析】根据图示可知,第一步反应的反应物能量比生成物的能量低,所以该步反应是吸热反应,而第二步反应中生成物的能量比反应物的能量低,该步反应是放热反应,A项错误;根据图示可知,三种化合物中C的能量最低,故其最稳定,B项正确;加入催化剂会改变反应的活化能,但是不能改变反应物、生成物的能量,所以不能改变反应的焓变,C项错误;整个反应的ΔH=E1+E3-E2-E4,D项错误。
灵犀一点:从宏观角度认识化学反应能量变化的原因
任务2:从微观角度探讨反应热的实质
情境导入 反应H2(g)+Cl2(g)2HCl(g)的变化过程及其能量变化如图所示。
问题生成
1.填写下表中的能量变化:
化学键 反应中能量变化
1 mol A—B化学键 反应中能量变化
H—H 吸收 kJ 共吸收 kJ
Cl—Cl 吸收 kJ
H—Cl 放出 kJ 共放出 kJ
结论 H2(g)+Cl2(g)2HCl(g)的反应热ΔH= kJ·mol-1
【答案】436 243 679 431 862 -183
2.化学反应中能量变化的主要原因是什么
【答案】化学键断裂和形成时的能量变化。
【核心归纳】
从微观角度认识化学反应能量变化的原因
ΔH=Q1-Q2
【典型例题】
【例3】由下列键能数据大小,不能得出的事实是( )。
化学键 O—H H—H OO
键能/(kJ·mol-1) 463 436 498.3
A.1 mol H2和 mol O2的总能量大于1 mol H2O的总能量
B.断开1 mol H2中的化学键所吸收的能量是436 kJ
C.H2(g)+O2(g)H2O(g) ΔH=-240.85 kJ·mol-1
D.生成1 mol H2O(g)的化学键所放出的热量是463 kJ
【答案】D
【解析】反应焓变等于反应物总键能减去生成物总键能,则H2(g)+O2(g)H2O(g) ΔH=436 kJ·mol-1+×498.3 kJ·mol-1-2×463 kJ·mol-1=-240.85 kJ·mol-1。A项,由分析可知,反应放热,则反应物总能量大于生成物总能量,正确;B项,1分子氢气中含有1个H—H,断开1 mol H2中的化学键所吸收的能量是436 kJ,正确;C项,由分析可知,正确;D项,1分子水中含有2个O—H,生成1 mol H2O(g)的化学键所放出的热量是926 kJ,错误。
【例4】已知某些化学键键能如下,下列说法不正确的是( )。
化学键 H—H Cl—Cl Br—Br H—Cl H—Br
键能/(kJ·mol-1) 436 243 194 432 a
A.根据键能可估算反应H2(g)+Cl2 (g)2HCl(g)的ΔH=-185 kJ·mol-1
B.根据原子半径可知键长:H—ClC.H2(g)与Br2(g)反应生成2 mol HBr (g)时,放出的热量小于185 kJ
D.常温下Cl2和Br2的状态不同,与Cl—Cl和Br—Br的键能有关
【答案】D
【解析】A项,反应热=反应物总键能-生成物总键能,则H2(g)+Cl2(g)2HCl(g) ΔH=+436 kJ·mol-1+243 kJ·mol-1-2×432 kJ·mol-1=-185 kJ·mol-1,正确;B项,Cl原子半径小于Br原子,H—Cl的键长比H—Br的短, H—Cl的键能比H—Br的大,进而推测a<432,正确;C项,键能:Cl—Cl>Br—Br,反应生成HBr比生成HCl更难,放出的热量更少,故生成2 mol HBr (g)时,放出的热量小于185 kJ,正确;D项,Cl—Cl键能大于Br—Br键能,说明Cl2分子比Br2分子稳定,破坏的是共价键,而状态由分子间作用力决定,错误。
灵犀一点:反应热的计算方法
宏观角度:ΔH=生成物总能量-反应物总能量。
微观角度:ΔH=反应物总键能-生成物总键能。
任务3:中和反应反应热的测定
情境导入 不同的化学反应具有不同的反应热,把盐酸和氢氧化钠溶液混合于烧杯中,触摸烧杯壁,感受温度的变化。化学上规定:在稀溶液中,强酸与强碱发生中和反应生成1 mol H2O时的反应热叫中和反应反应热。人们可以通过多种方法获得中和反应反应热的数据,最直接的方法就是通过实验进行测定。
【实验探究】
1.实验测量
按下列操作步骤测定盐酸与氢氧化钠溶液反应的反应热。
①用量筒量取50 mL 0.50 mol·L-1的盐酸,打开杯盖,倒入量热计(如图)的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
②用另一量筒量取50 mL 0.55 mol·L-1的NaOH溶液,用温度计测量并记录NaOH溶液的温度。
③打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用玻璃搅拌器匀速搅拌,密切关注温度变化,将最高温度记为反应后体系的温度(t2)。
④重复上述步骤两次。
在上述过程中,提高测定反应热准确度的措施有哪些
【答案】用保温效果较好的量热计;温度计使用后及时冲洗并擦干;NaOH溶液稍过量;用玻璃搅拌器匀速搅拌;操作动作迅速;多次测量取平均值。
2.原理分析
(1)实验为何使用0.55 mol·L-1 NaOH溶液与0.50 mol·L-1盐酸反应,而不是选用0.50 mol·L-1 NaOH溶液
(2)若用0.55 mol·L-1 KOH溶液代替0.55 mol·L-1 NaOH 溶液,对结果会产生影响吗 为什么
(3)①用浓硫酸代替盐酸对结果会产生什么影响
②用醋酸代替盐酸对结果会产生什么影响
(4)完整地做一次这样的实验,需测定多次温度,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点 为什么
【答案】(1)碱过量的目的是保证盐酸完全反应。
(2)无影响。因为强酸、强碱的稀溶液反应生成1 mol H2O(l)时放出的热量是相同的,与用KOH溶液还是NaOH 溶液以及酸、碱的用量无关。
(3)①浓硫酸溶于水时放热,所测反应热的数值偏大。
②弱酸、弱碱电离吸热,所测反应热的数值偏小。
(4)不同意,因为不同温度计精确度不同。
3.数据处理
[取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)]
(1)为记录本实验的实验数据,请设计实验记录表。
(2)量热计直接测得的数据是什么 通过什么公式计算反应热
(3)计算反应热。(为了计算简便,近似地认为实验所用酸、碱溶液的密度与水相同,都是1 g·mL-1,中和后生成的溶液的比热容与液态水相同,为4.18 J·g-1·℃-1)
(4)若上述实验测得t2-t1=3.4 ℃,则ΔH= (精确至0.01)kJ·mol-1。
答案(1)
实验 次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ (t2-t1)/℃
1
2
3
(2)体系温度的变化;Q=cmΔt(Q:反应放出的热量,m:反应混合液的总质量,c:反应混合液的比热容,Δt:反应前后溶液温度的变化量)。
(3)50 mL 0.50 mol·L-1盐酸的质量m1=50 g,50 mL 0.55 mol·L-1 NaOH溶液的质量m2=50 g。中和后生成的溶液的比热容c=4.18 J·g-1·℃-1,则放出的热量为(m1+m2)·c·(t2-t1)=0.418(t2-t1) kJ,生成1 mol H2O时的反应热ΔH=- kJ·mol-1。
(4)-56.85
4.误差分析
在下表空格内填“偏大”、“偏小”或“不变”。
引起误差的原因 与ΔH=-57.3 kJ·mol-1比较
保温措施不好
若将玻璃搅拌器改成“铜棒”
搅拌不充分
量取NaOH溶液和盐酸时,均仰视刻度线
用同浓度的氨水代替NaOH溶液
引起误差的原因 与ΔH=-57.3 kJ·mol-1比较
用同浓度的CH3COOH溶液代替盐酸
最后记录的温度不是最高温度
【答案】偏大 偏大 偏大 偏小 偏大 偏大 偏大
【核心归纳】
1.正确理解中和反应反应热
(1)离子方程式符合H++OH-H2O的稀的强酸与稀的强碱溶液反应,其中和反应反应热均相等,且室温下与强酸、强碱的用量无关。
(2)相同温度下,用稀的弱酸或弱碱测得的中和反应反应热会变大。
2.中和反应反应热测定实验的注意事项
(1)为了保证0.50 mol·L-1的盐酸完全被NaOH中和,采用0.55 mol·L-1NaOH溶液,使碱稍稍过量,因为过量的碱并不参加中和反应。
(2)先后测量酸、碱及混合液的温度时,测定一种溶液后必须用水冲洗干净并用滤纸擦干。温度计的水银球部分要完全浸入溶液中,且要稳定一段时间再记下读数。
(3)实验中所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温,才能使用。
(4)操作时动作要快,尽量减少热量的散失。
(5)实验时亦可选用浓度、体积都不相同的酸、碱溶液进行中和反应反应热的测定,但在计算时,应取二者中量少的一种,因为过量的酸或碱并不参加中和反应。
【典型例题】
【例5】某化学兴趣小组用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行中和反应反应热的测定实验,实验装置如图所示。试回答下列问题:
(1)实验时玻璃搅拌器的使用方法是 ;不能用铜质搅拌器代替玻璃搅拌器的理由是 。
(2)某同学记录的实验数据如表所示。(已知:实验中盐酸和氢氧化钠溶液的密度均为1 g·cm-3,中和反应后溶液的比热容c=4.18 J·g-1·℃-1)
实验 序号 起始温度T1/℃ 终止温度T2/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.3
2 20.2 20.4 23.4
3 20.4 20.6 23.8
依据该同学的实验数据计算,该实验测得反应放出的热量为 J。
(3)下列操作会导致实验结果出现偏差的是 (填字母)。
a.用量筒量取盐酸的体积时仰视读数
b.把量筒中的氢氧化钠溶液分多次倒入盐酸中
c.将50 mL 0.55 mol·L-1氢氧化钠溶液取成了50 mL 0.55 mol·L-1氢氧化钾溶液
d.做本实验的当天室温较高
(4)如果将NaOH溶液换成等量的NaOH固体,那么实验中测得的中和反应反应热(ΔH) (填“偏大”、“偏小”或“不变”)。
(5)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行实验,与上述实验相比,二者所放出的热量 (填“相等”或“不相等”,下同),所求的中和反应反应热(ΔH) 。
【答案】(1)上下匀速搅动 Cu是热的良导体,传热快,热量损失大
(2)1337.6
(3)ab
(4)偏小
(5)不相等 相等
【解析】(1)实验时为防止打断温度计,玻璃搅拌器的使用方法是上下匀速搅动;Cu是热的良导体,传热快,热量损失大,所以不能用铜质搅拌器代替玻璃搅拌器。(2)三次温度差分别为3.2 ℃、3.1 ℃、3.3 ℃,温度的平均值为3.2 ℃,溶液的总质量为100 g,该实验测得反应放出的热量为Q=100 g×4.18 J·g-1·℃-1×3.2 ℃=1337.6 J。(3)a项,用量筒量取盐酸的体积时仰视读数,会使盐酸的体积不准确,导致实验结果出现偏差;b项,把量筒中的氢氧化钠溶液分多次倒入盐酸中,会使热量散失,导致实验结果出现偏差;c项,将50 mL 0.55 mol·L-1氢氧化钠溶液取成了50 mL 0.55 mol·L-1氢氧化钾溶液,OH-的物质的量不变,对实验结果没有影响;d项,做本实验的当天室温较高,但测量的是温度差,与室温无关,对实验结果没有影响。(4)如果将NaOH溶液换成等量的NaOH固体,由于氢氧化钠固体溶解会放出热量,导致放热增多,使实验测得的中和反应反应热(ΔH)偏小。(5)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行实验,由于试剂的量不同,所放出的热量与上述实验不相等,但中和反应反应热是换算成生成1 mol H2O(l)时放出的热量,所求的中和反应反应热(ΔH)与上述反应相等。
灵犀一点:导致中和反应反应热测定存在误差的原因
(1)量取溶液的体积不准确。
(2)温度计读数有误(如未读取到混合溶液的最高温度,就记为终止温度)。
(3)实验过程中有液体溅出。
(4)混合酸、碱溶液时,动作缓慢。
(5)隔热层隔热效果不好,实验过程中有热量损失。
(6)测过酸溶液的温度计未用水清洗擦干便立即去测碱溶液的温度。
(7)溶液浓度不准确。
(8)没有进行重复实验。
【随堂检测】
课堂基础
1.下列反应既属于氧化还原反应,又属于吸热反应的是( )。
A.铝片与稀盐酸反应
B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的炭与CO2反应
D.甲烷在氧气中的燃烧反应
【答案】C
【解析】Al与盐酸的反应是放热反应;B项反应是吸热反应,但不是氧化还原反应;灼热的C和CO2反应生成CO,该反应既是氧化还原反应,又是吸热反应;甲烷的燃烧是放热反应。
2.下列有关中和反应反应热测定实验的说法正确的是( )。
A.温度计能代替玻璃搅拌器,用于搅拌反应物
B.强酸与强碱反应生成1 mol H2O(l)释放的热量都约为57.3 kJ
C.该实验中,读取混合溶液不再变化的温度为终止温度
D.内筒内若有水残留,会使测得的反应热数值绝对值偏小
【答案】D
【解析】A项,温度计不能代替玻璃搅拌器,温度计只能用于测量溶液的温度,错误;B项,强酸与强碱发生中和反应生成1 mol H2O(l)时,放出的热量不一定等于57.3 kJ,如浓硫酸与NaOH溶液反应生成1 mol H2O(l)时,放出的热量大于57.3 kJ,错误;C项,测定中和反应反应热时,应读取混合溶液的最高温度,错误;D项,内筒内残留水,使溶液的质量偏大,混合液最高温度降低,温度差减小,测得的反应热数值绝对值偏小,正确。
3.甲烷与氯气发生取代反应分别生成1 mol相关有机物的能量变化如图所示:
已知Cl—Cl、C—Cl键能分别为243 kJ·mol-1、327 kJ·mol-1,下列说法不正确的是( )。
A.1 mol CH4(g)的能量比1 mol CH2Cl2(g)的能量多197 kJ
B.CH4与Cl2的取代反应是放热反应
C.ΔH4≈ΔH3≈ΔH2≈ΔH1,说明CH4与Cl2的四步取代反应,难易程度相当
D.CH4(g)+Cl·(g)CH3·(g)+HCl(g) ΔH=-15 kJ·mol-1
【答案】A
【解析】A项,由图可知,甲烷和氯气反应生成CH2Cl2(g)的同时还会生成氯化氢,故不能说明1 mol CH4(g)的能量比1 mol CH2Cl2(g)的能量多197 kJ,错误;B项,由图可知,焓变均为负值,则为放热反应,正确; C项,ΔH4≈ΔH3≈ΔH2≈ΔH1,说明CH4与Cl2的四步取代反应每多取代1个氢原子的难易程度相当,正确;D项,CH4(g)+Cl·(g)CH3·(g)+HCl(g)反应中,断裂了1 mol C—H,形成了1 mol H—Cl,已知Cl—Cl、C—Cl键能分别为243 kJ·mol-1、327 kJ·mol-1,反应CH4(g)+Cl2(g)CH3Cl(g)+HCl(g)的焓变为ΔH=4×E(C—H)+E(Cl—Cl)-3×E(C—H)-E(C—Cl)-E(H—Cl)=-99 kJ·mol-1,即E(C—H)+243 kJ·mol-1-327 kJ·mol-1-E(H—Cl)=-99 kJ·mol-1,E(C—H)-E(H—Cl)=-15 kJ·mol-1,故CH4(g)+Cl·(g)CH3·(g)+HCl(g) ΔH=-15 kJ·mol-1,正确。
对接高考
4.(2022·浙江省6月选考,18)标准状态下,下列物质气态时的相对能量如下表:
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/(kJ·mol-1) 249 218 39 10 0 0 -136 -242
可根据HO(g)+HO(g)H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·mol-l。下列说法不正确的是( )。
A.H2的键能为436 kJ·mol-l
B.O2的键能大于H2O2中氧氧单键的键能的两倍
C.解离氧氧单键所需能量: HOOD.H2O(g)+O(g)H2O2(g) ΔH=-143 kJ·mol-1
【答案】C
【解析】A项,根据表格中的数据可知,H2的键能为218 kJ·mol-1×2=436 kJ·mol-1,正确;B项,由表格中的数据可知,O2的键能为249 kJ·mol-1×2=498 kJ·mol-l,由题中信息可知,H2O2中氧氧单键的键能为214 kJ·mol-l,则O2的键能大于H2O2中氧氧单键的键能的两倍,正确;C项,由表格中的数据可知,HOOHO+O,解离其中氧氧单键需要的能量为(249+39-10) kJ·mol-1=278 kJ·mol-1,H2O2中氧氧单键的键能为214 kJ·mol-1<278 kJ·mol-1,错误;D项,由表中的数据可知,H2O(g)+O(g)H2O2(g) ΔH=[-136-249-(-242)] kJ·mol-1=-143 kJ·mol-1,正确。
2
【学习目标】
1.通过交流讨论了解反应热、内能、焓变等基本概念。
2.通过分析图像了解反应热与反应物及生成物能量大小的关系,学会根据能量变化图示判断吸热反应、放热反应,提高宏观辨识能力。
3.通过练习实践认识化学键的断裂和形成是化学反应中能量变化的主要原因,学会根据化学键的键能数值定量计算反应热的大小,形成相关计算的思维模型。
4.通过实验了解定量测定反应热的基本原理和实验方法,能正确分析误差产生的原因并能采取适当措施减小误差,培养科学探究能力。
【自主预习】
一、反应热 焓变
1.体系(系统)及环境
(1)体系(系统):试管中的溶液及发生的反应等(包括反应物、生成物、发生的反应)。
(2)环境:与 相互影响的其他部分(如试管、空气等)。
2.反应热
在等温条件下,化学反应体系向环境 或从环境 的 ,称为化学反应的热效应,简称反应热。
3.放热反应和吸热反应
(1)放热反应:由于各物质所具有的能量不同,如果反应物所具有的总能量 生成物所具有的总能量,那么在发生化学反应时,有一部分能量就会变成热能等形式 出来。
表示:ΔH为“-”或“ΔH 0”,单位:kJ·mol-1。
(2)吸热反应:如果反应物所具有的总能量 生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收 才能转化为生成物。
表示:ΔH为“+”或“ΔH 0”,单位:kJ·mol-1。
4.焓与焓变 内能
(1)“焓”是用于描述物质所具有能量的物理量,常用符号 表示。不同的物质所具有的能量不同,其焓也不同。“焓变”是用于描述反应热(恒压条件下)的物理量,常用符号 表示。
(2)内能(符号为U):体系内物质的各种 的总和,受温度、压强和物质聚集状态等影响。
二、中和反应与中和反应反应热
1.中和反应
中和反应即酸和碱相互作用生成盐和水的反应,其实质是酸电离产生的 和碱电离产生的 结合生成难电离的水。强酸、强碱之间的中和反应一般都可用离子方程式 表示。
2.中和反应反应热
(1)概念:在稀溶液中,酸跟碱发生中和反应生成 mol H2O时的反应热(所放出的热量)。
(2)表示方法: 。
3.中和反应反应热的测定
(1)测定仪器: 。
(2)测定数据:盐酸、NaOH溶液的初始温度,反应后体系的 。
(3)计算公式: 。
【参考答案】一、1.体系 2.释放 吸收 热量 3.(1)大于
释放 < (2)小于 能量 > 4.(1)H ΔH (2)能量
二、1.H+ OH- H++OH-H2O
2.(1)1 (2)H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1
3.(1)简易量热计 (2)最高温度 (3)ΔH=-
【效果检测】
1.判断正误(正确的打“√”,错误的打“×”)。
(1)放热反应不需要加热就能进行,吸热反应不加热就不能进行。 ( )
(2)物质发生化学变化都伴有能量的变化。 ( )
(3)伴有能量变化的物质变化都是化学变化。 ( )
(4)Na转化为Na+时,吸收的能量就是该过程的反应热。 ( )
(5)水蒸气变为液态水时放出的能量就是该变化的反应热。 ( )
(6)准确测量中和反应反应热的实验过程中,至少需测定温度4次。 ( )
(7)若用50 mL 0.55 mol·L-1的氢氧化钠溶液,分别与50 mL 0.50 mol·L-1的盐酸和50 mL 0.50 mol·L-1的硝酸充分反应,两中和反应的反应热不相等。 ( )
(8)已知中和反应反应热ΔH=-57.3 kJ·mol-1,则H2SO4(aq)+Ba(OH)2(aq)2H2O(l) +BaSO4(s) ΔH=2×(-57.3) kJ·mol-1。 ( )
【答案】(1)× (2)√ (3)× (4)× (5)× (6)×
(7)× (8)×
2.物质在化学反应中发生能量变化的主要原因是什么
【答案】化学键断裂和形成时伴随着能量变化。
3.化学反应中焓变可能为零吗 为什么
【答案】不可能。因为焓变即生成物的焓与反应物的焓的差值,生成物的焓与反应物的焓不可能完全相等,即焓变不可能为零。
4.反应热定义中,“在等温条件下”是什么意思
【答案】等温条件下,指化学反应发生后,使反应后体系的温度恢复到反应前体系的温度,即反应前后体系的温度相等。
5.中和反应反应热测定过程中,提高测定反应热准确度的措施有哪些
【答案】①实验中用温度计先后测量酸溶液、碱溶液及混合溶液的温度时,使用同一支温度计可减小实验误差,且测量完一种溶液后,温度计必须用水冲洗干净并用滤纸擦干。温度计的水银球要完全浸入溶液中,且要稳定一段时间后再记下读数。②反应物应一次性迅速加入,且避免有液体溅出。③实验操作时动作要快,尽量减少热量的损失。④重复实验3次,取3次实验数据的平均值。
【合作探究】
任务1:反应热与焓变
情境导入 长征五号B运载火箭是我国目前近地轨道运载能力最大的火箭,它的起飞质量约849 t,而其中90%以上的质量为“肚子”里装满的深低温液氢、液氧燃料的质量,它周身冰冷,由此得名“冰箭”。氢气在氧气中燃烧的化学方程式为2H2(l)+O2(l)2H2O(g) ΔH=-474.92 kJ·mol-1,燃烧时火箭向下喷出强大气流,推进火箭向上运动。
问题生成
1.液氢与液氧的反应是吸热反应还是放热反应 在等压条件下,该反应的焓变是多少
【答案】放热反应;-474.92kJ·mol-1。
2.火箭在飞行时,发动机中能量如何转化 同质量的液氢和氢气在纯氧中燃烧生成液态水,哪一个放出的热量多
【答案】化学能转化为动能、内能、光能、声能等;同质量的氢气放出的热量多。
3.根据你的认识,请在下面画出反应物及生成物的能量变化示意图,并总结反应物、生成物总能量的相对大小与反应热的关系。
【答案】
若H(反应物)>H(生成物),则是放热反应,ΔH<0;若H(反应物)
【核心归纳】
1.常见的吸热、放热反应
常见的吸热反应:大多数分解反应、水解反应、Ba(OH)2·8H2O与NH4Cl的反应、C与CO2的反应等。常见的放热反应:中和反应、活泼金属与酸的反应、燃烧以及大多数化合反应等。
2.焓、焓变与放热反应、吸热反应的关系
反应类型 放热反应 吸热反应
图像
焓变(ΔH) ΔH为“-”,即ΔH<0,反应体系对环境放热,其焓减小 ΔH为“+”,即ΔH>0,反应体系从环境中吸热,其焓增大
3.反应热与焓变的区别与联系
反应热 焓变
含义 化学反应中吸收或放出的能量 化学反应中生成物所具有的焓与反应物所具有的焓之差
符号 Q ΔH
单位 kJ·mol-1 kJ·mol-1
与能量变化的关系 Q>0,反应吸收热量 Q<0,反应放出热量 ΔH>0,反应吸收热量 ΔH<0,反应放出热量
二者的相互联系 ΔH 是化学反应在恒定压强下(敞口容器中进行的化学反应)且不与外界进行电能、光能等其他能量的转化时的反应热,即恒压条件下进行的反应热Q与焓变的绝对值相等
【典型例题】
【例1】由图分析,下列说法正确的是( )。
A.XY+Z和Y+ZX两个反应吸收或放出的能量不等
B.XY+Z ΔH<0
C.X具有的焓高于Y和Z具有的焓的总和
D.XY+Z ΔH>0,则Y+ZX ΔH<0
【答案】D
【解析】由图可看出,Y和Z的焓之和高于X的焓,则反应Y+ZX一定是放热反应,ΔH<0;反之,XY+Z的反应一定是吸热反应,ΔH>0。根据能量守恒定律,两反应吸收和放出的能量一定相等。
【例2】某反应由两步反应ABC构成,它的反应能量曲线如图所示。下列有关叙述正确的是( )。
A.两步反应均为吸热反应
B.三种化合物中C最稳定
C.加入催化剂会改变反应的焓变
D.整个反应的ΔH=E1-E2
【答案】B
【解析】根据图示可知,第一步反应的反应物能量比生成物的能量低,所以该步反应是吸热反应,而第二步反应中生成物的能量比反应物的能量低,该步反应是放热反应,A项错误;根据图示可知,三种化合物中C的能量最低,故其最稳定,B项正确;加入催化剂会改变反应的活化能,但是不能改变反应物、生成物的能量,所以不能改变反应的焓变,C项错误;整个反应的ΔH=E1+E3-E2-E4,D项错误。
灵犀一点:从宏观角度认识化学反应能量变化的原因
任务2:从微观角度探讨反应热的实质
情境导入 反应H2(g)+Cl2(g)2HCl(g)的变化过程及其能量变化如图所示。
问题生成
1.填写下表中的能量变化:
化学键 反应中能量变化
1 mol A—B化学键 反应中能量变化
H—H 吸收 kJ 共吸收 kJ
Cl—Cl 吸收 kJ
H—Cl 放出 kJ 共放出 kJ
结论 H2(g)+Cl2(g)2HCl(g)的反应热ΔH= kJ·mol-1
【答案】436 243 679 431 862 -183
2.化学反应中能量变化的主要原因是什么
【答案】化学键断裂和形成时的能量变化。
【核心归纳】
从微观角度认识化学反应能量变化的原因
ΔH=Q1-Q2
【典型例题】
【例3】由下列键能数据大小,不能得出的事实是( )。
化学键 O—H H—H OO
键能/(kJ·mol-1) 463 436 498.3
A.1 mol H2和 mol O2的总能量大于1 mol H2O的总能量
B.断开1 mol H2中的化学键所吸收的能量是436 kJ
C.H2(g)+O2(g)H2O(g) ΔH=-240.85 kJ·mol-1
D.生成1 mol H2O(g)的化学键所放出的热量是463 kJ
【答案】D
【解析】反应焓变等于反应物总键能减去生成物总键能,则H2(g)+O2(g)H2O(g) ΔH=436 kJ·mol-1+×498.3 kJ·mol-1-2×463 kJ·mol-1=-240.85 kJ·mol-1。A项,由分析可知,反应放热,则反应物总能量大于生成物总能量,正确;B项,1分子氢气中含有1个H—H,断开1 mol H2中的化学键所吸收的能量是436 kJ,正确;C项,由分析可知,正确;D项,1分子水中含有2个O—H,生成1 mol H2O(g)的化学键所放出的热量是926 kJ,错误。
【例4】已知某些化学键键能如下,下列说法不正确的是( )。
化学键 H—H Cl—Cl Br—Br H—Cl H—Br
键能/(kJ·mol-1) 436 243 194 432 a
A.根据键能可估算反应H2(g)+Cl2 (g)2HCl(g)的ΔH=-185 kJ·mol-1
B.根据原子半径可知键长:H—Cl
D.常温下Cl2和Br2的状态不同,与Cl—Cl和Br—Br的键能有关
【答案】D
【解析】A项,反应热=反应物总键能-生成物总键能,则H2(g)+Cl2(g)2HCl(g) ΔH=+436 kJ·mol-1+243 kJ·mol-1-2×432 kJ·mol-1=-185 kJ·mol-1,正确;B项,Cl原子半径小于Br原子,H—Cl的键长比H—Br的短, H—Cl的键能比H—Br的大,进而推测a<432,正确;C项,键能:Cl—Cl>Br—Br,反应生成HBr比生成HCl更难,放出的热量更少,故生成2 mol HBr (g)时,放出的热量小于185 kJ,正确;D项,Cl—Cl键能大于Br—Br键能,说明Cl2分子比Br2分子稳定,破坏的是共价键,而状态由分子间作用力决定,错误。
灵犀一点:反应热的计算方法
宏观角度:ΔH=生成物总能量-反应物总能量。
微观角度:ΔH=反应物总键能-生成物总键能。
任务3:中和反应反应热的测定
情境导入 不同的化学反应具有不同的反应热,把盐酸和氢氧化钠溶液混合于烧杯中,触摸烧杯壁,感受温度的变化。化学上规定:在稀溶液中,强酸与强碱发生中和反应生成1 mol H2O时的反应热叫中和反应反应热。人们可以通过多种方法获得中和反应反应热的数据,最直接的方法就是通过实验进行测定。
【实验探究】
1.实验测量
按下列操作步骤测定盐酸与氢氧化钠溶液反应的反应热。
①用量筒量取50 mL 0.50 mol·L-1的盐酸,打开杯盖,倒入量热计(如图)的内筒中,盖上杯盖,插入温度计,测量并记录盐酸的温度。用水把温度计上的酸冲洗干净,擦干备用。
②用另一量筒量取50 mL 0.55 mol·L-1的NaOH溶液,用温度计测量并记录NaOH溶液的温度。
③打开杯盖,将量筒中的NaOH溶液迅速倒入量热计的内筒中,立即盖上杯盖,插入温度计,用玻璃搅拌器匀速搅拌,密切关注温度变化,将最高温度记为反应后体系的温度(t2)。
④重复上述步骤两次。
在上述过程中,提高测定反应热准确度的措施有哪些
【答案】用保温效果较好的量热计;温度计使用后及时冲洗并擦干;NaOH溶液稍过量;用玻璃搅拌器匀速搅拌;操作动作迅速;多次测量取平均值。
2.原理分析
(1)实验为何使用0.55 mol·L-1 NaOH溶液与0.50 mol·L-1盐酸反应,而不是选用0.50 mol·L-1 NaOH溶液
(2)若用0.55 mol·L-1 KOH溶液代替0.55 mol·L-1 NaOH 溶液,对结果会产生影响吗 为什么
(3)①用浓硫酸代替盐酸对结果会产生什么影响
②用醋酸代替盐酸对结果会产生什么影响
(4)完整地做一次这样的实验,需测定多次温度,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点 为什么
【答案】(1)碱过量的目的是保证盐酸完全反应。
(2)无影响。因为强酸、强碱的稀溶液反应生成1 mol H2O(l)时放出的热量是相同的,与用KOH溶液还是NaOH 溶液以及酸、碱的用量无关。
(3)①浓硫酸溶于水时放热,所测反应热的数值偏大。
②弱酸、弱碱电离吸热,所测反应热的数值偏小。
(4)不同意,因为不同温度计精确度不同。
3.数据处理
[取盐酸温度和NaOH溶液温度的平均值记为反应前体系的温度(t1)]
(1)为记录本实验的实验数据,请设计实验记录表。
(2)量热计直接测得的数据是什么 通过什么公式计算反应热
(3)计算反应热。(为了计算简便,近似地认为实验所用酸、碱溶液的密度与水相同,都是1 g·mL-1,中和后生成的溶液的比热容与液态水相同,为4.18 J·g-1·℃-1)
(4)若上述实验测得t2-t1=3.4 ℃,则ΔH= (精确至0.01)kJ·mol-1。
答案(1)
实验 次数 反应物的温度/℃ 反应前体系的温度 反应后体系的温度 温度差
盐酸 NaOH溶液 t1/℃ t2/℃ (t2-t1)/℃
1
2
3
(2)体系温度的变化;Q=cmΔt(Q:反应放出的热量,m:反应混合液的总质量,c:反应混合液的比热容,Δt:反应前后溶液温度的变化量)。
(3)50 mL 0.50 mol·L-1盐酸的质量m1=50 g,50 mL 0.55 mol·L-1 NaOH溶液的质量m2=50 g。中和后生成的溶液的比热容c=4.18 J·g-1·℃-1,则放出的热量为(m1+m2)·c·(t2-t1)=0.418(t2-t1) kJ,生成1 mol H2O时的反应热ΔH=- kJ·mol-1。
(4)-56.85
4.误差分析
在下表空格内填“偏大”、“偏小”或“不变”。
引起误差的原因 与ΔH=-57.3 kJ·mol-1比较
保温措施不好
若将玻璃搅拌器改成“铜棒”
搅拌不充分
量取NaOH溶液和盐酸时,均仰视刻度线
用同浓度的氨水代替NaOH溶液
引起误差的原因 与ΔH=-57.3 kJ·mol-1比较
用同浓度的CH3COOH溶液代替盐酸
最后记录的温度不是最高温度
【答案】偏大 偏大 偏大 偏小 偏大 偏大 偏大
【核心归纳】
1.正确理解中和反应反应热
(1)离子方程式符合H++OH-H2O的稀的强酸与稀的强碱溶液反应,其中和反应反应热均相等,且室温下与强酸、强碱的用量无关。
(2)相同温度下,用稀的弱酸或弱碱测得的中和反应反应热会变大。
2.中和反应反应热测定实验的注意事项
(1)为了保证0.50 mol·L-1的盐酸完全被NaOH中和,采用0.55 mol·L-1NaOH溶液,使碱稍稍过量,因为过量的碱并不参加中和反应。
(2)先后测量酸、碱及混合液的温度时,测定一种溶液后必须用水冲洗干净并用滤纸擦干。温度计的水银球部分要完全浸入溶液中,且要稳定一段时间再记下读数。
(3)实验中所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温,才能使用。
(4)操作时动作要快,尽量减少热量的散失。
(5)实验时亦可选用浓度、体积都不相同的酸、碱溶液进行中和反应反应热的测定,但在计算时,应取二者中量少的一种,因为过量的酸或碱并不参加中和反应。
【典型例题】
【例5】某化学兴趣小组用50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行中和反应反应热的测定实验,实验装置如图所示。试回答下列问题:
(1)实验时玻璃搅拌器的使用方法是 ;不能用铜质搅拌器代替玻璃搅拌器的理由是 。
(2)某同学记录的实验数据如表所示。(已知:实验中盐酸和氢氧化钠溶液的密度均为1 g·cm-3,中和反应后溶液的比热容c=4.18 J·g-1·℃-1)
实验 序号 起始温度T1/℃ 终止温度T2/℃
盐酸 氢氧化钠溶液 混合溶液
1 20.0 20.2 23.3
2 20.2 20.4 23.4
3 20.4 20.6 23.8
依据该同学的实验数据计算,该实验测得反应放出的热量为 J。
(3)下列操作会导致实验结果出现偏差的是 (填字母)。
a.用量筒量取盐酸的体积时仰视读数
b.把量筒中的氢氧化钠溶液分多次倒入盐酸中
c.将50 mL 0.55 mol·L-1氢氧化钠溶液取成了50 mL 0.55 mol·L-1氢氧化钾溶液
d.做本实验的当天室温较高
(4)如果将NaOH溶液换成等量的NaOH固体,那么实验中测得的中和反应反应热(ΔH) (填“偏大”、“偏小”或“不变”)。
(5)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行实验,与上述实验相比,二者所放出的热量 (填“相等”或“不相等”,下同),所求的中和反应反应热(ΔH) 。
【答案】(1)上下匀速搅动 Cu是热的良导体,传热快,热量损失大
(2)1337.6
(3)ab
(4)偏小
(5)不相等 相等
【解析】(1)实验时为防止打断温度计,玻璃搅拌器的使用方法是上下匀速搅动;Cu是热的良导体,传热快,热量损失大,所以不能用铜质搅拌器代替玻璃搅拌器。(2)三次温度差分别为3.2 ℃、3.1 ℃、3.3 ℃,温度的平均值为3.2 ℃,溶液的总质量为100 g,该实验测得反应放出的热量为Q=100 g×4.18 J·g-1·℃-1×3.2 ℃=1337.6 J。(3)a项,用量筒量取盐酸的体积时仰视读数,会使盐酸的体积不准确,导致实验结果出现偏差;b项,把量筒中的氢氧化钠溶液分多次倒入盐酸中,会使热量散失,导致实验结果出现偏差;c项,将50 mL 0.55 mol·L-1氢氧化钠溶液取成了50 mL 0.55 mol·L-1氢氧化钾溶液,OH-的物质的量不变,对实验结果没有影响;d项,做本实验的当天室温较高,但测量的是温度差,与室温无关,对实验结果没有影响。(4)如果将NaOH溶液换成等量的NaOH固体,由于氢氧化钠固体溶解会放出热量,导致放热增多,使实验测得的中和反应反应热(ΔH)偏小。(5)如果用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液进行实验,由于试剂的量不同,所放出的热量与上述实验不相等,但中和反应反应热是换算成生成1 mol H2O(l)时放出的热量,所求的中和反应反应热(ΔH)与上述反应相等。
灵犀一点:导致中和反应反应热测定存在误差的原因
(1)量取溶液的体积不准确。
(2)温度计读数有误(如未读取到混合溶液的最高温度,就记为终止温度)。
(3)实验过程中有液体溅出。
(4)混合酸、碱溶液时,动作缓慢。
(5)隔热层隔热效果不好,实验过程中有热量损失。
(6)测过酸溶液的温度计未用水清洗擦干便立即去测碱溶液的温度。
(7)溶液浓度不准确。
(8)没有进行重复实验。
【随堂检测】
课堂基础
1.下列反应既属于氧化还原反应,又属于吸热反应的是( )。
A.铝片与稀盐酸反应
B.Ba(OH)2·8H2O与NH4Cl反应
C.灼热的炭与CO2反应
D.甲烷在氧气中的燃烧反应
【答案】C
【解析】Al与盐酸的反应是放热反应;B项反应是吸热反应,但不是氧化还原反应;灼热的C和CO2反应生成CO,该反应既是氧化还原反应,又是吸热反应;甲烷的燃烧是放热反应。
2.下列有关中和反应反应热测定实验的说法正确的是( )。
A.温度计能代替玻璃搅拌器,用于搅拌反应物
B.强酸与强碱反应生成1 mol H2O(l)释放的热量都约为57.3 kJ
C.该实验中,读取混合溶液不再变化的温度为终止温度
D.内筒内若有水残留,会使测得的反应热数值绝对值偏小
【答案】D
【解析】A项,温度计不能代替玻璃搅拌器,温度计只能用于测量溶液的温度,错误;B项,强酸与强碱发生中和反应生成1 mol H2O(l)时,放出的热量不一定等于57.3 kJ,如浓硫酸与NaOH溶液反应生成1 mol H2O(l)时,放出的热量大于57.3 kJ,错误;C项,测定中和反应反应热时,应读取混合溶液的最高温度,错误;D项,内筒内残留水,使溶液的质量偏大,混合液最高温度降低,温度差减小,测得的反应热数值绝对值偏小,正确。
3.甲烷与氯气发生取代反应分别生成1 mol相关有机物的能量变化如图所示:
已知Cl—Cl、C—Cl键能分别为243 kJ·mol-1、327 kJ·mol-1,下列说法不正确的是( )。
A.1 mol CH4(g)的能量比1 mol CH2Cl2(g)的能量多197 kJ
B.CH4与Cl2的取代反应是放热反应
C.ΔH4≈ΔH3≈ΔH2≈ΔH1,说明CH4与Cl2的四步取代反应,难易程度相当
D.CH4(g)+Cl·(g)CH3·(g)+HCl(g) ΔH=-15 kJ·mol-1
【答案】A
【解析】A项,由图可知,甲烷和氯气反应生成CH2Cl2(g)的同时还会生成氯化氢,故不能说明1 mol CH4(g)的能量比1 mol CH2Cl2(g)的能量多197 kJ,错误;B项,由图可知,焓变均为负值,则为放热反应,正确; C项,ΔH4≈ΔH3≈ΔH2≈ΔH1,说明CH4与Cl2的四步取代反应每多取代1个氢原子的难易程度相当,正确;D项,CH4(g)+Cl·(g)CH3·(g)+HCl(g)反应中,断裂了1 mol C—H,形成了1 mol H—Cl,已知Cl—Cl、C—Cl键能分别为243 kJ·mol-1、327 kJ·mol-1,反应CH4(g)+Cl2(g)CH3Cl(g)+HCl(g)的焓变为ΔH=4×E(C—H)+E(Cl—Cl)-3×E(C—H)-E(C—Cl)-E(H—Cl)=-99 kJ·mol-1,即E(C—H)+243 kJ·mol-1-327 kJ·mol-1-E(H—Cl)=-99 kJ·mol-1,E(C—H)-E(H—Cl)=-15 kJ·mol-1,故CH4(g)+Cl·(g)CH3·(g)+HCl(g) ΔH=-15 kJ·mol-1,正确。
对接高考
4.(2022·浙江省6月选考,18)标准状态下,下列物质气态时的相对能量如下表:
物质(g) O H HO HOO H2 O2 H2O2 H2O
能量/(kJ·mol-1) 249 218 39 10 0 0 -136 -242
可根据HO(g)+HO(g)H2O2(g)计算出H2O2中氧氧单键的键能为214 kJ·mol-l。下列说法不正确的是( )。
A.H2的键能为436 kJ·mol-l
B.O2的键能大于H2O2中氧氧单键的键能的两倍
C.解离氧氧单键所需能量: HOO
【答案】C
【解析】A项,根据表格中的数据可知,H2的键能为218 kJ·mol-1×2=436 kJ·mol-1,正确;B项,由表格中的数据可知,O2的键能为249 kJ·mol-1×2=498 kJ·mol-l,由题中信息可知,H2O2中氧氧单键的键能为214 kJ·mol-l,则O2的键能大于H2O2中氧氧单键的键能的两倍,正确;C项,由表格中的数据可知,HOOHO+O,解离其中氧氧单键需要的能量为(249+39-10) kJ·mol-1=278 kJ·mol-1,H2O2中氧氧单键的键能为214 kJ·mol-1<278 kJ·mol-1,错误;D项,由表中的数据可知,H2O(g)+O(g)H2O2(g) ΔH=[-136-249-(-242)] kJ·mol-1=-143 kJ·mol-1,正确。
2
