河北南宫中学2015-2016学年高一化学人教必修1学案:第二章化学物质及其它复习课
文档属性
| 名称 | 河北南宫中学2015-2016学年高一化学人教必修1学案:第二章化学物质及其它复习课 | 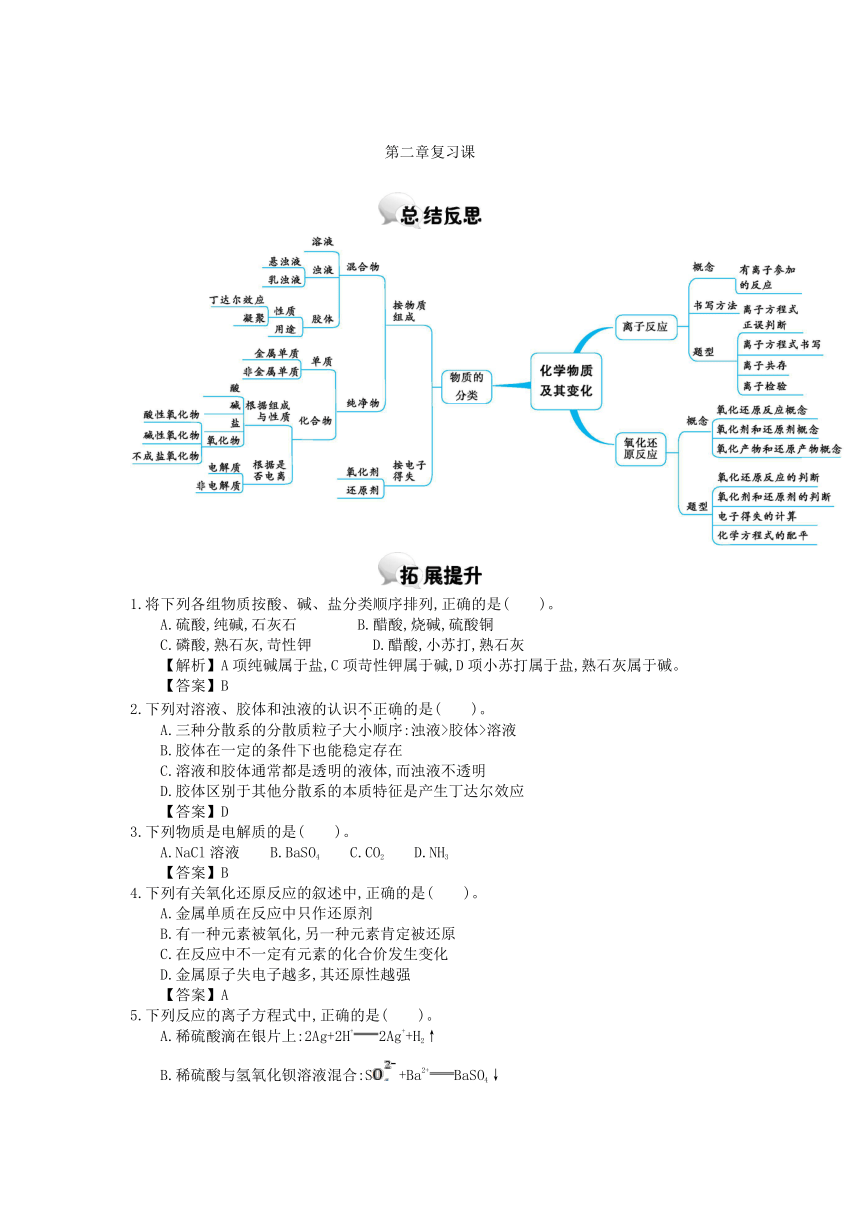 | |
| 格式 | zip | ||
| 文件大小 | 349.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-10-17 18:52:29 | ||
图片预览




文档简介
第二章复习课
( http: / / www.21cnjy.com )
1.将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )。
A.硫酸,纯碱,石灰石 B.醋酸,烧碱,硫酸铜
C.磷酸,熟石灰,苛性钾 D.醋酸,小苏打,熟石灰
【解析】A项纯碱属于盐,C项苛性钾属于碱,D项小苏打属于盐,熟石灰属于碱。
【答案】B
2.下列对溶液、胶体和浊液的认识不正确的是( )。
A.三种分散系的分散质粒子大小顺序:浊液>胶体>溶液
B.胶体在一定的条件下也能稳定存在
C.溶液和胶体通常都是透明的液体,而浊液不透明
D.胶体区别于其他分散系的本质特征是产生丁达尔效应
【答案】D
3.下列物质是电解质的是( )。
A.NaCl溶液 B.BaSO4 C.CO2 D.NH3
【答案】B
4.下列有关氧化还原反应的叙述中,正确的是( )。
A.金属单质在反应中只作还原剂
B.有一种元素被氧化,另一种元素肯定被还原
C.在反应中不一定有元素的化合价发生变化
D.金属原子失电子越多,其还原性越强
【答案】A
5.下列反应的离子方程式中,正确的是( )。
A.稀硫酸滴在银片上:2Ag+2H+2Ag++H2↑
B.稀硫酸与氢氧化钡溶液混合:S+Ba2+BaSO4↓
C.稀硝酸滴在大理石上:CaCO3+2H+Ca2++H2CO3
D.氧化铁与稀盐酸混合:Fe2O3+6H+2Fe3++3H2O
【答案】D
6.根据反应①2FeCl3+2KI2FeCl2+2KCl+I2,②2FeCl2+Cl22FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是( )。
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2
【解析】由化学方程式①可知Fe3+的氧化性强于I2,由②可知Cl2的氧化性强于Fe3+,故D项正确。
【答案】D
7.写出下列离子方程式能表示的一个化学方程式:
(1)C+2H+H2O+CO2↑ ;
(2)CO2+2OH-C+H2O ;
(3)Ba2++SBaSO4↓ ;
(4)2Ag++CuCu2++2Ag 。
【答案】(1)Na2CO3+2HCl2NaCl+H2O+CO2↑
(2)2NaOH+CO2Na2CO3+H2O
(3)BaCl2+Na2SO42NaCl+BaSO4↓
(4)2AgNO3+Cu2Ag+Cu(NO3)2(其他合理答案亦可)
8.砷及其化合物有毒,如砒霜(As2O3)有剧毒,环境监测法和医学分析砒霜中毒的反应原理均为As2O3+6Zn+12HCl6ZnCl2+2AsH3↑+3H2O。反应中氧化剂是 ,用单线桥法表示该反应的电子转移关系: ;若有3.25 g的Zn参加反应,则该反应中转移的电子数为 个(用NA表示阿伏加德罗常数)。
【答案】As2O3;
;0.1NA
一、选择题(本题包括15小题,共45分)
1.人体正常血红蛋白中应含Fe2+,若误 ( http: / / www.21cnjy.com )食亚硝酸盐,则导致血红蛋白中Fe2+转化为高铁血红蛋白而中毒。服用维生素C可解除亚硝酸盐中毒。下列叙述正确的是( )。
A.亚硝酸盐是还原剂
B.维生素C是氧化剂
C.亚硝酸盐被氧化
D.维生素C将Fe3+还原成Fe2+
【解析】亚硝酸盐中毒时,亚硝酸盐将Fe2+ ( http: / / www.21cnjy.com )氧化为Fe3+,因此亚硝酸盐作为氧化剂,被还原,A、C两项错误;维生素C解毒时,将Fe3+还原成Fe2+,本身作为还原剂,B项错误、D项正确。
【答案】D
2.蚂蚁等昆虫叮咬人时,会向人体射入一种蚁 ( http: / / www.21cnjy.com )酸(具有酸性的物质),使皮肤红肿、瘙痒,甚至疼痛。要消除这种症状,可在叮咬处涂抹下列物质中的( )。
A.NaHCO3溶液(呈弱碱性) B.食盐水
C.火碱液 D.食醋
【答案】A
3.下列有关物质的分类正确的组合是( )。
酸 碱 盐 碱性氧化物 酸性氧化物
A 盐酸 纯碱 烧碱 氧化铝 二氧化碳
B 硫酸 烧碱 食盐 氧化镁 一氧化碳
C 醋酸 苛性钠 CuSO4 过氧化钠 二氧化硫
D 硝酸 苛性钾 苏打 氧化钠 SO3
【答案】D
4.下列说法中正确的是( )。
A.氧化还原反应的实质是元素化合价发生变化
B.还原剂是一种能得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的
【答案】D
5.关于溶液中的离子反应, ( http: / / www.21cnjy.com )有下列说法:①不可能是氧化还原反应;②只能是复分解反应;③可能是置换反应;④不能有分子参加。其中正确的是( )。
A.①③ B.③ C.①② D.③④
【答案】B
6.下列物质中含有自由移动的S2-的是( )。
A.K2SO4溶液 B.K2S溶液
C.液态K2SO4 D.固体K2S
【答案】B
7.下列电离方程式书写正确的是( )。
A.Al2(SO4)32Al3++3S
B.AlCl3Al3++C
C.Mg(NO3)2Mg+2+2N
D.KMnO4K++Mn7++4O2-
【答案】A
8.磁性纳米材料TiO2·SiO2·NiFe2O4具有光催化活性,其制备的第一步反应为2Fe3++Ni2++8OH-NiFe2O4+4H2O。下列说法正确的是( )。
A.该反应的氧化剂是Fe3+
B.该反应的还原剂是Ni2+
C.Na2Fe2O4氧化性比KMnO4的氧化性强
D.该反应不是氧化还原反应
【解析】NiFe2O4中各元素化合价Ni:+2价、Fe:+3价、O:-2价,反应前后化合价没变,该反应不是氧化还原反应。
【答案】D
9.下列各组物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是(注:F没有正价)( )。
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2 D.O2、SO2、H2O
【解析】元素具有最高价时只有氧化性,具有最低化合价时只有还原性,而处于中间价态时既具有氧化性又具有还原性。
【答案】A
10.下列实验装置或操作与粒子的大小无直接关系的是( )。
( http: / / www.21cnjy.com )
【解析】过滤是利用溶液中的粒子可透过滤 ( http: / / www.21cnjy.com )纸,A项有关;渗析是利用胶体粒子不能透过半透膜,而溶液中离子能透过半透膜,B项有关;萃取是利用了物质在不同溶剂中溶解性的不同,与分散质粒子大小无关;丁达尔效应是胶体粒子对光线的散射作用形成的,D项无关。
【答案】C
11.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )。
A.Na+、K+、OH-、Cl- B.Na+、Cu2+ 、S、N
C.Mg2+、Na+、S、Cl- D.Ba2+、HC、S、K+
【答案】C
12.下列化学方程式中,能用离子方程式S+Ba2+BaSO4↓来表示的是( )。
A.BaCO3+H2SO4BaSO4↓+H2O+CO2↑
B.BaCl2+Na2CO3BaCO3↓+2NaCl
C.Ba(OH)2+CuSO4Cu(OH)2↓+BaSO4↓
D.BaCl2+Na2SO4BaSO4↓+2NaCl
【解析】A项中BaCO3难溶,不能改写为离子形式;B项中无硫酸盐;C项中Cu2+和OH-也参加离子反应;D项正确。
【答案】D
13.下列反应的现象描述与离子方程式都正确的是( )。
A.金属镁与稀盐酸反应:有气泡逸出 Mg+2H++2Cl-MgCl2+H2↑
B.氯化钡溶液与稀硫酸反应:有白色沉淀生成 Ba2++SBaSO4↓
C.碳酸钠溶液与盐酸反应:有气泡逸出 Na2CO3+2H+2Na++CO2↑+H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生 2HC+Ba2++2OH-BaCO3↓+2H2O+C
【答案】B
14.已知有如下反应:①2Fe3++2I-2Fe2++I2;②2Fe2++Br22Fe3++2Br-;③2Fe(CN+I22Fe(CN+2I-,试判断氧化性强弱顺序( )。
A.Fe3+>Br2>I2>Fe(CN
B.Br2>I2>Fe3+>Fe(CN
C.Br2>Fe3+>I2>Fe(CN
D.Fe(CN>Fe3+>Br2>I2
【答案】C
15.实验室制取少量N2常利用的反应是NaNO2+NH4ClNaCl+N2↑+2H2O,关于该反应的说法正确的是( )。
A.NaNO2是氧化剂
B.生成1 mol N2时转移的电子数为6 mol
C.NH4Cl中的N元素被还原
D.N2既是氧化剂又是还原剂
【答案】A
二、非选择题(本题包括7小题,共55分)
16.将1 mol·L-1的FeCl3溶液逐滴滴入沸水中,且持续加热一段时间。
(1)液体变为 色,得到的是 ,反应的化学方程式为 。
(2)为证明确实得到该物质,可采取的方法是 。
(3)向其中逐滴加入过量稀硫酸,现象是 ;原因是 (用离子方程式表示)。
【答案】(1)褐;Fe(OH)3胶体;FeCl3+3H2OFe(OH)3(胶体)+3HCl
(2)用一束光照射该化合物,若有丁达尔现象,说明生成了Fe(OH)3胶体
(3)先产生沉淀,后沉淀溶解;Fe(OH)3(胶体)+3H+Fe3++3H2O
17.以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面。(各空填写一个化学式即可)
物质类别 酸 碱 盐 氧化物 氢化物
化学式 ①HCl② ③ ④Ba(OH)2 ⑤Na2CO3⑥ ⑦CO2⑧Na2O ⑨NH3⑩H2O
(1)写出⑦转化为⑤的化学方程式: 。
(2)写出①与③反应的离子方程式: 。
(3)写出②与⑤反应的离子方程式: 。
【答案】H2SO4(或HNO3);NaOH(或KOH);Na2SO4(或K2SO4)(其他正确答案也可以)
(1)2NaOH+CO2Na2CO3+H2O
(2)H++OH-H2O
(3)C+2H+H2O+CO2↑
18.某化学反应的反应物和产物如下:Al+NaNO3+H2OAl(OH)3+N2↑+NaAlO2(未配平)。
(1)该反应的氧化剂是 。
(2)该反应的氧化产物是 。
(3)若反应过程中共转移5 mol e-,则生成标准状况下N2的体积为 L。
(4)配平该反应的化学方程式:
Al+ NaNO3+ H2O Al(OH)3+ N2+ NaAlO2
【解析】(1)反应过程中N的化合价降低,则氧化剂为NaNO3。(2)反应中Al作还原剂,对应的Al(OH)3,NaAlO2为氧化产物。(3)根据2NN2可知,转移5 mol e-时生成0.5 mol N2,在标准状况下的体积为11.2 L。(4)根据得失电子守恒配平该化学方程式:10Al+6NaNO2+6H2O4Al(OH)3+3N2↑+6NaAlO2。
【答案】(1)NaNO3
(2)Al(OH)3、NaAlO2
(3)11.2
(4)10;6;6;4;3;6
19.煅烧MgSO4过程存在以下反应:
MgSO4+CMgO+SO2↑+CO2↑(未配平)
MgSO4+CMgO+SO2↑+CO↑
利用下图装置对煅烧产生的气体进行吸收或收集
( http: / / www.21cnjy.com )
(1)C中收集的气体是 (填化学式)。
(2)B中盛放的溶液可以是 (填字母)。
a.NaOH 溶液
b.KOH 溶液
c.稀盐酸
d.稀硫酸
B中反应的离子方程式是 。
(3)反应MgSO4+CMgO+SO2↑+CO2↑中氧化剂与还原剂的物质的量之比为 ,氧化产物是 。
【解析】SO2、CO2都是酸性气体 ( http: / / www.21cnjy.com ),可用碱溶液吸收,所以C中收集的气体是CO;MgSO4中S化合价降低是氧化剂,C化合价升高是还原剂,其化合价变化如下:
依据化合价升降总数相等,MgSO4与C物质的量之比为2∶1。
【答案】(1)CO
(2)ab;CO2+2OH-C+H2O,SO2+2OH-S+H2O
(3)2∶1;CO2
20.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式: 。
(2)下列三种情况下,离子方程式与(1)相同的是 (填字母)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至S恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图甲中 曲线表示(填序号)。
( http: / / www.21cnjy.com )
(4)若有一表面光滑的塑料小球悬浮 ( http: / / www.21cnjy.com )于Ba(OH)2溶液中央,如图乙所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。
【解析】(1)Ba(OH)2和H2SO4反应生成BaSO4和H2O,其中Ba(OH)2和H2SO4拆成离子形式,BaSO4和H2O写化学式。(2)B、C两项中离子方程式为H++S+Ba2++OH-BaSO4↓+H2O。(3)缓缓加入稀硫酸的过程中,溶液中离子浓度先减小,后增大,溶液导电能力先减小后增大,可用图C表示。(4)随着反应的发生,溶液的密度减小,小球沉入烧杯底部。
【答案】(1)Ba2++2OH-+2H++SBaSO4↓+2H2O
(2)A
(3)C
(4)沉到烧杯底部
21.有五瓶未贴标签的试剂,分别盛有AgNO ( http: / / www.21cnjy.com )3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量上述溶液,多次进行两两混合反应,反应现象为A与B、A与E产生沉淀,B与D、B与E产生沉淀,C与E、D与E产生气体,而C与D无反应现象。
(1)判定各试剂瓶中所盛试剂:A 、B 、C、 、D 、E 。
(2)请写出下列要求的离子方程式:
A与E: 。
B与E: 。
C与E: 。
【解析】根据题意,E与A、 ( http: / / www.21cnjy.com )B分别产生沉淀,与C、D分别产生气体,可推断E为K2CO3溶液;A、B可能为AgNO3和BaCl2中的一种,可判断C、D必为稀硝酸和盐酸中的一种,而B与D能产生沉淀,可确定B为AgNO3溶液,D为盐酸,因此A为BaCl2溶液,C为稀硝酸。
【答案】(1)BaCl2;AgNO3;HNO3;盐酸;K2CO3
(2)Ba2++CBaCO3↓;2Ag++CAg2CO3↓;C+2H+CO2↑+H2O
22.向盛有KI溶液的试管中滴加氯水,依次发生下列反应:
①2I-+Cl22Cl-+I2
②I2+Cl2+H2OHIO3+HCl(未配平)
(1)反应①中 发生了氧化反应,反应②中的氧化剂是 。
(2)已知HBrO3+HClBr2+Cl2+H2O(未配平),则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(3)反应②中I2与Cl2的化学计量数之比为 。
【解析】(1)反应①中I元素化合价升高发生了氧化反应;反应②中Cl元素化合价降低,Cl2作氧化剂。
(2)反应②中的氧化剂是Cl2,氧化性:Cl2>HIO3,反应HBrO3+HClBr2+Cl2+H2O中的氧化剂是HBrO3,氧化性:HBrO3>Cl2,所以氧化性由强到弱的顺序是HBrO3>Cl2>HIO3。
(3)反应I2+Cl2+H2OHIO3+HCl中1个I化合价升高5,则1个I2化合价升高10;1个Cl化合价降低1,则1个Cl2化合价降低2,最小公倍数为10,所以I2的计量数为1,Cl2的计量数为5,I2与Cl2的计量数之比为1∶5。
【答案】(1)I-;Cl2
(2)HBrO3>Cl2>HIO3
(3)1∶5
( http: / / www.21cnjy.com )
1.将下列各组物质按酸、碱、盐分类顺序排列,正确的是( )。
A.硫酸,纯碱,石灰石 B.醋酸,烧碱,硫酸铜
C.磷酸,熟石灰,苛性钾 D.醋酸,小苏打,熟石灰
【解析】A项纯碱属于盐,C项苛性钾属于碱,D项小苏打属于盐,熟石灰属于碱。
【答案】B
2.下列对溶液、胶体和浊液的认识不正确的是( )。
A.三种分散系的分散质粒子大小顺序:浊液>胶体>溶液
B.胶体在一定的条件下也能稳定存在
C.溶液和胶体通常都是透明的液体,而浊液不透明
D.胶体区别于其他分散系的本质特征是产生丁达尔效应
【答案】D
3.下列物质是电解质的是( )。
A.NaCl溶液 B.BaSO4 C.CO2 D.NH3
【答案】B
4.下列有关氧化还原反应的叙述中,正确的是( )。
A.金属单质在反应中只作还原剂
B.有一种元素被氧化,另一种元素肯定被还原
C.在反应中不一定有元素的化合价发生变化
D.金属原子失电子越多,其还原性越强
【答案】A
5.下列反应的离子方程式中,正确的是( )。
A.稀硫酸滴在银片上:2Ag+2H+2Ag++H2↑
B.稀硫酸与氢氧化钡溶液混合:S+Ba2+BaSO4↓
C.稀硝酸滴在大理石上:CaCO3+2H+Ca2++H2CO3
D.氧化铁与稀盐酸混合:Fe2O3+6H+2Fe3++3H2O
【答案】D
6.根据反应①2FeCl3+2KI2FeCl2+2KCl+I2,②2FeCl2+Cl22FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是( )。
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2
【解析】由化学方程式①可知Fe3+的氧化性强于I2,由②可知Cl2的氧化性强于Fe3+,故D项正确。
【答案】D
7.写出下列离子方程式能表示的一个化学方程式:
(1)C+2H+H2O+CO2↑ ;
(2)CO2+2OH-C+H2O ;
(3)Ba2++SBaSO4↓ ;
(4)2Ag++CuCu2++2Ag 。
【答案】(1)Na2CO3+2HCl2NaCl+H2O+CO2↑
(2)2NaOH+CO2Na2CO3+H2O
(3)BaCl2+Na2SO42NaCl+BaSO4↓
(4)2AgNO3+Cu2Ag+Cu(NO3)2(其他合理答案亦可)
8.砷及其化合物有毒,如砒霜(As2O3)有剧毒,环境监测法和医学分析砒霜中毒的反应原理均为As2O3+6Zn+12HCl6ZnCl2+2AsH3↑+3H2O。反应中氧化剂是 ,用单线桥法表示该反应的电子转移关系: ;若有3.25 g的Zn参加反应,则该反应中转移的电子数为 个(用NA表示阿伏加德罗常数)。
【答案】As2O3;
;0.1NA
一、选择题(本题包括15小题,共45分)
1.人体正常血红蛋白中应含Fe2+,若误 ( http: / / www.21cnjy.com )食亚硝酸盐,则导致血红蛋白中Fe2+转化为高铁血红蛋白而中毒。服用维生素C可解除亚硝酸盐中毒。下列叙述正确的是( )。
A.亚硝酸盐是还原剂
B.维生素C是氧化剂
C.亚硝酸盐被氧化
D.维生素C将Fe3+还原成Fe2+
【解析】亚硝酸盐中毒时,亚硝酸盐将Fe2+ ( http: / / www.21cnjy.com )氧化为Fe3+,因此亚硝酸盐作为氧化剂,被还原,A、C两项错误;维生素C解毒时,将Fe3+还原成Fe2+,本身作为还原剂,B项错误、D项正确。
【答案】D
2.蚂蚁等昆虫叮咬人时,会向人体射入一种蚁 ( http: / / www.21cnjy.com )酸(具有酸性的物质),使皮肤红肿、瘙痒,甚至疼痛。要消除这种症状,可在叮咬处涂抹下列物质中的( )。
A.NaHCO3溶液(呈弱碱性) B.食盐水
C.火碱液 D.食醋
【答案】A
3.下列有关物质的分类正确的组合是( )。
酸 碱 盐 碱性氧化物 酸性氧化物
A 盐酸 纯碱 烧碱 氧化铝 二氧化碳
B 硫酸 烧碱 食盐 氧化镁 一氧化碳
C 醋酸 苛性钠 CuSO4 过氧化钠 二氧化硫
D 硝酸 苛性钾 苏打 氧化钠 SO3
【答案】D
4.下列说法中正确的是( )。
A.氧化还原反应的实质是元素化合价发生变化
B.还原剂是一种能得到电子的物质
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的
【答案】D
5.关于溶液中的离子反应, ( http: / / www.21cnjy.com )有下列说法:①不可能是氧化还原反应;②只能是复分解反应;③可能是置换反应;④不能有分子参加。其中正确的是( )。
A.①③ B.③ C.①② D.③④
【答案】B
6.下列物质中含有自由移动的S2-的是( )。
A.K2SO4溶液 B.K2S溶液
C.液态K2SO4 D.固体K2S
【答案】B
7.下列电离方程式书写正确的是( )。
A.Al2(SO4)32Al3++3S
B.AlCl3Al3++C
C.Mg(NO3)2Mg+2+2N
D.KMnO4K++Mn7++4O2-
【答案】A
8.磁性纳米材料TiO2·SiO2·NiFe2O4具有光催化活性,其制备的第一步反应为2Fe3++Ni2++8OH-NiFe2O4+4H2O。下列说法正确的是( )。
A.该反应的氧化剂是Fe3+
B.该反应的还原剂是Ni2+
C.Na2Fe2O4氧化性比KMnO4的氧化性强
D.该反应不是氧化还原反应
【解析】NiFe2O4中各元素化合价Ni:+2价、Fe:+3价、O:-2价,反应前后化合价没变,该反应不是氧化还原反应。
【答案】D
9.下列各组物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是(注:F没有正价)( )。
A.F2、K、HCl B.Cl2、Al、H2
C.NO2、Na、Br2 D.O2、SO2、H2O
【解析】元素具有最高价时只有氧化性,具有最低化合价时只有还原性,而处于中间价态时既具有氧化性又具有还原性。
【答案】A
10.下列实验装置或操作与粒子的大小无直接关系的是( )。
( http: / / www.21cnjy.com )
【解析】过滤是利用溶液中的粒子可透过滤 ( http: / / www.21cnjy.com )纸,A项有关;渗析是利用胶体粒子不能透过半透膜,而溶液中离子能透过半透膜,B项有关;萃取是利用了物质在不同溶剂中溶解性的不同,与分散质粒子大小无关;丁达尔效应是胶体粒子对光线的散射作用形成的,D项无关。
【答案】C
11.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )。
A.Na+、K+、OH-、Cl- B.Na+、Cu2+ 、S、N
C.Mg2+、Na+、S、Cl- D.Ba2+、HC、S、K+
【答案】C
12.下列化学方程式中,能用离子方程式S+Ba2+BaSO4↓来表示的是( )。
A.BaCO3+H2SO4BaSO4↓+H2O+CO2↑
B.BaCl2+Na2CO3BaCO3↓+2NaCl
C.Ba(OH)2+CuSO4Cu(OH)2↓+BaSO4↓
D.BaCl2+Na2SO4BaSO4↓+2NaCl
【解析】A项中BaCO3难溶,不能改写为离子形式;B项中无硫酸盐;C项中Cu2+和OH-也参加离子反应;D项正确。
【答案】D
13.下列反应的现象描述与离子方程式都正确的是( )。
A.金属镁与稀盐酸反应:有气泡逸出 Mg+2H++2Cl-MgCl2+H2↑
B.氯化钡溶液与稀硫酸反应:有白色沉淀生成 Ba2++SBaSO4↓
C.碳酸钠溶液与盐酸反应:有气泡逸出 Na2CO3+2H+2Na++CO2↑+H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生 2HC+Ba2++2OH-BaCO3↓+2H2O+C
【答案】B
14.已知有如下反应:①2Fe3++2I-2Fe2++I2;②2Fe2++Br22Fe3++2Br-;③2Fe(CN+I22Fe(CN+2I-,试判断氧化性强弱顺序( )。
A.Fe3+>Br2>I2>Fe(CN
B.Br2>I2>Fe3+>Fe(CN
C.Br2>Fe3+>I2>Fe(CN
D.Fe(CN>Fe3+>Br2>I2
【答案】C
15.实验室制取少量N2常利用的反应是NaNO2+NH4ClNaCl+N2↑+2H2O,关于该反应的说法正确的是( )。
A.NaNO2是氧化剂
B.生成1 mol N2时转移的电子数为6 mol
C.NH4Cl中的N元素被还原
D.N2既是氧化剂又是还原剂
【答案】A
二、非选择题(本题包括7小题,共55分)
16.将1 mol·L-1的FeCl3溶液逐滴滴入沸水中,且持续加热一段时间。
(1)液体变为 色,得到的是 ,反应的化学方程式为 。
(2)为证明确实得到该物质,可采取的方法是 。
(3)向其中逐滴加入过量稀硫酸,现象是 ;原因是 (用离子方程式表示)。
【答案】(1)褐;Fe(OH)3胶体;FeCl3+3H2OFe(OH)3(胶体)+3HCl
(2)用一束光照射该化合物,若有丁达尔现象,说明生成了Fe(OH)3胶体
(3)先产生沉淀,后沉淀溶解;Fe(OH)3(胶体)+3H+Fe3++3H2O
17.以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面。(各空填写一个化学式即可)
物质类别 酸 碱 盐 氧化物 氢化物
化学式 ①HCl② ③ ④Ba(OH)2 ⑤Na2CO3⑥ ⑦CO2⑧Na2O ⑨NH3⑩H2O
(1)写出⑦转化为⑤的化学方程式: 。
(2)写出①与③反应的离子方程式: 。
(3)写出②与⑤反应的离子方程式: 。
【答案】H2SO4(或HNO3);NaOH(或KOH);Na2SO4(或K2SO4)(其他正确答案也可以)
(1)2NaOH+CO2Na2CO3+H2O
(2)H++OH-H2O
(3)C+2H+H2O+CO2↑
18.某化学反应的反应物和产物如下:Al+NaNO3+H2OAl(OH)3+N2↑+NaAlO2(未配平)。
(1)该反应的氧化剂是 。
(2)该反应的氧化产物是 。
(3)若反应过程中共转移5 mol e-,则生成标准状况下N2的体积为 L。
(4)配平该反应的化学方程式:
Al+ NaNO3+ H2O Al(OH)3+ N2+ NaAlO2
【解析】(1)反应过程中N的化合价降低,则氧化剂为NaNO3。(2)反应中Al作还原剂,对应的Al(OH)3,NaAlO2为氧化产物。(3)根据2NN2可知,转移5 mol e-时生成0.5 mol N2,在标准状况下的体积为11.2 L。(4)根据得失电子守恒配平该化学方程式:10Al+6NaNO2+6H2O4Al(OH)3+3N2↑+6NaAlO2。
【答案】(1)NaNO3
(2)Al(OH)3、NaAlO2
(3)11.2
(4)10;6;6;4;3;6
19.煅烧MgSO4过程存在以下反应:
MgSO4+CMgO+SO2↑+CO2↑(未配平)
MgSO4+CMgO+SO2↑+CO↑
利用下图装置对煅烧产生的气体进行吸收或收集
( http: / / www.21cnjy.com )
(1)C中收集的气体是 (填化学式)。
(2)B中盛放的溶液可以是 (填字母)。
a.NaOH 溶液
b.KOH 溶液
c.稀盐酸
d.稀硫酸
B中反应的离子方程式是 。
(3)反应MgSO4+CMgO+SO2↑+CO2↑中氧化剂与还原剂的物质的量之比为 ,氧化产物是 。
【解析】SO2、CO2都是酸性气体 ( http: / / www.21cnjy.com ),可用碱溶液吸收,所以C中收集的气体是CO;MgSO4中S化合价降低是氧化剂,C化合价升高是还原剂,其化合价变化如下:
依据化合价升降总数相等,MgSO4与C物质的量之比为2∶1。
【答案】(1)CO
(2)ab;CO2+2OH-C+H2O,SO2+2OH-S+H2O
(3)2∶1;CO2
20.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式: 。
(2)下列三种情况下,离子方程式与(1)相同的是 (填字母)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至S恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图甲中 曲线表示(填序号)。
( http: / / www.21cnjy.com )
(4)若有一表面光滑的塑料小球悬浮 ( http: / / www.21cnjy.com )于Ba(OH)2溶液中央,如图乙所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。
【解析】(1)Ba(OH)2和H2SO4反应生成BaSO4和H2O,其中Ba(OH)2和H2SO4拆成离子形式,BaSO4和H2O写化学式。(2)B、C两项中离子方程式为H++S+Ba2++OH-BaSO4↓+H2O。(3)缓缓加入稀硫酸的过程中,溶液中离子浓度先减小,后增大,溶液导电能力先减小后增大,可用图C表示。(4)随着反应的发生,溶液的密度减小,小球沉入烧杯底部。
【答案】(1)Ba2++2OH-+2H++SBaSO4↓+2H2O
(2)A
(3)C
(4)沉到烧杯底部
21.有五瓶未贴标签的试剂,分别盛有AgNO ( http: / / www.21cnjy.com )3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸钾溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量上述溶液,多次进行两两混合反应,反应现象为A与B、A与E产生沉淀,B与D、B与E产生沉淀,C与E、D与E产生气体,而C与D无反应现象。
(1)判定各试剂瓶中所盛试剂:A 、B 、C、 、D 、E 。
(2)请写出下列要求的离子方程式:
A与E: 。
B与E: 。
C与E: 。
【解析】根据题意,E与A、 ( http: / / www.21cnjy.com )B分别产生沉淀,与C、D分别产生气体,可推断E为K2CO3溶液;A、B可能为AgNO3和BaCl2中的一种,可判断C、D必为稀硝酸和盐酸中的一种,而B与D能产生沉淀,可确定B为AgNO3溶液,D为盐酸,因此A为BaCl2溶液,C为稀硝酸。
【答案】(1)BaCl2;AgNO3;HNO3;盐酸;K2CO3
(2)Ba2++CBaCO3↓;2Ag++CAg2CO3↓;C+2H+CO2↑+H2O
22.向盛有KI溶液的试管中滴加氯水,依次发生下列反应:
①2I-+Cl22Cl-+I2
②I2+Cl2+H2OHIO3+HCl(未配平)
(1)反应①中 发生了氧化反应,反应②中的氧化剂是 。
(2)已知HBrO3+HClBr2+Cl2+H2O(未配平),则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
(3)反应②中I2与Cl2的化学计量数之比为 。
【解析】(1)反应①中I元素化合价升高发生了氧化反应;反应②中Cl元素化合价降低,Cl2作氧化剂。
(2)反应②中的氧化剂是Cl2,氧化性:Cl2>HIO3,反应HBrO3+HClBr2+Cl2+H2O中的氧化剂是HBrO3,氧化性:HBrO3>Cl2,所以氧化性由强到弱的顺序是HBrO3>Cl2>HIO3。
(3)反应I2+Cl2+H2OHIO3+HCl中1个I化合价升高5,则1个I2化合价升高10;1个Cl化合价降低1,则1个Cl2化合价降低2,最小公倍数为10,所以I2的计量数为1,Cl2的计量数为5,I2与Cl2的计量数之比为1∶5。
【答案】(1)I-;Cl2
(2)HBrO3>Cl2>HIO3
(3)1∶5
