培优课堂1 “方法建构”下的化学计算 专项特训(含解析)2024年高考化学二轮复习
文档属性
| 名称 | 培优课堂1 “方法建构”下的化学计算 专项特训(含解析)2024年高考化学二轮复习 |

|
|
| 格式 | DOCX | ||
| 文件大小 | 190.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-11 00:00:00 | ||
图片预览



文档简介
培优课堂 “方法建构”下的化学计算
1.过氧化钙晶体(CaO2·8H2O)可用于改善地表水质、处理含重金属粒子废水、应急供氧等。
(1)已知:I2+2S2O===2I-+S4O,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:
第一步:准确称取a g产品放入锥形瓶中,再加入过量的b g KI晶体,加入适量蒸馏水溶解,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液发生反应,滴定达到终点时出现的现象是______________________________________________________
________________________________________________________________。
若滴定消耗Na2S2O3溶液V mL,则样品中CaO2的质量分数为________(用字母表示)。
(2)已知过氧化钙加热至350 ℃左右开始分解放出氧气。将过氧化钙晶体(CaO2·8H2O)在坩埚中加热逐渐升高温度,测得样品质量随温度的变化如图所示,则350 ℃左右所得固体物质的化学式为________________。
2.(1)碱式碳酸镁是制备金属镁及其化合物的原料,以卤块(主要成分为MgCl2,此外还含有Fe3+、Fe2+等离子)为原料制备碱式碳酸镁[MgCO3·Mg(OH)2]。采用上述流程制得的碱式碳酸镁常含一定量结晶水,化学式为MgCO3·Mg(OH)2·xH2O。称取42.8 g样品,进行热重分析,并绘制出如图所示热重曲线示意图。已知T ℃时固体样品为MgO,计算x=________。
(2)近年来,FePO4作为制备锂离子电池正极材料LiFePO4的重要原料而成为研究热点。一种以FeCl3、H3PO4、 氨水为主要原料制备FePO4的流程如图。
测定产物样品中铁元素的质量分数,主要步骤如下:
ⅰ.取a g样品,加入过量盐酸充分溶解,再滴加SnCl2 (还原剂)至溶液呈浅黄色;
ⅱ.加入TiCl3,恰好将ⅰ中残余的少量Fe3+还原为Fe2+;
ⅲ.用c mol·L-1K2Cr2O7标准溶液滴定Fe2+,消耗V mL K2Cr2O7标准溶液。
产物中铁元素的质量分数为________ %。
3.我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700 ℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、____________和____________(填化学式)。
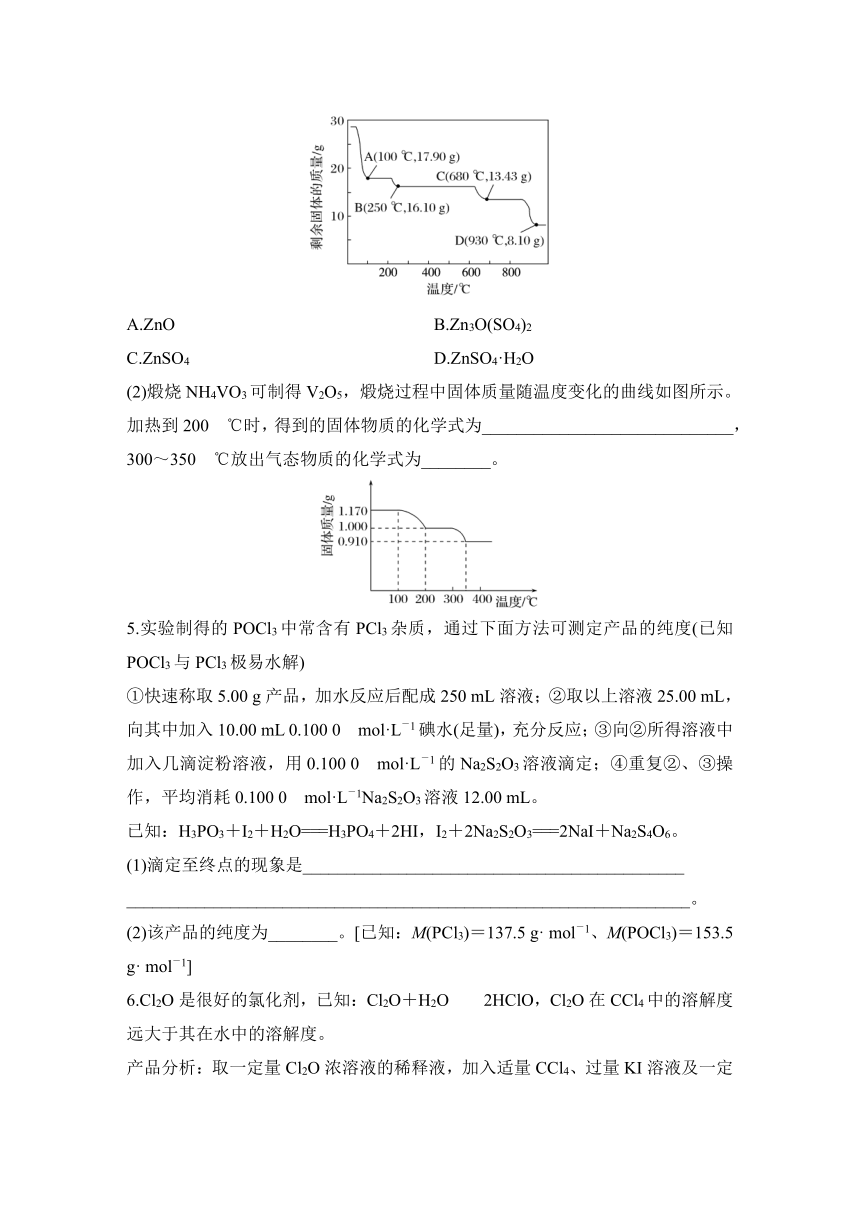
4.(1)ZnSO4·7H2O在不同的温度下分解产物不同,取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680 ℃时所得固体的化学式为______________________________________________(填标号)。
A.ZnO B.Zn3O(SO4)2
C.ZnSO4 D.ZnSO4·H2O
(2)煅烧NH4VO3可制得V2O5,煅烧过程中固体质量随温度变化的曲线如图所示。加热到200 ℃时,得到的固体物质的化学式为_____________________________,300~350 ℃放出气态物质的化学式为________。
5.实验制得的POCl3中常含有PCl3杂质,通过下面方法可测定产品的纯度(已知POCl3与PCl3极易水解)
①快速称取5.00 g产品,加水反应后配成250 mL溶液;②取以上溶液25.00 mL,向其中加入10.00 mL 0.100 0 mol·L-1碘水(足量),充分反应;③向②所得溶液中加入几滴淀粉溶液,用0.100 0 mol·L-1的Na2S2O3溶液滴定;④重复②、③操作,平均消耗0.100 0 mol·L-1Na2S2O3溶液12.00 mL。
已知:H3PO3+I2+H2O===H3PO4+2HI,I2+2Na2S2O3===2NaI+Na2S4O6。
(1)滴定至终点的现象是____________________________________________
_________________________________________________________________。
(2)该产品的纯度为________。[已知:M(PCl3)=137.5 g· mol-1、M(POCl3)=153.5 g· mol-1]
6.Cl2O是很好的氯化剂,已知:Cl2O+H2O??2HClO,Cl2O在CCl4中的溶解度远大于其在水中的溶解度。
产品分析:取一定量Cl2O浓溶液的稀释液,加入适量CCl4、过量KI溶液及一定量的稀H2SO4,充分反应。用标准Na2S2O3溶液滴定(滴定Ⅰ);再以酚酞为指示剂,用标准NaOH溶液滴定(滴定Ⅱ)。已知产生I2的反应(不考虑Cl2与水反应):
2I-+Cl2===I2+2Cl-
4I-+Cl2O+2H+===2I2+H2O+2Cl-
2I-+HClO+H+===I2+H2O+Cl-
实验数据如下表:
加入量 n(H2SO4)/mol 2.505×10-3
滴定Ⅰ测出量n(I2)/mol 2.005×10-3
滴定Ⅱ测出量n(H2SO4)/mol 1.505×10-3
(1)用标准Na2S2O3溶液滴定时,无需另加指示剂。判断滴定Ⅰ到达终点的实验现象是_____________________________________________________
_________________________________________________________。
(2)高纯度Cl2O浓溶液中要求n(Cl2O)/n(Cl2)≥99(Cl2O和HClO均以Cl2O计)。结合数据分析所制备的Cl2O浓溶液是否符合要求__________________________
___________________________________________________________________。
7.钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。TiCl4可制备纳米TiO2;以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米xTiO2·yH2O,测定产物xTiO2·yH2O组成的方法如下:
步骤一:取样品2.100 g用稀硫酸充分溶解得到TiOSO4,再用足量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250 mL容量瓶,定容得到待测液。
步骤二:取待测液25.00 mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.100 0 mol·L-1的NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+,三次滴定消耗标准溶液的平均值为24.00 mL。
(1)滴定终点的判断方法是___________________________________________。
(2)通过分析、计算,该样品的组成为_________________________________。
8.二氧化氯(ClO2)可用于自来水消毒。ClO2很不稳定,需随用随制,为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知ClO2+I-+H+——I2+Cl-+H2O未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O===2I-+S4O)
(1)准确量取10.00 mL ClO2溶液的玻璃仪器是________。
(2)上述步骤3中滴定终点的现象是___________________________________
________________________。
(3)若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果________(填“偏高”“偏低”或“无影响”)。
(4)根据上述步骤可计算出原ClO2溶液的浓度为________ mol·L-1(用含字母的代数式表示)。
9.我国科学家以铬铁合金(主要成分:铬、铁、镍)为原料,提出了制备氧化铬的“铬铁—三价铬冶金化工联合法”,彻底解决了传统铬生产工艺中六价铬的污染问题,为满足冶金及颜料级铬绿的要求,氧化铬产品中铁的质量分数应低于0.03%。一种测定氧化铬中铁含量的操作如下:
ⅰ.称取m g氧化铬产品,用酸溶解;
ⅱ.多步操作分离铁和铬;
ⅲ.取含有Fe3+的溶液,调pH,加入指示剂,用c mol·L-1的无色EDTA-2Na溶液滴定,共消耗EDTA-2Na标准液V mL。
资料:EDTA-2Na和Fe3+按物质的量1∶1反应,低浓度时产物无明显颜色。
①指示剂是________,滴定终点的现象为___________________________________________________________________
___________________________________________________________________;
②氧化铬产品中铁的质量分数是________________。
培优课堂1 “方法建构”下的化学计算
1.答案 (1)溶液由蓝色变无色,且30 s内不恢复蓝色 ×100% (2)CaO
解析 (1)根据得失电子守恒,可得关系式CaO2~I2~2S2O,则样品中CaO2的质量分数为×100%=×100%。(2)CaO2·8H2O的摩尔质量为216 g· mol-1,故2.16 g过氧化钙晶体为0.01 mol,350 ℃左右所得固体质量为0.56 g,根据钙原子守恒,可知为CaO。
2.答案 (1)4 (2)
解析 (1)由化学式可知MgCO3·Mg(OH)2·xH2O的摩尔质量为(142+18x) g· mol-1,则起始时MgCO3·Mg(OH)2·xH2O的物质的量为 mol,其中镁离子的物质的量为 mol,热重后得到氧化镁的质量为16.0 g,则镁离子的物质的量为=0.4 mol;根据元素守恒可得:=0.4,解得:x=4。(2)测定产品中铁元素的质量分数时,Fe3+被SnCl2和TiCl3还原为Fe2+,生成的Fe2+被酸性重铬酸钾氧化,发生反应的离子方程式为6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O,根据关系式Cr2O~6Fe2+~6FePO4可得n(FePO4)=6×10-3cV mol,铁元素的质量分数w==×100%=%。
3.答案 CuO SO3
解析 根据图示的热重曲线所示,在700 ℃左右会出现两个吸热峰,说明此时CuSO4发生热分解反应,从TG图像可以看出,质量减少量为原CuSO4质量的一半,说明有固体CuO剩余,还有其他气体产出,此时气体产物为SO2、SO3、O2,可能出现的化学方程式为3CuSO43CuO+2SO2↑+SO3↑+O2↑,结合反应中产物的固体产物质量和气体产物质量可以确定,该反应的产物为CuO、SO2、SO3、O2。
4.答案 (1)B (2)HVO3 H2O
解析 (1)28.70 g ZnSO4·7H2O的物质的量为0.1 mol,由Zn元素守恒可知,生成ZnSO4·H2O或ZnSO4或ZnO时,物质的量均为0.1 mol。若得ZnSO4·H2O,则质量为17.90 g(100 ℃);若得ZnSO4,则质量为16.10 g(250 ℃);若得ZnO,则质量为8.10 g(930 ℃);据此可确定680 ℃时所得固体的化学式为Zn3O(SO4)2。(2)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200 ℃时,质量减少0.17 g,所以0.01 mol NH4VO3受热分解生成气体为0.01 mol NH3,发生NH4VO3NH3↑+HVO3;加热到350 ℃时固体质量又减少0.09 g,失去0.005 mol H2O,发生的反应为2HVO3H2O+V2O5,则放出气态物质的化学式为H2O。
5.答案 (1)当滴入最后半滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不变色 (2)89.0%
解析 (1)当滴入最后半滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不变色,说明滴定达到终点。(2)POCl3与水反应生成H3PO4和HCl,PCl3与水反应生成H3PO3和HCl,根据题意知,存在关系式:PCl3~H3PO3~I2,I2~2Na2S2O3;消耗Na2S2O3的物质的量=0.100 0 mol·L-1×12.00×10-3L=12×10-4 mol,则和Na2S2O3反应的I2的物质的量=×12×10-4 mol =6×10-4 mol;PCl3的物质的量等于和H3PO3反应的I2的物质的量=0.100 0 mol·L-1×10.00×10-3 L-6×10-4 mol=4×10-4 mol,PCl3的质量为4×10-4 mol×137.5 g· mol-1=5.5×10-2g,产品中含PCl3的质量为5.5×10-2g×=0.55 g,则产品的纯度为×100%=89.0%。
6.答案 (1)CCl4中由紫红色突变到无色,且30 s不恢复
(2)溶液中Cl2O和Cl2分别为1.000×10-3 mol、5×10-6 mol,=200>99,符合要求
解析 (1)溶有I2的CCl4溶液呈紫红色,用标准Na2S2O3溶液滴定I2过程中,当I2恰好反应完全时,溶液呈无色,因此滴定I2到达终点的实验现象是CCl4中由紫红色突变到无色,且30 s不恢复。(2)由2I-+Cl2===I2+2Cl-、4I-+Cl2O+2H+===2I2+H2O+2Cl-、2I-+HClO+H+===I2+H2O+Cl-(HClO为Cl2O与H2O反应的产物)可得关系式:Cl2O~2H+~2I2,由实验数据可知Cl2O和HClO共消耗n(H+)=2×(2.505×10-3 mol-1.505×10-3 mol)=2×10-3 mol,生成I2的物质的量为2×10-3 mol,则高纯度Cl2O浓溶液中n(Cl2O)=1×10-3 mol,加入过量KI溶液共生成I2的物质的量为2.005×10-3 mol,因此Cl2与I-反应生成I2的物质的量为2.005×10-3 mol-2×10-3 mol=5×10-6 mol,由此可知高纯度Cl2O浓溶液中n(Cl2)=5×10-6 mol,所以高纯度Cl2O浓溶液中==200>99,则所制备的高纯度Cl2O浓溶液符合要求。
7.答案 (1)溶液出现红色且半分钟不褪色
(2)12TiO2·5H2O
解析 (1)若反应完全,滴入标准溶液,标准溶液中的Fe3+与SCN-结合,使溶液变为红色,滴定终点现象为溶液出现红色且半分钟不褪色。(2)三次滴定消耗标准溶液的平均值为24.00 mL,物质反应转化关系为TiO2~NH4Fe(SO4)2,m(TiO2)=80 g· mol-1×0.100 0 mol·L-1×0.024 L×=1.92 g,m(H2O)=2.100 g-1.92 g=0.18 g,所以x∶y=∶=12∶5,故物质的化学式为12TiO2·5H2O。
8.答案 (1)酸式滴定管 (2)溶液蓝色恰好消失,且30 s内不恢复原色 (3)偏高 (4)
解析 (1)ClO2能用于自来水的消毒,即ClO2具有强氧化性,ClO2溶液应盛放在酸式滴定管中。(2)锥形瓶溶液显蓝色,滴加Na2S2O3溶液过程中碘单质被消耗,达到终点的现象是:溶液恰好蓝色消失,且30 s内不恢复原色。(3)Na2S2O3被氧气氧化,则消耗Na2S2O3溶液的体积增大,测定结果偏高。(4)根据反应方程式,建立关系式为2ClO2~5I2~10Na2S2O3,则ClO2的浓度为
= mol·L-1。
9.答案 ①KSCN溶液 溶液由红色变为无色,且30秒无明显变化 ②×100%
解析 ①滴定时,EDTA-2Na和Fe3+按物质的量1∶1反应,低浓度时产物无明显颜色,而铁离子与KSCN溶液反应所得溶液呈红色,则指示剂是KSCN溶液,滴定终点的现象为溶液由红色变为无色,且30秒内无明显变化;②EDTA-2Na和Fe3+按物质的量1∶1反应,消耗EDTA-2Na标准液的物质的量为 mol,则铁的物质的量为 mol,氧化铬产品中铁的质量分数是×100%。
1.过氧化钙晶体(CaO2·8H2O)可用于改善地表水质、处理含重金属粒子废水、应急供氧等。
(1)已知:I2+2S2O===2I-+S4O,测定制备的过氧化钙晶体中CaO2的含量的实验步骤如下:
第一步:准确称取a g产品放入锥形瓶中,再加入过量的b g KI晶体,加入适量蒸馏水溶解,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液发生反应,滴定达到终点时出现的现象是______________________________________________________
________________________________________________________________。
若滴定消耗Na2S2O3溶液V mL,则样品中CaO2的质量分数为________(用字母表示)。
(2)已知过氧化钙加热至350 ℃左右开始分解放出氧气。将过氧化钙晶体(CaO2·8H2O)在坩埚中加热逐渐升高温度,测得样品质量随温度的变化如图所示,则350 ℃左右所得固体物质的化学式为________________。
2.(1)碱式碳酸镁是制备金属镁及其化合物的原料,以卤块(主要成分为MgCl2,此外还含有Fe3+、Fe2+等离子)为原料制备碱式碳酸镁[MgCO3·Mg(OH)2]。采用上述流程制得的碱式碳酸镁常含一定量结晶水,化学式为MgCO3·Mg(OH)2·xH2O。称取42.8 g样品,进行热重分析,并绘制出如图所示热重曲线示意图。已知T ℃时固体样品为MgO,计算x=________。
(2)近年来,FePO4作为制备锂离子电池正极材料LiFePO4的重要原料而成为研究热点。一种以FeCl3、H3PO4、 氨水为主要原料制备FePO4的流程如图。
测定产物样品中铁元素的质量分数,主要步骤如下:
ⅰ.取a g样品,加入过量盐酸充分溶解,再滴加SnCl2 (还原剂)至溶液呈浅黄色;
ⅱ.加入TiCl3,恰好将ⅰ中残余的少量Fe3+还原为Fe2+;
ⅲ.用c mol·L-1K2Cr2O7标准溶液滴定Fe2+,消耗V mL K2Cr2O7标准溶液。
产物中铁元素的质量分数为________ %。
3.我国古籍记载了硫酸的制备方法——“炼石胆(CuSO4·5H2O)取精华法”。借助现代仪器分析,该制备过程中CuSO4·5H2O分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。700 ℃左右有两个吸热峰,则此时分解生成的氧化物有SO2、____________和____________(填化学式)。
4.(1)ZnSO4·7H2O在不同的温度下分解产物不同,取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680 ℃时所得固体的化学式为______________________________________________(填标号)。
A.ZnO B.Zn3O(SO4)2
C.ZnSO4 D.ZnSO4·H2O
(2)煅烧NH4VO3可制得V2O5,煅烧过程中固体质量随温度变化的曲线如图所示。加热到200 ℃时,得到的固体物质的化学式为_____________________________,300~350 ℃放出气态物质的化学式为________。
5.实验制得的POCl3中常含有PCl3杂质,通过下面方法可测定产品的纯度(已知POCl3与PCl3极易水解)
①快速称取5.00 g产品,加水反应后配成250 mL溶液;②取以上溶液25.00 mL,向其中加入10.00 mL 0.100 0 mol·L-1碘水(足量),充分反应;③向②所得溶液中加入几滴淀粉溶液,用0.100 0 mol·L-1的Na2S2O3溶液滴定;④重复②、③操作,平均消耗0.100 0 mol·L-1Na2S2O3溶液12.00 mL。
已知:H3PO3+I2+H2O===H3PO4+2HI,I2+2Na2S2O3===2NaI+Na2S4O6。
(1)滴定至终点的现象是____________________________________________
_________________________________________________________________。
(2)该产品的纯度为________。[已知:M(PCl3)=137.5 g· mol-1、M(POCl3)=153.5 g· mol-1]
6.Cl2O是很好的氯化剂,已知:Cl2O+H2O??2HClO,Cl2O在CCl4中的溶解度远大于其在水中的溶解度。
产品分析:取一定量Cl2O浓溶液的稀释液,加入适量CCl4、过量KI溶液及一定量的稀H2SO4,充分反应。用标准Na2S2O3溶液滴定(滴定Ⅰ);再以酚酞为指示剂,用标准NaOH溶液滴定(滴定Ⅱ)。已知产生I2的反应(不考虑Cl2与水反应):
2I-+Cl2===I2+2Cl-
4I-+Cl2O+2H+===2I2+H2O+2Cl-
2I-+HClO+H+===I2+H2O+Cl-
实验数据如下表:
加入量 n(H2SO4)/mol 2.505×10-3
滴定Ⅰ测出量n(I2)/mol 2.005×10-3
滴定Ⅱ测出量n(H2SO4)/mol 1.505×10-3
(1)用标准Na2S2O3溶液滴定时,无需另加指示剂。判断滴定Ⅰ到达终点的实验现象是_____________________________________________________
_________________________________________________________。
(2)高纯度Cl2O浓溶液中要求n(Cl2O)/n(Cl2)≥99(Cl2O和HClO均以Cl2O计)。结合数据分析所制备的Cl2O浓溶液是否符合要求__________________________
___________________________________________________________________。
7.钛在医疗领域的使用非常广泛,如制人造关节、头盖、主动心瓣等。TiCl4可制备纳米TiO2;以N2为载体,用TiCl4和水蒸气反应生成Ti(OH)4。再控制温度生成纳米xTiO2·yH2O,测定产物xTiO2·yH2O组成的方法如下:
步骤一:取样品2.100 g用稀硫酸充分溶解得到TiOSO4,再用足量铝将TiO2+还原为Ti3+,过滤并洗涤,将所得滤液和洗涤液合并注入250 mL容量瓶,定容得到待测液。
步骤二:取待测液25.00 mL于锥形瓶中,加几滴KSCN溶液作指示剂,用0.100 0 mol·L-1的NH4Fe(SO4)2标准溶液滴定,将Ti3+氧化为TiO2+,三次滴定消耗标准溶液的平均值为24.00 mL。
(1)滴定终点的判断方法是___________________________________________。
(2)通过分析、计算,该样品的组成为_________________________________。
8.二氧化氯(ClO2)可用于自来水消毒。ClO2很不稳定,需随用随制,为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1 mL试样加入锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知ClO2+I-+H+——I2+Cl-+H2O未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O===2I-+S4O)
(1)准确量取10.00 mL ClO2溶液的玻璃仪器是________。
(2)上述步骤3中滴定终点的现象是___________________________________
________________________。
(3)若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果________(填“偏高”“偏低”或“无影响”)。
(4)根据上述步骤可计算出原ClO2溶液的浓度为________ mol·L-1(用含字母的代数式表示)。
9.我国科学家以铬铁合金(主要成分:铬、铁、镍)为原料,提出了制备氧化铬的“铬铁—三价铬冶金化工联合法”,彻底解决了传统铬生产工艺中六价铬的污染问题,为满足冶金及颜料级铬绿的要求,氧化铬产品中铁的质量分数应低于0.03%。一种测定氧化铬中铁含量的操作如下:
ⅰ.称取m g氧化铬产品,用酸溶解;
ⅱ.多步操作分离铁和铬;
ⅲ.取含有Fe3+的溶液,调pH,加入指示剂,用c mol·L-1的无色EDTA-2Na溶液滴定,共消耗EDTA-2Na标准液V mL。
资料:EDTA-2Na和Fe3+按物质的量1∶1反应,低浓度时产物无明显颜色。
①指示剂是________,滴定终点的现象为___________________________________________________________________
___________________________________________________________________;
②氧化铬产品中铁的质量分数是________________。
培优课堂1 “方法建构”下的化学计算
1.答案 (1)溶液由蓝色变无色,且30 s内不恢复蓝色 ×100% (2)CaO
解析 (1)根据得失电子守恒,可得关系式CaO2~I2~2S2O,则样品中CaO2的质量分数为×100%=×100%。(2)CaO2·8H2O的摩尔质量为216 g· mol-1,故2.16 g过氧化钙晶体为0.01 mol,350 ℃左右所得固体质量为0.56 g,根据钙原子守恒,可知为CaO。
2.答案 (1)4 (2)
解析 (1)由化学式可知MgCO3·Mg(OH)2·xH2O的摩尔质量为(142+18x) g· mol-1,则起始时MgCO3·Mg(OH)2·xH2O的物质的量为 mol,其中镁离子的物质的量为 mol,热重后得到氧化镁的质量为16.0 g,则镁离子的物质的量为=0.4 mol;根据元素守恒可得:=0.4,解得:x=4。(2)测定产品中铁元素的质量分数时,Fe3+被SnCl2和TiCl3还原为Fe2+,生成的Fe2+被酸性重铬酸钾氧化,发生反应的离子方程式为6Fe2++Cr2O+14H+===6Fe3++2Cr3++7H2O,根据关系式Cr2O~6Fe2+~6FePO4可得n(FePO4)=6×10-3cV mol,铁元素的质量分数w==×100%=%。
3.答案 CuO SO3
解析 根据图示的热重曲线所示,在700 ℃左右会出现两个吸热峰,说明此时CuSO4发生热分解反应,从TG图像可以看出,质量减少量为原CuSO4质量的一半,说明有固体CuO剩余,还有其他气体产出,此时气体产物为SO2、SO3、O2,可能出现的化学方程式为3CuSO43CuO+2SO2↑+SO3↑+O2↑,结合反应中产物的固体产物质量和气体产物质量可以确定,该反应的产物为CuO、SO2、SO3、O2。
4.答案 (1)B (2)HVO3 H2O
解析 (1)28.70 g ZnSO4·7H2O的物质的量为0.1 mol,由Zn元素守恒可知,生成ZnSO4·H2O或ZnSO4或ZnO时,物质的量均为0.1 mol。若得ZnSO4·H2O,则质量为17.90 g(100 ℃);若得ZnSO4,则质量为16.10 g(250 ℃);若得ZnO,则质量为8.10 g(930 ℃);据此可确定680 ℃时所得固体的化学式为Zn3O(SO4)2。(2)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200 ℃时,质量减少0.17 g,所以0.01 mol NH4VO3受热分解生成气体为0.01 mol NH3,发生NH4VO3NH3↑+HVO3;加热到350 ℃时固体质量又减少0.09 g,失去0.005 mol H2O,发生的反应为2HVO3H2O+V2O5,则放出气态物质的化学式为H2O。
5.答案 (1)当滴入最后半滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不变色 (2)89.0%
解析 (1)当滴入最后半滴Na2S2O3溶液时,溶液由蓝色变为无色,且半分钟内不变色,说明滴定达到终点。(2)POCl3与水反应生成H3PO4和HCl,PCl3与水反应生成H3PO3和HCl,根据题意知,存在关系式:PCl3~H3PO3~I2,I2~2Na2S2O3;消耗Na2S2O3的物质的量=0.100 0 mol·L-1×12.00×10-3L=12×10-4 mol,则和Na2S2O3反应的I2的物质的量=×12×10-4 mol =6×10-4 mol;PCl3的物质的量等于和H3PO3反应的I2的物质的量=0.100 0 mol·L-1×10.00×10-3 L-6×10-4 mol=4×10-4 mol,PCl3的质量为4×10-4 mol×137.5 g· mol-1=5.5×10-2g,产品中含PCl3的质量为5.5×10-2g×=0.55 g,则产品的纯度为×100%=89.0%。
6.答案 (1)CCl4中由紫红色突变到无色,且30 s不恢复
(2)溶液中Cl2O和Cl2分别为1.000×10-3 mol、5×10-6 mol,=200>99,符合要求
解析 (1)溶有I2的CCl4溶液呈紫红色,用标准Na2S2O3溶液滴定I2过程中,当I2恰好反应完全时,溶液呈无色,因此滴定I2到达终点的实验现象是CCl4中由紫红色突变到无色,且30 s不恢复。(2)由2I-+Cl2===I2+2Cl-、4I-+Cl2O+2H+===2I2+H2O+2Cl-、2I-+HClO+H+===I2+H2O+Cl-(HClO为Cl2O与H2O反应的产物)可得关系式:Cl2O~2H+~2I2,由实验数据可知Cl2O和HClO共消耗n(H+)=2×(2.505×10-3 mol-1.505×10-3 mol)=2×10-3 mol,生成I2的物质的量为2×10-3 mol,则高纯度Cl2O浓溶液中n(Cl2O)=1×10-3 mol,加入过量KI溶液共生成I2的物质的量为2.005×10-3 mol,因此Cl2与I-反应生成I2的物质的量为2.005×10-3 mol-2×10-3 mol=5×10-6 mol,由此可知高纯度Cl2O浓溶液中n(Cl2)=5×10-6 mol,所以高纯度Cl2O浓溶液中==200>99,则所制备的高纯度Cl2O浓溶液符合要求。
7.答案 (1)溶液出现红色且半分钟不褪色
(2)12TiO2·5H2O
解析 (1)若反应完全,滴入标准溶液,标准溶液中的Fe3+与SCN-结合,使溶液变为红色,滴定终点现象为溶液出现红色且半分钟不褪色。(2)三次滴定消耗标准溶液的平均值为24.00 mL,物质反应转化关系为TiO2~NH4Fe(SO4)2,m(TiO2)=80 g· mol-1×0.100 0 mol·L-1×0.024 L×=1.92 g,m(H2O)=2.100 g-1.92 g=0.18 g,所以x∶y=∶=12∶5,故物质的化学式为12TiO2·5H2O。
8.答案 (1)酸式滴定管 (2)溶液蓝色恰好消失,且30 s内不恢复原色 (3)偏高 (4)
解析 (1)ClO2能用于自来水的消毒,即ClO2具有强氧化性,ClO2溶液应盛放在酸式滴定管中。(2)锥形瓶溶液显蓝色,滴加Na2S2O3溶液过程中碘单质被消耗,达到终点的现象是:溶液恰好蓝色消失,且30 s内不恢复原色。(3)Na2S2O3被氧气氧化,则消耗Na2S2O3溶液的体积增大,测定结果偏高。(4)根据反应方程式,建立关系式为2ClO2~5I2~10Na2S2O3,则ClO2的浓度为
= mol·L-1。
9.答案 ①KSCN溶液 溶液由红色变为无色,且30秒无明显变化 ②×100%
解析 ①滴定时,EDTA-2Na和Fe3+按物质的量1∶1反应,低浓度时产物无明显颜色,而铁离子与KSCN溶液反应所得溶液呈红色,则指示剂是KSCN溶液,滴定终点的现象为溶液由红色变为无色,且30秒内无明显变化;②EDTA-2Na和Fe3+按物质的量1∶1反应,消耗EDTA-2Na标准液的物质的量为 mol,则铁的物质的量为 mol,氧化铬产品中铁的质量分数是×100%。
同课章节目录
