2024年中考化学专题训练——溶解度(含解析)
文档属性
| 名称 | 2024年中考化学专题训练——溶解度(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 466.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-12 09:06:00 | ||
图片预览


文档简介
2024年中考化学专题训练——溶解度
一、选择题
1.下列有关溶液的说法正确的是
A.具有均一性、稳定性的液体一定是溶液
B.配制溶液时,搅拌可以增大固体溶质的溶解能力
C.对于同一溶质的溶液,相同温度下,饱和溶液的一定比不饱和溶液浓
D.溶液中溶质只能是一种
2.下列有关饱和溶液和不饱和溶液的说法中,不正确的是
A.在一定条件下,不能继续溶解该溶质的溶液即为该溶质的饱和溶液
B.浓溶液一定是饱和溶液
C.析出晶体后的溶液还是当时条件下的饱和溶液
D.冷却或蒸发溶剂都有可能使不饱和氯化钾溶液达到饱和
3.若把江河湖泊水中溶解的气体收集起来,分析的结果是:氧气所占的体积大于21%,氮气所占的体积小于78%,对此应得出的结论正确的是
A.只有空气中的氧气和氮气能溶解在天然水中
B.溶解在天然水中氧气和氮气与空气中的氧气和氮气的百分含量相同
C.天然水中溶解的氧气极少,所以在湖泊中养鱼要采取增氧措施
D.在相同条件下,氧气比氮气在水中的溶解度大一些
4.今年5月4日,习总书记在推进南水北调后续工程高质量发展座谈会上强调:“水是生存之本,文明之源,要坚持节水优先,抓好水污染的防治工作”。下列有关水与溶液的说法错误的是
A.实验室的废水和废液不能直接排入下水道
B.溶液是均一、稳定的混合物
C.饱和溶液就是不能再溶解任何物质的溶液
D.电解水时,负极产生的是氢气
5.为探究硝酸钾的溶解性,进行了如图实验,其中溶液①、溶液③中没有剩余固体,溶液②、溶液④中有剩余固体,下列说法错误的是
A.溶液②、溶液④一定是饱和溶液
B.溶液①、溶液③一定是不饱和溶液
C.溶液②、溶液③的质量:③>②
D.升高温度,溶液②可以变成不饱和溶液
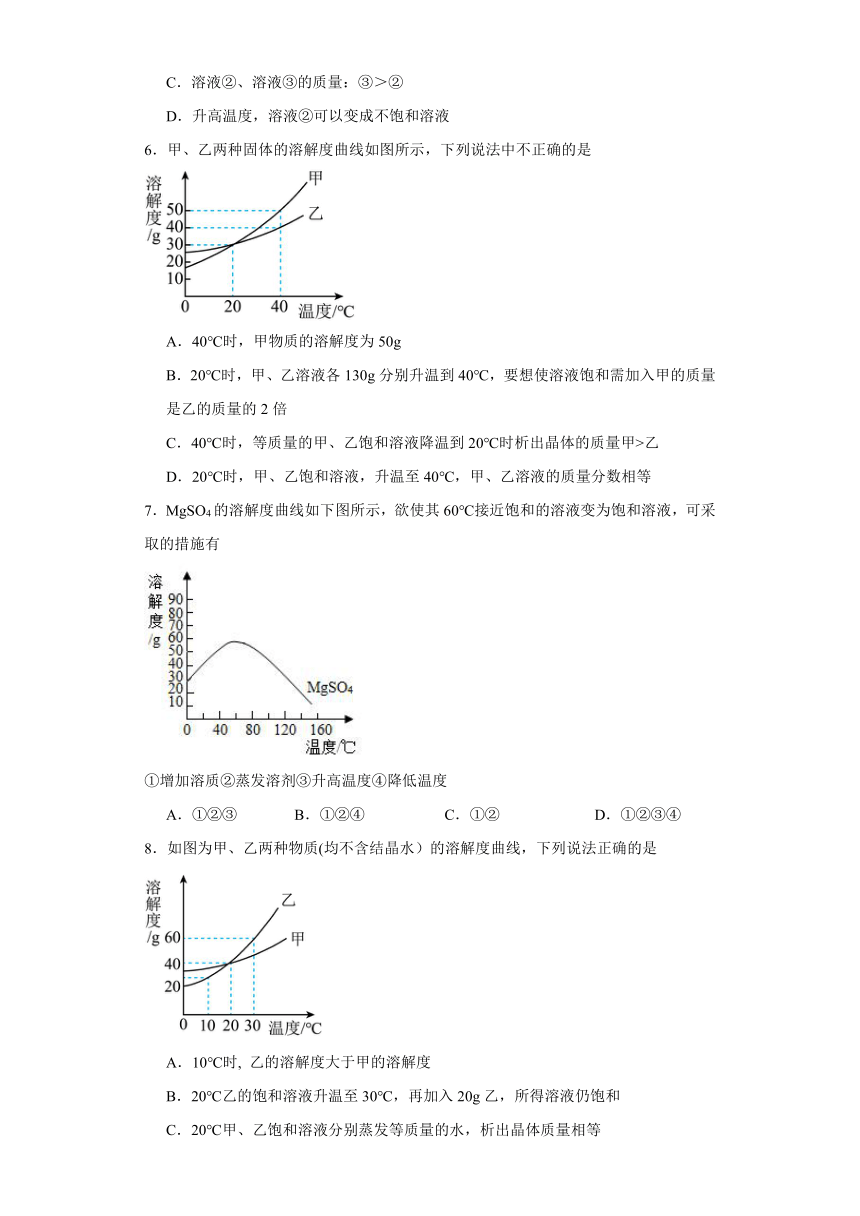
6.甲、乙两种固体的溶解度曲线如图所示,下列说法中不正确的是
A.40℃时,甲物质的溶解度为50g
B.20℃时,甲、乙溶液各130g分别升温到40℃,要想使溶液饱和需加入甲的质量是乙的质量的2倍
C.40℃时,等质量的甲、乙饱和溶液降温到20℃时析出晶体的质量甲>乙
D.20℃时,甲、乙饱和溶液,升温至40℃,甲、乙溶液的质量分数相等
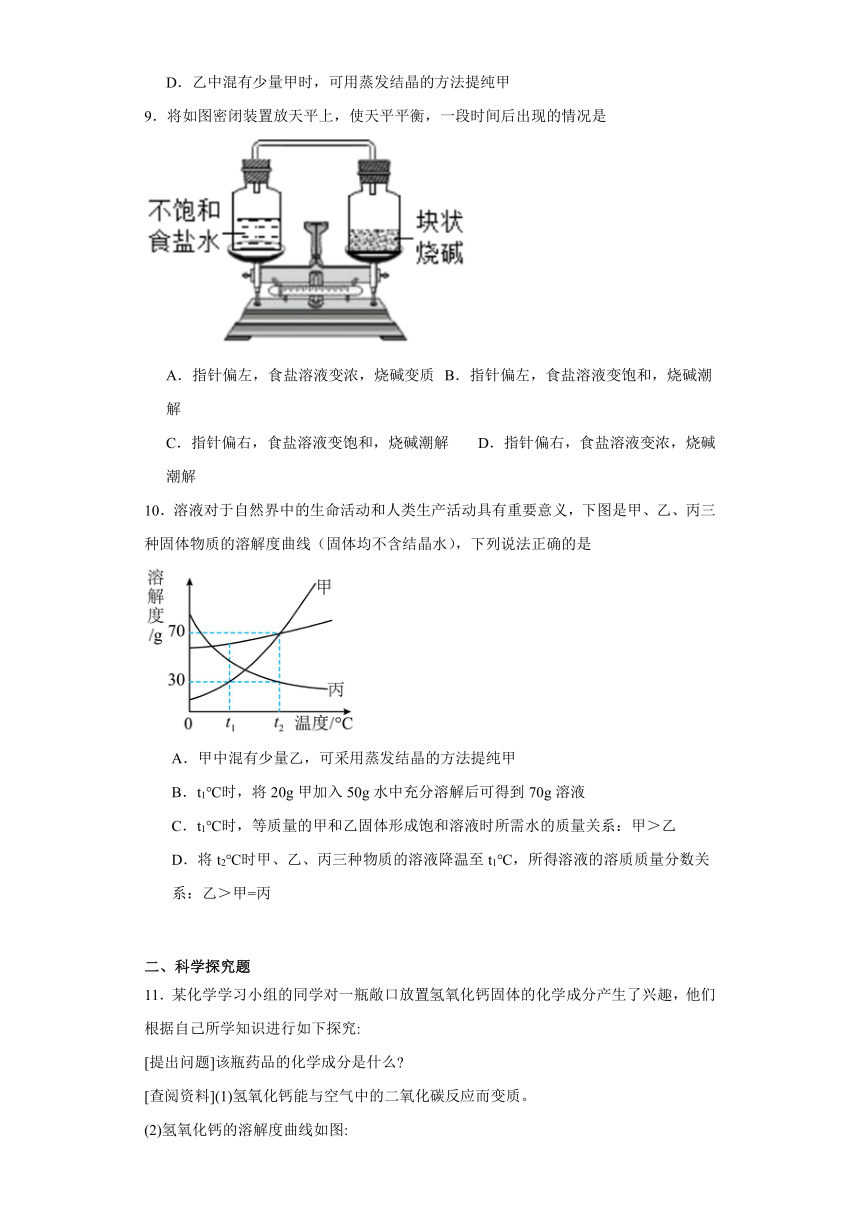
7.MgSO4的溶解度曲线如下图所示,欲使其60℃接近饱和的溶液变为饱和溶液,可采取的措施有
①增加溶质②蒸发溶剂③升高温度④降低温度
A.①②③ B.①②④ C.①② D.①②③④
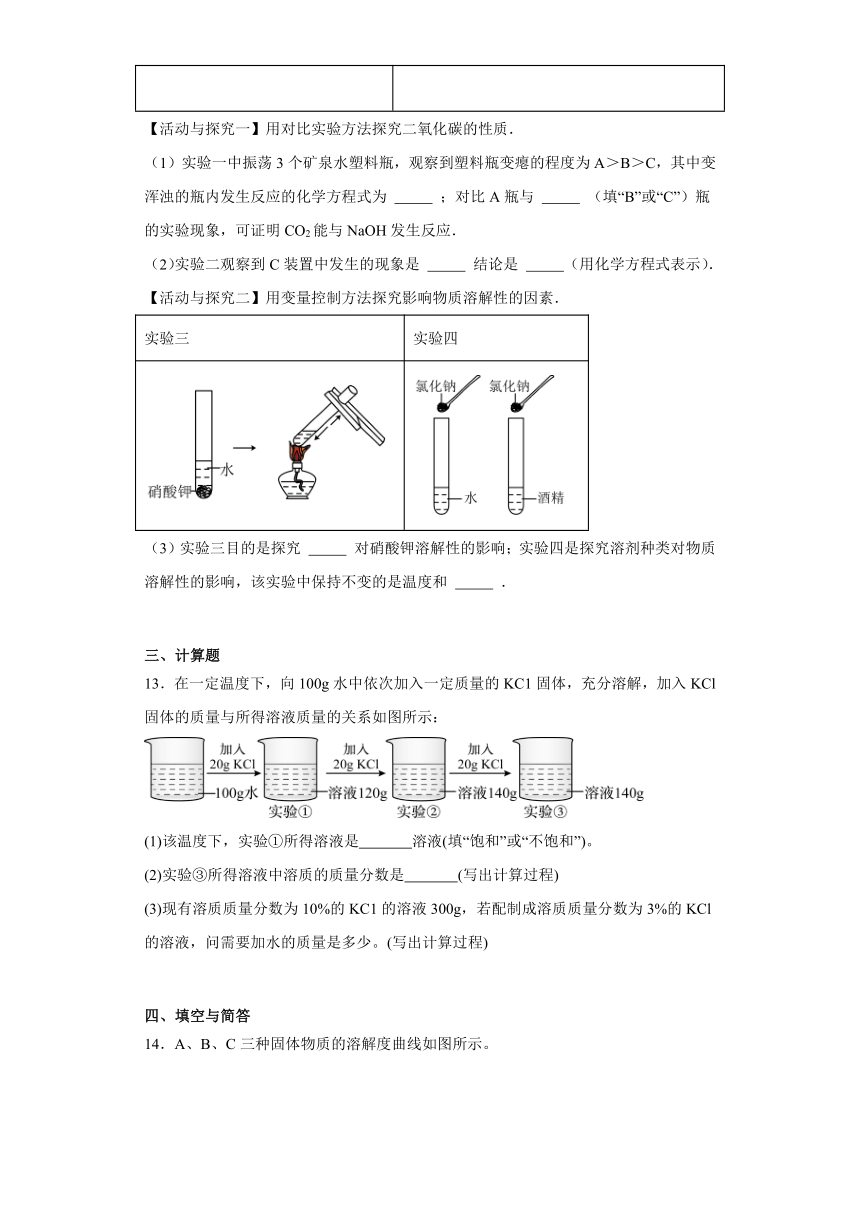
8.如图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是
A.10℃时, 乙的溶解度大于甲的溶解度
B.20℃乙的饱和溶液升温至30℃,再加入20g乙,所得溶液仍饱和
C.20℃甲、乙饱和溶液分别蒸发等质量的水,析出晶体质量相等
D.乙中混有少量甲时,可用蒸发结晶的方法提纯甲
9.将如图密闭装置放天平上,使天平平衡,一段时间后出现的情况是
A.指针偏左,食盐溶液变浓,烧碱变质 B.指针偏左,食盐溶液变饱和,烧碱潮解
C.指针偏右,食盐溶液变饱和,烧碱潮解 D.指针偏右,食盐溶液变浓,烧碱潮解
10.溶液对于自然界中的生命活动和人类生产活动具有重要意义,下图是甲、乙、丙三种固体物质的溶解度曲线(固体均不含结晶水),下列说法正确的是
A.甲中混有少量乙,可采用蒸发结晶的方法提纯甲
B.t1℃时,将20g甲加入50g水中充分溶解后可得到70g溶液
C.t1℃时,等质量的甲和乙固体形成饱和溶液时所需水的质量关系:甲>乙
D.将t2℃时甲、乙、丙三种物质的溶液降温至t1℃,所得溶液的溶质质量分数关系:乙>甲=丙
二、科学探究题
11.某化学学习小组的同学对一瓶敞口放置氢氧化钙固体的化学成分产生了兴趣,他们根据自己所学知识进行如下探究:
[提出问题]该瓶药品的化学成分是什么
[查阅资料](1)氢氧化钙能与空气中的二氧化碳反应而变质。
(2)氢氧化钙的溶解度曲线如图:
[猜想假设]猜想一:Ca(OH)2
猜想二:
猜想三:CaCO3
[实验验证]
实验操作 实验现象 实验结论
(1)取1g样品放入盛有50g水的烧杯中,充分搅拌后,静置 烧杯底部有较多固体未溶解 样品中含有CaCO3
(2)取实验(1)中上层清液少许于试管中,再向试管中滴加2~3滴无色酚酞试液 样品中含有Ca(OH)2
[得出结论]甲同学认为猜想二正确。
[反思交流]
(1)乙同学认为甲同学的结论不合理,他认为猜想 也可能正确,原因是 。
(2)丙同学认为要想验证猜想二正确,还需做如下实验:取实验(1)中未溶解固体于试管中,向试管中滴加适量稀盐酸,如有 ,则猜想二正确。
[拓展提升]要想验证反应后物质的成分,除需验证有生成物以外,还应考虑反应物是否 。
12.实验设计是化学实验的重要环节.请根据下列实验要求回答相关问题:
实验一 实验二
【活动与探究一】用对比实验方法探究二氧化碳的性质.
(1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为 ;对比A瓶与 (填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是 结论是 (用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
实验三 实验四
(3)实验三目的是探究 对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中保持不变的是温度和 .
三、计算题
13.在一定温度下,向100g水中依次加入一定质量的KC1固体,充分溶解,加入KCl固体的质量与所得溶液质量的关系如图所示:
(1)该温度下,实验①所得溶液是 溶液(填“饱和”或“不饱和”)。
(2)实验③所得溶液中溶质的质量分数是 (写出计算过程)
(3)现有溶质质量分数为10%的KC1的溶液300g,若配制成溶质质量分数为3%的KCl的溶液,问需要加水的质量是多少。(写出计算过程)
四、填空与简答
14.A、B、C三种固体物质的溶解度曲线如图所示。
(1)P点的含义是 。
(2)当A中混有少量B时,可用 方法提纯A。
(3)t2℃时,30g A物质加入到50g水中,充分溶解后,所得溶液的质量为 。
(4)t2℃时,将A、B、C三种物质各25g分别溶于100g水中,充分搅拌后,降温至t1℃,此时三种溶液的溶质质量分数大小关系是 。
15.根据表中物质的溶解度回答下列问题。
温度/℃ 0 20 40 60 80 100
溶解度/g KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)20℃时,将31.6gKNO3加入50g水中,充分溶解后所得溶液质量为 g。
(2)60℃时,30gKNO3饱和溶液中溶质与溶剂的质量比为 。
(3)某温度时,KNO3与NaCl溶解度相等。该温度所在范围为 (填序号)。
A.0℃~20℃ B.20℃~40℃ C.40℃~100℃
(4)海水是获取NaCl的主要来源。海水制盐利用蒸发结晶而不用降温结晶的主要原因是 。
16.根据表中NaCl和KNO3溶解度数据,回答下列问题。
温度/℃ 0 20 40 60 80 100
NaCl溶解度(g/100g水) 35.7 36.0 36.6 37.3 38.4 39.8
KNO3溶解度(g/100g水) 13.3 31.6 63.9 110 169 246
①40℃时,NaCl的溶解度是 。
②20℃时,将等质量KNO3和NaCl固体,分别加入到盛有100g的烧杯中,充分搅拌后现象如图1,加热到60℃时现象如图2(不考虑水分蒸发)。
根据图1和图2现象判断:甲烧杯中的固体是 ;将图2中的两溶液降温至40℃时,对两种溶液的分析正确的是 。
A 甲一定是饱和溶液 B 两溶液中溶质质量分数一定相等
C 甲一定会析出晶体 D 甲溶液浓度一定大于乙溶液浓度
③如果60℃时KNO3饱和溶液中混有少量NaCl时提纯KNO3可采用方法 。
④将等质量KNO3的饱和溶液和NaCl的饱和溶液从60℃降温到20℃后,所得溶液中溶质质量分数大的是 溶液。
试卷第1页,共3页
参考答案:
1.C
【详解】A、溶液是均一、稳定的混合物,具有均一性、稳定性的液体不一定是溶液,如水是均一、稳定的,属于纯净物,不符合题意;
B、配制溶液时,搅拌可以加快溶解速率,不能增大固体溶质的溶解能力,不符合题意;
C、对于同一溶质的溶液,相同温度下,饱和溶液的一定比不饱和溶液浓,符合题意;
D、溶液中的溶质可以有多种,如海水,不符合题意。
故选C。
2.B
【详解】A.在一定条件下,不能继续溶解该溶质的溶液即为该溶质的饱和溶液,说法正确。
B.浓溶液不一定是饱和溶液,选项说法错误。
C.因为析出晶体后的溶液不能再继续溶解该溶质,所以还是当时条件下的饱和溶液,说法正确。
D. 氯化钾溶液的溶解度随温度的增大而增大,所以冷却或蒸发溶剂都有可能使不饱和氯化钾溶液达到饱和,说法正确。
故选:B
3.D
【详解】A、实验结果不能说明只有空气中的氧气和氮气能溶解在天然水中,选项A错误;
B、湖泊水中,氧气所占的体积大于21%,氮气所占的体积小于78%,而空气中,氧气占空气体积的21%,氮气占空气体积的78%,所以溶解在天然水中氧气和氮气与空气中的氧气和氮气的百分含量不相同,选项B错误;
C、天然水中溶解的氧气所占的体积大于21%,天然水中溶解的氧气较多,不需要采取增氧措施,选项C错误;
D、湖泊水中,氧气所占的体积大于21%,空气中,氧气占空气体积的21%;湖泊水中,氮气所占的体积小于78%,而空气中,氮气占空气体积的78%,在相同条件下,氧气比氮气在水中的溶解度大一些,选项D正确;
故选:D。
4.C
【详解】A、实验室的废水和废液不能直接排入下水道,以免破坏管道,污染环境,造成危险等。正确。
B、溶液是均一、稳定的混合物,正确。
C、饱和溶液不能溶解达到饱和的溶质,但还可以溶解其它物质。错误。
D、电解水时,负极产生的是氢气,正极产生的是氧气,正确。
故选C。
5.B
【分析】查阅资料,20°C时,硝酸钾的溶解度是31.6g;
①20°C,溶剂20g,则最多能溶解溶质6.32g,形成不饱和溶液;
②20°C,溶剂20g,最多能溶解溶质6.32g,有固体剩余;
③升高到的温度不能确定,该溶液的状态不能确定;
④降温到20°C,烧杯底部析出固体,得到饱和溶液。
【详解】A、溶液②、溶液④的烧杯底部有固体剩余,所以一定是饱和溶液,故选项正确;
B、溶液①一定是不饱和溶液,溶液③的状态不能确定,故选项错误;
C、溶液②、溶液③的质量:③>②,故选项正确;
D、溶液②中有固体,升高温度,固体消失,可以变成不饱和溶液,故选项正确。
故选:B。
6.B
【详解】A、由图可知,40℃时,甲物质的溶解度为50g,正确;
B、20℃时,甲、乙的溶解度为30g,甲、乙饱和溶液各130g中溶质甲乙质量均为30g,溶剂水的质量均为100g;40℃时甲物质的溶解度为50g,乙物质的溶解度为40g,所以40℃时,要想使溶液饱和需加入甲的质量、乙的质量分别为20g、10g,故要想使溶液饱和需加入甲的质量是乙的质量的2倍;但是题目中没有说明20℃时溶液状态,不能判断需要加入溶质质量,错误;
C、40℃时甲物质的溶解度为50g,而乙物质的溶解度为40g,且20℃时甲乙物质的溶解度相同,所以40℃等质量的甲、乙饱和溶液降温后析出晶体的质量甲大于乙,正确;
D、甲乙溶解度随温度升高而变大,20℃时,甲、乙溶解度相等,此时两者的饱和溶液,升温至40℃,甲、乙溶液变为不饱和溶液,溶质、溶剂质量不变,质量分数仍相等,正确。
故选B。
7.D
【分析】对于溶解度随温度升高而减小的物质,其不饱和溶液转化为饱和溶液,可以采用增加溶质、蒸发溶剂或升高温度的方法。
【详解】①增加溶质,能使其60℃接近饱和的溶液变为饱和溶液。
②蒸发溶剂,能使其60℃接近饱和的溶液变为饱和溶液。
③60℃时,升高温度,硫酸镁的溶解度减小,能使其60℃接近饱和的溶液变为饱和溶液。
④60℃时,降低温度,硫酸镁的溶解度减小,能使其60℃接近饱和的溶液变为饱和溶液。
故①②③④符合题意。故选:D。
8.C
【详解】A、由溶解度曲线可知,10℃时, 乙的溶解度小于甲的溶解度,故A选项错误;
B、20℃乙的溶解度是40g,即100g水中最多溶解40g乙,形成140g饱和溶液, 30℃时乙物质的溶解度是60g,即100g水中最多溶解60g乙,形成160g饱和溶液,若20℃乙的饱和溶液刚好为140g,则升温至30℃,再加入20g乙,刚好得到160g乙的饱和溶液,但若20℃时乙的饱和溶液的质量大于140g,则加入20g乙升温至30℃,所得溶液不饱和,故B选项错误;
C、20℃时,甲、乙溶解度相等,饱和溶液的溶质质量分数相等,分别蒸发等质量的水,析出晶体的质量相等,故C选项正确;
D、乙中混有少量甲,乙的溶解度受温度影响大,可用降温结晶的方法提纯乙,故D选项错误。
故选C。
9.D
【详解】烧碱具有易潮解的性质,根据图示可知,块状烧碱会吸收不饱和食盐水中挥发的水蒸气,发生潮解现象,天平右托盘质量增加;不饱和食盐水中的水减少,食盐浓度变大,天平左托盘质量减少,导致一段时间后天平的指针向右偏转,故选D。
10.C
【详解】A、甲的溶解度受温度变化影响较大,乙的溶解度受温度变化影响较小,甲中混有少量乙,可采用降温结晶的方法提纯甲,此选项说法不正确;
B、t1℃时甲的溶解度是30g,将20g甲加入50g水中充分溶解后,能够溶解15g,可得到65g溶液,此选项说法不正确;
C、t1℃时甲的溶解度小于乙,等质量的甲和乙固体形成饱和溶液时所需水的质量关系:甲>乙,此选项说法正确;
D、将t2℃时甲、乙、丙三种物质的溶液降温至t1℃,没有说明溶液是否饱和,所得溶液的溶质的质量分数无法比较,此选项不正确。
故选C。
【点睛】本题考查溶解度曲线的应用,溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
11. Ca(OH)2和CaCO3 溶液由无色变成红色 一 氢氧化钙微溶于水,未溶解固体可能只含氢氧化钙 气泡产生. 有剩余
【详解】本题通过氢氧化钙变质探究实验考查了碱的性质,碳酸根离子的检验等。解答时要根据各种物质的性质,结合各方面条件进行分析、判断得出正确的结论。
猜想假设:氢氧化钙能与空气中的二氧化碳生成碳酸钙和水。若没有变质,则固体成分是Ca(OH)2,部分变质固体成分是 Ca(OH)2和CaCO3的混合物,若完全变质固体成分是CaCO3,所以猜想二是 Ca(OH)2和CaCO3;
实验验证:若样品中含有Ca(OH)2,Ca(OH)2溶液呈碱性,能使酚酞试液变红色,所以实验(2)的现象是溶液由无色变成红色;
反思交流:(1)根据氢氧化钙的溶解度曲线可知,氢氧化钙微溶于水。乙同学认为甲同学的结论不合理,他认为猜想一也可能正确,原因是氢氧化钙微溶于水,未溶解固体可能只含氢氧化钙;
(2)若猜想二正确,固体中含的碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,可用盐酸来检验。丙同学认为要想验证猜想二正确,还需做如下实验:取实验(1)中未溶解固体于试管中,向试管中滴加适量稀盐酸,如有气泡产生,则猜想二正确;
拓展提升:根据上述探究可知,要想验证反应后物质的成分,除需验证有生成物以外,还应考虑反应物是否有剩余。
12. Ca(OH)2+CO2=CaCO3↓+H2O C 干燥的蓝色石蕊试纸不变色、湿润的变红, CO2+H2O== H2CO3 温度 溶剂的体积
【分析】本题中使湿润的蓝色石蕊试纸变红得使碳酸,而不是二氧化碳。
【详解】(1)二氧化碳和澄清的石灰水反应生成碳酸钙和水,Ca(OH)2+CO2=CaCO3↓+H2O;对比A瓶与C瓶的实验现象,可证明二氧化碳能与NaOH发生反应,因为它们的变量是氢氧化钠;
(2)实验二观察到C装置中发生的现象是:湿润的蓝色石蕊试纸变红,而干燥的不变;结论是:与水反应变成碳酸,碳酸能使紫色石蕊试纸变红CO2+H2O= H2CO3 ,二氧化碳不能使紫色石蕊试纸变红;
(3)实验三的不同点是加热改变温度,目的是探究温度对硝酸钾溶解性的影响;实验四是溶剂种类不同,探究溶剂种类对物质溶解性的影响,该实验中需要保持不变的是温度和溶剂体积.
13.(1)不饱和
(2)根据图示可知100g水中加入60g氯化钾所得溶液质量为140g,说明只溶解了40g氯化钾固体,所以该温度下氯化钾的溶解度是40g;实验③溶液的质量分数为 ;
(3)设需要加水的质量是x,根据题意可得:
300g×10%=(300g+x)×3%
解得:x=700g
答:需要加水的质量是700g。
【详解】(1)饱和溶液是指一定温度下不能继续溶解某种溶质的溶液,由图可知,①能继续溶解这种溶质,所以是不饱和溶液;
(2)见答案;
(3)见答案。
14. t1℃时,A、C物质的溶解度相等 降温结晶 75g A=B=C
【详解】(1)通过分析溶解度曲线可知,t1℃时,A和 C的溶解度曲线相交于P点,故P点的含义是t1℃时,A、C物质的溶解度相等,均为25g;
(2)A物质的溶解度受温度变化影响较大,B物质的溶解度受温度变化影响较小,所以当A中混有少量B时,可用降温结晶方法提纯A;
(3)t2℃时,A物质的溶解度是50g,所以30gA物质加入到50g水中,充分溶解后,只能溶解25g的晶体,所得溶液的质量为75g;
(4)t2℃时,将A、B、C三种物质各25g分别溶于100g水中,充分搅拌后,降温至t1℃,B物质的溶解度大于25g,晶体可以全部溶解,A、C物质的溶解度等于25g,晶体也可以全部溶解,溶质、溶剂质量都相等,所以此时三种溶液的溶质质量分数大小关系是A=B=C。
15. 65.8 11:10 B 氯化钠溶解度随温度变化不大
【详解】(1)20℃时硝酸甲溶解度31.6g,将31.6gKNO3加入50g水中溶解硝酸钾31.6g×=15.8g,溶液质量50g+15.8g=65.8g,故填:65.8。
(2)60℃时,硝酸加溶解度110g,故饱和溶液溶质和溶剂质量比为110g:100g=11:10,故填:11:10。
(3)20℃之前溶解度氯化钠大于硝酸钾,40℃之后溶解度硝酸钾大于氯化钠,某温度时,KNO3与NaCl溶解度相等,该温度所在范围为20℃~40℃,故选:B。
(4)由表格可知,氯化钠溶解度随温度变化很小,故海水制盐利用蒸发结晶而不用降温结晶,故填:氯化钠溶解度随温度变化不大。
16. 36.6g/100g水 KNO3 B 降温结晶 NaCl
【详解】①由表中数据可知,40℃时,NaCl的溶解度是36.6g;
②20℃时,溶解度:氯化钠大于硝酸钾,将等质量KNO3和NaCl固体,分别加入到盛有100g的烧杯中,乙中固体全部溶解,甲中有部分溶质未溶解,故甲烧杯中的固体是:KNO3;
20℃时,乙中固体全部溶解,甲中有部分溶质未溶解,故31.6g<固体质量≤36.0g,40℃时,氯化钠的溶解度是36.6g,硝酸钾的溶解度是63.9g,故40℃时,氯化钠和硝酸钾均完全溶解,是不饱和溶液。
A、40℃时,甲全部溶解,是不饱和溶液,不符合题意;
B、40℃时,甲、乙溶质和溶剂质量均相等,两溶液中溶质质量分数一定相等,符合题意;
C、40℃时,甲全部溶解,无晶体析出,不符合题意;
D、40℃时,甲、乙溶质和溶剂质量均相等,两溶液中溶质质量分数一定相等,不符合题意。
故选B;
③硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,如果60℃时KNO3饱和溶液中混有少量NaCl时,可采用降温结晶的方法;
④将等质量KNO3的饱和溶液和NaCl的饱和溶液从60℃降温到20℃后,硝酸钾和氯化钠的溶解度均减小,还是饱和溶液,20℃时,溶解度:氯化钠>硝酸钾,故饱和溶液的溶质质量分数:氯化钠大于硝酸钾,故所得溶液中溶质质量分数大的是氯化钠溶液。
答案第1页,共2页
一、选择题
1.下列有关溶液的说法正确的是
A.具有均一性、稳定性的液体一定是溶液
B.配制溶液时,搅拌可以增大固体溶质的溶解能力
C.对于同一溶质的溶液,相同温度下,饱和溶液的一定比不饱和溶液浓
D.溶液中溶质只能是一种
2.下列有关饱和溶液和不饱和溶液的说法中,不正确的是
A.在一定条件下,不能继续溶解该溶质的溶液即为该溶质的饱和溶液
B.浓溶液一定是饱和溶液
C.析出晶体后的溶液还是当时条件下的饱和溶液
D.冷却或蒸发溶剂都有可能使不饱和氯化钾溶液达到饱和
3.若把江河湖泊水中溶解的气体收集起来,分析的结果是:氧气所占的体积大于21%,氮气所占的体积小于78%,对此应得出的结论正确的是
A.只有空气中的氧气和氮气能溶解在天然水中
B.溶解在天然水中氧气和氮气与空气中的氧气和氮气的百分含量相同
C.天然水中溶解的氧气极少,所以在湖泊中养鱼要采取增氧措施
D.在相同条件下,氧气比氮气在水中的溶解度大一些
4.今年5月4日,习总书记在推进南水北调后续工程高质量发展座谈会上强调:“水是生存之本,文明之源,要坚持节水优先,抓好水污染的防治工作”。下列有关水与溶液的说法错误的是
A.实验室的废水和废液不能直接排入下水道
B.溶液是均一、稳定的混合物
C.饱和溶液就是不能再溶解任何物质的溶液
D.电解水时,负极产生的是氢气
5.为探究硝酸钾的溶解性,进行了如图实验,其中溶液①、溶液③中没有剩余固体,溶液②、溶液④中有剩余固体,下列说法错误的是
A.溶液②、溶液④一定是饱和溶液
B.溶液①、溶液③一定是不饱和溶液
C.溶液②、溶液③的质量:③>②
D.升高温度,溶液②可以变成不饱和溶液
6.甲、乙两种固体的溶解度曲线如图所示,下列说法中不正确的是
A.40℃时,甲物质的溶解度为50g
B.20℃时,甲、乙溶液各130g分别升温到40℃,要想使溶液饱和需加入甲的质量是乙的质量的2倍
C.40℃时,等质量的甲、乙饱和溶液降温到20℃时析出晶体的质量甲>乙
D.20℃时,甲、乙饱和溶液,升温至40℃,甲、乙溶液的质量分数相等
7.MgSO4的溶解度曲线如下图所示,欲使其60℃接近饱和的溶液变为饱和溶液,可采取的措施有
①增加溶质②蒸发溶剂③升高温度④降低温度
A.①②③ B.①②④ C.①② D.①②③④
8.如图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是
A.10℃时, 乙的溶解度大于甲的溶解度
B.20℃乙的饱和溶液升温至30℃,再加入20g乙,所得溶液仍饱和
C.20℃甲、乙饱和溶液分别蒸发等质量的水,析出晶体质量相等
D.乙中混有少量甲时,可用蒸发结晶的方法提纯甲
9.将如图密闭装置放天平上,使天平平衡,一段时间后出现的情况是
A.指针偏左,食盐溶液变浓,烧碱变质 B.指针偏左,食盐溶液变饱和,烧碱潮解
C.指针偏右,食盐溶液变饱和,烧碱潮解 D.指针偏右,食盐溶液变浓,烧碱潮解
10.溶液对于自然界中的生命活动和人类生产活动具有重要意义,下图是甲、乙、丙三种固体物质的溶解度曲线(固体均不含结晶水),下列说法正确的是
A.甲中混有少量乙,可采用蒸发结晶的方法提纯甲
B.t1℃时,将20g甲加入50g水中充分溶解后可得到70g溶液
C.t1℃时,等质量的甲和乙固体形成饱和溶液时所需水的质量关系:甲>乙
D.将t2℃时甲、乙、丙三种物质的溶液降温至t1℃,所得溶液的溶质质量分数关系:乙>甲=丙
二、科学探究题
11.某化学学习小组的同学对一瓶敞口放置氢氧化钙固体的化学成分产生了兴趣,他们根据自己所学知识进行如下探究:
[提出问题]该瓶药品的化学成分是什么
[查阅资料](1)氢氧化钙能与空气中的二氧化碳反应而变质。
(2)氢氧化钙的溶解度曲线如图:
[猜想假设]猜想一:Ca(OH)2
猜想二:
猜想三:CaCO3
[实验验证]
实验操作 实验现象 实验结论
(1)取1g样品放入盛有50g水的烧杯中,充分搅拌后,静置 烧杯底部有较多固体未溶解 样品中含有CaCO3
(2)取实验(1)中上层清液少许于试管中,再向试管中滴加2~3滴无色酚酞试液 样品中含有Ca(OH)2
[得出结论]甲同学认为猜想二正确。
[反思交流]
(1)乙同学认为甲同学的结论不合理,他认为猜想 也可能正确,原因是 。
(2)丙同学认为要想验证猜想二正确,还需做如下实验:取实验(1)中未溶解固体于试管中,向试管中滴加适量稀盐酸,如有 ,则猜想二正确。
[拓展提升]要想验证反应后物质的成分,除需验证有生成物以外,还应考虑反应物是否 。
12.实验设计是化学实验的重要环节.请根据下列实验要求回答相关问题:
实验一 实验二
【活动与探究一】用对比实验方法探究二氧化碳的性质.
(1)实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为 ;对比A瓶与 (填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是 结论是 (用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
实验三 实验四
(3)实验三目的是探究 对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中保持不变的是温度和 .
三、计算题
13.在一定温度下,向100g水中依次加入一定质量的KC1固体,充分溶解,加入KCl固体的质量与所得溶液质量的关系如图所示:
(1)该温度下,实验①所得溶液是 溶液(填“饱和”或“不饱和”)。
(2)实验③所得溶液中溶质的质量分数是 (写出计算过程)
(3)现有溶质质量分数为10%的KC1的溶液300g,若配制成溶质质量分数为3%的KCl的溶液,问需要加水的质量是多少。(写出计算过程)
四、填空与简答
14.A、B、C三种固体物质的溶解度曲线如图所示。
(1)P点的含义是 。
(2)当A中混有少量B时,可用 方法提纯A。
(3)t2℃时,30g A物质加入到50g水中,充分溶解后,所得溶液的质量为 。
(4)t2℃时,将A、B、C三种物质各25g分别溶于100g水中,充分搅拌后,降温至t1℃,此时三种溶液的溶质质量分数大小关系是 。
15.根据表中物质的溶解度回答下列问题。
温度/℃ 0 20 40 60 80 100
溶解度/g KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)20℃时,将31.6gKNO3加入50g水中,充分溶解后所得溶液质量为 g。
(2)60℃时,30gKNO3饱和溶液中溶质与溶剂的质量比为 。
(3)某温度时,KNO3与NaCl溶解度相等。该温度所在范围为 (填序号)。
A.0℃~20℃ B.20℃~40℃ C.40℃~100℃
(4)海水是获取NaCl的主要来源。海水制盐利用蒸发结晶而不用降温结晶的主要原因是 。
16.根据表中NaCl和KNO3溶解度数据,回答下列问题。
温度/℃ 0 20 40 60 80 100
NaCl溶解度(g/100g水) 35.7 36.0 36.6 37.3 38.4 39.8
KNO3溶解度(g/100g水) 13.3 31.6 63.9 110 169 246
①40℃时,NaCl的溶解度是 。
②20℃时,将等质量KNO3和NaCl固体,分别加入到盛有100g的烧杯中,充分搅拌后现象如图1,加热到60℃时现象如图2(不考虑水分蒸发)。
根据图1和图2现象判断:甲烧杯中的固体是 ;将图2中的两溶液降温至40℃时,对两种溶液的分析正确的是 。
A 甲一定是饱和溶液 B 两溶液中溶质质量分数一定相等
C 甲一定会析出晶体 D 甲溶液浓度一定大于乙溶液浓度
③如果60℃时KNO3饱和溶液中混有少量NaCl时提纯KNO3可采用方法 。
④将等质量KNO3的饱和溶液和NaCl的饱和溶液从60℃降温到20℃后,所得溶液中溶质质量分数大的是 溶液。
试卷第1页,共3页
参考答案:
1.C
【详解】A、溶液是均一、稳定的混合物,具有均一性、稳定性的液体不一定是溶液,如水是均一、稳定的,属于纯净物,不符合题意;
B、配制溶液时,搅拌可以加快溶解速率,不能增大固体溶质的溶解能力,不符合题意;
C、对于同一溶质的溶液,相同温度下,饱和溶液的一定比不饱和溶液浓,符合题意;
D、溶液中的溶质可以有多种,如海水,不符合题意。
故选C。
2.B
【详解】A.在一定条件下,不能继续溶解该溶质的溶液即为该溶质的饱和溶液,说法正确。
B.浓溶液不一定是饱和溶液,选项说法错误。
C.因为析出晶体后的溶液不能再继续溶解该溶质,所以还是当时条件下的饱和溶液,说法正确。
D. 氯化钾溶液的溶解度随温度的增大而增大,所以冷却或蒸发溶剂都有可能使不饱和氯化钾溶液达到饱和,说法正确。
故选:B
3.D
【详解】A、实验结果不能说明只有空气中的氧气和氮气能溶解在天然水中,选项A错误;
B、湖泊水中,氧气所占的体积大于21%,氮气所占的体积小于78%,而空气中,氧气占空气体积的21%,氮气占空气体积的78%,所以溶解在天然水中氧气和氮气与空气中的氧气和氮气的百分含量不相同,选项B错误;
C、天然水中溶解的氧气所占的体积大于21%,天然水中溶解的氧气较多,不需要采取增氧措施,选项C错误;
D、湖泊水中,氧气所占的体积大于21%,空气中,氧气占空气体积的21%;湖泊水中,氮气所占的体积小于78%,而空气中,氮气占空气体积的78%,在相同条件下,氧气比氮气在水中的溶解度大一些,选项D正确;
故选:D。
4.C
【详解】A、实验室的废水和废液不能直接排入下水道,以免破坏管道,污染环境,造成危险等。正确。
B、溶液是均一、稳定的混合物,正确。
C、饱和溶液不能溶解达到饱和的溶质,但还可以溶解其它物质。错误。
D、电解水时,负极产生的是氢气,正极产生的是氧气,正确。
故选C。
5.B
【分析】查阅资料,20°C时,硝酸钾的溶解度是31.6g;
①20°C,溶剂20g,则最多能溶解溶质6.32g,形成不饱和溶液;
②20°C,溶剂20g,最多能溶解溶质6.32g,有固体剩余;
③升高到的温度不能确定,该溶液的状态不能确定;
④降温到20°C,烧杯底部析出固体,得到饱和溶液。
【详解】A、溶液②、溶液④的烧杯底部有固体剩余,所以一定是饱和溶液,故选项正确;
B、溶液①一定是不饱和溶液,溶液③的状态不能确定,故选项错误;
C、溶液②、溶液③的质量:③>②,故选项正确;
D、溶液②中有固体,升高温度,固体消失,可以变成不饱和溶液,故选项正确。
故选:B。
6.B
【详解】A、由图可知,40℃时,甲物质的溶解度为50g,正确;
B、20℃时,甲、乙的溶解度为30g,甲、乙饱和溶液各130g中溶质甲乙质量均为30g,溶剂水的质量均为100g;40℃时甲物质的溶解度为50g,乙物质的溶解度为40g,所以40℃时,要想使溶液饱和需加入甲的质量、乙的质量分别为20g、10g,故要想使溶液饱和需加入甲的质量是乙的质量的2倍;但是题目中没有说明20℃时溶液状态,不能判断需要加入溶质质量,错误;
C、40℃时甲物质的溶解度为50g,而乙物质的溶解度为40g,且20℃时甲乙物质的溶解度相同,所以40℃等质量的甲、乙饱和溶液降温后析出晶体的质量甲大于乙,正确;
D、甲乙溶解度随温度升高而变大,20℃时,甲、乙溶解度相等,此时两者的饱和溶液,升温至40℃,甲、乙溶液变为不饱和溶液,溶质、溶剂质量不变,质量分数仍相等,正确。
故选B。
7.D
【分析】对于溶解度随温度升高而减小的物质,其不饱和溶液转化为饱和溶液,可以采用增加溶质、蒸发溶剂或升高温度的方法。
【详解】①增加溶质,能使其60℃接近饱和的溶液变为饱和溶液。
②蒸发溶剂,能使其60℃接近饱和的溶液变为饱和溶液。
③60℃时,升高温度,硫酸镁的溶解度减小,能使其60℃接近饱和的溶液变为饱和溶液。
④60℃时,降低温度,硫酸镁的溶解度减小,能使其60℃接近饱和的溶液变为饱和溶液。
故①②③④符合题意。故选:D。
8.C
【详解】A、由溶解度曲线可知,10℃时, 乙的溶解度小于甲的溶解度,故A选项错误;
B、20℃乙的溶解度是40g,即100g水中最多溶解40g乙,形成140g饱和溶液, 30℃时乙物质的溶解度是60g,即100g水中最多溶解60g乙,形成160g饱和溶液,若20℃乙的饱和溶液刚好为140g,则升温至30℃,再加入20g乙,刚好得到160g乙的饱和溶液,但若20℃时乙的饱和溶液的质量大于140g,则加入20g乙升温至30℃,所得溶液不饱和,故B选项错误;
C、20℃时,甲、乙溶解度相等,饱和溶液的溶质质量分数相等,分别蒸发等质量的水,析出晶体的质量相等,故C选项正确;
D、乙中混有少量甲,乙的溶解度受温度影响大,可用降温结晶的方法提纯乙,故D选项错误。
故选C。
9.D
【详解】烧碱具有易潮解的性质,根据图示可知,块状烧碱会吸收不饱和食盐水中挥发的水蒸气,发生潮解现象,天平右托盘质量增加;不饱和食盐水中的水减少,食盐浓度变大,天平左托盘质量减少,导致一段时间后天平的指针向右偏转,故选D。
10.C
【详解】A、甲的溶解度受温度变化影响较大,乙的溶解度受温度变化影响较小,甲中混有少量乙,可采用降温结晶的方法提纯甲,此选项说法不正确;
B、t1℃时甲的溶解度是30g,将20g甲加入50g水中充分溶解后,能够溶解15g,可得到65g溶液,此选项说法不正确;
C、t1℃时甲的溶解度小于乙,等质量的甲和乙固体形成饱和溶液时所需水的质量关系:甲>乙,此选项说法正确;
D、将t2℃时甲、乙、丙三种物质的溶液降温至t1℃,没有说明溶液是否饱和,所得溶液的溶质的质量分数无法比较,此选项不正确。
故选C。
【点睛】本题考查溶解度曲线的应用,溶解度曲线能定量地表示出溶解度变化的规律,从溶解度曲线可以看出:同一溶质在不同温度下的溶解度不同;同一温度下,不同溶质的溶解度可能相同,也可能不同;温度对不同物质的溶解度影响不同。
11. Ca(OH)2和CaCO3 溶液由无色变成红色 一 氢氧化钙微溶于水,未溶解固体可能只含氢氧化钙 气泡产生. 有剩余
【详解】本题通过氢氧化钙变质探究实验考查了碱的性质,碳酸根离子的检验等。解答时要根据各种物质的性质,结合各方面条件进行分析、判断得出正确的结论。
猜想假设:氢氧化钙能与空气中的二氧化碳生成碳酸钙和水。若没有变质,则固体成分是Ca(OH)2,部分变质固体成分是 Ca(OH)2和CaCO3的混合物,若完全变质固体成分是CaCO3,所以猜想二是 Ca(OH)2和CaCO3;
实验验证:若样品中含有Ca(OH)2,Ca(OH)2溶液呈碱性,能使酚酞试液变红色,所以实验(2)的现象是溶液由无色变成红色;
反思交流:(1)根据氢氧化钙的溶解度曲线可知,氢氧化钙微溶于水。乙同学认为甲同学的结论不合理,他认为猜想一也可能正确,原因是氢氧化钙微溶于水,未溶解固体可能只含氢氧化钙;
(2)若猜想二正确,固体中含的碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,可用盐酸来检验。丙同学认为要想验证猜想二正确,还需做如下实验:取实验(1)中未溶解固体于试管中,向试管中滴加适量稀盐酸,如有气泡产生,则猜想二正确;
拓展提升:根据上述探究可知,要想验证反应后物质的成分,除需验证有生成物以外,还应考虑反应物是否有剩余。
12. Ca(OH)2+CO2=CaCO3↓+H2O C 干燥的蓝色石蕊试纸不变色、湿润的变红, CO2+H2O== H2CO3 温度 溶剂的体积
【分析】本题中使湿润的蓝色石蕊试纸变红得使碳酸,而不是二氧化碳。
【详解】(1)二氧化碳和澄清的石灰水反应生成碳酸钙和水,Ca(OH)2+CO2=CaCO3↓+H2O;对比A瓶与C瓶的实验现象,可证明二氧化碳能与NaOH发生反应,因为它们的变量是氢氧化钠;
(2)实验二观察到C装置中发生的现象是:湿润的蓝色石蕊试纸变红,而干燥的不变;结论是:与水反应变成碳酸,碳酸能使紫色石蕊试纸变红CO2+H2O= H2CO3 ,二氧化碳不能使紫色石蕊试纸变红;
(3)实验三的不同点是加热改变温度,目的是探究温度对硝酸钾溶解性的影响;实验四是溶剂种类不同,探究溶剂种类对物质溶解性的影响,该实验中需要保持不变的是温度和溶剂体积.
13.(1)不饱和
(2)根据图示可知100g水中加入60g氯化钾所得溶液质量为140g,说明只溶解了40g氯化钾固体,所以该温度下氯化钾的溶解度是40g;实验③溶液的质量分数为 ;
(3)设需要加水的质量是x,根据题意可得:
300g×10%=(300g+x)×3%
解得:x=700g
答:需要加水的质量是700g。
【详解】(1)饱和溶液是指一定温度下不能继续溶解某种溶质的溶液,由图可知,①能继续溶解这种溶质,所以是不饱和溶液;
(2)见答案;
(3)见答案。
14. t1℃时,A、C物质的溶解度相等 降温结晶 75g A=B=C
【详解】(1)通过分析溶解度曲线可知,t1℃时,A和 C的溶解度曲线相交于P点,故P点的含义是t1℃时,A、C物质的溶解度相等,均为25g;
(2)A物质的溶解度受温度变化影响较大,B物质的溶解度受温度变化影响较小,所以当A中混有少量B时,可用降温结晶方法提纯A;
(3)t2℃时,A物质的溶解度是50g,所以30gA物质加入到50g水中,充分溶解后,只能溶解25g的晶体,所得溶液的质量为75g;
(4)t2℃时,将A、B、C三种物质各25g分别溶于100g水中,充分搅拌后,降温至t1℃,B物质的溶解度大于25g,晶体可以全部溶解,A、C物质的溶解度等于25g,晶体也可以全部溶解,溶质、溶剂质量都相等,所以此时三种溶液的溶质质量分数大小关系是A=B=C。
15. 65.8 11:10 B 氯化钠溶解度随温度变化不大
【详解】(1)20℃时硝酸甲溶解度31.6g,将31.6gKNO3加入50g水中溶解硝酸钾31.6g×=15.8g,溶液质量50g+15.8g=65.8g,故填:65.8。
(2)60℃时,硝酸加溶解度110g,故饱和溶液溶质和溶剂质量比为110g:100g=11:10,故填:11:10。
(3)20℃之前溶解度氯化钠大于硝酸钾,40℃之后溶解度硝酸钾大于氯化钠,某温度时,KNO3与NaCl溶解度相等,该温度所在范围为20℃~40℃,故选:B。
(4)由表格可知,氯化钠溶解度随温度变化很小,故海水制盐利用蒸发结晶而不用降温结晶,故填:氯化钠溶解度随温度变化不大。
16. 36.6g/100g水 KNO3 B 降温结晶 NaCl
【详解】①由表中数据可知,40℃时,NaCl的溶解度是36.6g;
②20℃时,溶解度:氯化钠大于硝酸钾,将等质量KNO3和NaCl固体,分别加入到盛有100g的烧杯中,乙中固体全部溶解,甲中有部分溶质未溶解,故甲烧杯中的固体是:KNO3;
20℃时,乙中固体全部溶解,甲中有部分溶质未溶解,故31.6g<固体质量≤36.0g,40℃时,氯化钠的溶解度是36.6g,硝酸钾的溶解度是63.9g,故40℃时,氯化钠和硝酸钾均完全溶解,是不饱和溶液。
A、40℃时,甲全部溶解,是不饱和溶液,不符合题意;
B、40℃时,甲、乙溶质和溶剂质量均相等,两溶液中溶质质量分数一定相等,符合题意;
C、40℃时,甲全部溶解,无晶体析出,不符合题意;
D、40℃时,甲、乙溶质和溶剂质量均相等,两溶液中溶质质量分数一定相等,不符合题意。
故选B;
③硝酸钾的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,如果60℃时KNO3饱和溶液中混有少量NaCl时,可采用降温结晶的方法;
④将等质量KNO3的饱和溶液和NaCl的饱和溶液从60℃降温到20℃后,硝酸钾和氯化钠的溶解度均减小,还是饱和溶液,20℃时,溶解度:氯化钠>硝酸钾,故饱和溶液的溶质质量分数:氯化钠大于硝酸钾,故所得溶液中溶质质量分数大的是氯化钠溶液。
答案第1页,共2页
同课章节目录
