北京市顺义区第一中学2023-2024学年高一下学期3月月考试题 化学(解析版)
文档属性
| 名称 | 北京市顺义区第一中学2023-2024学年高一下学期3月月考试题 化学(解析版) |  | |
| 格式 | docx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-12 17:52:20 | ||
图片预览



文档简介
北京市顺义区第一中学2023—2024学年高一下学期3月月考
化学试题
考试说明:
1.本试卷共8页,答题卡1张;考试结束只交答题卡。
2.试卷满分100分,考试时间90分钟。
3.试卷共两部分,第一部分为选择题,共计42分;第二部分为非选择题,共计58分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Cl-35.5 S-32 Cu-64
第一部分(选择题)
本部分每小题3分,共42分。在每题列出的四个选项中选出最符合题目要求的一项。
1. 下列有关试剂的保存方法不正确的是
A. Na保存于煤油中 B. 过氧化钠应密封保存
C. 氯水保存于无色试剂瓶中 D. 浓硫酸保存于铁质容器中
2. 镓(31Ga)与K位于元素周期表中同一周期,下列关于Ga的说法不正确的是
A. 位于元素周期表第ⅢA族 B. 原子半径比K小
C. 单质的还原性比K弱 D. Ga(OH)3的碱性比Al(OH)3弱
3. 下列图示装置所表示的实验中,没有发生氧化还原反应的是
A B C D
蘸有浓盐酸和浓氨水的玻璃棒靠近 铝丝伸入硫酸铜溶液中 氯气通入溶液变成黄色 向蔗糖中加入浓硫酸
A. A B. B C. C D. D
4. 实验室需要460mL0.20mol L-1Na2CO3溶液,某同学配制过程如图所示。
下列关于该实验的叙述错误的是
A. 将药品放在称量纸上称取10.6gNa2CO3固体
B. Na2CO3固体在烧杯中完全溶解后,恢复至室温转移到容量瓶中定容
C. ⑤中定容时俯视刻度线会导致溶液浓度偏低
D. 容量瓶不宜长期贮存配制好的溶液
5. 下列对应离子方程式书写正确的是
A. 铜溶于稀硝酸:
B. 向Al2O3中滴加NaOH溶液:
C. 将少量Na2O2投入水中:
D. 向水中通入适量
6. 能实现下列物质间直接转化的元素是
单质氧化物酸(或碱)盐
A. N B. Al C. S D. Fe
7. 下列实验结论与实验操作及现象相符的一组是
选项 实验操作及现象 实验结论
A 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 原溶液中一定含有NH
B 向某溶液中滴加AgNO3溶液,产生白色沉淀 原溶液中一定含有Cl-
C 向某溶液中滴加酸性KMnO4溶液,紫色褪去 原溶液中一定含Fe2+
D 向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀 原溶液中一定有SO
A. A B. B C. C D. D
8. S2Cl2常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。S2Cl2各原子最外层均达到8电子稳定结构,与水极易反应:S2Cl2+H2O—S↓+SO2+HCl(未配平),下列说法不正确的是
A. S2Cl2中硫元素化合价:+1
B. S2Cl2中存在极性共价键和非极性共价键
C. S2Cl2与水反应时,氧化产物与还原产物的物质的量之比为1∶3
D 向硝酸银溶液中滴加S2Cl2,若有白色沉淀产生,则S2Cl2中含有Cl-
9. 某化学研究小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、、、Cl-中的若干种离子。该小组同学取部分水样进行实验。①向水样中先滴加足量硝酸钡溶液,产生白色沉淀;②向其中再滴加足量稀盐酸,沉淀部分溶解;③最后滴加硝酸银溶液,又产生白色沉淀。下列说法正确的是
A. 经过实验可以不能确定是否含有K+离子
B. 经过实验可以确定一定存在的离子是、、Cl-
C. 步骤②中发生反应的化学方程式为
D. 步骤③中发生反应的离子方程式为
10. 已知:A、C、D、E为无色气体,F为红棕色气体。物质间的转化关系如图所示,其中部分产物已略去,则下列说法错误的是
A A、B互换位置也满足该流程
B. 反应①中每生成转移电子
C. F与水的反应中氧化剂与还原剂的物质的量之比为1:2
D. C为,D为,C可以在D中燃烧生成氮气
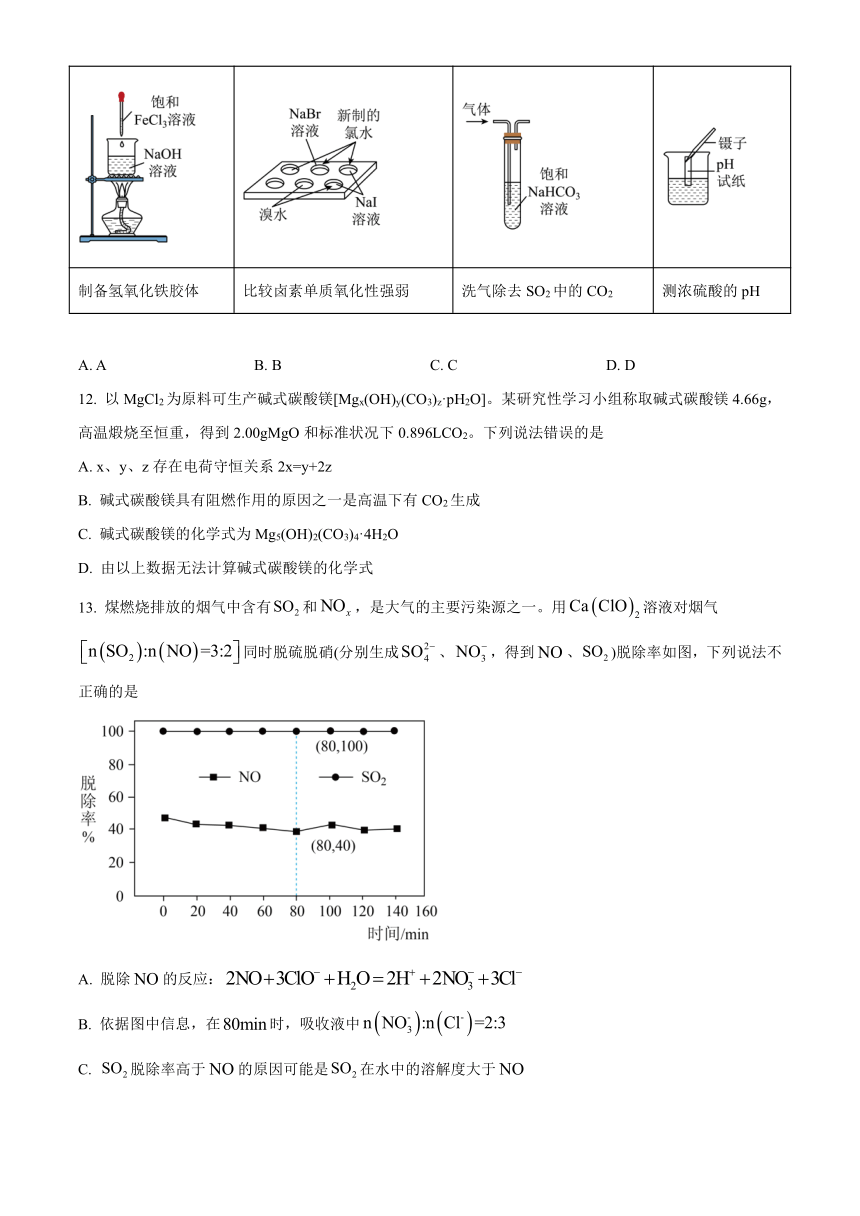
11. 下列实验或装置能达到实验目的的是
A B C D
制备氢氧化铁胶体 比较卤素单质氧化性强弱 洗气除去SO2中的CO2 测浓硫酸的pH
A. A B. B C. C D. D
12. 以MgCl2为原料可生产碱式碳酸镁[Mgx(OH)y(CO3)z·pH2O]。某研究性学习小组称取碱式碳酸镁4.66g,高温煅烧至恒重,得到2.00gMgO和标准状况下0.896LCO2。下列说法错误的是
A. x、y、z存在电荷守恒关系2x=y+2z
B. 碱式碳酸镁具有阻燃作用的原因之一是高温下有CO2生成
C. 碱式碳酸镁的化学式为Mg5(OH)2(CO3)4·4H2O
D. 由以上数据无法计算碱式碳酸镁的化学式
13. 煤燃烧排放的烟气中含有和,是大气的主要污染源之一。用溶液对烟气同时脱硫脱硝(分别生成、,得到、)脱除率如图,下列说法不正确的是
A. 脱除的反应:
B. 依据图中信息,在时,吸收液中
C. 脱除率高于的原因可能是在水中的溶解度大于
D. 随着脱除反应的进行,吸收剂溶液的逐渐减小
14. 硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:
实验
现象 a中产生凝胶状沉淀
下列结论不正确是
A. 盐酸与石灰石反应离子反应方程式:
B. 由实验不能说明酸性H2CO3>H2SiO3
C. 若想比较碳酸和硅酸的酸性强弱,应该让气体在通入a之前先通过盛有饱和碳酸氢钠溶液的洗气瓶
D. 向Na2SiO3溶液中通入过量CO2,发生反应:
第二部分 (非选择题)
本部分共5题,共58分。
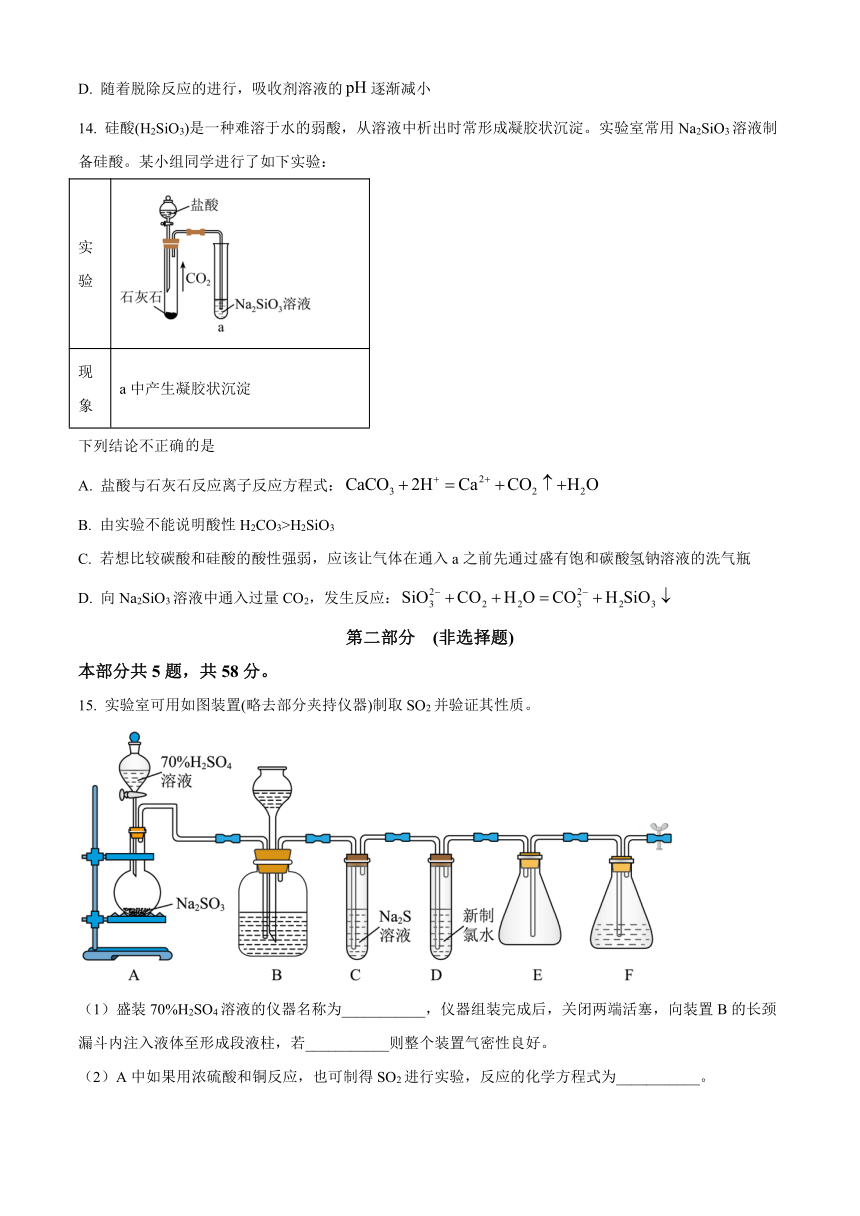
15. 实验室可用如图装置(略去部分夹持仪器)制取SO2并验证其性质。
(1)盛装70%H2SO4溶液的仪器名称为___________,仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成段液柱,若___________则整个装置气密性良好。
(2)A中如果用浓硫酸和铜反应,也可制得SO2进行实验,反应的化学方程式为___________。
(3)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择___________(填代号)。
a.蒸馏水 b.饱和NaHCO3溶液 c.饱和NaHSO3溶液 d.饱和NaOH溶液
(4)C试管中的试剂可以验证二氧化硫的氧化性,现象为___________。
(5)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案合理的是方案___________(填“I”“Ⅱ”或“Ⅲ”);SO2通入试管D中发生的主要反应的离子方程式为___________。
(6)装置E的作用是做安全瓶,防止F中的液体倒吸入D中,装置F中为___________溶液。
16. 硝酸是重要的化工原料。下图是以合成氨为基础的传统硝酸生产工艺流程(其中空气等基础原料已略去)。
(1)关于合成氨工艺,下列说法不正确的是___________(填序号)。
a.合成氨是一种重要的人工固氮方法
b.该反应过程中氮元素被氧化
c.合成的氨气还可以用于化肥工业
d.该反应采用高温、高压等苛刻条件,与N2化学性质很稳定有关
(2)氮氧化装置中,先生成NO,反应的化学方程式为___________。然后NO被氧化成NO2。
(3)吸收装置中,发生的反应为,若用VaLxmol·L-1的稀硝酸作为吸收液,反应后得到VbLymol·L-1的浓硝酸,则理论上吸收装置中需消耗的O2的物质的量为___________mol(写出计算式)。
(4)为实现制硝酸的绿色化改进,技术人员将①分离液态空气、②电解水等工艺整合在上述流程中。请在①、②中任选一种,说明该工艺的产物如何应用于硝酸生产流程:___________。
(5)NH3催化还原氯氧化物技术(SCR)是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如下图所示:
若催化剂表面参与反应的NO和NO2物质的量之比为1:1,则总反应的化学方程式为___________。
17. 元素周期表是学习化学的重要工具。A-H为短周期主族元素,其原子半径→原子序数→最高正化合价(或最低负化合价)的关系如图所示。
回答下列问题:
(1)F原子的结构示意图为___________,写出质量数为35的H原子符号:___________。
(2)B、D形成的化合物BD2的电子式为___________,结构式为___________。
(3)A与H形成的化合物属于___________(填“离子”或“共价”)化合物;元素B、G、H的最高价氧化物的水化物中,酸性由大到小的是___________(用“>”连接化学式)。
(4)D、E的简单离子半径由大到小顺序为___________(填离子符号)。
(5)元素G的简单气态氢化物与GD2的水溶液反应的实验现象为___________。
(6)单质F与E最高价氧化物对应的水化物之间发生反应的离子方程式为___________。
18. 碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下x克钢样中碳、硫转化为CO2、SO2。
①气体a的成分是____________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5 O21____+3_____。
(2)将气体a通入测硫酸装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:_________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mLNaOH溶液,若消耗1mLNaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:_________________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
①气体a通过B和C的目的是_____________________。
②计算钢样中碳的质量分数,应测量的数据是__________________。
19. 某化学小组研究硝酸与金属的反应。下列实验中硝酸与金属的反应均在注射器中完成,实验操作及实验现象记录如表:
序号 实验操作与实验现象
实验1 加入适量铜片与2mL的浓硝酸。反应剧烈,产生红棕色气体,溶液立即呈绿色。
实验2 加入过量的铜片与2mL0.5mol/LHNO3溶液。产生无色气泡,溶液逐渐变为蓝色。注射器中的气体始终无色。反应结束后,向注射器中充入一定量的O2,气体迅速变为红棕色
实验3 加入过量的铁粉与2mL0.5mol/LHNO3溶液,立即有无色气体生成,溶液为很浅的绿色,反应结束后将气体通入有空气的容器无明显变化,点燃,有尖锐的爆鸣声,容器壁出现无色液滴;取反应后溶液,加入足量NaOH溶液,立刻得到白色沉淀,迅速变为灰绿色,最后变成红褐色,加热后产生能使湿润红色石蕊试纸变蓝的气体。
(1)铜与浓HNO3反应产生红棕色气体化学方程式是___________。
(2)对实验1所得溶液呈绿色,而实验2所得溶液呈蓝色的原因提出猜想。
查阅资料:
i.NO2溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
ⅱ.NO2与水反应时会有部分发生反应:,HNO2是弱酸,无色,不稳定。
ⅲ.离子颜色为绿色。
猜想1:NO2溶于浓硝酸,与蓝色溶液混合而呈现绿色。
猜想2:HNO2电离出的与结合为(绿色)。
①向浓硝酸中通入NO2,溶液呈黄色,加入___________(填试剂)后呈绿色,证实猜想1合理。
②研究猜想2是否为实验I所得溶液呈绿色的主要原因,实验如下。
a.证明溶液A中含有HNO2的证据是___________。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验I所得溶液呈绿色的主要原因,说明理由:___________。
(3)实验2中充入O2后气体变为红棕色的反应的化学方程式是___________。
(4)查阅文献:铁粉与稀硝酸反应会生成H2.由实验3中的实验现象可知,过量的铁粉与0.5mol/L稀HNO3反应的还原产物中除了H2外,还有___________生成。写出白色沉淀迅速变为灰绿色,最后变成红褐色的化学方程式___________。
(5)甲同学对实验3产生H2的原因提出假设:该浓度的硝酸中H+的氧化性大于。乙同学认为该假设不合理。依据是实验2中观察到了___________(填实验现象),该现象能说明假设不合理。
(6)结合以上实验可知,金属与硝酸反应的产物与___________等因素有关。
北京市顺义区第一中学2023—2024学年高一下学期3月月考
化学试题
考试说明:
1.本试卷共8页,答题卡1张;考试结束只交答题卡。
2.试卷满分100分,考试时间90分钟。
3.试卷共两部分,第一部分为选择题,共计42分;第二部分为非选择题,共计58分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Cl-35.5 S-32 Cu-64
第一部分(选择题)
本部分每小题3分,共42分。在每题列出的四个选项中选出最符合题目要求的一项。
1. 下列有关试剂的保存方法不正确的是
A. Na保存于煤油中 B. 过氧化钠应密封保存
C. 氯水保存于无色试剂瓶中 D. 浓硫酸保存于铁质容器中
【答案】C
【解析】
【详解】A.Na的密度大于煤油,在空气中易反应,所以保存于煤油中,A项正确;
B.过氧化钠,在空气中易反应,所以应密封保存,B项正确;
C.氯水中有次氯酸,见光易分解,应该保存于棕色试剂瓶中,C项错误;
D.浓硫酸与铁反应钝化反应,可以将浓硫酸保存于铁质容器中,D项正确;
答案选C。
2. 镓(31Ga)与K位于元素周期表中同一周期,下列关于Ga的说法不正确的是
A. 位于元素周期表第ⅢA族 B. 原子半径比K小
C. 单质的还原性比K弱 D. Ga(OH)3的碱性比Al(OH)3弱
【答案】D
【解析】
【详解】A.镓(31Ga)位于元素周期表第四周期第ⅢA族,A正确;
B.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;原子半径比K小,B正确;
C.同周期从左到右,金属性减弱,非金属性变强;则镓单质的还原性比K弱,C正确;
D.金属性越强,最高价氧化物对应水化物的碱性越强,Ga(OH)3的碱性比Al(OH)3强,D错误;
故选D。
3. 下列图示装置所表示的实验中,没有发生氧化还原反应的是
A B C D
蘸有浓盐酸和浓氨水的玻璃棒靠近 铝丝伸入硫酸铜溶液中 氯气通入溶液变成黄色 向蔗糖中加入浓硫酸
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.蘸有浓盐酸和浓氨水的玻璃棒靠近,氨气与氯化氢反应生成氯化铵,反应无化合价变化,不属于氧化还原反应,A符合题意;
B.铝丝伸入硫酸铜溶液中,发生反应2Al+3Cu2+=3Cu+2Al3+,有化合价变化,属于氧化还原反应,B不符合题意;
C.氯气通入NaBr溶液中变成黄色,发生反应2NaBr+Cl2=2NaCl+Br2,有化合价变化,属于氧化还原反应,C不符合题意;
D.浓硫酸具有脱水性,能将蔗糖中的H、O元素以2:1脱去,蔗糖转变为C和H2O,同时C和浓硫酸反应生成二氧化硫、二氧化碳和水,发生氧化还原反应,D不符合题意;
故选A。
4. 实验室需要460mL0.20mol L-1Na2CO3溶液,某同学配制过程如图所示。
下列关于该实验的叙述错误的是
A. 将药品放在称量纸上称取10.6gNa2CO3固体
B. Na2CO3固体在烧杯中完全溶解后,恢复至室温转移到容量瓶中定容
C. ⑤中定容时俯视刻度线会导致溶液浓度偏低
D. 容量瓶不宜长期贮存配制好的溶液
【答案】C
【解析】
【分析】实验室中没有460mL容量瓶,应选用500mL的容量瓶。
【详解】A.将Na2CO3固体放在称量纸上称取,需称量Na2CO3固体的质量为0.5L×0.20mol L-1×106g/mol=10.6g,A正确;
B.溶解Na2CO3固体时,应放在烧杯中,待溶解后的溶液恢复至室温,转移入容量瓶中定容,B正确;
C.⑤中,定容时俯视刻度线,所配溶液体积偏小,从而导致溶液浓度偏高,B错误;
D.容量瓶不宜长期存放溶液,尤其不宜贮存配制好的碱性溶液,D正确;
故选C。
5. 下列对应离子方程式书写正确的是
A. 铜溶于稀硝酸:
B. 向Al2O3中滴加NaOH溶液:
C. 将少量Na2O2投入水中:
D. 向水中通入适量
【答案】B
【解析】
【详解】A.金属铜溶于稀硝酸中反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:,故A错误;
B.Al2O3与NaOH溶液反应生成四羟基合铝酸钠和水,离子方程式为:,故B正确;
C.Na2O2投入水中生成氢氧化钠和氧气,离子方程式,故C错误;
D.次氯酸为弱酸,向水中通入适量Cl2反应生成盐酸和次氯酸,反应的离子方程式为:,故D错误。
答案选B。
6. 能实现下列物质间直接转化的元素是
单质氧化物酸(或碱)盐
A. N B. Al C. S D. Fe
【答案】C
【解析】
【详解】A.N2和O2生成NO,NO难溶于水,不与水反应,不能直接转化,故A不选;
B.氧化铝不溶于水,也不与水反应,故B不选;
C.S和O2生成SO2,SO2和H2O生成H2SO3,H2SO3与NaOH生成Na2SO3,故C选;
D.金属铁和氧气反应生成四氧化三铁,不溶于水,所以不能实现物质间直接转化,故D不选;
答案选C。
7. 下列实验结论与实验操作及现象相符的一组是
选项 实验操作及现象 实验结论
A 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 原溶液中一定含有NH
B 向某溶液中滴加AgNO3溶液,产生白色沉淀 原溶液中一定含有Cl-
C 向某溶液中滴加酸性KMnO4溶液,紫色褪去 原溶液中一定含Fe2+
D 向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀 原溶液中一定有SO
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,原溶液中一定含有NH,,A正确;;
B.由于Ag2CO3为白色沉淀、Ag2SO4为白色微溶物,故向某溶液中滴加AgNO3溶液,产生白色沉淀,原溶液中不一定含有Cl-,也可能是CO、SO等,B错误;
C.能使酸性高锰酸钾溶液褪色的物质有很多,如SO2、SO等,向某溶液中滴加酸性KMnO4溶液,紫色褪去,原溶液中不一定含Fe2+,C错误;
D.向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,则溶液中可能含有硫酸根离子,也可能含有银离子,D错误;
故选A。
8. S2Cl2常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。S2Cl2各原子最外层均达到8电子稳定结构,与水极易反应:S2Cl2+H2O—S↓+SO2+HCl(未配平),下列说法不正确的是
A. S2Cl2中硫元素化合价:+1
B. S2Cl2中存在极性共价键和非极性共价键
C. S2Cl2与水反应时,氧化产物与还原产物的物质的量之比为1∶3
D. 向硝酸银溶液中滴加S2Cl2,若有白色沉淀产生,则S2Cl2中含有Cl-
【答案】D
【解析】
【详解】A.硫与氯是同周期元素,从左到右非金属性越来越强,氯的非金属性强于硫,故S2Cl2中硫元素化合价:+1,A正确;
B.S2Cl2的结构式为Cl-S-S-Cl,存在极性共价键和非极性共价键,B正确;
C.2S2Cl2+2H2O=3S↓+SO2+4HCl,氧化产物与还原产物的物质的量之比为1∶3,C正确;
D.S2Cl2溶于水反应生成氯化氢含有氯离子能使硝酸银产生白色沉淀,但S2Cl2为共价化合物,自身不含氯离子,D错误;
故选D。
9. 某化学研究小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、、、Cl-中的若干种离子。该小组同学取部分水样进行实验。①向水样中先滴加足量硝酸钡溶液,产生白色沉淀;②向其中再滴加足量稀盐酸,沉淀部分溶解;③最后滴加硝酸银溶液,又产生白色沉淀。下列说法正确的是
A. 经过实验可以不能确定是否含有K+离子
B. 经过实验可以确定一定存在的离子是、、Cl-
C. 步骤②中发生反应的化学方程式为
D. 步骤③中发生反应的离子方程式为
【答案】D
【解析】
【分析】该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、、、Cl-中的若干种离子。无色水样,说明没有Fe3+、Cu2+,该小组同学取部分水样进行实验;①向水样中先滴加足量硝酸钡溶液,产生白色沉淀;②再滴加足量稀盐酸,沉淀部分溶解,说明溶解的是碳酸钡沉淀,说明含有碳酸根离子,不含有Mg2+、Ag+、Ca2+,不溶解的可能是硫酸钡,说明含有硫酸根离子,根据电荷守恒,则一定含有钾离子;③最后滴加硝酸银溶液,又产生白色沉淀,产生氯化银沉淀,但不能说明原溶液中一定含有氯离子,原因是加入了盐酸,引入了氯离子,综上:经过实验可以确定一定不存在的离子有Mg2+、Fe3+、Cu2+、Ag+、Ca2+;一定存在的离子是K+、、,可能存在Cl-;
【详解】A.由分析可知,K+一定含有,故A错误;
B.由分析可知,一定存在的离子是K+、、,可能存在Cl-,故B错误;
C.步骤②中发生反应的化学方程式为BaCO3+2HCl=BaCl2+CO2↑+H2O,故C错误;
D.步骤③中是生成了氯化银沉淀,其反应的离子方程式为Ag++Cl-=AgCl↓,故D正确。
答案选D。
10. 已知:A、C、D、E为无色气体,F为红棕色气体。物质间的转化关系如图所示,其中部分产物已略去,则下列说法错误的是
A. A、B互换位置也满足该流程
B. 反应①中每生成转移电子
C. F与水的反应中氧化剂与还原剂的物质的量之比为1:2
D. C为,D为,C可以在D中燃烧生成氮气
【答案】B
【解析】
【分析】F为红棕色气体,则F为二氧化氮,二氧化和水反应生成一氧化氮和硝酸,硝酸和碳加热条件下反应生成二氧化碳、二氧化氮和水,A(二氧化碳)和过氧化钠反应生成碳酸钠和D(氧气),硝酸和铜反应生成硝酸铜、E(一氧化氮)和水,一氧化氮和氧气反应生成二氧化氮,C(氨气)催化氧化生成一氧化氮和水,M受热分解生成氨气、二氧化碳和水,则M为碳酸铵或碳酸氢铵。
【详解】A.A为二氧化碳,B为水,A、B互换位置也满足该流程,水和过氧化钠反应生成氢氧化钠和D(氧气),硝酸和碳加热反应生成二氧化碳、二氧化氮和水,故A正确;
B.反应①方程式为,根据方程式分析,生成1mol氧气转移2mol电子,故B错误;
C.F与水即,二氧化氮中氮化合价既升高又降低,有两个氮升高,有1个氮降低,因此反应中氧化剂与还原剂的物质的量之比为1:2,故C正确;
D.C为,D为,C可以在D中燃烧生成氮气即,故D正确。
综上所述,答案为B。
11. 下列实验或装置能达到实验目的的是
A B C D
制备氢氧化铁胶体 比较卤素单质氧化性强弱 洗气除去SO2中的CO2 测浓硫酸的pH
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.制备氢氧化铁胶体是将饱和氯化铁溶液滴入到沸水中而不是NaOH溶液中,否则得到的是沉淀而不是胶体,A不选;
B.新制氯水可以置换出NaBr中Br2,也能置换出NaI中的I2,可知氧化性:Cl2> Br2、Cl2> I2,再利用溴水置换出NaI中的I2,可知氧化性:Br2>I2,从而可得氧化性:Cl2> Br2>I2,B选;
C.饱和NaHCO3溶液会吸收SO2,而杂质CO2不会和NaHCO3反应,因而不能达到除杂的目的,C不选;
D.用pH试纸测定溶液的pH时,用玻璃棒蘸取待测液滴到pH试纸上,读出pH,以免污染待测液,同时由于浓硫酸具有脱水性,会使试纸碳化,D不选;
故选B。
12. 以MgCl2为原料可生产碱式碳酸镁[Mgx(OH)y(CO3)z·pH2O]。某研究性学习小组称取碱式碳酸镁4.66g,高温煅烧至恒重,得到2.00gMgO和标准状况下0.896LCO2。下列说法错误的是
A. x、y、z存在电荷守恒关系2x=y+2z
B. 碱式碳酸镁具有阻燃作用的原因之一是高温下有CO2生成
C. 碱式碳酸镁的化学式为Mg5(OH)2(CO3)4·4H2O
D. 由以上数据无法计算碱式碳酸镁的化学式
【答案】D
【解析】
【分析】高温煅烧碱式碳酸镁可得到MgO、CO2和H2O,反应的化学方程式为:Mgx(OH)y(CO3)z·pH2OxMgO+zCO2+(p+)H2O,取碱式碳酸镁4.66g,高温煅烧至恒重,得到2.00gMgO,其物质的量为,和标准状况下0.896LCO2,其物质的量为,质量为0.04mol×44g/mol=1.76g,则根据质量守恒可得m(H2O)=4.66g-2.00g-1.76g=0.9g,n(H2O)= ,则Mgx(OH)y(CO3)z·pH2O中,n(Mg2+)= n(MgO)=0.05mol,n()=n(CO2)=0.04mol,根据电荷守恒,2n(Mg2+)= 2n()+n(OH-),求得n(OH-)=0.02mol,因此n(H2O)=0.05mol-=0.04mol,则x∶y∶z∶p=0.05∶0.02∶0.04∶0.04=5∶2∶4∶4,碱式碳酸镁的化学式为Mg5(OH)2(CO3)4·4H2O。
【详解】A.在[Mgx(OH)y(CO3)z·pH2O]中,根据电荷守恒,2n(Mg2+)= 2n()+n(OH-),即2x=y+2z,A正确;
B.碱式碳酸镁高温下分解为MgO、CO2和H2O,生成的CO2既不燃烧也不支持燃烧,使得碱式碳酸镁能起到阻燃的作用,B正确;
C.根据以上分析,可得出碱式碳酸镁的化学式为Mg5(OH)2(CO3)4·4H2O,C正确;
D.根据选项C分析知,可计算出碱式碳酸镁的化学式,D错误;
故选D。
13. 煤燃烧排放的烟气中含有和,是大气的主要污染源之一。用溶液对烟气同时脱硫脱硝(分别生成、,得到、)脱除率如图,下列说法不正确的是
A. 脱除的反应:
B. 依据图中信息,在时,吸收液中
C. 脱除率高于的原因可能是在水中的溶解度大于
D. 随着脱除反应的进行,吸收剂溶液的逐渐减小
【答案】B
【解析】
【详解】A.Ca(ClO)2溶液脱除NO的反应生成Cl-和NO,根据质量守恒和电子得失守恒配平方程式为2NO+3ClO-+H2O=2H++2NO+3Cl-,故A说法正确;
B.2NO+3ClO-+H2O=2H++2NO+3Cl-,SO2+ClO-+H2O=2H++SO+Cl-;已知n(NO):n(SO2)=2∶3;令n(NO)=2mol,n(SO2)=3mol,依据图中信息及离子方程式中的比例关系得:在80min时,NO脱除率40%,即反应的NO为:2mol×40%=0.8mol,生成1.2molCl-,同时生成NO物质的量为0.8mol;SO2脱除率100%,即3molSO2全部反应生成3molCl-,所以Cl-共3mol+1.2mol=4.2mol;吸收液中n(NO)∶n(Cl-)=0.8mol∶4.2mol=4∶21,故B说法错误;
C.根据SO2和NO气体在水中的溶解度:SO2大于NO,SO2比NO更易溶于水,更容易发生反应;SO2脱除率高于NO的原因可能是SO2在水中的溶解度大于NO,故C是说法正确;
D.无论发生:2NO+3ClO-+H2O=2H++2NO+3Cl-,还是发生:SO2+ClO-+H2O=2H++SO+Cl-,都是使H+浓度增大,吸收剂溶液的pH减小,故D说法正确;
答案为B。
14. 硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:
实验
现象 a中产生凝胶状沉淀
下列结论不正确的是
A. 盐酸与石灰石反应离子反应方程式:
B. 由实验不能说明酸性H2CO3>H2SiO3
C. 若想比较碳酸和硅酸的酸性强弱,应该让气体在通入a之前先通过盛有饱和碳酸氢钠溶液的洗气瓶
D. 向Na2SiO3溶液中通入过量CO2,发生反应:
【答案】D
【解析】
【详解】A.碳酸钙是难溶物,与盐酸反应的离子方程式为,故A正确;
B.因为盐酸有挥发性,挥发的HCl也能与硅酸钠反应生成硅酸,故不能说明酸性H2CO3>H2SiO3,故B正确;
C.因为盐酸有挥发性,挥发的HCl也能与硅酸钠反应生成硅酸,若想比较碳酸和硅酸的酸性强弱,应该让气体在通入a之前先通过盛有饱和碳酸氢钠溶液的洗气瓶,除掉挥发的HCl,故C正确;
D.向Na2SiO3溶液中通入过量CO2,生成硅酸和碳酸氢钠,离子方程式为:,故D错误。
答案选D。
第二部分 (非选择题)
本部分共5题,共58分。
15. 实验室可用如图装置(略去部分夹持仪器)制取SO2并验证其性质。
(1)盛装70%H2SO4溶液的仪器名称为___________,仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成段液柱,若___________则整个装置气密性良好。
(2)A中如果用浓硫酸和铜反应,也可制得SO2进行实验,反应的化学方程式为___________。
(3)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择___________(填代号)。
a.蒸馏水 b.饱和NaHCO3溶液 c.饱和NaHSO3溶液 d.饱和NaOH溶液
(4)C试管中的试剂可以验证二氧化硫的氧化性,现象为___________。
(5)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案合理的是方案___________(填“I”“Ⅱ”或“Ⅲ”);SO2通入试管D中发生的主要反应的离子方程式为___________。
(6)装置E的作用是做安全瓶,防止F中的液体倒吸入D中,装置F中为___________溶液。
【答案】(1) ①. 分液漏斗 ②. 一段时间后液柱高度保持不变
(2)
(3)有淡黄色沉淀生成
(4)c (5) ①. Ⅲ ②.
(6)NaOH
【解析】
【分析】装置A中Na2SO3与浓H2SO4反应生成SO2,装置B内装有饱和NaHSO3溶液判断SO2生成的快慢,为验证二氧化硫的氧化性,与硫化钠发生归中反应生成S单质,有淡黄色固体生成,装置D中SO2与氯水反应生成HCl和H2SO4,E为安全瓶,装置F内装有NaOH溶液吸收尾气。
【小问1详解】
盛装浓H2SO4溶液的仪器名称为分液漏斗,如果一段时间后长颈漏斗中液柱高度保持不变,则证明该装置气密性良好;
【小问2详解】
浓硫酸和铜加热反应,生成硫酸铜、二氧化硫和水,化学方程式为;
【小问3详解】
SO2和水反应生成亚硫酸,SO2和NaOH溶液反应生成Na2SO3,SO2与饱和NaHCO3溶液也会反应;故应该选取饱和NaHSO3溶液,答案为c;
【小问4详解】
C试管中的试剂可以验证SO2的氧化性,则Na2S作还原剂,被SO2氧化生成难溶性的S单质,所以看到的现象是:有浅黄色沉淀生成;
【小问5详解】
为验证二氧化硫的还原性,充分反应后,SO2被氧化生成SO,只要证明溶液中含有SO即可,
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成,说明溶液中含有Cl-;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去,说明溶液中含有HClO或SO2;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀,说明溶液中含有SO,
故选Ⅲ;
D中SO2和Cl2在水溶液中发生氧化还原反应生成HCl、H2SO4,离子方程式为:;
【小问6详解】
装置F的作用是除去SO2的尾气,则应选择NaOH溶液。
16. 硝酸是重要的化工原料。下图是以合成氨为基础的传统硝酸生产工艺流程(其中空气等基础原料已略去)。
(1)关于合成氨工艺,下列说法不正确的是___________(填序号)。
a.合成氨是一种重要的人工固氮方法
b.该反应过程中氮元素被氧化
c.合成氨气还可以用于化肥工业
d.该反应采用高温、高压等苛刻条件,与N2化学性质很稳定有关
(2)氮氧化装置中,先生成NO,反应的化学方程式为___________。然后NO被氧化成NO2。
(3)吸收装置中,发生的反应为,若用VaLxmol·L-1的稀硝酸作为吸收液,反应后得到VbLymol·L-1的浓硝酸,则理论上吸收装置中需消耗的O2的物质的量为___________mol(写出计算式)。
(4)为实现制硝酸的绿色化改进,技术人员将①分离液态空气、②电解水等工艺整合在上述流程中。请在①、②中任选一种,说明该工艺的产物如何应用于硝酸生产流程:___________。
(5)NH3催化还原氯氧化物技术(SCR)是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如下图所示:
若催化剂表面参与反应的NO和NO2物质的量之比为1:1,则总反应的化学方程式为___________。
【答案】(1)b (2)
(3)
(4)①中,分离液态空气得到的氮气可用于合成氨,氧气可用于氨氧化等或②中,电解水得到的氢气可用于合成氨,氧气可用于氨氧化等
(5)
【解析】
【小问1详解】
a.合成氨将氮气转化为氨气,是一种重要的人工固氮方法,故a正确;
b.该反应过程中氮元素的化合价减低,被还原,故b错误;
c.合成的NH3可用于制作氮肥,可以用于化肥工业,故c正确;
d.由于N2化学性质很稳定,则该反应采用高温、高压等苛刻条件,与氮气的稳定性有关,故d正确;
故答案为:b;
【小问2详解】
氨氧化装置中,氨气和氧气反应生成的NO和水,其反应的化学方程式为;
【小问3详解】
吸收装置中,发生的反应为2N2O4+O2+2H2O═4HNO3,若用VaLxmol L-1的稀硝酸作为吸收液,反应后得到VbLymol L-1的浓硝酸,反应的关系式为O2~4HNO3,则理论上吸收装置中需消耗的O2的物质的量为mol;
小问4详解】
为实现制硝酸的绿色化改进,技术人员将①分离液态空气得到氮气可用于合成氨气,氧气可用于氨氧化等;②电解水得到氢气,可用于合成氨气,氧气可用于氨氧化等;
【小问5详解】
NH3催化还原氮氧化物生成氮气和水,参与反应的NO和NO2物质的量之比为1:1,则总反应的化学方程式为。
17. 元素周期表是学习化学的重要工具。A-H为短周期主族元素,其原子半径→原子序数→最高正化合价(或最低负化合价)的关系如图所示。
回答下列问题:
(1)F原子的结构示意图为___________,写出质量数为35的H原子符号:___________。
(2)B、D形成的化合物BD2的电子式为___________,结构式为___________。
(3)A与H形成的化合物属于___________(填“离子”或“共价”)化合物;元素B、G、H的最高价氧化物的水化物中,酸性由大到小的是___________(用“>”连接化学式)。
(4)D、E的简单离子半径由大到小顺序为___________(填离子符号)。
(5)元素G的简单气态氢化物与GD2的水溶液反应的实验现象为___________。
(6)单质F与E的最高价氧化物对应的水化物之间发生反应的离子方程式为___________。
【答案】17. ①. ②.
18. ①. ②. O=C=O
19. ①. 共价 ②.
20.
21. 产生淡黄色沉淀
22.
【解析】
【分析】短周期元素中,A的原子序数及原子半径最小,则A为H元素;D只有-2价,D为O元素;结合原子序数可知,B、C位于第二周期,F、H位于第三周期,B有+4价,B为C;C有+5价,C为N;E为+1价,E为Na;F为+3价,F为Al;H为-1价,H为Cl,G为-2价,原子半径比Cl稍大,G为S;以此来解答。
【小问1详解】
F为Al元素,原子结构示意图为,H为Cl元素,一种氯原子的质量数为35的符号为:;
【小问2详解】
BD2为CO2,电子式为,结构式为O=C=O;
【小问3详解】
H与Cl形成HCl,属于共价化合物;C、S、Cl的非金属性Cl>S>C,故最高价氧化物的水化物中,酸性由大到小顺序是;
【小问4详解】
O2-和Na+的电子层结构相同,核电荷数小则半径大,故半径;
【小问5详解】
H2S与SO2在溶液中反应会生成单质硫,现象为产生淡黄色沉淀;
【小问6详解】
Al与NaOH溶液反应生成四羟基合铝酸钠和氢气,离子方程式为。
18. 碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下x克钢样中碳、硫转化为CO2、SO2。
①气体a的成分是____________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5 O21____+3_____。
(2)将气体a通入测硫酸装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:_________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mLNaOH溶液,若消耗1mLNaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:_________________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
①气体a通过B和C的目的是_____________________。
②计算钢样中碳的质量分数,应测量的数据是__________________。
【答案】 ①. CO2、SO2、O2 ②. Fe3O4 ③. SO2 ④. H2O2+SO2=H2SO4 ⑤. zy/x ⑥. 除去SO2对CO2测定的干扰 ⑦. 吸收CO2气体前后吸收瓶的质量
【解析】
【详解】(1)①钢样中的碳、硫在装置A中被氧化为CO2、SO2,故a的成分为CO2、SO2以及未反应的O2;
②FeS中的-2价的硫被氧化为SO2,+2价的Fe被氧化为+3价的铁,结合所给化学计量数,可知产物应为Fe3O4和SO2,故方程式为3FeS+5O2Fe3O4+3SO2;
(2)①H2O2具有氧化性,可氧化SO2使S的化合价升高为+6价,在溶液中反应产物应为硫酸,故反应方程式为:H2O2+SO2=H2SO4;
②1mL NaOH相当于yg S,故z mL NaOH相当于 zy g S,则该样品中硫的质量分数为zy/x 。
(3)①测定碳的含量需将气体a中的SO2除去,故装置B和C的作用是除去SO2;
②计算碳的质量分数须利用CO2的质量进行分析,故需测量CO2吸收瓶在吸收CO2气体前后的质量。
19. 某化学小组研究硝酸与金属的反应。下列实验中硝酸与金属的反应均在注射器中完成,实验操作及实验现象记录如表:
序号 实验操作与实验现象
实验1 加入适量铜片与2mL的浓硝酸。反应剧烈,产生红棕色气体,溶液立即呈绿色。
实验2 加入过量的铜片与2mL0.5mol/LHNO3溶液。产生无色气泡,溶液逐渐变为蓝色。注射器中的气体始终无色。反应结束后,向注射器中充入一定量的O2,气体迅速变为红棕色
实验3 加入过量的铁粉与2mL0.5mol/LHNO3溶液,立即有无色气体生成,溶液为很浅的绿色,反应结束后将气体通入有空气的容器无明显变化,点燃,有尖锐的爆鸣声,容器壁出现无色液滴;取反应后溶液,加入足量NaOH溶液,立刻得到白色沉淀,迅速变为灰绿色,最后变成红褐色,加热后产生能使湿润红色石蕊试纸变蓝的气体。
(1)铜与浓HNO3反应产生红棕色气体化学方程式是___________。
(2)对实验1所得溶液呈绿色,而实验2所得溶液呈蓝色的原因提出猜想。
查阅资料:
i.NO2溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
ⅱ.NO2与水反应时会有部分发生反应:,HNO2是弱酸,无色,不稳定。
ⅲ.离子颜色为绿色。
猜想1:NO2溶于浓硝酸,与蓝色溶液混合而呈现绿色。
猜想2:HNO2电离出的与结合为(绿色)。
①向浓硝酸中通入NO2,溶液呈黄色,加入___________(填试剂)后呈绿色,证实猜想1合理。
②研究猜想2是否为实验I所得溶液呈绿色的主要原因,实验如下。
a.证明溶液A中含有HNO2的证据是___________。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验I所得溶液呈绿色的主要原因,说明理由:___________。
(3)实验2中充入O2后气体变为红棕色的反应的化学方程式是___________。
(4)查阅文献:铁粉与稀硝酸反应会生成H2.由实验3中的实验现象可知,过量的铁粉与0.5mol/L稀HNO3反应的还原产物中除了H2外,还有___________生成。写出白色沉淀迅速变为灰绿色,最后变成红褐色的化学方程式___________。
(5)甲同学对实验3产生H2的原因提出假设:该浓度的硝酸中H+的氧化性大于。乙同学认为该假设不合理。依据是实验2中观察到了___________(填实验现象),该现象能说明假设不合理。
(6)结合以上实验可知,金属与硝酸反应的产物与___________等因素有关。
【答案】(1)
(2) ①. ②. 溶液A为无色、溶液B为绿色 ③. 实验表明在酸性环境下不能稳定存在;由于实验1中有大量的浓硝酸存在,故不应含有大量的
(3)
(4) ①. 铵根离子(或) ②.
(5)反应后得到无色气体充入O2后气体迅速变为红棕色
(6)硝酸的浓度、金属种类
【解析】
【小问1详解】
铜与浓HNO3反应产生红棕色气体NO2的化学方程式是:;
【小问2详解】
①猜想1是NO2溶于浓硝酸,与蓝色溶液混合而呈现绿色,要证明猜想合理,向浓硝酸中通入NO2后再加溶液,观察到溶液呈绿色即可证明;
②a.结合题目已知资料:HNO2是弱酸,无色,不稳定;离子颜色为绿色,根据A溶液呈无色,B溶液呈绿色,能说明A中含有HNO2;
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色,说明在酸性环境下不能稳定存在;由于实验1中有大量的浓硝酸存在,故不应含有大量的;
【小问3详解】
实验2中充入O2后,NO与O2反应生成NO2,气体变为红棕色,反应的化学方程式是;
【小问4详解】
量的铁粉与HNO3溶液生成浅的绿色Fe2+溶液,得到气体通入有空气的容器无明显变化,则气体中无NO,点燃气体尖锐的爆鸣声,容器壁出现无色液滴,说明气体含有氢气,加入足量NaOH溶液并加热,生成Fe(OH)2,迅速被氧化生成Fe(OH)3和使湿润红色石蕊试纸变蓝的NH3,故产物中除了H2外,还有生成;Fe(OH)2迅速被氧化生成Fe(OH)3的化学方程式为:。
【小问5详解】
实验2中铜片表面产生无色气泡,且反应结束后,向注射器中充入一定量的O2,则气体迅速变为红棕色,说明该气体是NO,即说明该浓度的稀硝酸加入过量的铜片,是硝酸根离子被还原生成NO,说明氧化性大于H+;
【小问6详解】
结合实验1和实验2可知,硝酸若是浓硝酸则生成NO2,若是浓度较低则生成NO,结合实验2和实验3可知,相同浓度的硝酸溶液,与较活泼的铁反应则被还原生成,与较不活泼的铜反应则生成NO,故金属与硝酸反应的产物与金属的活泼性、硝酸的浓度等因素有关。
化学试题
考试说明:
1.本试卷共8页,答题卡1张;考试结束只交答题卡。
2.试卷满分100分,考试时间90分钟。
3.试卷共两部分,第一部分为选择题,共计42分;第二部分为非选择题,共计58分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Cl-35.5 S-32 Cu-64
第一部分(选择题)
本部分每小题3分,共42分。在每题列出的四个选项中选出最符合题目要求的一项。
1. 下列有关试剂的保存方法不正确的是
A. Na保存于煤油中 B. 过氧化钠应密封保存
C. 氯水保存于无色试剂瓶中 D. 浓硫酸保存于铁质容器中
2. 镓(31Ga)与K位于元素周期表中同一周期,下列关于Ga的说法不正确的是
A. 位于元素周期表第ⅢA族 B. 原子半径比K小
C. 单质的还原性比K弱 D. Ga(OH)3的碱性比Al(OH)3弱
3. 下列图示装置所表示的实验中,没有发生氧化还原反应的是
A B C D
蘸有浓盐酸和浓氨水的玻璃棒靠近 铝丝伸入硫酸铜溶液中 氯气通入溶液变成黄色 向蔗糖中加入浓硫酸
A. A B. B C. C D. D
4. 实验室需要460mL0.20mol L-1Na2CO3溶液,某同学配制过程如图所示。
下列关于该实验的叙述错误的是
A. 将药品放在称量纸上称取10.6gNa2CO3固体
B. Na2CO3固体在烧杯中完全溶解后,恢复至室温转移到容量瓶中定容
C. ⑤中定容时俯视刻度线会导致溶液浓度偏低
D. 容量瓶不宜长期贮存配制好的溶液
5. 下列对应离子方程式书写正确的是
A. 铜溶于稀硝酸:
B. 向Al2O3中滴加NaOH溶液:
C. 将少量Na2O2投入水中:
D. 向水中通入适量
6. 能实现下列物质间直接转化的元素是
单质氧化物酸(或碱)盐
A. N B. Al C. S D. Fe
7. 下列实验结论与实验操作及现象相符的一组是
选项 实验操作及现象 实验结论
A 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 原溶液中一定含有NH
B 向某溶液中滴加AgNO3溶液,产生白色沉淀 原溶液中一定含有Cl-
C 向某溶液中滴加酸性KMnO4溶液,紫色褪去 原溶液中一定含Fe2+
D 向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀 原溶液中一定有SO
A. A B. B C. C D. D
8. S2Cl2常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。S2Cl2各原子最外层均达到8电子稳定结构,与水极易反应:S2Cl2+H2O—S↓+SO2+HCl(未配平),下列说法不正确的是
A. S2Cl2中硫元素化合价:+1
B. S2Cl2中存在极性共价键和非极性共价键
C. S2Cl2与水反应时,氧化产物与还原产物的物质的量之比为1∶3
D 向硝酸银溶液中滴加S2Cl2,若有白色沉淀产生,则S2Cl2中含有Cl-
9. 某化学研究小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、、、Cl-中的若干种离子。该小组同学取部分水样进行实验。①向水样中先滴加足量硝酸钡溶液,产生白色沉淀;②向其中再滴加足量稀盐酸,沉淀部分溶解;③最后滴加硝酸银溶液,又产生白色沉淀。下列说法正确的是
A. 经过实验可以不能确定是否含有K+离子
B. 经过实验可以确定一定存在的离子是、、Cl-
C. 步骤②中发生反应的化学方程式为
D. 步骤③中发生反应的离子方程式为
10. 已知:A、C、D、E为无色气体,F为红棕色气体。物质间的转化关系如图所示,其中部分产物已略去,则下列说法错误的是
A A、B互换位置也满足该流程
B. 反应①中每生成转移电子
C. F与水的反应中氧化剂与还原剂的物质的量之比为1:2
D. C为,D为,C可以在D中燃烧生成氮气
11. 下列实验或装置能达到实验目的的是
A B C D
制备氢氧化铁胶体 比较卤素单质氧化性强弱 洗气除去SO2中的CO2 测浓硫酸的pH
A. A B. B C. C D. D
12. 以MgCl2为原料可生产碱式碳酸镁[Mgx(OH)y(CO3)z·pH2O]。某研究性学习小组称取碱式碳酸镁4.66g,高温煅烧至恒重,得到2.00gMgO和标准状况下0.896LCO2。下列说法错误的是
A. x、y、z存在电荷守恒关系2x=y+2z
B. 碱式碳酸镁具有阻燃作用的原因之一是高温下有CO2生成
C. 碱式碳酸镁的化学式为Mg5(OH)2(CO3)4·4H2O
D. 由以上数据无法计算碱式碳酸镁的化学式
13. 煤燃烧排放的烟气中含有和,是大气的主要污染源之一。用溶液对烟气同时脱硫脱硝(分别生成、,得到、)脱除率如图,下列说法不正确的是
A. 脱除的反应:
B. 依据图中信息,在时,吸收液中
C. 脱除率高于的原因可能是在水中的溶解度大于
D. 随着脱除反应的进行,吸收剂溶液的逐渐减小
14. 硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:
实验
现象 a中产生凝胶状沉淀
下列结论不正确是
A. 盐酸与石灰石反应离子反应方程式:
B. 由实验不能说明酸性H2CO3>H2SiO3
C. 若想比较碳酸和硅酸的酸性强弱,应该让气体在通入a之前先通过盛有饱和碳酸氢钠溶液的洗气瓶
D. 向Na2SiO3溶液中通入过量CO2,发生反应:
第二部分 (非选择题)
本部分共5题,共58分。
15. 实验室可用如图装置(略去部分夹持仪器)制取SO2并验证其性质。
(1)盛装70%H2SO4溶液的仪器名称为___________,仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成段液柱,若___________则整个装置气密性良好。
(2)A中如果用浓硫酸和铜反应,也可制得SO2进行实验,反应的化学方程式为___________。
(3)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择___________(填代号)。
a.蒸馏水 b.饱和NaHCO3溶液 c.饱和NaHSO3溶液 d.饱和NaOH溶液
(4)C试管中的试剂可以验证二氧化硫的氧化性,现象为___________。
(5)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案合理的是方案___________(填“I”“Ⅱ”或“Ⅲ”);SO2通入试管D中发生的主要反应的离子方程式为___________。
(6)装置E的作用是做安全瓶,防止F中的液体倒吸入D中,装置F中为___________溶液。
16. 硝酸是重要的化工原料。下图是以合成氨为基础的传统硝酸生产工艺流程(其中空气等基础原料已略去)。
(1)关于合成氨工艺,下列说法不正确的是___________(填序号)。
a.合成氨是一种重要的人工固氮方法
b.该反应过程中氮元素被氧化
c.合成的氨气还可以用于化肥工业
d.该反应采用高温、高压等苛刻条件,与N2化学性质很稳定有关
(2)氮氧化装置中,先生成NO,反应的化学方程式为___________。然后NO被氧化成NO2。
(3)吸收装置中,发生的反应为,若用VaLxmol·L-1的稀硝酸作为吸收液,反应后得到VbLymol·L-1的浓硝酸,则理论上吸收装置中需消耗的O2的物质的量为___________mol(写出计算式)。
(4)为实现制硝酸的绿色化改进,技术人员将①分离液态空气、②电解水等工艺整合在上述流程中。请在①、②中任选一种,说明该工艺的产物如何应用于硝酸生产流程:___________。
(5)NH3催化还原氯氧化物技术(SCR)是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如下图所示:
若催化剂表面参与反应的NO和NO2物质的量之比为1:1,则总反应的化学方程式为___________。
17. 元素周期表是学习化学的重要工具。A-H为短周期主族元素,其原子半径→原子序数→最高正化合价(或最低负化合价)的关系如图所示。
回答下列问题:
(1)F原子的结构示意图为___________,写出质量数为35的H原子符号:___________。
(2)B、D形成的化合物BD2的电子式为___________,结构式为___________。
(3)A与H形成的化合物属于___________(填“离子”或“共价”)化合物;元素B、G、H的最高价氧化物的水化物中,酸性由大到小的是___________(用“>”连接化学式)。
(4)D、E的简单离子半径由大到小顺序为___________(填离子符号)。
(5)元素G的简单气态氢化物与GD2的水溶液反应的实验现象为___________。
(6)单质F与E最高价氧化物对应的水化物之间发生反应的离子方程式为___________。
18. 碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下x克钢样中碳、硫转化为CO2、SO2。
①气体a的成分是____________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5 O21____+3_____。
(2)将气体a通入测硫酸装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:_________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mLNaOH溶液,若消耗1mLNaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:_________________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
①气体a通过B和C的目的是_____________________。
②计算钢样中碳的质量分数,应测量的数据是__________________。
19. 某化学小组研究硝酸与金属的反应。下列实验中硝酸与金属的反应均在注射器中完成,实验操作及实验现象记录如表:
序号 实验操作与实验现象
实验1 加入适量铜片与2mL的浓硝酸。反应剧烈,产生红棕色气体,溶液立即呈绿色。
实验2 加入过量的铜片与2mL0.5mol/LHNO3溶液。产生无色气泡,溶液逐渐变为蓝色。注射器中的气体始终无色。反应结束后,向注射器中充入一定量的O2,气体迅速变为红棕色
实验3 加入过量的铁粉与2mL0.5mol/LHNO3溶液,立即有无色气体生成,溶液为很浅的绿色,反应结束后将气体通入有空气的容器无明显变化,点燃,有尖锐的爆鸣声,容器壁出现无色液滴;取反应后溶液,加入足量NaOH溶液,立刻得到白色沉淀,迅速变为灰绿色,最后变成红褐色,加热后产生能使湿润红色石蕊试纸变蓝的气体。
(1)铜与浓HNO3反应产生红棕色气体化学方程式是___________。
(2)对实验1所得溶液呈绿色,而实验2所得溶液呈蓝色的原因提出猜想。
查阅资料:
i.NO2溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
ⅱ.NO2与水反应时会有部分发生反应:,HNO2是弱酸,无色,不稳定。
ⅲ.离子颜色为绿色。
猜想1:NO2溶于浓硝酸,与蓝色溶液混合而呈现绿色。
猜想2:HNO2电离出的与结合为(绿色)。
①向浓硝酸中通入NO2,溶液呈黄色,加入___________(填试剂)后呈绿色,证实猜想1合理。
②研究猜想2是否为实验I所得溶液呈绿色的主要原因,实验如下。
a.证明溶液A中含有HNO2的证据是___________。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验I所得溶液呈绿色的主要原因,说明理由:___________。
(3)实验2中充入O2后气体变为红棕色的反应的化学方程式是___________。
(4)查阅文献:铁粉与稀硝酸反应会生成H2.由实验3中的实验现象可知,过量的铁粉与0.5mol/L稀HNO3反应的还原产物中除了H2外,还有___________生成。写出白色沉淀迅速变为灰绿色,最后变成红褐色的化学方程式___________。
(5)甲同学对实验3产生H2的原因提出假设:该浓度的硝酸中H+的氧化性大于。乙同学认为该假设不合理。依据是实验2中观察到了___________(填实验现象),该现象能说明假设不合理。
(6)结合以上实验可知,金属与硝酸反应的产物与___________等因素有关。
北京市顺义区第一中学2023—2024学年高一下学期3月月考
化学试题
考试说明:
1.本试卷共8页,答题卡1张;考试结束只交答题卡。
2.试卷满分100分,考试时间90分钟。
3.试卷共两部分,第一部分为选择题,共计42分;第二部分为非选择题,共计58分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Mg-24 Cl-35.5 S-32 Cu-64
第一部分(选择题)
本部分每小题3分,共42分。在每题列出的四个选项中选出最符合题目要求的一项。
1. 下列有关试剂的保存方法不正确的是
A. Na保存于煤油中 B. 过氧化钠应密封保存
C. 氯水保存于无色试剂瓶中 D. 浓硫酸保存于铁质容器中
【答案】C
【解析】
【详解】A.Na的密度大于煤油,在空气中易反应,所以保存于煤油中,A项正确;
B.过氧化钠,在空气中易反应,所以应密封保存,B项正确;
C.氯水中有次氯酸,见光易分解,应该保存于棕色试剂瓶中,C项错误;
D.浓硫酸与铁反应钝化反应,可以将浓硫酸保存于铁质容器中,D项正确;
答案选C。
2. 镓(31Ga)与K位于元素周期表中同一周期,下列关于Ga的说法不正确的是
A. 位于元素周期表第ⅢA族 B. 原子半径比K小
C. 单质的还原性比K弱 D. Ga(OH)3的碱性比Al(OH)3弱
【答案】D
【解析】
【详解】A.镓(31Ga)位于元素周期表第四周期第ⅢA族,A正确;
B.电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小;原子半径比K小,B正确;
C.同周期从左到右,金属性减弱,非金属性变强;则镓单质的还原性比K弱,C正确;
D.金属性越强,最高价氧化物对应水化物的碱性越强,Ga(OH)3的碱性比Al(OH)3强,D错误;
故选D。
3. 下列图示装置所表示的实验中,没有发生氧化还原反应的是
A B C D
蘸有浓盐酸和浓氨水的玻璃棒靠近 铝丝伸入硫酸铜溶液中 氯气通入溶液变成黄色 向蔗糖中加入浓硫酸
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.蘸有浓盐酸和浓氨水的玻璃棒靠近,氨气与氯化氢反应生成氯化铵,反应无化合价变化,不属于氧化还原反应,A符合题意;
B.铝丝伸入硫酸铜溶液中,发生反应2Al+3Cu2+=3Cu+2Al3+,有化合价变化,属于氧化还原反应,B不符合题意;
C.氯气通入NaBr溶液中变成黄色,发生反应2NaBr+Cl2=2NaCl+Br2,有化合价变化,属于氧化还原反应,C不符合题意;
D.浓硫酸具有脱水性,能将蔗糖中的H、O元素以2:1脱去,蔗糖转变为C和H2O,同时C和浓硫酸反应生成二氧化硫、二氧化碳和水,发生氧化还原反应,D不符合题意;
故选A。
4. 实验室需要460mL0.20mol L-1Na2CO3溶液,某同学配制过程如图所示。
下列关于该实验的叙述错误的是
A. 将药品放在称量纸上称取10.6gNa2CO3固体
B. Na2CO3固体在烧杯中完全溶解后,恢复至室温转移到容量瓶中定容
C. ⑤中定容时俯视刻度线会导致溶液浓度偏低
D. 容量瓶不宜长期贮存配制好的溶液
【答案】C
【解析】
【分析】实验室中没有460mL容量瓶,应选用500mL的容量瓶。
【详解】A.将Na2CO3固体放在称量纸上称取,需称量Na2CO3固体的质量为0.5L×0.20mol L-1×106g/mol=10.6g,A正确;
B.溶解Na2CO3固体时,应放在烧杯中,待溶解后的溶液恢复至室温,转移入容量瓶中定容,B正确;
C.⑤中,定容时俯视刻度线,所配溶液体积偏小,从而导致溶液浓度偏高,B错误;
D.容量瓶不宜长期存放溶液,尤其不宜贮存配制好的碱性溶液,D正确;
故选C。
5. 下列对应离子方程式书写正确的是
A. 铜溶于稀硝酸:
B. 向Al2O3中滴加NaOH溶液:
C. 将少量Na2O2投入水中:
D. 向水中通入适量
【答案】B
【解析】
【详解】A.金属铜溶于稀硝酸中反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:,故A错误;
B.Al2O3与NaOH溶液反应生成四羟基合铝酸钠和水,离子方程式为:,故B正确;
C.Na2O2投入水中生成氢氧化钠和氧气,离子方程式,故C错误;
D.次氯酸为弱酸,向水中通入适量Cl2反应生成盐酸和次氯酸,反应的离子方程式为:,故D错误。
答案选B。
6. 能实现下列物质间直接转化的元素是
单质氧化物酸(或碱)盐
A. N B. Al C. S D. Fe
【答案】C
【解析】
【详解】A.N2和O2生成NO,NO难溶于水,不与水反应,不能直接转化,故A不选;
B.氧化铝不溶于水,也不与水反应,故B不选;
C.S和O2生成SO2,SO2和H2O生成H2SO3,H2SO3与NaOH生成Na2SO3,故C选;
D.金属铁和氧气反应生成四氧化三铁,不溶于水,所以不能实现物质间直接转化,故D不选;
答案选C。
7. 下列实验结论与实验操作及现象相符的一组是
选项 实验操作及现象 实验结论
A 向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体 原溶液中一定含有NH
B 向某溶液中滴加AgNO3溶液,产生白色沉淀 原溶液中一定含有Cl-
C 向某溶液中滴加酸性KMnO4溶液,紫色褪去 原溶液中一定含Fe2+
D 向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀 原溶液中一定有SO
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.向某溶液中加入浓NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,原溶液中一定含有NH,,A正确;;
B.由于Ag2CO3为白色沉淀、Ag2SO4为白色微溶物,故向某溶液中滴加AgNO3溶液,产生白色沉淀,原溶液中不一定含有Cl-,也可能是CO、SO等,B错误;
C.能使酸性高锰酸钾溶液褪色的物质有很多,如SO2、SO等,向某溶液中滴加酸性KMnO4溶液,紫色褪去,原溶液中不一定含Fe2+,C错误;
D.向某溶液中加入盐酸酸化的BaCl2溶液,产生白色沉淀,则溶液中可能含有硫酸根离子,也可能含有银离子,D错误;
故选A。
8. S2Cl2常用作橡胶的硫化剂,能改变生橡胶遇冷变硬的性质。S2Cl2各原子最外层均达到8电子稳定结构,与水极易反应:S2Cl2+H2O—S↓+SO2+HCl(未配平),下列说法不正确的是
A. S2Cl2中硫元素化合价:+1
B. S2Cl2中存在极性共价键和非极性共价键
C. S2Cl2与水反应时,氧化产物与还原产物的物质的量之比为1∶3
D. 向硝酸银溶液中滴加S2Cl2,若有白色沉淀产生,则S2Cl2中含有Cl-
【答案】D
【解析】
【详解】A.硫与氯是同周期元素,从左到右非金属性越来越强,氯的非金属性强于硫,故S2Cl2中硫元素化合价:+1,A正确;
B.S2Cl2的结构式为Cl-S-S-Cl,存在极性共价键和非极性共价键,B正确;
C.2S2Cl2+2H2O=3S↓+SO2+4HCl,氧化产物与还原产物的物质的量之比为1∶3,C正确;
D.S2Cl2溶于水反应生成氯化氢含有氯离子能使硝酸银产生白色沉淀,但S2Cl2为共价化合物,自身不含氯离子,D错误;
故选D。
9. 某化学研究小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、、、Cl-中的若干种离子。该小组同学取部分水样进行实验。①向水样中先滴加足量硝酸钡溶液,产生白色沉淀;②向其中再滴加足量稀盐酸,沉淀部分溶解;③最后滴加硝酸银溶液,又产生白色沉淀。下列说法正确的是
A. 经过实验可以不能确定是否含有K+离子
B. 经过实验可以确定一定存在的离子是、、Cl-
C. 步骤②中发生反应的化学方程式为
D. 步骤③中发生反应的离子方程式为
【答案】D
【解析】
【分析】该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Ag+、Ca2+、、、Cl-中的若干种离子。无色水样,说明没有Fe3+、Cu2+,该小组同学取部分水样进行实验;①向水样中先滴加足量硝酸钡溶液,产生白色沉淀;②再滴加足量稀盐酸,沉淀部分溶解,说明溶解的是碳酸钡沉淀,说明含有碳酸根离子,不含有Mg2+、Ag+、Ca2+,不溶解的可能是硫酸钡,说明含有硫酸根离子,根据电荷守恒,则一定含有钾离子;③最后滴加硝酸银溶液,又产生白色沉淀,产生氯化银沉淀,但不能说明原溶液中一定含有氯离子,原因是加入了盐酸,引入了氯离子,综上:经过实验可以确定一定不存在的离子有Mg2+、Fe3+、Cu2+、Ag+、Ca2+;一定存在的离子是K+、、,可能存在Cl-;
【详解】A.由分析可知,K+一定含有,故A错误;
B.由分析可知,一定存在的离子是K+、、,可能存在Cl-,故B错误;
C.步骤②中发生反应的化学方程式为BaCO3+2HCl=BaCl2+CO2↑+H2O,故C错误;
D.步骤③中是生成了氯化银沉淀,其反应的离子方程式为Ag++Cl-=AgCl↓,故D正确。
答案选D。
10. 已知:A、C、D、E为无色气体,F为红棕色气体。物质间的转化关系如图所示,其中部分产物已略去,则下列说法错误的是
A. A、B互换位置也满足该流程
B. 反应①中每生成转移电子
C. F与水的反应中氧化剂与还原剂的物质的量之比为1:2
D. C为,D为,C可以在D中燃烧生成氮气
【答案】B
【解析】
【分析】F为红棕色气体,则F为二氧化氮,二氧化和水反应生成一氧化氮和硝酸,硝酸和碳加热条件下反应生成二氧化碳、二氧化氮和水,A(二氧化碳)和过氧化钠反应生成碳酸钠和D(氧气),硝酸和铜反应生成硝酸铜、E(一氧化氮)和水,一氧化氮和氧气反应生成二氧化氮,C(氨气)催化氧化生成一氧化氮和水,M受热分解生成氨气、二氧化碳和水,则M为碳酸铵或碳酸氢铵。
【详解】A.A为二氧化碳,B为水,A、B互换位置也满足该流程,水和过氧化钠反应生成氢氧化钠和D(氧气),硝酸和碳加热反应生成二氧化碳、二氧化氮和水,故A正确;
B.反应①方程式为,根据方程式分析,生成1mol氧气转移2mol电子,故B错误;
C.F与水即,二氧化氮中氮化合价既升高又降低,有两个氮升高,有1个氮降低,因此反应中氧化剂与还原剂的物质的量之比为1:2,故C正确;
D.C为,D为,C可以在D中燃烧生成氮气即,故D正确。
综上所述,答案为B。
11. 下列实验或装置能达到实验目的的是
A B C D
制备氢氧化铁胶体 比较卤素单质氧化性强弱 洗气除去SO2中的CO2 测浓硫酸的pH
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.制备氢氧化铁胶体是将饱和氯化铁溶液滴入到沸水中而不是NaOH溶液中,否则得到的是沉淀而不是胶体,A不选;
B.新制氯水可以置换出NaBr中Br2,也能置换出NaI中的I2,可知氧化性:Cl2> Br2、Cl2> I2,再利用溴水置换出NaI中的I2,可知氧化性:Br2>I2,从而可得氧化性:Cl2> Br2>I2,B选;
C.饱和NaHCO3溶液会吸收SO2,而杂质CO2不会和NaHCO3反应,因而不能达到除杂的目的,C不选;
D.用pH试纸测定溶液的pH时,用玻璃棒蘸取待测液滴到pH试纸上,读出pH,以免污染待测液,同时由于浓硫酸具有脱水性,会使试纸碳化,D不选;
故选B。
12. 以MgCl2为原料可生产碱式碳酸镁[Mgx(OH)y(CO3)z·pH2O]。某研究性学习小组称取碱式碳酸镁4.66g,高温煅烧至恒重,得到2.00gMgO和标准状况下0.896LCO2。下列说法错误的是
A. x、y、z存在电荷守恒关系2x=y+2z
B. 碱式碳酸镁具有阻燃作用的原因之一是高温下有CO2生成
C. 碱式碳酸镁的化学式为Mg5(OH)2(CO3)4·4H2O
D. 由以上数据无法计算碱式碳酸镁的化学式
【答案】D
【解析】
【分析】高温煅烧碱式碳酸镁可得到MgO、CO2和H2O,反应的化学方程式为:Mgx(OH)y(CO3)z·pH2OxMgO+zCO2+(p+)H2O,取碱式碳酸镁4.66g,高温煅烧至恒重,得到2.00gMgO,其物质的量为,和标准状况下0.896LCO2,其物质的量为,质量为0.04mol×44g/mol=1.76g,则根据质量守恒可得m(H2O)=4.66g-2.00g-1.76g=0.9g,n(H2O)= ,则Mgx(OH)y(CO3)z·pH2O中,n(Mg2+)= n(MgO)=0.05mol,n()=n(CO2)=0.04mol,根据电荷守恒,2n(Mg2+)= 2n()+n(OH-),求得n(OH-)=0.02mol,因此n(H2O)=0.05mol-=0.04mol,则x∶y∶z∶p=0.05∶0.02∶0.04∶0.04=5∶2∶4∶4,碱式碳酸镁的化学式为Mg5(OH)2(CO3)4·4H2O。
【详解】A.在[Mgx(OH)y(CO3)z·pH2O]中,根据电荷守恒,2n(Mg2+)= 2n()+n(OH-),即2x=y+2z,A正确;
B.碱式碳酸镁高温下分解为MgO、CO2和H2O,生成的CO2既不燃烧也不支持燃烧,使得碱式碳酸镁能起到阻燃的作用,B正确;
C.根据以上分析,可得出碱式碳酸镁的化学式为Mg5(OH)2(CO3)4·4H2O,C正确;
D.根据选项C分析知,可计算出碱式碳酸镁的化学式,D错误;
故选D。
13. 煤燃烧排放的烟气中含有和,是大气的主要污染源之一。用溶液对烟气同时脱硫脱硝(分别生成、,得到、)脱除率如图,下列说法不正确的是
A. 脱除的反应:
B. 依据图中信息,在时,吸收液中
C. 脱除率高于的原因可能是在水中的溶解度大于
D. 随着脱除反应的进行,吸收剂溶液的逐渐减小
【答案】B
【解析】
【详解】A.Ca(ClO)2溶液脱除NO的反应生成Cl-和NO,根据质量守恒和电子得失守恒配平方程式为2NO+3ClO-+H2O=2H++2NO+3Cl-,故A说法正确;
B.2NO+3ClO-+H2O=2H++2NO+3Cl-,SO2+ClO-+H2O=2H++SO+Cl-;已知n(NO):n(SO2)=2∶3;令n(NO)=2mol,n(SO2)=3mol,依据图中信息及离子方程式中的比例关系得:在80min时,NO脱除率40%,即反应的NO为:2mol×40%=0.8mol,生成1.2molCl-,同时生成NO物质的量为0.8mol;SO2脱除率100%,即3molSO2全部反应生成3molCl-,所以Cl-共3mol+1.2mol=4.2mol;吸收液中n(NO)∶n(Cl-)=0.8mol∶4.2mol=4∶21,故B说法错误;
C.根据SO2和NO气体在水中的溶解度:SO2大于NO,SO2比NO更易溶于水,更容易发生反应;SO2脱除率高于NO的原因可能是SO2在水中的溶解度大于NO,故C是说法正确;
D.无论发生:2NO+3ClO-+H2O=2H++2NO+3Cl-,还是发生:SO2+ClO-+H2O=2H++SO+Cl-,都是使H+浓度增大,吸收剂溶液的pH减小,故D说法正确;
答案为B。
14. 硅酸(H2SiO3)是一种难溶于水的弱酸,从溶液中析出时常形成凝胶状沉淀。实验室常用Na2SiO3溶液制备硅酸。某小组同学进行了如下实验:
实验
现象 a中产生凝胶状沉淀
下列结论不正确的是
A. 盐酸与石灰石反应离子反应方程式:
B. 由实验不能说明酸性H2CO3>H2SiO3
C. 若想比较碳酸和硅酸的酸性强弱,应该让气体在通入a之前先通过盛有饱和碳酸氢钠溶液的洗气瓶
D. 向Na2SiO3溶液中通入过量CO2,发生反应:
【答案】D
【解析】
【详解】A.碳酸钙是难溶物,与盐酸反应的离子方程式为,故A正确;
B.因为盐酸有挥发性,挥发的HCl也能与硅酸钠反应生成硅酸,故不能说明酸性H2CO3>H2SiO3,故B正确;
C.因为盐酸有挥发性,挥发的HCl也能与硅酸钠反应生成硅酸,若想比较碳酸和硅酸的酸性强弱,应该让气体在通入a之前先通过盛有饱和碳酸氢钠溶液的洗气瓶,除掉挥发的HCl,故C正确;
D.向Na2SiO3溶液中通入过量CO2,生成硅酸和碳酸氢钠,离子方程式为:,故D错误。
答案选D。
第二部分 (非选择题)
本部分共5题,共58分。
15. 实验室可用如图装置(略去部分夹持仪器)制取SO2并验证其性质。
(1)盛装70%H2SO4溶液的仪器名称为___________,仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至形成段液柱,若___________则整个装置气密性良好。
(2)A中如果用浓硫酸和铜反应,也可制得SO2进行实验,反应的化学方程式为___________。
(3)装置B的作用之一是通过观察产生气泡的多少判断SO2生成的快慢,其中的液体最好选择___________(填代号)。
a.蒸馏水 b.饱和NaHCO3溶液 c.饱和NaHSO3溶液 d.饱和NaOH溶液
(4)C试管中的试剂可以验证二氧化硫的氧化性,现象为___________。
(5)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案合理的是方案___________(填“I”“Ⅱ”或“Ⅲ”);SO2通入试管D中发生的主要反应的离子方程式为___________。
(6)装置E的作用是做安全瓶,防止F中的液体倒吸入D中,装置F中为___________溶液。
【答案】(1) ①. 分液漏斗 ②. 一段时间后液柱高度保持不变
(2)
(3)有淡黄色沉淀生成
(4)c (5) ①. Ⅲ ②.
(6)NaOH
【解析】
【分析】装置A中Na2SO3与浓H2SO4反应生成SO2,装置B内装有饱和NaHSO3溶液判断SO2生成的快慢,为验证二氧化硫的氧化性,与硫化钠发生归中反应生成S单质,有淡黄色固体生成,装置D中SO2与氯水反应生成HCl和H2SO4,E为安全瓶,装置F内装有NaOH溶液吸收尾气。
【小问1详解】
盛装浓H2SO4溶液的仪器名称为分液漏斗,如果一段时间后长颈漏斗中液柱高度保持不变,则证明该装置气密性良好;
【小问2详解】
浓硫酸和铜加热反应,生成硫酸铜、二氧化硫和水,化学方程式为;
【小问3详解】
SO2和水反应生成亚硫酸,SO2和NaOH溶液反应生成Na2SO3,SO2与饱和NaHCO3溶液也会反应;故应该选取饱和NaHSO3溶液,答案为c;
【小问4详解】
C试管中的试剂可以验证SO2的氧化性,则Na2S作还原剂,被SO2氧化生成难溶性的S单质,所以看到的现象是:有浅黄色沉淀生成;
【小问5详解】
为验证二氧化硫的还原性,充分反应后,SO2被氧化生成SO,只要证明溶液中含有SO即可,
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成,说明溶液中含有Cl-;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去,说明溶液中含有HClO或SO2;
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀,说明溶液中含有SO,
故选Ⅲ;
D中SO2和Cl2在水溶液中发生氧化还原反应生成HCl、H2SO4,离子方程式为:;
【小问6详解】
装置F的作用是除去SO2的尾气,则应选择NaOH溶液。
16. 硝酸是重要的化工原料。下图是以合成氨为基础的传统硝酸生产工艺流程(其中空气等基础原料已略去)。
(1)关于合成氨工艺,下列说法不正确的是___________(填序号)。
a.合成氨是一种重要的人工固氮方法
b.该反应过程中氮元素被氧化
c.合成氨气还可以用于化肥工业
d.该反应采用高温、高压等苛刻条件,与N2化学性质很稳定有关
(2)氮氧化装置中,先生成NO,反应的化学方程式为___________。然后NO被氧化成NO2。
(3)吸收装置中,发生的反应为,若用VaLxmol·L-1的稀硝酸作为吸收液,反应后得到VbLymol·L-1的浓硝酸,则理论上吸收装置中需消耗的O2的物质的量为___________mol(写出计算式)。
(4)为实现制硝酸的绿色化改进,技术人员将①分离液态空气、②电解水等工艺整合在上述流程中。请在①、②中任选一种,说明该工艺的产物如何应用于硝酸生产流程:___________。
(5)NH3催化还原氯氧化物技术(SCR)是目前应用最广泛的氮氧化物脱除技术,可用于上述硝酸生产工艺的废气处理,反应原理如下图所示:
若催化剂表面参与反应的NO和NO2物质的量之比为1:1,则总反应的化学方程式为___________。
【答案】(1)b (2)
(3)
(4)①中,分离液态空气得到的氮气可用于合成氨,氧气可用于氨氧化等或②中,电解水得到的氢气可用于合成氨,氧气可用于氨氧化等
(5)
【解析】
【小问1详解】
a.合成氨将氮气转化为氨气,是一种重要的人工固氮方法,故a正确;
b.该反应过程中氮元素的化合价减低,被还原,故b错误;
c.合成的NH3可用于制作氮肥,可以用于化肥工业,故c正确;
d.由于N2化学性质很稳定,则该反应采用高温、高压等苛刻条件,与氮气的稳定性有关,故d正确;
故答案为:b;
【小问2详解】
氨氧化装置中,氨气和氧气反应生成的NO和水,其反应的化学方程式为;
【小问3详解】
吸收装置中,发生的反应为2N2O4+O2+2H2O═4HNO3,若用VaLxmol L-1的稀硝酸作为吸收液,反应后得到VbLymol L-1的浓硝酸,反应的关系式为O2~4HNO3,则理论上吸收装置中需消耗的O2的物质的量为mol;
小问4详解】
为实现制硝酸的绿色化改进,技术人员将①分离液态空气得到氮气可用于合成氨气,氧气可用于氨氧化等;②电解水得到氢气,可用于合成氨气,氧气可用于氨氧化等;
【小问5详解】
NH3催化还原氮氧化物生成氮气和水,参与反应的NO和NO2物质的量之比为1:1,则总反应的化学方程式为。
17. 元素周期表是学习化学的重要工具。A-H为短周期主族元素,其原子半径→原子序数→最高正化合价(或最低负化合价)的关系如图所示。
回答下列问题:
(1)F原子的结构示意图为___________,写出质量数为35的H原子符号:___________。
(2)B、D形成的化合物BD2的电子式为___________,结构式为___________。
(3)A与H形成的化合物属于___________(填“离子”或“共价”)化合物;元素B、G、H的最高价氧化物的水化物中,酸性由大到小的是___________(用“>”连接化学式)。
(4)D、E的简单离子半径由大到小顺序为___________(填离子符号)。
(5)元素G的简单气态氢化物与GD2的水溶液反应的实验现象为___________。
(6)单质F与E的最高价氧化物对应的水化物之间发生反应的离子方程式为___________。
【答案】17. ①. ②.
18. ①. ②. O=C=O
19. ①. 共价 ②.
20.
21. 产生淡黄色沉淀
22.
【解析】
【分析】短周期元素中,A的原子序数及原子半径最小,则A为H元素;D只有-2价,D为O元素;结合原子序数可知,B、C位于第二周期,F、H位于第三周期,B有+4价,B为C;C有+5价,C为N;E为+1价,E为Na;F为+3价,F为Al;H为-1价,H为Cl,G为-2价,原子半径比Cl稍大,G为S;以此来解答。
【小问1详解】
F为Al元素,原子结构示意图为,H为Cl元素,一种氯原子的质量数为35的符号为:;
【小问2详解】
BD2为CO2,电子式为,结构式为O=C=O;
【小问3详解】
H与Cl形成HCl,属于共价化合物;C、S、Cl的非金属性Cl>S>C,故最高价氧化物的水化物中,酸性由大到小顺序是;
【小问4详解】
O2-和Na+的电子层结构相同,核电荷数小则半径大,故半径;
【小问5详解】
H2S与SO2在溶液中反应会生成单质硫,现象为产生淡黄色沉淀;
【小问6详解】
Al与NaOH溶液反应生成四羟基合铝酸钠和氢气,离子方程式为。
18. 碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下x克钢样中碳、硫转化为CO2、SO2。
①气体a的成分是____________________。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5 O21____+3_____。
(2)将气体a通入测硫酸装置中(如右图),采用滴定法测定硫的含量。
①H2O2氧化SO2的化学方程式:_________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mLNaOH溶液,若消耗1mLNaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:_________________。
(3)将气体a通入测碳装置中(如下图),采用重量法测定碳的含量。
①气体a通过B和C的目的是_____________________。
②计算钢样中碳的质量分数,应测量的数据是__________________。
【答案】 ①. CO2、SO2、O2 ②. Fe3O4 ③. SO2 ④. H2O2+SO2=H2SO4 ⑤. zy/x ⑥. 除去SO2对CO2测定的干扰 ⑦. 吸收CO2气体前后吸收瓶的质量
【解析】
【详解】(1)①钢样中的碳、硫在装置A中被氧化为CO2、SO2,故a的成分为CO2、SO2以及未反应的O2;
②FeS中的-2价的硫被氧化为SO2,+2价的Fe被氧化为+3价的铁,结合所给化学计量数,可知产物应为Fe3O4和SO2,故方程式为3FeS+5O2Fe3O4+3SO2;
(2)①H2O2具有氧化性,可氧化SO2使S的化合价升高为+6价,在溶液中反应产物应为硫酸,故反应方程式为:H2O2+SO2=H2SO4;
②1mL NaOH相当于yg S,故z mL NaOH相当于 zy g S,则该样品中硫的质量分数为zy/x 。
(3)①测定碳的含量需将气体a中的SO2除去,故装置B和C的作用是除去SO2;
②计算碳的质量分数须利用CO2的质量进行分析,故需测量CO2吸收瓶在吸收CO2气体前后的质量。
19. 某化学小组研究硝酸与金属的反应。下列实验中硝酸与金属的反应均在注射器中完成,实验操作及实验现象记录如表:
序号 实验操作与实验现象
实验1 加入适量铜片与2mL的浓硝酸。反应剧烈,产生红棕色气体,溶液立即呈绿色。
实验2 加入过量的铜片与2mL0.5mol/LHNO3溶液。产生无色气泡,溶液逐渐变为蓝色。注射器中的气体始终无色。反应结束后,向注射器中充入一定量的O2,气体迅速变为红棕色
实验3 加入过量的铁粉与2mL0.5mol/LHNO3溶液,立即有无色气体生成,溶液为很浅的绿色,反应结束后将气体通入有空气的容器无明显变化,点燃,有尖锐的爆鸣声,容器壁出现无色液滴;取反应后溶液,加入足量NaOH溶液,立刻得到白色沉淀,迅速变为灰绿色,最后变成红褐色,加热后产生能使湿润红色石蕊试纸变蓝的气体。
(1)铜与浓HNO3反应产生红棕色气体化学方程式是___________。
(2)对实验1所得溶液呈绿色,而实验2所得溶液呈蓝色的原因提出猜想。
查阅资料:
i.NO2溶于稀硝酸会反应:而溶于浓硝酸不反应,使溶液呈黄色;
ⅱ.NO2与水反应时会有部分发生反应:,HNO2是弱酸,无色,不稳定。
ⅲ.离子颜色为绿色。
猜想1:NO2溶于浓硝酸,与蓝色溶液混合而呈现绿色。
猜想2:HNO2电离出的与结合为(绿色)。
①向浓硝酸中通入NO2,溶液呈黄色,加入___________(填试剂)后呈绿色,证实猜想1合理。
②研究猜想2是否为实验I所得溶液呈绿色的主要原因,实验如下。
a.证明溶液A中含有HNO2的证据是___________。
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色。结果表明,猜想2不是实验I所得溶液呈绿色的主要原因,说明理由:___________。
(3)实验2中充入O2后气体变为红棕色的反应的化学方程式是___________。
(4)查阅文献:铁粉与稀硝酸反应会生成H2.由实验3中的实验现象可知,过量的铁粉与0.5mol/L稀HNO3反应的还原产物中除了H2外,还有___________生成。写出白色沉淀迅速变为灰绿色,最后变成红褐色的化学方程式___________。
(5)甲同学对实验3产生H2的原因提出假设:该浓度的硝酸中H+的氧化性大于。乙同学认为该假设不合理。依据是实验2中观察到了___________(填实验现象),该现象能说明假设不合理。
(6)结合以上实验可知,金属与硝酸反应的产物与___________等因素有关。
【答案】(1)
(2) ①. ②. 溶液A为无色、溶液B为绿色 ③. 实验表明在酸性环境下不能稳定存在;由于实验1中有大量的浓硝酸存在,故不应含有大量的
(3)
(4) ①. 铵根离子(或) ②.
(5)反应后得到无色气体充入O2后气体迅速变为红棕色
(6)硝酸的浓度、金属种类
【解析】
【小问1详解】
铜与浓HNO3反应产生红棕色气体NO2的化学方程式是:;
【小问2详解】
①猜想1是NO2溶于浓硝酸,与蓝色溶液混合而呈现绿色,要证明猜想合理,向浓硝酸中通入NO2后再加溶液,观察到溶液呈绿色即可证明;
②a.结合题目已知资料:HNO2是弱酸,无色,不稳定;离子颜色为绿色,根据A溶液呈无色,B溶液呈绿色,能说明A中含有HNO2;
b.向溶液B中滴加少量硝酸,溶液由绿色变为蓝色,说明在酸性环境下不能稳定存在;由于实验1中有大量的浓硝酸存在,故不应含有大量的;
【小问3详解】
实验2中充入O2后,NO与O2反应生成NO2,气体变为红棕色,反应的化学方程式是;
【小问4详解】
量的铁粉与HNO3溶液生成浅的绿色Fe2+溶液,得到气体通入有空气的容器无明显变化,则气体中无NO,点燃气体尖锐的爆鸣声,容器壁出现无色液滴,说明气体含有氢气,加入足量NaOH溶液并加热,生成Fe(OH)2,迅速被氧化生成Fe(OH)3和使湿润红色石蕊试纸变蓝的NH3,故产物中除了H2外,还有生成;Fe(OH)2迅速被氧化生成Fe(OH)3的化学方程式为:。
【小问5详解】
实验2中铜片表面产生无色气泡,且反应结束后,向注射器中充入一定量的O2,则气体迅速变为红棕色,说明该气体是NO,即说明该浓度的稀硝酸加入过量的铜片,是硝酸根离子被还原生成NO,说明氧化性大于H+;
【小问6详解】
结合实验1和实验2可知,硝酸若是浓硝酸则生成NO2,若是浓度较低则生成NO,结合实验2和实验3可知,相同浓度的硝酸溶液,与较活泼的铁反应则被还原生成,与较不活泼的铜反应则生成NO,故金属与硝酸反应的产物与金属的活泼性、硝酸的浓度等因素有关。
同课章节目录
