8.2化学品的合理使用同步练习(含解析)2023——2024学年高中化学人教版(2019)必修第二册
文档属性
| 名称 | 8.2化学品的合理使用同步练习(含解析)2023——2024学年高中化学人教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-12 00:00:00 | ||
图片预览




文档简介
8.2化学品的合理使用同步练习
姓名()班级()学号()
一、单选题
1.我国古代用“卓筒井”钻凿盐井技术获取食盐。食盐的主要成分是
A. B.
C.NaCl D.NaOH
2.“生活离不开化学”,下列叙述合理的是
A.食用加碘盐可预防甲状腺疾病,所以应尽量多吃
B.甲醛有毒,不要食用甲醛浸泡过的海产品
C.冬天在炉火旁放一盆清水能防止一氧化碳中毒
D.有人称自己有特异功能,能“化水为油”
3.物质的性质往往决定着其在实际生活中的用途,下列物质的性质与用途描述正确且具有对应关系的是
A.金属铝具有良好的导电性和导热性,因此可以用来制作航空航天材料
B.无水硫酸铜能够与水结合形成蓝色晶体,因此常常被用作干燥剂
C.二氧化硫虽然具有一定毒性,但可以起到漂白、防腐和抗氧化的作用,因此可以用作食品添加剂
D.氨气是一种无色无味的气体,很容易液化,且汽化时需要吸收大量的热,因此可以用作制冷剂
4.根据物质的组成和结构的变化可推测其性能变化及用途,下列推测不合理的是
材料 组成和结构变化 性能变化及用途
A 铝 加入等 密度大、强度小
B 奶粉 加入碳酸钙、硫酸锌等 儿童营养强化
C 聚乙炔塑料 掺杂 增强导电性
D 取代部分取代部分 制作LED发光材料
A.A B.B C.C D.D
5.化学知识在生活中有广泛的应用,下列有关说法正确的是
A.维生素又名抗坏血酸,有较强的还原性,在食品中添加适量维生素可以延长食品的保质期
B.节日燃放的烟花所呈现的艳丽色彩,是利用了钠、铜、铁等金属元素的焰色反应
C.碳酸钠溶液呈碱性能与盐酸反应,胃酸过多的病人可以在饮用水中加适量碳酸钠
D.使用氯气对自来水消毒时可能产生对人体有害的有机氯化物,可以使用、氧气的同位素作为新的自来水消毒剂
6.物质的性质决定用途,下列两者对应关系不正确的是
A.易分解,可用于治疗胃酸过多
B.是一种绿色消毒剂,可用于自来水杀菌消毒
C.维生素C具有还原性,可用作食品抗氧化剂
D.过氧化钠溶于水具有漂白性,可作潜水艇中的供氧剂
7.中药自然铜具有散瘀止痛、续筋接骨之功效,其炮制方法始见于南北朝《雷公炮炙论》:取净自然铜(含FeS2的矿石)置于敞口耐火容器中,大火煅制红透,立即取出投入米醋淬火,反复煅淬数次至褐色,干燥后碾碎装存。下列说法正确的是
A.古代煅制自然铜应在通风环境中进行
B.煅制过程中1 mol FeS2被完全氧化,转移电子的数目约为
C.自然铜淬火过程中发生反应的离子方程式为
D.含自然铜成分的中成药大七厘散(处方药),其包装上有“OTC”标识
8.许多食品包装袋中常有一个小纸袋,内盛白色固体物质,标有“干燥剂”字样,其主要成分为生石灰.下列说法不正确的是
A.生石灰的化学式为,属于酸性氧化物
B.生石灰作干燥剂的原理是
C.从类别角度看,生石灰可与稀盐酸、等发生反应
D.浓硫酸也是重要的干燥剂
9.食物中的营养物质是人类生命活动的基础,下列说法正确且有利于人体健康的是
A.发霉的食物清洗后可继续食用 B.饮用碳酸饮料可增强钙的吸收
C.食用铁强化酱油越多越好 D.食用蔬菜和水果能摄取维生素
10.下列有关化学品的使用以及有机化合物的说法正确的是
A.葡萄糖、果糖、蔗糖都属于单糖
B.重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒
C.亚硝酸钠是常用的防腐剂,对人体无害
D.药物可以帮助我们战胜疾病,但我们仍需要合理用药
11.从日常生活到科技前沿,化学无处不在。下列说法正确的是
A.食品包装袋中的生石灰、还原铁粉等的作用都是防止食品氧化变质
B.稀土元素加入钢中可以增加钢的塑性、韧性、耐磨性等
C.量子通信材料螺旋碳纳米管TEM与石墨烯互为同位素
D.家庭厨卫所用的固体管道疏松剂主要成分有盐酸和铝粉
12.化学与生产、生活、科技密切相关。下列说法错误的是
A.稀土元素是自然界共生在一起的一类元素,稀土元素被称为“冶金工业的维生素”
B.胃舒平中含有氢氧化铝,可以用来治疗胃酸过多
C.二硫化钼是我国自主研制的能导电、能储存能量的二维材料,属于新型有机功能材料
D.屠呦呦使用乙醚提取青蒿中的青蒿素,荣获诺贝尔生理学或医学奖
13.当下,预制菜是否适合进入校园引起人们广泛关注。为了延长菜品保存时间,保持鲜亮色泽,需要添加一定量的食品添加剂,其中蕴含着许多化学知识,下列说法不正确的是
A.为让汤底更加浓郁、颜色更佳、口感更好,需添加三聚磷酸、日落黄等添加剂和着色剂,以及鸡精、酱油、醋等调味剂
B.为保证菜品整体品质的稳定,延长保存时间,可添加抗坏血酸(即维生素C)等抗氧化剂,抗坏血酸发生还原反应
C.目前市面上的预制菜大多需经过高温蒸煮后方可食用,部分添加剂在高温情况下可能会发生二次化学反应,存在一定的食品安全风险
D.在规定范围内合理使用食品添加剂,对人体健康不会产生不良影响
二、多选题
14.阿司匹林(乙酰水杨酸)具有解热镇痛的作用,是家中常备药,其合成原理如图所示:
下列说法错误的是
A.阿司匹林的分子式为,该药物属于OTC药物可以长期服用
B.水杨酸可以发生酯化反应、加成反应
C.可以用碳酸氢钠溶液区别水杨酸和阿司匹林
D.阿司匹林与布洛芬(退烧)药物不能同时服用
15.毒品大麻的结构简式为,下列有关大麻的说法错误的是
A.青少年好奇心强,偶尔吸食一点,很快就会提神,学习效率高
B.大麻分子中含两种官能团
C.大麻能使酸性KMnO4溶液褪色
D.1mol大麻可以和足量单质钠反应生成1mol氢气
三、解答题
16.食品添加剂的常见类别有:着色剂、增味剂、膨松剂、凝固剂、防腐剂、营养强化剂等。
(1)碘酸钾为 (填食品添加剂的类别)。
(2)从海带中提取碘的主要实验过程如下图所示:
①干海带的“灼烧”需在 (填仪器名称)中进行。
②操作1为 (填操作名称)。
③在“氧化”步骤中,最符合绿色化学思想的氧化剂是下列物质中的 (填选项字母),酸性条件下该反应的离子方程式为 。
A.溶液 B.浓硝酸 C.
④检验操作2后水层中是否含有碘单质的方法为 。
(3)在加热条件下,将通入到和的混合溶液中制备,该反应的化学方程式为 ;若要制备500g的加碘食盐(碘含量为2.54%),至少需要 g。
17.三氧化二铋(Bi2O3)是黄色不溶于水的固体,俗称铋黄,可用于制作黄色颜料、耐火纸等。利用含铋废料(还含Cu、Pb、Zn的硫酸盐及CuS、Fe2O3)制备Bi2O3流程如下:
(1)“酸浸”后的固体中除含铋的化合物、CuS外,还含有 ;料液中含有多种成分,向料液中加入过量锌粉并充分搅拌,过滤后,滤液经过 冷却结晶、过滤、洗涤、干燥即可制得ZnSO4·7H2O。
(2)“溶铜”时,试剂X可以是多种物质,分别使用O2、H2O2、MnO2三种氧化剂,氧化等物质的量同一种还原剂时,且得到相同氧化产物,消耗这三种氧化剂物质的量之比为 (MnO2转化为Mn2+);写出X为O2时,“溶铜”CuS反应的离子方程式: 。
(3)其他条件相同时,溶液中c(Cl-)越大,铋的溶出率越大,仅从原料成本角度考虑,试剂Y是 。
(4)写出“制备”步骤生成铋黄的离子方程式: 。
18.海水是巨大的资源宝库,从海水中提取溴和碘的过程如下。
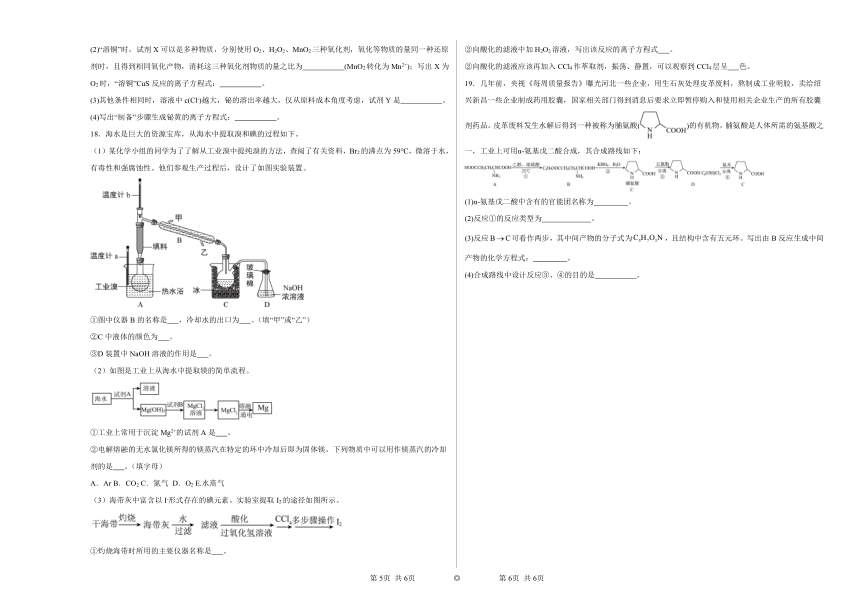
(1)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置。
①图中仪器B的名称是 ,冷却水的出口为 。(填“甲”或“乙”)
②C中液体的颜色为 。
③D装置中NaOH溶液的作用是 。
(2)如图是工业上从海水中提取镁的简单流程。
①工业上常用于沉淀Mg2+的试剂A是 。
②电解熔融的无水氯化镁所得的镁蒸汽在特定的环中冷却后即为固体镁。下列物质中可以用作镁蒸汽的冷却剂的是 。(填字母)
A.Ar B.CO2 C.氮气 D.O2 E.水蒸气
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示。
①灼烧海带时所用的主要仪器名称是 。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式 。
②向酸化的滤液应该再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈 色。
19.几年前,央视《每周质量报告》曝光河北一些企业,用生石灰处理皮革废料,熬制成工业明胶,卖给绍兴新昌一些企业制成药用胶囊,国家相关部门得到消息后要求立即暂停购入和使用相关企业生产的所有胶囊剂药品。皮革废料发生水解后得到一种被称为脯氨酸()的有机物,脯氨酸是人体所需的氨基酸之一,工业上可用α-氨基戊二酸合成,其合成路线如下:
(1)α-氨基戊二酸中含有的官能团名称为 。
(2)反应①的反应类型为 。
(3)反应可看作两步,其中间产物的分子式为,且结构中含有五元环。写出由B反应生成中间产物的化学方程式: 。
(4)合成路线中设计反应③、④的目的是 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】食盐的主要成分是氯化钠,其化学式为NaCl,故选C。
2.B
【详解】A.人体所含的微量元素,应适量补充,过多或过少都会对人体产生不适,A错误;
B.甲醛有毒,所以不能食用甲醛浸泡过的海产品,B正确;
C.因为CO不溶于水,所以在炉火旁放一盆清水不能防止一氧化碳中毒,C错误;
D.“化水为油”是不能实现的,D错误;
故选B。
3.C
【详解】
A.铝具有较低的密度,且其合金的强度较大,可以用来制作航空航天材料,A错误;
B.无水硫酸铜能够与水结合形成蓝色晶体,因此常常检测水的存在,B错误;
C.二氧化硫在控制用量前提下,可以作食品添加剂,如葡萄酒中添加少量二氧化硫,起到调节酸度、杀菌、抗氧化等作用,C正确;
D.氨容易液化,且液氨汽化时吸收大量的热从而使周围温度降低,因此,液氨可以用作制冷剂,D错误;
故选C。
4.A
【详解】A.铝中加入等制成合金,可以增强材料的强度,A错误;
B.奶粉中加入碳酸钙、硫酸锌等,可以补充钙、锌等元素,强化营养,B正确;
C.在聚乙炔塑料中掺杂,可以增强导电性,C正确;
D.用Al、O部分取代中的Si、N,可以制作LED发光材料,D正确;
综上所述,选A。
5.A
【详解】A.维生素C具有还原性,在食品中添加适量维生素C可以防止食品氧化,延长食品的保质期,A正确;
B.铁灼烧时火焰不变色,节日燃放的烟花是碱金属、锶等金属化合物焰色反应所呈现的色彩,B错误;
C.碳酸钠碱性较强,若用于治疗胃酸过多,对人体有害,应该使用碳酸氢钠,C错误;
D.同种元素组成的不同单质为同素异形体,和属于同素异形体,不是同位素,D错误;
故选A。
6.A
【详解】A.能与酸反应,可用于治疗胃酸过多,与碳酸氢钠易分解无关,A错误;
B.具有强氧化性,还原产物是氯离子,是一种绿色消毒剂,可用于自来水杀菌消毒,B正确;
C.维生素C具有还原性,因此可用作食品抗氧化剂,C正确;
D.过氧化钠具有强氧化性,能和水或二氧化碳反应产生氧气,溶于水具有漂白性,可作潜水艇中的供氧剂,D正确;
答案选A。
7.A
【详解】A.由题干信息可知,古代煅制自然铜时因会产生有毒有害的气体SO2,故应在通风环境中进行,A正确;
B. 锻制过程是FeS2与O2反应生成Fe2O3和SO2,即Fe由+2价转化为+3价,S由-1价转化为+4价,故煅制过程中1 mol FeS2被完全氧化,转移电子的数目约为,B错误;
C.自然铜淬火过程中即Fe2O3与醋酸反应,故发生反应的离子方程式为,C错误;
D.处方药的标识为 “R”,OTC为非处方药的标识,即含自然铜成分的中成药大七厘散(处方药),其包装上有“R”标识,D错误;
故答案为:A。
8.A
【详解】A.生石灰是氧化钙,其化学式为CaO,属于碱性氧化物,A不正确;
B.生石灰可与水反应生成氢氧化钙,故可防止食品受潮,B正确;
C.从类别角度看,生石灰属于碱性氧化物,可与稀盐酸、等发生反应,C正确;
D.浓硫酸具有吸水性,也是重要的干燥剂,D正确;
答案选A。
9.D
【详解】A.发霉的食物即使洗了,也可能还存在有害物质,食用后会导致身体不适、中毒等症状,A不符合题意;
B.碳酸饮料中含有磷酸,摄入到人体内可形成难溶的磷酸钙而影响人体对钙元素的吸收,B不符合题意;
C.食用铁强化酱油可以补铁,但不是越多越好,每天食用为宜,C不符合题意;
D.新鲜的蔬菜和水果中富含维生素,食用蔬菜和水果能摄取维生素,有利于人体健康,D符合题意;
故选D。
10.D
【详解】A.葡萄糖、果糖属于单糖,蔗糖属于二糖,A不正确;
B.易溶于水或盐酸的重金属盐能使蛋白质变性,钡餐的主要成分为硫酸钡,它难溶于水,不能被人体吸收,所以吞服“钡餐”不会引起中毒,B不正确;
C.亚硝酸钠是常用的防腐剂,但对人体有害,使用时需严格控制用量,C不正确;
D.虽然药物可以帮助我们战胜疾病,但通常药物都具有一定的毒性,使用时需要在医生的指导下合理用药,D正确;
故选D。
11.B
【详解】A.生石灰只能吸收水分,无法除去氧气,不能防止食品氧化变质,A错误;
B.稀土元素加入钢中可以增加钢的塑性、韧性、耐磨性等,B正确;
C.碳纳米管与石墨烯为碳元素的不同单质,互为同素异形体,C错误;
D.家庭厨卫所用的固体管道疏松剂主要成分有NaOH和铝粉,D错误;
答案选B。
12.C
【详解】A.在金属元素中,有一类性质相似、并在自然界共生在一起的稀土元素,稀土元素既可以单独使用,也可以用于生产合金,在合金中加入适量稀土元素,能大大改善合金的性能,因而稀土元素又被称为“冶金工业的维生素”,A正确;
B.胃舒平中含有氢氧化铝,可以和胃酸(主要成分为盐酸)发生反应,B正确;
C.二硫化钼属于无机物,不属于新型有机功能材料,属于新型无机非金属材料,C错误;
D.屠呦呦使用乙醚提取青蒿中的青蒿素,荣获诺贝尔生理学或医学奖,D正确;
故选:C。
13.B
【详解】A.为让汤底更加浓郁、颜色更佳、口感更好,需适量添加三聚磷酸、日落黄等添加剂和着色剂,以及鸡精、酱油、醋等调味剂,故A正确;
B.抗坏血酸(即维生素C)等抗氧化剂,抗坏血酸具有还原性,发生氧化反应,故B错误;
C.目前市面上的预制菜大多需经过高温蒸煮后方可食用,部分添加剂在高温情况下可能会发生二次化学反应,存在一定的食品安全风险,故C正确;
D.在规定范围内合理使用食品添加剂,对人体健康不会产生不良影响,故D正确;
故选B。
14.AC
【详解】A.阿司匹林的分子式为,该药物属于OTC药物,仍需在医生指导下进行服用,不可以长期服用,故A错误;
B.水杨酸苯环可以与氢气发生加成反应,羧基可以发生酯化反应,故B正确;
C.水杨酸和阿司匹林均含有羧基,与碳酸氢钠溶液均能产生二氧化碳气体,不能用于区别二者,故C错误;
D.阿司匹林与布洛芬(退烧)两者都有解热镇痛的效果,故药物不能同时服用,故D正确。
答案为:AC。
15.AD
【解析】略
16.(1)营养强化剂
(2) 坩埚 过滤 C H2O2+2I-+2H+=I2+2H2O 在水层中滴加淀粉溶液,若溶液变蓝,说明还有碘单质,反之则没有
(3) I2+5Cl2+12KOH=2KIO3+10KCl+6H2O 17.75
【分析】海带经灼烧,将其中的有机物转变成气体,所含碘元素转变成盐,得到海带灰浸泡,操作1为过滤,除去不溶物得到含碘离子的水溶液,在溶液中加双氧水氧化碘离子得到含碘单质的水溶液,再加四氯化碳或苯能有机溶剂萃取出碘单质,操作2为萃取分液,得到碘的有机溶液,再蒸馏得到碘单质。
【详解】(1)碘酸钾添加在食盐中,能起到补充碘元素的作用,因此碘酸钾为营养强化剂;
(2)①干海带灼烧,需要在坩埚中进行;
②根据分析,操作1为过滤;
③ A.KMnO4被还原为Mn2+,引入杂质,不符合绿色化学思想,A不符合题意;
B.浓HNO3被还原为NO2,有毒,不符合绿色化学思想,B不符合题意;
C.H2O2还原为H2O,无污染,符合绿色化学思想,C符合题意;
故选C;
H2O2、I-在酸性条件下反应生成I2和H2O,方程式为H2O2+2I-+2H+=I2+2H2O;
④淀粉遇碘单质会变蓝,可以用淀粉检验碘单质,在水层中滴加淀粉溶液,若溶液变蓝,说明还有碘单质,反之则没有;
(3)将Cl2通入到I2和KOH的混合溶液中生成KIO3、KCl和H2O,方程式为I2+5Cl2+12KOH=2KIO3+10KCl+6H2O;500g的加碘食盐(碘含量为2.54%)中m(I)=500g×2.54%=12.7g,n(I)= =0.1mol,n(I2)=0.05mol,n(Cl2)=5n(I2)=0.25mol,m(Cl2)=0.25mol×71g/mol=17.75g。
17. PbSO4 蒸发浓缩 1:2:2 2CuS+O2+4H+=2Cu2++2H2O+2S↓ NaCl 2BiOCl+2OH-=Bi2O3+2Cl-+H2O
【分析】由题干信息可知,含铋废料(还含Cu、Pb、Zn的硫酸盐及CuS、Fe2O3),故“酸浸”步骤发生的主要反应有:Zn+H2SO4=ZnSO4+H2↑、Pb+H2SO4=PbSO4↓+H2↑、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Cu+ Fe2(SO4)3=CuSO4+2FeSO4,过滤后固体为CuS、PbSO4和含铋的化合物,料液中主要有H+、Cu2+、Fe2+等阳离子,加入过量锌粉后,将置换出Cu和Fe,剩下硫酸锌溶液,然后蒸发浓缩、冷却结晶,过滤洗涤干燥得硫酸锌晶体,“溶铜”步骤中主要是将CuS转化为Cu2+和S,“溶铋”步骤中是将铋转化为可溶性的氯化物,通过调节溶液的pH将铋转化为BiOCl沉淀,再与浓的NaOH溶液反应生成铋黄,据此分析解题。
【详解】(1)由分析可知,“酸浸”后的固体中除含铋的化合物、CuS外,还含有PbSO4;料液中含有多种成分,向料液中加入过量锌粉并充分搅拌,过滤后,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥即可制得ZnSO4·7H2O,故答案为:PbSO4;蒸发浓缩;
(2)“溶铜”时,试剂X可以是多种物质,分别使用O2、H2O2、MnO2三种氧化剂,氧化等物质的量同一种还原剂时,且得到相同氧化产物,故三种氧化剂得到的电子数目相等,故有4n(O2)=2n(H2O2)=2n(MnO2),消耗这三种氧化剂物质的量之比为1:2:2,根据流程图可知, X为O2时,“溶铜”CuS反应生成S、硫酸铜和水,故该反应的离子方程式为:2CuS+O2+4H+=2Cu2++2H2O+2S↓,故答案为:1:2:2;2CuS+O2+4H+=2Cu2++2H2O+2S↓;
(3)其他条件相同时,溶液中c(Cl-)越大,铋的溶出率越大,仅从原料成本角度考虑,NaCl是一种原料丰富,容易获得的化学物质,且能增大溶液中c(Cl-),故试剂Y是NaCl,故答案为:NaCl;
(4)由题干流程图可知,“制备”步骤是BiOCl与浓的NaOH溶液加热生成铋黄、NaCl和水,故该反应的离子方程式为:2BiOCl+2OH-=Bi2O3+2Cl-+H2O,故答案为:2BiOCl+2OH-=Bi2O3+2Cl-+H2O。
18. 直形冷凝管 甲 深红棕色或红棕色 吸收尾气,防止污染环境 Ca(OH)2 A 坩埚、酒精灯、泥三角、三脚架 2H++2I-+H2O2=I2+2H2O 紫红
【分析】本题通过三组实验分别从海水中提取溴、镁、碘,第一组实验为工业溴的提纯实验,因为溴是一种极易挥发的液体,故在热水浴中可以将溴挥发出来,通过冷凝管的冷凝作用将纯净的溴收集起来,达到提纯的效果;第二组实验为海水提镁实验,向海水中加入氢氧化钙溶液将海水中的镁提取出来,后经过盐酸的溶解、蒸发得到固体氯化镁,通过电解熔融的氯化镁得到纯净的镁,在电解过程中需通入惰性气体以保护镁不被氧化;第三组实验为海带提碘实验,将干海带灼烧呈灰后加水溶解,含有碘的物质就转移到溶液中,向溶液中加入少量酸化过的过氧化氢,碘离子可以与酸化的过氧化氢反应生成碘单质,在通过萃取的方式将单质提纯,即得到纯净的碘单质。
【详解】(1)①图中仪器B的名称是直形冷凝管,为达到较好的冷凝效果,采用逆流原理,冷却水的出口为甲,故答案为:直形冷凝管;甲;
②由题中信息可知,C中液体为液态溴,颜色为深红棕色或红棕色,故答案为:深红棕色或红棕色;
③溴有毒性和强腐蚀性,D装置中NaOH溶液的作用是吸收尾气,防止污染环境,故答案为:吸收尾气,防止污染环境;
(2)①石灰乳便宜易得,则工业上常用于沉淀Mg2+的试剂A是Ca(OH)2,故答案为:Ca(OH)2;
②电解熔融的无水氯化镁所得的镁蒸汽在特定的环境中冷却后即为固体镁,Mg与二氧化碳、氮气、氧气、水蒸气均反应,只有Ar可以用作镁蒸汽的冷却剂,故答案为:A;
(3)①灼烧海带时所用的主要仪器名称是坩埚、酒精灯、泥三角、三脚架,故答案为:坩埚、酒精灯、泥三角、三脚架;
②向酸化的滤液中加H2O2溶液,碘离子被氧化为碘单质,该反应的离子方程式为2H++2I-+H2O2=I2+2H2O,故答案为:2H++2I-+H2O2=I2+2H2O;
②酸化的滤液中含有碘,碘易溶于有机溶剂,向滤液中再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈紫红色,故答案为:紫红。
19. 氨基和羧基 取代(或酯化)反应 →+CH3CH2OH 提纯脯氨酸
【分析】根据合成路线分析可知,物质A与乙醇在浓硫酸加热的条件下发生酯化反应,生成物质B,B在经过一系列反应得到C(脯氨酸),再经过③④两个过程对脯氨酸进行除杂提纯,从而得到纯净的脯氨酸,据此结合题干可分析解答问题。
【详解】(1)根据α-氨基戊二酸的结构简式可知,该有机物中含有(氨基)和(羧基)两种官能团,故答案为:氨基和羧基;
(2)反应①是物质A与乙醇在浓硫酸加热的条件下发生酯化反应,生成物质B,反应类型为取代(或酯化)反应,故答案为:取代(或酯化)反应;
(3)反应可看作两步,其中间产物的分子式为,且结构中含有五元环,则中间产物的结构简式为,故答案为:→+CH3CH2OH;
(4)合成路线中设计的反应③是五氯酚与脯氨酸反应,反应④是反应③生成的产物脱去五氯酚,故反应③④的目的是提纯脯氨酸,故答案为:提纯脯氨酸。
【点睛】本题的难点是(3),对照分子式可知另一生成物是C2H5OH。
答案第1页,共2页
答案第1页,共2页
姓名()班级()学号()
一、单选题
1.我国古代用“卓筒井”钻凿盐井技术获取食盐。食盐的主要成分是
A. B.
C.NaCl D.NaOH
2.“生活离不开化学”,下列叙述合理的是
A.食用加碘盐可预防甲状腺疾病,所以应尽量多吃
B.甲醛有毒,不要食用甲醛浸泡过的海产品
C.冬天在炉火旁放一盆清水能防止一氧化碳中毒
D.有人称自己有特异功能,能“化水为油”
3.物质的性质往往决定着其在实际生活中的用途,下列物质的性质与用途描述正确且具有对应关系的是
A.金属铝具有良好的导电性和导热性,因此可以用来制作航空航天材料
B.无水硫酸铜能够与水结合形成蓝色晶体,因此常常被用作干燥剂
C.二氧化硫虽然具有一定毒性,但可以起到漂白、防腐和抗氧化的作用,因此可以用作食品添加剂
D.氨气是一种无色无味的气体,很容易液化,且汽化时需要吸收大量的热,因此可以用作制冷剂
4.根据物质的组成和结构的变化可推测其性能变化及用途,下列推测不合理的是
材料 组成和结构变化 性能变化及用途
A 铝 加入等 密度大、强度小
B 奶粉 加入碳酸钙、硫酸锌等 儿童营养强化
C 聚乙炔塑料 掺杂 增强导电性
D 取代部分取代部分 制作LED发光材料
A.A B.B C.C D.D
5.化学知识在生活中有广泛的应用,下列有关说法正确的是
A.维生素又名抗坏血酸,有较强的还原性,在食品中添加适量维生素可以延长食品的保质期
B.节日燃放的烟花所呈现的艳丽色彩,是利用了钠、铜、铁等金属元素的焰色反应
C.碳酸钠溶液呈碱性能与盐酸反应,胃酸过多的病人可以在饮用水中加适量碳酸钠
D.使用氯气对自来水消毒时可能产生对人体有害的有机氯化物,可以使用、氧气的同位素作为新的自来水消毒剂
6.物质的性质决定用途,下列两者对应关系不正确的是
A.易分解,可用于治疗胃酸过多
B.是一种绿色消毒剂,可用于自来水杀菌消毒
C.维生素C具有还原性,可用作食品抗氧化剂
D.过氧化钠溶于水具有漂白性,可作潜水艇中的供氧剂
7.中药自然铜具有散瘀止痛、续筋接骨之功效,其炮制方法始见于南北朝《雷公炮炙论》:取净自然铜(含FeS2的矿石)置于敞口耐火容器中,大火煅制红透,立即取出投入米醋淬火,反复煅淬数次至褐色,干燥后碾碎装存。下列说法正确的是
A.古代煅制自然铜应在通风环境中进行
B.煅制过程中1 mol FeS2被完全氧化,转移电子的数目约为
C.自然铜淬火过程中发生反应的离子方程式为
D.含自然铜成分的中成药大七厘散(处方药),其包装上有“OTC”标识
8.许多食品包装袋中常有一个小纸袋,内盛白色固体物质,标有“干燥剂”字样,其主要成分为生石灰.下列说法不正确的是
A.生石灰的化学式为,属于酸性氧化物
B.生石灰作干燥剂的原理是
C.从类别角度看,生石灰可与稀盐酸、等发生反应
D.浓硫酸也是重要的干燥剂
9.食物中的营养物质是人类生命活动的基础,下列说法正确且有利于人体健康的是
A.发霉的食物清洗后可继续食用 B.饮用碳酸饮料可增强钙的吸收
C.食用铁强化酱油越多越好 D.食用蔬菜和水果能摄取维生素
10.下列有关化学品的使用以及有机化合物的说法正确的是
A.葡萄糖、果糖、蔗糖都属于单糖
B.重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒
C.亚硝酸钠是常用的防腐剂,对人体无害
D.药物可以帮助我们战胜疾病,但我们仍需要合理用药
11.从日常生活到科技前沿,化学无处不在。下列说法正确的是
A.食品包装袋中的生石灰、还原铁粉等的作用都是防止食品氧化变质
B.稀土元素加入钢中可以增加钢的塑性、韧性、耐磨性等
C.量子通信材料螺旋碳纳米管TEM与石墨烯互为同位素
D.家庭厨卫所用的固体管道疏松剂主要成分有盐酸和铝粉
12.化学与生产、生活、科技密切相关。下列说法错误的是
A.稀土元素是自然界共生在一起的一类元素,稀土元素被称为“冶金工业的维生素”
B.胃舒平中含有氢氧化铝,可以用来治疗胃酸过多
C.二硫化钼是我国自主研制的能导电、能储存能量的二维材料,属于新型有机功能材料
D.屠呦呦使用乙醚提取青蒿中的青蒿素,荣获诺贝尔生理学或医学奖
13.当下,预制菜是否适合进入校园引起人们广泛关注。为了延长菜品保存时间,保持鲜亮色泽,需要添加一定量的食品添加剂,其中蕴含着许多化学知识,下列说法不正确的是
A.为让汤底更加浓郁、颜色更佳、口感更好,需添加三聚磷酸、日落黄等添加剂和着色剂,以及鸡精、酱油、醋等调味剂
B.为保证菜品整体品质的稳定,延长保存时间,可添加抗坏血酸(即维生素C)等抗氧化剂,抗坏血酸发生还原反应
C.目前市面上的预制菜大多需经过高温蒸煮后方可食用,部分添加剂在高温情况下可能会发生二次化学反应,存在一定的食品安全风险
D.在规定范围内合理使用食品添加剂,对人体健康不会产生不良影响
二、多选题
14.阿司匹林(乙酰水杨酸)具有解热镇痛的作用,是家中常备药,其合成原理如图所示:
下列说法错误的是
A.阿司匹林的分子式为,该药物属于OTC药物可以长期服用
B.水杨酸可以发生酯化反应、加成反应
C.可以用碳酸氢钠溶液区别水杨酸和阿司匹林
D.阿司匹林与布洛芬(退烧)药物不能同时服用
15.毒品大麻的结构简式为,下列有关大麻的说法错误的是
A.青少年好奇心强,偶尔吸食一点,很快就会提神,学习效率高
B.大麻分子中含两种官能团
C.大麻能使酸性KMnO4溶液褪色
D.1mol大麻可以和足量单质钠反应生成1mol氢气
三、解答题
16.食品添加剂的常见类别有:着色剂、增味剂、膨松剂、凝固剂、防腐剂、营养强化剂等。
(1)碘酸钾为 (填食品添加剂的类别)。
(2)从海带中提取碘的主要实验过程如下图所示:
①干海带的“灼烧”需在 (填仪器名称)中进行。
②操作1为 (填操作名称)。
③在“氧化”步骤中,最符合绿色化学思想的氧化剂是下列物质中的 (填选项字母),酸性条件下该反应的离子方程式为 。
A.溶液 B.浓硝酸 C.
④检验操作2后水层中是否含有碘单质的方法为 。
(3)在加热条件下,将通入到和的混合溶液中制备,该反应的化学方程式为 ;若要制备500g的加碘食盐(碘含量为2.54%),至少需要 g。
17.三氧化二铋(Bi2O3)是黄色不溶于水的固体,俗称铋黄,可用于制作黄色颜料、耐火纸等。利用含铋废料(还含Cu、Pb、Zn的硫酸盐及CuS、Fe2O3)制备Bi2O3流程如下:
(1)“酸浸”后的固体中除含铋的化合物、CuS外,还含有 ;料液中含有多种成分,向料液中加入过量锌粉并充分搅拌,过滤后,滤液经过 冷却结晶、过滤、洗涤、干燥即可制得ZnSO4·7H2O。
(2)“溶铜”时,试剂X可以是多种物质,分别使用O2、H2O2、MnO2三种氧化剂,氧化等物质的量同一种还原剂时,且得到相同氧化产物,消耗这三种氧化剂物质的量之比为 (MnO2转化为Mn2+);写出X为O2时,“溶铜”CuS反应的离子方程式: 。
(3)其他条件相同时,溶液中c(Cl-)越大,铋的溶出率越大,仅从原料成本角度考虑,试剂Y是 。
(4)写出“制备”步骤生成铋黄的离子方程式: 。
18.海水是巨大的资源宝库,从海水中提取溴和碘的过程如下。
(1)某化学小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置。
①图中仪器B的名称是 ,冷却水的出口为 。(填“甲”或“乙”)
②C中液体的颜色为 。
③D装置中NaOH溶液的作用是 。
(2)如图是工业上从海水中提取镁的简单流程。
①工业上常用于沉淀Mg2+的试剂A是 。
②电解熔融的无水氯化镁所得的镁蒸汽在特定的环中冷却后即为固体镁。下列物质中可以用作镁蒸汽的冷却剂的是 。(填字母)
A.Ar B.CO2 C.氮气 D.O2 E.水蒸气
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如图所示。
①灼烧海带时所用的主要仪器名称是 。
②向酸化的滤液中加H2O2溶液,写出该反应的离子方程式 。
②向酸化的滤液应该再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈 色。
19.几年前,央视《每周质量报告》曝光河北一些企业,用生石灰处理皮革废料,熬制成工业明胶,卖给绍兴新昌一些企业制成药用胶囊,国家相关部门得到消息后要求立即暂停购入和使用相关企业生产的所有胶囊剂药品。皮革废料发生水解后得到一种被称为脯氨酸()的有机物,脯氨酸是人体所需的氨基酸之一,工业上可用α-氨基戊二酸合成,其合成路线如下:
(1)α-氨基戊二酸中含有的官能团名称为 。
(2)反应①的反应类型为 。
(3)反应可看作两步,其中间产物的分子式为,且结构中含有五元环。写出由B反应生成中间产物的化学方程式: 。
(4)合成路线中设计反应③、④的目的是 。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.C
【详解】食盐的主要成分是氯化钠,其化学式为NaCl,故选C。
2.B
【详解】A.人体所含的微量元素,应适量补充,过多或过少都会对人体产生不适,A错误;
B.甲醛有毒,所以不能食用甲醛浸泡过的海产品,B正确;
C.因为CO不溶于水,所以在炉火旁放一盆清水不能防止一氧化碳中毒,C错误;
D.“化水为油”是不能实现的,D错误;
故选B。
3.C
【详解】
A.铝具有较低的密度,且其合金的强度较大,可以用来制作航空航天材料,A错误;
B.无水硫酸铜能够与水结合形成蓝色晶体,因此常常检测水的存在,B错误;
C.二氧化硫在控制用量前提下,可以作食品添加剂,如葡萄酒中添加少量二氧化硫,起到调节酸度、杀菌、抗氧化等作用,C正确;
D.氨容易液化,且液氨汽化时吸收大量的热从而使周围温度降低,因此,液氨可以用作制冷剂,D错误;
故选C。
4.A
【详解】A.铝中加入等制成合金,可以增强材料的强度,A错误;
B.奶粉中加入碳酸钙、硫酸锌等,可以补充钙、锌等元素,强化营养,B正确;
C.在聚乙炔塑料中掺杂,可以增强导电性,C正确;
D.用Al、O部分取代中的Si、N,可以制作LED发光材料,D正确;
综上所述,选A。
5.A
【详解】A.维生素C具有还原性,在食品中添加适量维生素C可以防止食品氧化,延长食品的保质期,A正确;
B.铁灼烧时火焰不变色,节日燃放的烟花是碱金属、锶等金属化合物焰色反应所呈现的色彩,B错误;
C.碳酸钠碱性较强,若用于治疗胃酸过多,对人体有害,应该使用碳酸氢钠,C错误;
D.同种元素组成的不同单质为同素异形体,和属于同素异形体,不是同位素,D错误;
故选A。
6.A
【详解】A.能与酸反应,可用于治疗胃酸过多,与碳酸氢钠易分解无关,A错误;
B.具有强氧化性,还原产物是氯离子,是一种绿色消毒剂,可用于自来水杀菌消毒,B正确;
C.维生素C具有还原性,因此可用作食品抗氧化剂,C正确;
D.过氧化钠具有强氧化性,能和水或二氧化碳反应产生氧气,溶于水具有漂白性,可作潜水艇中的供氧剂,D正确;
答案选A。
7.A
【详解】A.由题干信息可知,古代煅制自然铜时因会产生有毒有害的气体SO2,故应在通风环境中进行,A正确;
B. 锻制过程是FeS2与O2反应生成Fe2O3和SO2,即Fe由+2价转化为+3价,S由-1价转化为+4价,故煅制过程中1 mol FeS2被完全氧化,转移电子的数目约为,B错误;
C.自然铜淬火过程中即Fe2O3与醋酸反应,故发生反应的离子方程式为,C错误;
D.处方药的标识为 “R”,OTC为非处方药的标识,即含自然铜成分的中成药大七厘散(处方药),其包装上有“R”标识,D错误;
故答案为:A。
8.A
【详解】A.生石灰是氧化钙,其化学式为CaO,属于碱性氧化物,A不正确;
B.生石灰可与水反应生成氢氧化钙,故可防止食品受潮,B正确;
C.从类别角度看,生石灰属于碱性氧化物,可与稀盐酸、等发生反应,C正确;
D.浓硫酸具有吸水性,也是重要的干燥剂,D正确;
答案选A。
9.D
【详解】A.发霉的食物即使洗了,也可能还存在有害物质,食用后会导致身体不适、中毒等症状,A不符合题意;
B.碳酸饮料中含有磷酸,摄入到人体内可形成难溶的磷酸钙而影响人体对钙元素的吸收,B不符合题意;
C.食用铁强化酱油可以补铁,但不是越多越好,每天食用为宜,C不符合题意;
D.新鲜的蔬菜和水果中富含维生素,食用蔬菜和水果能摄取维生素,有利于人体健康,D符合题意;
故选D。
10.D
【详解】A.葡萄糖、果糖属于单糖,蔗糖属于二糖,A不正确;
B.易溶于水或盐酸的重金属盐能使蛋白质变性,钡餐的主要成分为硫酸钡,它难溶于水,不能被人体吸收,所以吞服“钡餐”不会引起中毒,B不正确;
C.亚硝酸钠是常用的防腐剂,但对人体有害,使用时需严格控制用量,C不正确;
D.虽然药物可以帮助我们战胜疾病,但通常药物都具有一定的毒性,使用时需要在医生的指导下合理用药,D正确;
故选D。
11.B
【详解】A.生石灰只能吸收水分,无法除去氧气,不能防止食品氧化变质,A错误;
B.稀土元素加入钢中可以增加钢的塑性、韧性、耐磨性等,B正确;
C.碳纳米管与石墨烯为碳元素的不同单质,互为同素异形体,C错误;
D.家庭厨卫所用的固体管道疏松剂主要成分有NaOH和铝粉,D错误;
答案选B。
12.C
【详解】A.在金属元素中,有一类性质相似、并在自然界共生在一起的稀土元素,稀土元素既可以单独使用,也可以用于生产合金,在合金中加入适量稀土元素,能大大改善合金的性能,因而稀土元素又被称为“冶金工业的维生素”,A正确;
B.胃舒平中含有氢氧化铝,可以和胃酸(主要成分为盐酸)发生反应,B正确;
C.二硫化钼属于无机物,不属于新型有机功能材料,属于新型无机非金属材料,C错误;
D.屠呦呦使用乙醚提取青蒿中的青蒿素,荣获诺贝尔生理学或医学奖,D正确;
故选:C。
13.B
【详解】A.为让汤底更加浓郁、颜色更佳、口感更好,需适量添加三聚磷酸、日落黄等添加剂和着色剂,以及鸡精、酱油、醋等调味剂,故A正确;
B.抗坏血酸(即维生素C)等抗氧化剂,抗坏血酸具有还原性,发生氧化反应,故B错误;
C.目前市面上的预制菜大多需经过高温蒸煮后方可食用,部分添加剂在高温情况下可能会发生二次化学反应,存在一定的食品安全风险,故C正确;
D.在规定范围内合理使用食品添加剂,对人体健康不会产生不良影响,故D正确;
故选B。
14.AC
【详解】A.阿司匹林的分子式为,该药物属于OTC药物,仍需在医生指导下进行服用,不可以长期服用,故A错误;
B.水杨酸苯环可以与氢气发生加成反应,羧基可以发生酯化反应,故B正确;
C.水杨酸和阿司匹林均含有羧基,与碳酸氢钠溶液均能产生二氧化碳气体,不能用于区别二者,故C错误;
D.阿司匹林与布洛芬(退烧)两者都有解热镇痛的效果,故药物不能同时服用,故D正确。
答案为:AC。
15.AD
【解析】略
16.(1)营养强化剂
(2) 坩埚 过滤 C H2O2+2I-+2H+=I2+2H2O 在水层中滴加淀粉溶液,若溶液变蓝,说明还有碘单质,反之则没有
(3) I2+5Cl2+12KOH=2KIO3+10KCl+6H2O 17.75
【分析】海带经灼烧,将其中的有机物转变成气体,所含碘元素转变成盐,得到海带灰浸泡,操作1为过滤,除去不溶物得到含碘离子的水溶液,在溶液中加双氧水氧化碘离子得到含碘单质的水溶液,再加四氯化碳或苯能有机溶剂萃取出碘单质,操作2为萃取分液,得到碘的有机溶液,再蒸馏得到碘单质。
【详解】(1)碘酸钾添加在食盐中,能起到补充碘元素的作用,因此碘酸钾为营养强化剂;
(2)①干海带灼烧,需要在坩埚中进行;
②根据分析,操作1为过滤;
③ A.KMnO4被还原为Mn2+,引入杂质,不符合绿色化学思想,A不符合题意;
B.浓HNO3被还原为NO2,有毒,不符合绿色化学思想,B不符合题意;
C.H2O2还原为H2O,无污染,符合绿色化学思想,C符合题意;
故选C;
H2O2、I-在酸性条件下反应生成I2和H2O,方程式为H2O2+2I-+2H+=I2+2H2O;
④淀粉遇碘单质会变蓝,可以用淀粉检验碘单质,在水层中滴加淀粉溶液,若溶液变蓝,说明还有碘单质,反之则没有;
(3)将Cl2通入到I2和KOH的混合溶液中生成KIO3、KCl和H2O,方程式为I2+5Cl2+12KOH=2KIO3+10KCl+6H2O;500g的加碘食盐(碘含量为2.54%)中m(I)=500g×2.54%=12.7g,n(I)= =0.1mol,n(I2)=0.05mol,n(Cl2)=5n(I2)=0.25mol,m(Cl2)=0.25mol×71g/mol=17.75g。
17. PbSO4 蒸发浓缩 1:2:2 2CuS+O2+4H+=2Cu2++2H2O+2S↓ NaCl 2BiOCl+2OH-=Bi2O3+2Cl-+H2O
【分析】由题干信息可知,含铋废料(还含Cu、Pb、Zn的硫酸盐及CuS、Fe2O3),故“酸浸”步骤发生的主要反应有:Zn+H2SO4=ZnSO4+H2↑、Pb+H2SO4=PbSO4↓+H2↑、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Cu+ Fe2(SO4)3=CuSO4+2FeSO4,过滤后固体为CuS、PbSO4和含铋的化合物,料液中主要有H+、Cu2+、Fe2+等阳离子,加入过量锌粉后,将置换出Cu和Fe,剩下硫酸锌溶液,然后蒸发浓缩、冷却结晶,过滤洗涤干燥得硫酸锌晶体,“溶铜”步骤中主要是将CuS转化为Cu2+和S,“溶铋”步骤中是将铋转化为可溶性的氯化物,通过调节溶液的pH将铋转化为BiOCl沉淀,再与浓的NaOH溶液反应生成铋黄,据此分析解题。
【详解】(1)由分析可知,“酸浸”后的固体中除含铋的化合物、CuS外,还含有PbSO4;料液中含有多种成分,向料液中加入过量锌粉并充分搅拌,过滤后,滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥即可制得ZnSO4·7H2O,故答案为:PbSO4;蒸发浓缩;
(2)“溶铜”时,试剂X可以是多种物质,分别使用O2、H2O2、MnO2三种氧化剂,氧化等物质的量同一种还原剂时,且得到相同氧化产物,故三种氧化剂得到的电子数目相等,故有4n(O2)=2n(H2O2)=2n(MnO2),消耗这三种氧化剂物质的量之比为1:2:2,根据流程图可知, X为O2时,“溶铜”CuS反应生成S、硫酸铜和水,故该反应的离子方程式为:2CuS+O2+4H+=2Cu2++2H2O+2S↓,故答案为:1:2:2;2CuS+O2+4H+=2Cu2++2H2O+2S↓;
(3)其他条件相同时,溶液中c(Cl-)越大,铋的溶出率越大,仅从原料成本角度考虑,NaCl是一种原料丰富,容易获得的化学物质,且能增大溶液中c(Cl-),故试剂Y是NaCl,故答案为:NaCl;
(4)由题干流程图可知,“制备”步骤是BiOCl与浓的NaOH溶液加热生成铋黄、NaCl和水,故该反应的离子方程式为:2BiOCl+2OH-=Bi2O3+2Cl-+H2O,故答案为:2BiOCl+2OH-=Bi2O3+2Cl-+H2O。
18. 直形冷凝管 甲 深红棕色或红棕色 吸收尾气,防止污染环境 Ca(OH)2 A 坩埚、酒精灯、泥三角、三脚架 2H++2I-+H2O2=I2+2H2O 紫红
【分析】本题通过三组实验分别从海水中提取溴、镁、碘,第一组实验为工业溴的提纯实验,因为溴是一种极易挥发的液体,故在热水浴中可以将溴挥发出来,通过冷凝管的冷凝作用将纯净的溴收集起来,达到提纯的效果;第二组实验为海水提镁实验,向海水中加入氢氧化钙溶液将海水中的镁提取出来,后经过盐酸的溶解、蒸发得到固体氯化镁,通过电解熔融的氯化镁得到纯净的镁,在电解过程中需通入惰性气体以保护镁不被氧化;第三组实验为海带提碘实验,将干海带灼烧呈灰后加水溶解,含有碘的物质就转移到溶液中,向溶液中加入少量酸化过的过氧化氢,碘离子可以与酸化的过氧化氢反应生成碘单质,在通过萃取的方式将单质提纯,即得到纯净的碘单质。
【详解】(1)①图中仪器B的名称是直形冷凝管,为达到较好的冷凝效果,采用逆流原理,冷却水的出口为甲,故答案为:直形冷凝管;甲;
②由题中信息可知,C中液体为液态溴,颜色为深红棕色或红棕色,故答案为:深红棕色或红棕色;
③溴有毒性和强腐蚀性,D装置中NaOH溶液的作用是吸收尾气,防止污染环境,故答案为:吸收尾气,防止污染环境;
(2)①石灰乳便宜易得,则工业上常用于沉淀Mg2+的试剂A是Ca(OH)2,故答案为:Ca(OH)2;
②电解熔融的无水氯化镁所得的镁蒸汽在特定的环境中冷却后即为固体镁,Mg与二氧化碳、氮气、氧气、水蒸气均反应,只有Ar可以用作镁蒸汽的冷却剂,故答案为:A;
(3)①灼烧海带时所用的主要仪器名称是坩埚、酒精灯、泥三角、三脚架,故答案为:坩埚、酒精灯、泥三角、三脚架;
②向酸化的滤液中加H2O2溶液,碘离子被氧化为碘单质,该反应的离子方程式为2H++2I-+H2O2=I2+2H2O,故答案为:2H++2I-+H2O2=I2+2H2O;
②酸化的滤液中含有碘,碘易溶于有机溶剂,向滤液中再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈紫红色,故答案为:紫红。
19. 氨基和羧基 取代(或酯化)反应 →+CH3CH2OH 提纯脯氨酸
【分析】根据合成路线分析可知,物质A与乙醇在浓硫酸加热的条件下发生酯化反应,生成物质B,B在经过一系列反应得到C(脯氨酸),再经过③④两个过程对脯氨酸进行除杂提纯,从而得到纯净的脯氨酸,据此结合题干可分析解答问题。
【详解】(1)根据α-氨基戊二酸的结构简式可知,该有机物中含有(氨基)和(羧基)两种官能团,故答案为:氨基和羧基;
(2)反应①是物质A与乙醇在浓硫酸加热的条件下发生酯化反应,生成物质B,反应类型为取代(或酯化)反应,故答案为:取代(或酯化)反应;
(3)反应可看作两步,其中间产物的分子式为,且结构中含有五元环,则中间产物的结构简式为,故答案为:→+CH3CH2OH;
(4)合成路线中设计的反应③是五氯酚与脯氨酸反应,反应④是反应③生成的产物脱去五氯酚,故反应③④的目的是提纯脯氨酸,故答案为:提纯脯氨酸。
【点睛】本题的难点是(3),对照分子式可知另一生成物是C2H5OH。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
