3.1认识有机化合物(共49张PPT) 化学鲁科版(2019)必修第二册
文档属性
| 名称 | 3.1认识有机化合物(共49张PPT) 化学鲁科版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 21.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-12 23:22:36 | ||
图片预览






文档简介
(共49张PPT)
第3章 简单的有机化合物
第1节 认识有机化合物
04
02
03
01
学习
目标
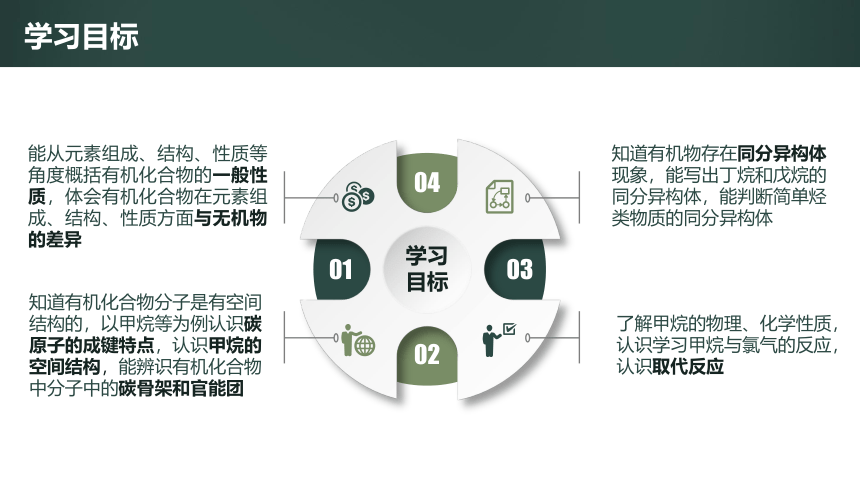
学习目标
知道有机化合物分子是有空间结构的,以甲烷等为例认识碳原子的成键特点,认识甲烷的空间结构,能辨识有机化合物中分子中的碳骨架和官能团
了解甲烷的物理、化学性质,认识学习甲烷与氯气的反应,认识取代反应
能从元素组成、结构、性质等角度概括有机化合物的一般性质,体会有机化合物在元素组成、结构、性质方面与无机物的差异
知道有机物存在同分异构体现象,能写出丁烷和戊烷的同分异构体,能判断简单烃类物质的同分异构体
导入
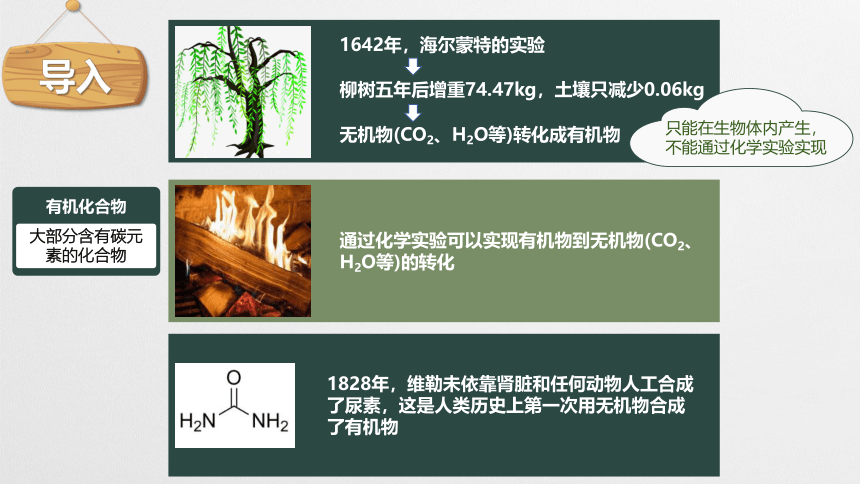
1642年,海尔蒙特的实验
柳树五年后增重74.47kg,土壤只减少0.06kg
无机物(CO2、H2O等)转化成有机物
只能在生物体内产生,不能通过化学实验实现
通过化学实验可以实现有机物到无机物(CO2、H2O等)的转化
1828年,维勒未依靠肾脏和任何动物人工合成了尿素,这是人类历史上第一次用无机物合成了有机物
大部分含有碳元素的化合物
有机化合物
1
有机物的通性
有机化合物
大多数含碳的化合物
碳、氢、氧、氮、硫、磷、卤素等
必备元素
CO、CO2、H2CO3、碳酸盐、碳酸氢盐、SiC、CaC2、HCN氢氰酸及其盐、HSCN硫氰酸及其盐等是无机物
目前,在自然界中发现的和由人工合成的有机物已达上亿种,有机物在食品、材料、能源、药物等领域都发挥着举足轻重的作用
有机物的应用是由它们的性质决定的,而性质是由结构决定的
结构
性质
应用
有机物的种类为何如此繁多?
它们的结构和性质具有哪些一般特点?
1
有机物的通性
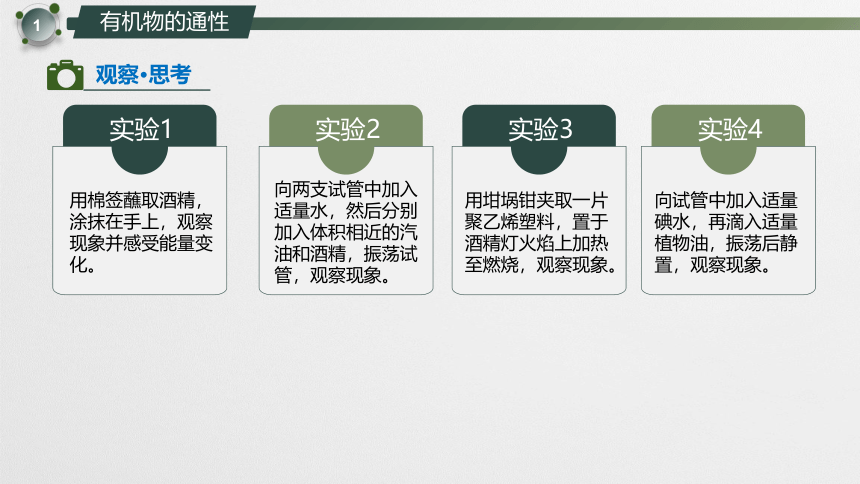
实验1
用棉签蘸取酒精,涂抹在手上,观察现象并感受能量变化。
实验2
向两支试管中加入适量水,然后分别加入体积相近的汽油和酒精,振荡试
管,观察现象。
实验3
用坩埚钳夹取一片聚乙烯塑料,置于酒精灯火焰上加热至燃烧,观察现象。
实验4
向试管中加入适量碘水,再滴入适量植物油,振荡后静置,观察现象。
观察·思考
1
有机物的通性
观察·思考
实验1 实验2 实验3 实验4
现象
结论
酒精逐渐消失,温度降低
汽油与水分层,汽油在上层;酒精与水互溶不分层
明亮火焰,冒黑烟
水层变为无色,植物油层变为紫红色
酒精易挥发
汽油密度小,不溶于水;酒精可以和水互溶
聚乙烯塑料易燃烧
碘更易容溶于植物油
这些实验对你认识有机物的性质有什么启示?
1
有机物的通性
大部分的有机物熔点比较低,且难溶于水,易溶于有机溶剂(乙醇、汽油、苯等)
大多数有机物容易燃烧,受热会发生分解
在挥发性、溶解性、热稳定等方面,有机物的性质具有很大差异
有机物的通性
相似相溶原理
还具有特性
1
有机物的通性
凡是含碳元素的化合物都属于有机化合物
易溶于汽油、酒精、苯等有机溶剂的物质一定是有机化合物
所有的有机化合物都很容易燃烧
有机物都无毒
有机物存在相似相溶原理
判断
思考
记号笔通常分水性和油性两种,二者所使用的颜料分别为无机颜料和有机颜料。使用时发现,水性笔书写在白板上的笔迹用湿抹布即可擦去,而油性笔的笔迹则需要用汽油等有机溶剂才能擦掉,试解释原因。
下列物质中,属于有机化合物的是 ______________
① H2S ② C2H2 ③ CH3Cl ④ C2H5OH ⑤ CH4
⑥ H2 ⑦ 金刚石 ⑧ CH3COOH ⑨ CO2 ⑩ C2H4
②③④⑤⑧⑩
√
×
×
×
×
1
有机物的通性
有机化合物
大多数含碳的化合物
碳、氢、氧、氮、硫、磷、卤素等
必备元素
CO、CO2、H2CO3、碳酸盐、碳酸氢盐、SiC、CaC2、HCN氢氰酸及其盐、HSCN硫氰酸及其盐等是无机物
目前,在自然界中发现的和由人工合成的有机物已达上亿种,有机物在食品、材料、能源、药物等领域都发挥着举足轻重的作用
有机物的应用是由它们的性质决定的,而性质是由结构决定的
结构
性质
应用
有机物的种类为何如此繁多?
它们的结构和性质具有哪些一般特点?
2
有机物中碳原子的结构及成键特点
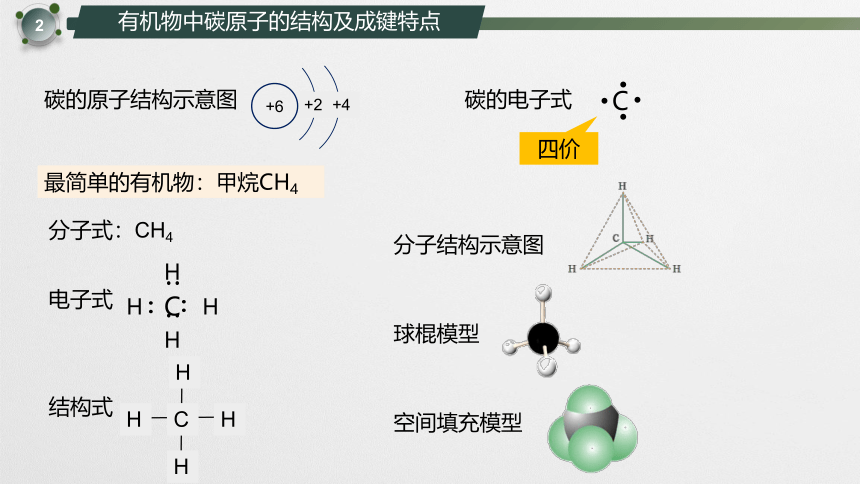
碳的原子结构示意图
+4
+2
+6
碳的电子式
·
·
·
·
C
最简单的有机物:甲烷CH4
四价
分子式:CH4
电子式
C
:
:
:
:
H
H
H
H
结构式
C
H
H
H
H
分子结构示意图
球棍模型
空间填充模型
2
有机物中碳原子的结构及成键特点
材料:下图显示的是4个碳原子相互结合的几种方式(黑球表示碳原子)
单键
直链
支链
C
C
碳碳双键
直链
支链
直链
碳碳三键
C
C
环状
先关注碳原子,搭建碳骨架,再按照“碳四价”原则,补充连接其他原子
C
C
碳原子所能形成的
共价键类型
链
状
2
有机物中碳原子的结构及成键特点
归纳
①碳原子所形成的共价键类型——单键、碳碳双键、碳碳三键
C
C
C
C
C
C
②多个碳原子可以相互结合成链状,也可以结合成环状,还可能带支链
③碳原子还可以和H、O、N、P、S、卤素等多种非金属原子形成共价键
2
有机物中碳原子的结构及成键特点
在有机化合物中,碳原子既可以与其他元素的原子形成共价键,也可以相互成键。两个碳原子之间可以形成的共价键的类型有________、_______和_______ ;多个碳原子可以相互结合,形成的碳骨架的类型有______ 和______
碳碳单键
碳碳双键
碳碳三键
链状
环状
在甲烷分子中,碳原子最外层的___个电子分别与4个氢原子形成___对___键。甲烷分子中的5个原子不在同一平面上,而是形成了________的 立体结构:碳原子位于中心, 氢原子位于四角,分子中的4个C-H的长度和强度_____,相互之间的夹角______,是________
4
4
共价
正四面体
相等
相等
109°28’
2
有机物中碳原子的结构及成键特点
下列关于甲烷的说法不正确的是
A.甲烷的电子式是
B.甲烷的结构式是
C.甲烷分子中C、H之间是离子键
D.甲烷分子中四个碳氢键C-H完全等同
C
:
:
:
:
H
H
H
H
C
H
H
H
H
共价键
C
2
有机物中碳原子的结构及成键特点
.用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构简式如图所示。
该物质的分子式是________
该物质的分子含有的单键为_____________,含有的双键为____________。
(用化学符号表示,如碳碳单键表示为“C-C”)
C-C、C-S、C-H
C6H4S4
C=C
甲烷
乙烷
丙烷
丁烷
2
有机物中碳原子的结构及成键特点
从所含元素、碳原子之间的结合方式、形成共价键角度、碳氢原子数、命名角度分析以下四种有机物的异同点
只含碳、氢两种元素
形成单键、碳原子一定连着四个原子(饱和)
通式:CnH2n+2
异丁烷
CH4
C2H6
C3H8
C4H10
烷烃
3
烃
烃
1.概念:只含有碳、氢两种元素的有机物
tàn
qīng
tīng
碳 + 氢 = 烃
直链或直链上有支链的饱和烷烃
环丙烷
环丁烷
环状饱和烷烃
通式:CnH2n
直链或直链上有支链的、含有碳碳双键的不饱和烷烃
烯烃
2.分类:
通式:CnH2n
直链或直链上有支链的、含有碳碳三键的不饱和烷烃
炔烃
通式:CnHn
通式:CnH2n+2
3
烃
烃
1.概念:只含有碳、氢两种元素的有机物
tàn
qīng
tīng
碳 + 氢 = 烃
2.分类:
烃
饱和烃
链状烷烃
环状烷烃
不饱和烃
烯烃
炔烃
芳香烃
甲烷CH4
乙烷C2H6/CH3CH3
环丁烷C4H8
乙烯CH2=CH2
丙烯CH2=CH-CH3
乙炔CH≡CH
丙炔CH≡C-CH3
苯
4
烷烃
1.概念:碳原子之间都以碳碳单键结合,剩余的价键均与H结合,使每个碳原子的化合价达到“饱和”的烃称为饱和烃,也称为烷烃
“饱和”碳原子的四个共价键分别连接__个原子
正丁烷
异丁烷
2.分类、结构特点、通式
烷烃
链状烷烃
环状烷烃
结构特点:链状、单键、饱和
通式:CnH2n+2(n≥1)
结构特点:环状、单键、饱和
通式:CnH2n (n≥3)
链状烷烃一定符合这个通式,符合这个通式的一定是链状烷烃
环状烷烃一定符合这个通式,符合这个通式的不一定是环状烷烃
4
4
烷烃
1.概念:碳原子之间都以碳碳单键结合,剩余的价键均与H结合,使每个碳原子的化合价达到“饱和”的烃称为饱和烃,也成为烷烃
正丁烷
异丁烷
3.命名
2.分类、结构特点、通式
(1)碳原子数n及表示
n≤10 1 2 3 4 5 6 7 8 9 10
甲 乙 丙 丁 戊 己 庚 辛 壬 癸
n>10 相应汉字数字 举例:C6H14命名为己烷,C18H38命名为十八烷
(2)碳原子数n相同,结构不同时,用正、异、新表示
像两种或多种化合物具有相同分子式,但具有不同结构的现象称为同分异构现象
4
烷烃
正丁烷
异丁烷
像两种或多种化合物具有相同分子式,但具有不同结构的现象称为同分异构现象
同分异构现象和同分异构体
而具有相同分子式而结构不同的化合物互称为同分异构体
例:正戊烷、异戊烷、新戊烷
CH3CH2CH2CH2CH3
CH3CH2CH2CH3
(CH3)3CH
CH3CH(CH3)CH2CH2CH3
C(CH3)4
同分异构体之间物理性质存在差异,支链越多,熔沸点越低
4
烷烃
正丁烷
同系物
CH3CH2CH2CH2CH3
CH3CH2CH2CH3
正戊烷
结构相似,在分子组成上相差一个或若干个CH2分子团的物质互称为同系物
正己烷
CH3CH2CH2CH2CH2CH3
CH3(CH2)4CH3
CH3(CH2)2CH3
CH3(CH2)3CH3
C4H10
C5H12
C6H14
同分异构体:C原子数与其他原子数都相同
同系物:分子组成上相差一个或若干个CH2
辨析
结构简式
分子式
4
烷烃
同分异构体:C原子数与其他原子数都相同
同系物:结构相似的基础上,分子组成上相差一个或若干个CH2
辨析
练习:1.下列物质中,互为同分异构体的是______,互为同系物的是 ______。
②④
①③④
2.这两种物质互为同分异构体还是同系物?
3.这两种物质互为同分异构体还是同系物?
4
该物质属于( )
A.烃 B.烷烃 C.有机化合物 D.无机物
下列有机物属于烃类的是( )
A.CH3CH2OH
B.
C.CH3CH3
D.CH3COOCH2CH3
以下有机物是链状烷烃的是( )
A.CH3OH B.CH2=CH2 C. D.
烷烃
C
C
C
小结
有机物中碳原子的成键特点
概念
结构特点/通式
命名
同分异构体
同系物
成键数目
成键类型
碳骨架类型
烷烃
每个碳原子形成4个共价键
认识有机物
单键、双键、三键
链状、环状
甲烷
5
CH4——天然气、沼气、煤层气的主要成分
天然气
沼气
煤层气
结合生活经验和有关知识,想一想甲烷可能具有哪些性质?
甲烷
5
一、CH4的物理性质
无色、无味、难溶于水的气体
* 烷烃物理性质递变规律
名称 分子式 常温下的状态 熔点/℃ 沸点/℃ 相对密度(以水为1) 水溶性
甲烷 CH4 气 -182 -164 0.466 不溶于水
乙烷 C2H6 气 - -88.6 0.572 不溶于水
丙烷 C3H8 气 - -42.1 - 不溶于水
丁烷 C4H10 气 -138.4 -0.5 0.579 不溶于水
戊烷 C5H12 液 -130 36.1 0.626 不溶于水
十七烷 C17H36 固 22 301.8 0.778 不溶于水
状态:碳原子数≤4的烷烃常温下为气态
熔沸点:随碳原子数增加,熔沸点升高
密度:随碳原子数增加,相对密度逐渐增加,但始终小于水的密度
溶解性:均不溶于水,易溶于有机溶剂(相似相溶原理)
甲烷
5
二、CH4的化学性质
1.燃烧(氧化反应)
CH4+2O2
点燃
天然气灶
CO2+2H2O
现象:甲烷安静地燃烧,火焰呈淡蓝色,放出大量的热
反应方程式:
注意:甲烷点燃前要验纯
有机反应式用箭头
相同条件下,同体积甲烷、氢气、一氧化碳燃烧,甲烷放出的热更多
甲烷
5
二、CH4的化学性质
1.燃烧(氧化反应)
2.稳定性:通常情况下很稳定,不与强酸、强碱、酸性高锰酸钾反应
3.取代反应:与Cl2
[实验]取两支含有CH4和Cl2混合气体的两支试管,分别用铁架台固定好。将其中一支试管用铝箔套上,另一支试管放在光亮处。静置,比较两支试管内的现象。
[现象]在室温下,甲烷与氯气的混合气体:
无光照时:不发生反应
光照时:
试管内水面上升
试管内气体颜色逐渐变浅
试管壁出现油状液滴
试管内出现白雾
气体体积减小
产物难溶于水
氯气发生反应
甲烷
5
生成的一氯甲烷在常温下是气体,可与氯气进一步反应,依次又生成了二氯甲烷、三氯甲烷(氯仿)和四氯甲烷(四氯化碳CCl4)。
甲烷和氯气在光照下的分步反应过程
[分析]甲烷中的一个氢原子被氯原子取代,形成一氯甲烷
二氯甲烷、四氯化碳CCl4是常用的有机溶剂,三氯甲烷曾被用作外科手术的麻醉剂。
甲烷
5
二、CH4的化学性质
1.燃烧(氧化反应)
2.稳定性:通常情况下很稳定,不与强酸、强碱、酸性高锰酸钾反应
3.取代反应:与Cl2
有机化合物参加的反应往往比较复杂,常有副反应发生。因此,有机化学反应的方程式中,常用“→ ”代替“ =”。
CH4+Cl2
CH3Cl+HCl
光照
CH3Cl+Cl2
CH2Cl2+HCl
光照
CH2Cl2+Cl2
CHCl3+HCl
光照
CHCl3+Cl2
CCl4+HCl
光照
上述反应中,甲烷分子中的氢原子被氯原子取代。像这样,有机化合物分子里的某些原子(或原子团)被其他原子(或原子团)取代的反应叫作取代反应
甲烷
5
1.燃烧(氧化反应)
2.稳定性:通常情况下很稳定,不与强酸、强碱、酸性高锰酸钾反应
3.取代反应:与Cl2(光照条件下)
烷烃
性质
甲烷
状态:碳原子数≤4的烷烃常温下为气态
熔沸点:碳原子数越多,熔沸点越高,越易液化
密度:碳原子数增加,相对密度逐渐增加,但始终小于水的密度
溶解性:均不溶于水,易溶于有机溶剂(相似相溶原理)
物理性质
化学性质
甲烷
5
练一练
1.下列反应属于取代反应的是( )
A.CH4
C+2H2
高温
B.2HI+Cl2 = 2HCl+I2
C.CH4+2O2
点燃
CO2+2H2O
D.C2H6+Cl2
C2H5Cl+HCl
光
取代反应定义:有机物分子里的某些原子被其他原子取代的反应叫作取代反应
烷烃的取代反应条件:与Cl2(光照条件下)
甲烷
5
练一练
2.关于CH4和Cl2的反应(如图所示)叙述不正确的是( )
A.该反应属于取代反应
B.该反应的条件是光照
C.该反应的生成物有四种
D.该反应的现象是试管内水面上升,气体颜色逐渐变浅,试管壁出现油状液滴,试管内出现白雾
×
CH4+Cl2
CH3Cl+HCl
光照
CH3Cl+Cl2
CH2Cl2+HCl
光照
CH2Cl2+Cl2
CHCl3+HCl
光照
CHCl3+Cl2
CCl4+HCl
光照
产物4+1=5种
甲烷
5
练一练
3.下列各图均能表示甲烷的分子结构,其中能反应其真实存在状况的是
A.结构示意图
C.球棍模型
D.空间填充模型
B.电子式
C
:
:
:
:
H
H
H
H
甲烷
5
练一练
4.在一定条件下,下列物质可与甲烷发生反应的是
A.浓硫酸
B.Cl2
C.氢氧化钠溶液
D.酸性高锰酸钾溶液
甲烷
5
练一练
5.若甲烷与氯气以物质的量比1:1混合,在光照下得到的产物有( )①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4 ⑤HCl
A.只有①
B.①②③④⑤的混合物
C.①②③④的混合物
D.只有①②
甲烷
5
练一练
6.(多选)打火机所采用燃料有丙烷和丁烷,下列有关它们的叙述不正确的是
A.光照下能与氯气发生取代反应
B.丙烷比丁烷更易液化
C.它们都是清洁燃料
D.都能使酸性高锰酸钾溶液褪色
×
×
含碳原子数越多越易液化
官能团及烃的衍生物
6
已知白醋中的乙酸(俗称醋酸)、柠檬汁中的柠檬酸均能表现出酸性,而乙醇不具有酸性,分析乙酸、柠檬酸和乙醇的结构简式,推断乙酸、柠檬酸分子中能使其表现出酸性的原子或原子团。
乙酸
柠檬酸
乙醇
结构
性质
物质的结构决定物质的性质。乙酸和柠檬酸分子均含有特殊的原子团——羧基( COOH),正是羧基决定了这两种物质均具有酸性。
有机化合物分子中,像羧基这样,比较活泼、容易发生反应并决定着某类有机化合物共同特性的原子或原子团称为官能团
羧基( COOH)
官能团及烃的衍生物
6
官能团:决定着某类有机化合物共同特性的原子或原子团
物质类别 官能团 代表物
结构式 名称 烃 烷烃 无官能团 -
烯烃
炔烃
芳香烃 无官能团
C
C
C
C
碳碳双键
碳碳三键
CH2=CH2
CH2≡CH2
苯
烃:只含碳、氢两种元素的有机物
烃的衍生物:含有除碳、氢之外的元素原子的有机物
乙烯
乙炔
官能团及烃的衍生物
6
官能团:决定着某类有机化合物共同特性的原子或原子团
物质类别 官能团 代表物
结构式 名称 烃 的 衍 生 物 醇
酸
酯
卤代烃
烃:只含碳、氢两种元素的有机物
烃的衍生物:含有除碳、氢之外的元素原子的有机物
—OH
羟基
乙醇CH3CH2OH
—COOH
羧基
乙酸CH3COOH
CH3─C─O─H
O=
─C─O─R
O=
酯基
乙酸乙酯
CH3COOC2H5
CH3─C─O─C2H5
O=
─C─X
┃
┃
碳卤键(X代表卤素原子F、Cl、Br、I)
CH3Cl
可以把烃的衍生物看成烃基和官能团互相结合而成的
官能团及烃的衍生物
6
官能团:决定着某类有机化合物共同特性的原子或原子团
练一练:生产和生活中许多有重要用途的有机化合物结构较复杂,它们的分子含有一些常见官能团。请标示出下列有机化合物分子中的官能团并写出其名称。
乳酸
顺丁橡胶
甘油
官能团名称:
羟基、羧基
碳碳双键
羟基
官能团名称:
碳碳双键、酯基
官能团及烃的衍生物
6
官能团:决定着某类有机化合物共同特性的原子或原子团
练一练:请说出以下物质中可能含有的官能团名称
官能团名称:
羟基
碳碳三键
羟基
木糖醇 鲸蜡醇 丙烯醇 丁炔醇
羟基
碳碳双键羟基
官能团及烃的衍生物
6
官能团:决定着某类有机化合物共同特性的原子或原子团
小结
碳碳双键
碳碳三键
C
C
C
C
—OH
─C─O─H
O=
─C─O─R
O=
烃:只含碳、氢两种元素的有机物
烃的衍生物:含有除碳、氢元素之外的有机物
羟基
羧基
酯基
概括·整合
有机物的分子结构
有机物的性质
有机物的应用
官能团
碳骨架
有机物的多样性
碳原子的成键特点
同系物
同分异构体
决定
决定
本课结束
第3章 简单的有机化合物
第1节 认识有机化合物
04
02
03
01
学习
目标
学习目标
知道有机化合物分子是有空间结构的,以甲烷等为例认识碳原子的成键特点,认识甲烷的空间结构,能辨识有机化合物中分子中的碳骨架和官能团
了解甲烷的物理、化学性质,认识学习甲烷与氯气的反应,认识取代反应
能从元素组成、结构、性质等角度概括有机化合物的一般性质,体会有机化合物在元素组成、结构、性质方面与无机物的差异
知道有机物存在同分异构体现象,能写出丁烷和戊烷的同分异构体,能判断简单烃类物质的同分异构体
导入
1642年,海尔蒙特的实验
柳树五年后增重74.47kg,土壤只减少0.06kg
无机物(CO2、H2O等)转化成有机物
只能在生物体内产生,不能通过化学实验实现
通过化学实验可以实现有机物到无机物(CO2、H2O等)的转化
1828年,维勒未依靠肾脏和任何动物人工合成了尿素,这是人类历史上第一次用无机物合成了有机物
大部分含有碳元素的化合物
有机化合物
1
有机物的通性
有机化合物
大多数含碳的化合物
碳、氢、氧、氮、硫、磷、卤素等
必备元素
CO、CO2、H2CO3、碳酸盐、碳酸氢盐、SiC、CaC2、HCN氢氰酸及其盐、HSCN硫氰酸及其盐等是无机物
目前,在自然界中发现的和由人工合成的有机物已达上亿种,有机物在食品、材料、能源、药物等领域都发挥着举足轻重的作用
有机物的应用是由它们的性质决定的,而性质是由结构决定的
结构
性质
应用
有机物的种类为何如此繁多?
它们的结构和性质具有哪些一般特点?
1
有机物的通性
实验1
用棉签蘸取酒精,涂抹在手上,观察现象并感受能量变化。
实验2
向两支试管中加入适量水,然后分别加入体积相近的汽油和酒精,振荡试
管,观察现象。
实验3
用坩埚钳夹取一片聚乙烯塑料,置于酒精灯火焰上加热至燃烧,观察现象。
实验4
向试管中加入适量碘水,再滴入适量植物油,振荡后静置,观察现象。
观察·思考
1
有机物的通性
观察·思考
实验1 实验2 实验3 实验4
现象
结论
酒精逐渐消失,温度降低
汽油与水分层,汽油在上层;酒精与水互溶不分层
明亮火焰,冒黑烟
水层变为无色,植物油层变为紫红色
酒精易挥发
汽油密度小,不溶于水;酒精可以和水互溶
聚乙烯塑料易燃烧
碘更易容溶于植物油
这些实验对你认识有机物的性质有什么启示?
1
有机物的通性
大部分的有机物熔点比较低,且难溶于水,易溶于有机溶剂(乙醇、汽油、苯等)
大多数有机物容易燃烧,受热会发生分解
在挥发性、溶解性、热稳定等方面,有机物的性质具有很大差异
有机物的通性
相似相溶原理
还具有特性
1
有机物的通性
凡是含碳元素的化合物都属于有机化合物
易溶于汽油、酒精、苯等有机溶剂的物质一定是有机化合物
所有的有机化合物都很容易燃烧
有机物都无毒
有机物存在相似相溶原理
判断
思考
记号笔通常分水性和油性两种,二者所使用的颜料分别为无机颜料和有机颜料。使用时发现,水性笔书写在白板上的笔迹用湿抹布即可擦去,而油性笔的笔迹则需要用汽油等有机溶剂才能擦掉,试解释原因。
下列物质中,属于有机化合物的是 ______________
① H2S ② C2H2 ③ CH3Cl ④ C2H5OH ⑤ CH4
⑥ H2 ⑦ 金刚石 ⑧ CH3COOH ⑨ CO2 ⑩ C2H4
②③④⑤⑧⑩
√
×
×
×
×
1
有机物的通性
有机化合物
大多数含碳的化合物
碳、氢、氧、氮、硫、磷、卤素等
必备元素
CO、CO2、H2CO3、碳酸盐、碳酸氢盐、SiC、CaC2、HCN氢氰酸及其盐、HSCN硫氰酸及其盐等是无机物
目前,在自然界中发现的和由人工合成的有机物已达上亿种,有机物在食品、材料、能源、药物等领域都发挥着举足轻重的作用
有机物的应用是由它们的性质决定的,而性质是由结构决定的
结构
性质
应用
有机物的种类为何如此繁多?
它们的结构和性质具有哪些一般特点?
2
有机物中碳原子的结构及成键特点
碳的原子结构示意图
+4
+2
+6
碳的电子式
·
·
·
·
C
最简单的有机物:甲烷CH4
四价
分子式:CH4
电子式
C
:
:
:
:
H
H
H
H
结构式
C
H
H
H
H
分子结构示意图
球棍模型
空间填充模型
2
有机物中碳原子的结构及成键特点
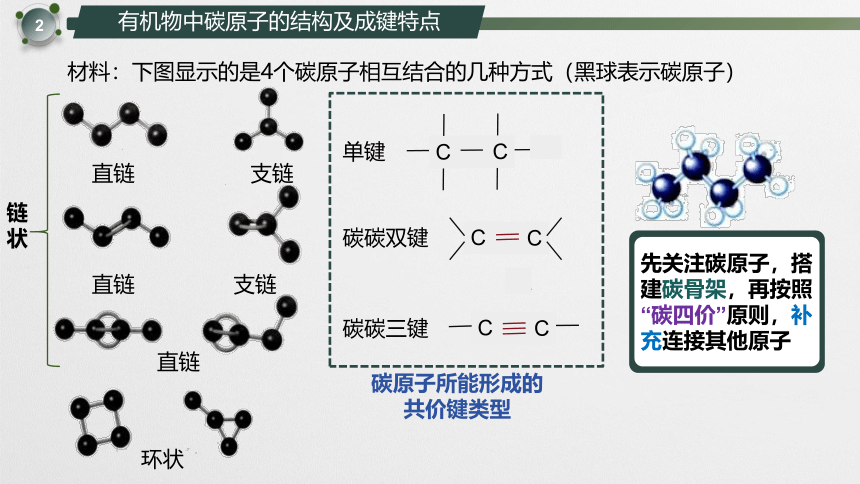
材料:下图显示的是4个碳原子相互结合的几种方式(黑球表示碳原子)
单键
直链
支链
C
C
碳碳双键
直链
支链
直链
碳碳三键
C
C
环状
先关注碳原子,搭建碳骨架,再按照“碳四价”原则,补充连接其他原子
C
C
碳原子所能形成的
共价键类型
链
状
2
有机物中碳原子的结构及成键特点
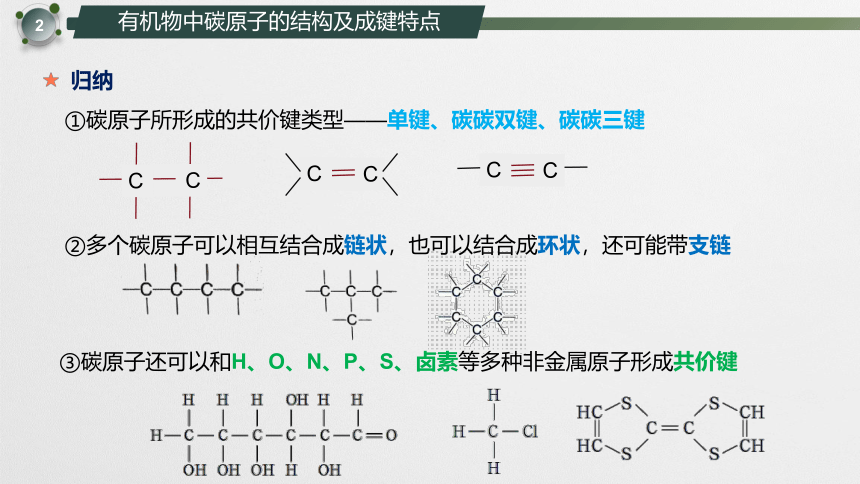
归纳
①碳原子所形成的共价键类型——单键、碳碳双键、碳碳三键
C
C
C
C
C
C
②多个碳原子可以相互结合成链状,也可以结合成环状,还可能带支链
③碳原子还可以和H、O、N、P、S、卤素等多种非金属原子形成共价键
2
有机物中碳原子的结构及成键特点
在有机化合物中,碳原子既可以与其他元素的原子形成共价键,也可以相互成键。两个碳原子之间可以形成的共价键的类型有________、_______和_______ ;多个碳原子可以相互结合,形成的碳骨架的类型有______ 和______
碳碳单键
碳碳双键
碳碳三键
链状
环状
在甲烷分子中,碳原子最外层的___个电子分别与4个氢原子形成___对___键。甲烷分子中的5个原子不在同一平面上,而是形成了________的 立体结构:碳原子位于中心, 氢原子位于四角,分子中的4个C-H的长度和强度_____,相互之间的夹角______,是________
4
4
共价
正四面体
相等
相等
109°28’
2
有机物中碳原子的结构及成键特点
下列关于甲烷的说法不正确的是
A.甲烷的电子式是
B.甲烷的结构式是
C.甲烷分子中C、H之间是离子键
D.甲烷分子中四个碳氢键C-H完全等同
C
:
:
:
:
H
H
H
H
C
H
H
H
H
共价键
C
2
有机物中碳原子的结构及成键特点
.用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构简式如图所示。
该物质的分子式是________
该物质的分子含有的单键为_____________,含有的双键为____________。
(用化学符号表示,如碳碳单键表示为“C-C”)
C-C、C-S、C-H
C6H4S4
C=C
甲烷
乙烷
丙烷
丁烷
2
有机物中碳原子的结构及成键特点
从所含元素、碳原子之间的结合方式、形成共价键角度、碳氢原子数、命名角度分析以下四种有机物的异同点
只含碳、氢两种元素
形成单键、碳原子一定连着四个原子(饱和)
通式:CnH2n+2
异丁烷
CH4
C2H6
C3H8
C4H10
烷烃
3
烃
烃
1.概念:只含有碳、氢两种元素的有机物
tàn
qīng
tīng
碳 + 氢 = 烃
直链或直链上有支链的饱和烷烃
环丙烷
环丁烷
环状饱和烷烃
通式:CnH2n
直链或直链上有支链的、含有碳碳双键的不饱和烷烃
烯烃
2.分类:
通式:CnH2n
直链或直链上有支链的、含有碳碳三键的不饱和烷烃
炔烃
通式:CnHn
通式:CnH2n+2
3
烃
烃
1.概念:只含有碳、氢两种元素的有机物
tàn
qīng
tīng
碳 + 氢 = 烃
2.分类:
烃
饱和烃
链状烷烃
环状烷烃
不饱和烃
烯烃
炔烃
芳香烃
甲烷CH4
乙烷C2H6/CH3CH3
环丁烷C4H8
乙烯CH2=CH2
丙烯CH2=CH-CH3
乙炔CH≡CH
丙炔CH≡C-CH3
苯
4
烷烃
1.概念:碳原子之间都以碳碳单键结合,剩余的价键均与H结合,使每个碳原子的化合价达到“饱和”的烃称为饱和烃,也称为烷烃
“饱和”碳原子的四个共价键分别连接__个原子
正丁烷
异丁烷
2.分类、结构特点、通式
烷烃
链状烷烃
环状烷烃
结构特点:链状、单键、饱和
通式:CnH2n+2(n≥1)
结构特点:环状、单键、饱和
通式:CnH2n (n≥3)
链状烷烃一定符合这个通式,符合这个通式的一定是链状烷烃
环状烷烃一定符合这个通式,符合这个通式的不一定是环状烷烃
4
4
烷烃
1.概念:碳原子之间都以碳碳单键结合,剩余的价键均与H结合,使每个碳原子的化合价达到“饱和”的烃称为饱和烃,也成为烷烃
正丁烷
异丁烷
3.命名
2.分类、结构特点、通式
(1)碳原子数n及表示
n≤10 1 2 3 4 5 6 7 8 9 10
甲 乙 丙 丁 戊 己 庚 辛 壬 癸
n>10 相应汉字数字 举例:C6H14命名为己烷,C18H38命名为十八烷
(2)碳原子数n相同,结构不同时,用正、异、新表示
像两种或多种化合物具有相同分子式,但具有不同结构的现象称为同分异构现象
4
烷烃
正丁烷
异丁烷
像两种或多种化合物具有相同分子式,但具有不同结构的现象称为同分异构现象
同分异构现象和同分异构体
而具有相同分子式而结构不同的化合物互称为同分异构体
例:正戊烷、异戊烷、新戊烷
CH3CH2CH2CH2CH3
CH3CH2CH2CH3
(CH3)3CH
CH3CH(CH3)CH2CH2CH3
C(CH3)4
同分异构体之间物理性质存在差异,支链越多,熔沸点越低
4
烷烃
正丁烷
同系物
CH3CH2CH2CH2CH3
CH3CH2CH2CH3
正戊烷
结构相似,在分子组成上相差一个或若干个CH2分子团的物质互称为同系物
正己烷
CH3CH2CH2CH2CH2CH3
CH3(CH2)4CH3
CH3(CH2)2CH3
CH3(CH2)3CH3
C4H10
C5H12
C6H14
同分异构体:C原子数与其他原子数都相同
同系物:分子组成上相差一个或若干个CH2
辨析
结构简式
分子式
4
烷烃
同分异构体:C原子数与其他原子数都相同
同系物:结构相似的基础上,分子组成上相差一个或若干个CH2
辨析
练习:1.下列物质中,互为同分异构体的是______,互为同系物的是 ______。
②④
①③④
2.这两种物质互为同分异构体还是同系物?
3.这两种物质互为同分异构体还是同系物?
4
该物质属于( )
A.烃 B.烷烃 C.有机化合物 D.无机物
下列有机物属于烃类的是( )
A.CH3CH2OH
B.
C.CH3CH3
D.CH3COOCH2CH3
以下有机物是链状烷烃的是( )
A.CH3OH B.CH2=CH2 C. D.
烷烃
C
C
C
小结
有机物中碳原子的成键特点
概念
结构特点/通式
命名
同分异构体
同系物
成键数目
成键类型
碳骨架类型
烷烃
每个碳原子形成4个共价键
认识有机物
单键、双键、三键
链状、环状
甲烷
5
CH4——天然气、沼气、煤层气的主要成分
天然气
沼气
煤层气
结合生活经验和有关知识,想一想甲烷可能具有哪些性质?
甲烷
5
一、CH4的物理性质
无色、无味、难溶于水的气体
* 烷烃物理性质递变规律
名称 分子式 常温下的状态 熔点/℃ 沸点/℃ 相对密度(以水为1) 水溶性
甲烷 CH4 气 -182 -164 0.466 不溶于水
乙烷 C2H6 气 - -88.6 0.572 不溶于水
丙烷 C3H8 气 - -42.1 - 不溶于水
丁烷 C4H10 气 -138.4 -0.5 0.579 不溶于水
戊烷 C5H12 液 -130 36.1 0.626 不溶于水
十七烷 C17H36 固 22 301.8 0.778 不溶于水
状态:碳原子数≤4的烷烃常温下为气态
熔沸点:随碳原子数增加,熔沸点升高
密度:随碳原子数增加,相对密度逐渐增加,但始终小于水的密度
溶解性:均不溶于水,易溶于有机溶剂(相似相溶原理)
甲烷
5
二、CH4的化学性质
1.燃烧(氧化反应)
CH4+2O2
点燃
天然气灶
CO2+2H2O
现象:甲烷安静地燃烧,火焰呈淡蓝色,放出大量的热
反应方程式:
注意:甲烷点燃前要验纯
有机反应式用箭头
相同条件下,同体积甲烷、氢气、一氧化碳燃烧,甲烷放出的热更多
甲烷
5
二、CH4的化学性质
1.燃烧(氧化反应)
2.稳定性:通常情况下很稳定,不与强酸、强碱、酸性高锰酸钾反应
3.取代反应:与Cl2
[实验]取两支含有CH4和Cl2混合气体的两支试管,分别用铁架台固定好。将其中一支试管用铝箔套上,另一支试管放在光亮处。静置,比较两支试管内的现象。
[现象]在室温下,甲烷与氯气的混合气体:
无光照时:不发生反应
光照时:
试管内水面上升
试管内气体颜色逐渐变浅
试管壁出现油状液滴
试管内出现白雾
气体体积减小
产物难溶于水
氯气发生反应
甲烷
5
生成的一氯甲烷在常温下是气体,可与氯气进一步反应,依次又生成了二氯甲烷、三氯甲烷(氯仿)和四氯甲烷(四氯化碳CCl4)。
甲烷和氯气在光照下的分步反应过程
[分析]甲烷中的一个氢原子被氯原子取代,形成一氯甲烷
二氯甲烷、四氯化碳CCl4是常用的有机溶剂,三氯甲烷曾被用作外科手术的麻醉剂。
甲烷
5
二、CH4的化学性质
1.燃烧(氧化反应)
2.稳定性:通常情况下很稳定,不与强酸、强碱、酸性高锰酸钾反应
3.取代反应:与Cl2
有机化合物参加的反应往往比较复杂,常有副反应发生。因此,有机化学反应的方程式中,常用“→ ”代替“ =”。
CH4+Cl2
CH3Cl+HCl
光照
CH3Cl+Cl2
CH2Cl2+HCl
光照
CH2Cl2+Cl2
CHCl3+HCl
光照
CHCl3+Cl2
CCl4+HCl
光照
上述反应中,甲烷分子中的氢原子被氯原子取代。像这样,有机化合物分子里的某些原子(或原子团)被其他原子(或原子团)取代的反应叫作取代反应
甲烷
5
1.燃烧(氧化反应)
2.稳定性:通常情况下很稳定,不与强酸、强碱、酸性高锰酸钾反应
3.取代反应:与Cl2(光照条件下)
烷烃
性质
甲烷
状态:碳原子数≤4的烷烃常温下为气态
熔沸点:碳原子数越多,熔沸点越高,越易液化
密度:碳原子数增加,相对密度逐渐增加,但始终小于水的密度
溶解性:均不溶于水,易溶于有机溶剂(相似相溶原理)
物理性质
化学性质
甲烷
5
练一练
1.下列反应属于取代反应的是( )
A.CH4
C+2H2
高温
B.2HI+Cl2 = 2HCl+I2
C.CH4+2O2
点燃
CO2+2H2O
D.C2H6+Cl2
C2H5Cl+HCl
光
取代反应定义:有机物分子里的某些原子被其他原子取代的反应叫作取代反应
烷烃的取代反应条件:与Cl2(光照条件下)
甲烷
5
练一练
2.关于CH4和Cl2的反应(如图所示)叙述不正确的是( )
A.该反应属于取代反应
B.该反应的条件是光照
C.该反应的生成物有四种
D.该反应的现象是试管内水面上升,气体颜色逐渐变浅,试管壁出现油状液滴,试管内出现白雾
×
CH4+Cl2
CH3Cl+HCl
光照
CH3Cl+Cl2
CH2Cl2+HCl
光照
CH2Cl2+Cl2
CHCl3+HCl
光照
CHCl3+Cl2
CCl4+HCl
光照
产物4+1=5种
甲烷
5
练一练
3.下列各图均能表示甲烷的分子结构,其中能反应其真实存在状况的是
A.结构示意图
C.球棍模型
D.空间填充模型
B.电子式
C
:
:
:
:
H
H
H
H
甲烷
5
练一练
4.在一定条件下,下列物质可与甲烷发生反应的是
A.浓硫酸
B.Cl2
C.氢氧化钠溶液
D.酸性高锰酸钾溶液
甲烷
5
练一练
5.若甲烷与氯气以物质的量比1:1混合,在光照下得到的产物有( )①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4 ⑤HCl
A.只有①
B.①②③④⑤的混合物
C.①②③④的混合物
D.只有①②
甲烷
5
练一练
6.(多选)打火机所采用燃料有丙烷和丁烷,下列有关它们的叙述不正确的是
A.光照下能与氯气发生取代反应
B.丙烷比丁烷更易液化
C.它们都是清洁燃料
D.都能使酸性高锰酸钾溶液褪色
×
×
含碳原子数越多越易液化
官能团及烃的衍生物
6
已知白醋中的乙酸(俗称醋酸)、柠檬汁中的柠檬酸均能表现出酸性,而乙醇不具有酸性,分析乙酸、柠檬酸和乙醇的结构简式,推断乙酸、柠檬酸分子中能使其表现出酸性的原子或原子团。
乙酸
柠檬酸
乙醇
结构
性质
物质的结构决定物质的性质。乙酸和柠檬酸分子均含有特殊的原子团——羧基( COOH),正是羧基决定了这两种物质均具有酸性。
有机化合物分子中,像羧基这样,比较活泼、容易发生反应并决定着某类有机化合物共同特性的原子或原子团称为官能团
羧基( COOH)
官能团及烃的衍生物
6
官能团:决定着某类有机化合物共同特性的原子或原子团
物质类别 官能团 代表物
结构式 名称 烃 烷烃 无官能团 -
烯烃
炔烃
芳香烃 无官能团
C
C
C
C
碳碳双键
碳碳三键
CH2=CH2
CH2≡CH2
苯
烃:只含碳、氢两种元素的有机物
烃的衍生物:含有除碳、氢之外的元素原子的有机物
乙烯
乙炔
官能团及烃的衍生物
6
官能团:决定着某类有机化合物共同特性的原子或原子团
物质类别 官能团 代表物
结构式 名称 烃 的 衍 生 物 醇
酸
酯
卤代烃
烃:只含碳、氢两种元素的有机物
烃的衍生物:含有除碳、氢之外的元素原子的有机物
—OH
羟基
乙醇CH3CH2OH
—COOH
羧基
乙酸CH3COOH
CH3─C─O─H
O=
─C─O─R
O=
酯基
乙酸乙酯
CH3COOC2H5
CH3─C─O─C2H5
O=
─C─X
┃
┃
碳卤键(X代表卤素原子F、Cl、Br、I)
CH3Cl
可以把烃的衍生物看成烃基和官能团互相结合而成的
官能团及烃的衍生物
6
官能团:决定着某类有机化合物共同特性的原子或原子团
练一练:生产和生活中许多有重要用途的有机化合物结构较复杂,它们的分子含有一些常见官能团。请标示出下列有机化合物分子中的官能团并写出其名称。
乳酸
顺丁橡胶
甘油
官能团名称:
羟基、羧基
碳碳双键
羟基
官能团名称:
碳碳双键、酯基
官能团及烃的衍生物
6
官能团:决定着某类有机化合物共同特性的原子或原子团
练一练:请说出以下物质中可能含有的官能团名称
官能团名称:
羟基
碳碳三键
羟基
木糖醇 鲸蜡醇 丙烯醇 丁炔醇
羟基
碳碳双键羟基
官能团及烃的衍生物
6
官能团:决定着某类有机化合物共同特性的原子或原子团
小结
碳碳双键
碳碳三键
C
C
C
C
—OH
─C─O─H
O=
─C─O─R
O=
烃:只含碳、氢两种元素的有机物
烃的衍生物:含有除碳、氢元素之外的有机物
羟基
羧基
酯基
概括·整合
有机物的分子结构
有机物的性质
有机物的应用
官能团
碳骨架
有机物的多样性
碳原子的成键特点
同系物
同分异构体
决定
决定
本课结束
