6.1.2化学反应与电能课件(共23张ppt)化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1.2化学反应与电能课件(共23张ppt)化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 13.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-13 08:39:06 | ||
图片预览






文档简介
(共23张PPT)
第六章 化学反应与能量
第一节 化学反应与能量变化
第2课时 化学反应与电能
成本问题
化学能直接转变为电能
思考:原电池是如何把化学能直接转变为电能?
电流是怎样产生的?
什么反应中有电子的转移?
电子定向移动
氧化还原反应
写出锌和稀硫酸反应的化学方程式并用单线桥分析
Zn+2H+=Zn2++H2 ↑
2e-
能否以锌和稀硫酸反应来设计原电池?原电池的结构?
实验6-3
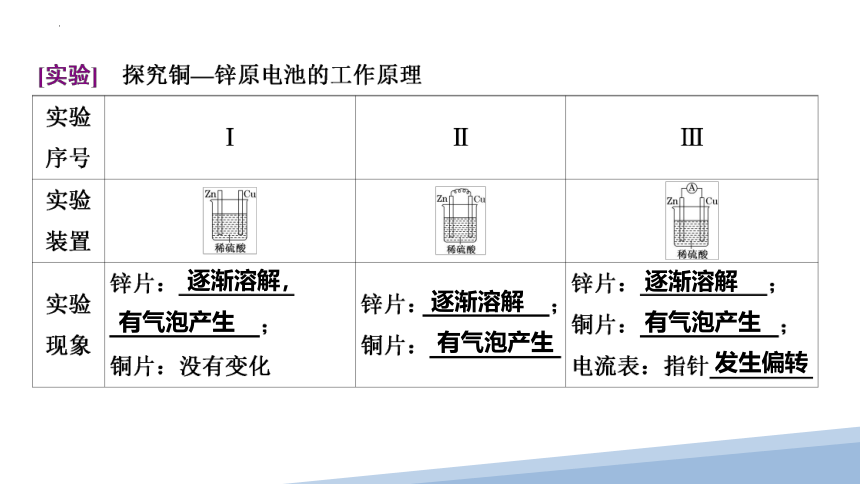
逐渐溶解,
有气泡产生
逐渐溶解
有气泡产生
逐渐溶解
有气泡产生
发生偏转
分点突破(一) 化学反应与电能
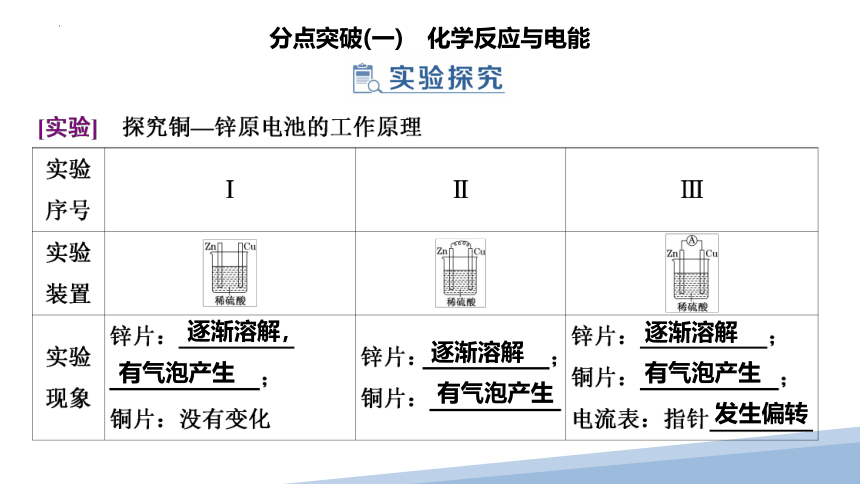
逐渐溶解,
有气泡产生
逐渐溶解
有气泡产生
逐渐溶解
有气泡产生
发生偏转
1.实验Ⅰ中锌片、铜片上发生所述现象的原因是什么?实验Ⅱ中用导线将锌片与铜片相连后浸入稀H2SO4中,为什么铜片上有气泡产生?
2.实验Ⅲ中电流表的指针为什么会发生偏转?你能写出两极发生的电极反应吗?
3.电子的移动方向?离子的移动方向?
原电池
工作原理:以锌-铜原电池为例
原电池
原电池总反应式:______________________。
负极
正极
氧化反应
还原反应
Zn+2H+===Zn2++H2↑
Zn-2e-===Zn2+
2H++2e ===H2↑
自发的氧化
还原反应
1.外电路:电子的移动方向:从 流出,经导线流向 。
2.内电路:离子的移动方向:阳离子向 移动,阴离子向 移动。
3.整个电路中:电流的移动方向:
负极
正极
正极
负极
e-
↑
e-→
e-
↓
_
电子不下水,离子不上岸
正极→导线→负极→溶液→正极
小结
原电池的形成条件?
活泼性不同
电解质
闭合回路
氧化还原
正极一般不参与电极反应,只起导电作用
酒精、蔗糖、四氯化碳不是电解质
形成闭合回路的方式有多种,可以用导线连接两个电极构成闭合回路,也可以让两个电极相接触构成闭合回路。
1.下列装置哪些能构成原电池?其他不能构成原电池的原因是什么?
2.如图是一个原电池装置。结合电化学的有关知识,回答下列问题:
(1)如何判断该电池的正、负极?
(2)C中阳离子向哪一极移动?
(3)若A、B、C分别为Fe、Cu和浓硝酸,能否构成原电池?若能,正、
负极分别是什么?
思考交流
如何判断原电池的正、负极
实验现象
电子流向
反应类型
电极名称
电极材料
离子流向
负极
电子流出
一般为活泼性较强的金属
氧化反应
阴离子移向的一极
电极溶解
电子流入
活泼性较弱的金属或非金属
还原反应
阳离子移向的一极
增重或有气泡放出
正极
1.下列装置能构成原电池的是 ( )
C
2.如图所示的装置,M为活泼性顺序位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是 ( )
A.N上有气体放出
B.M为负极,N为正极
C.稀硫酸中 移向M极
D.导线中有电流通过,电流方向是由M到N
D
3.如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,记录如下,其中描述合理的是 ( )
①Zn作正极,Cu作负极
②H+向负极移动
③电子流动方向:从Zn经外电路流向Cu
④Cu极上有H2产生
⑤Zn极上发生氧化反应
⑥正极的电极反应式为Zn-2e-===Zn2+
A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
B
4. 有 、 、 、 四种金属,有关的实验装置及部分实验结论如表所示:
实验装置
部分实验结论 极质量减小, 极质量增大 极有气体产生, 极无变化 电流从 极流
向 极
由此可判断这四种金属的活动性顺序是 ( )
A. B.
C. D.
C
原电池的构成条件——“两极一液一线一反应”
一般原电池
原电池中的三个方向
①电流方向:正极―→负极。
②电子流动方向(导线中):负极―→正极。
③电解质溶液中阴、阳离子移动方向
阳离子:移向正极;
阴离子:移向负极。
谢 谢 观 看
第六章 化学反应与能量
第一节 化学反应与能量变化
第2课时 化学反应与电能
成本问题
化学能直接转变为电能
思考:原电池是如何把化学能直接转变为电能?
电流是怎样产生的?
什么反应中有电子的转移?
电子定向移动
氧化还原反应
写出锌和稀硫酸反应的化学方程式并用单线桥分析
Zn+2H+=Zn2++H2 ↑
2e-
能否以锌和稀硫酸反应来设计原电池?原电池的结构?
实验6-3
逐渐溶解,
有气泡产生
逐渐溶解
有气泡产生
逐渐溶解
有气泡产生
发生偏转
分点突破(一) 化学反应与电能
逐渐溶解,
有气泡产生
逐渐溶解
有气泡产生
逐渐溶解
有气泡产生
发生偏转
1.实验Ⅰ中锌片、铜片上发生所述现象的原因是什么?实验Ⅱ中用导线将锌片与铜片相连后浸入稀H2SO4中,为什么铜片上有气泡产生?
2.实验Ⅲ中电流表的指针为什么会发生偏转?你能写出两极发生的电极反应吗?
3.电子的移动方向?离子的移动方向?
原电池
工作原理:以锌-铜原电池为例
原电池
原电池总反应式:______________________。
负极
正极
氧化反应
还原反应
Zn+2H+===Zn2++H2↑
Zn-2e-===Zn2+
2H++2e ===H2↑
自发的氧化
还原反应
1.外电路:电子的移动方向:从 流出,经导线流向 。
2.内电路:离子的移动方向:阳离子向 移动,阴离子向 移动。
3.整个电路中:电流的移动方向:
负极
正极
正极
负极
e-
↑
e-→
e-
↓
_
电子不下水,离子不上岸
正极→导线→负极→溶液→正极
小结
原电池的形成条件?
活泼性不同
电解质
闭合回路
氧化还原
正极一般不参与电极反应,只起导电作用
酒精、蔗糖、四氯化碳不是电解质
形成闭合回路的方式有多种,可以用导线连接两个电极构成闭合回路,也可以让两个电极相接触构成闭合回路。
1.下列装置哪些能构成原电池?其他不能构成原电池的原因是什么?
2.如图是一个原电池装置。结合电化学的有关知识,回答下列问题:
(1)如何判断该电池的正、负极?
(2)C中阳离子向哪一极移动?
(3)若A、B、C分别为Fe、Cu和浓硝酸,能否构成原电池?若能,正、
负极分别是什么?
思考交流
如何判断原电池的正、负极
实验现象
电子流向
反应类型
电极名称
电极材料
离子流向
负极
电子流出
一般为活泼性较强的金属
氧化反应
阴离子移向的一极
电极溶解
电子流入
活泼性较弱的金属或非金属
还原反应
阳离子移向的一极
增重或有气泡放出
正极
1.下列装置能构成原电池的是 ( )
C
2.如图所示的装置,M为活泼性顺序位于氢之前的金属,N为石墨棒,关于此装置的下列叙述中,不正确的是 ( )
A.N上有气体放出
B.M为负极,N为正极
C.稀硫酸中 移向M极
D.导线中有电流通过,电流方向是由M到N
D
3.如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,记录如下,其中描述合理的是 ( )
①Zn作正极,Cu作负极
②H+向负极移动
③电子流动方向:从Zn经外电路流向Cu
④Cu极上有H2产生
⑤Zn极上发生氧化反应
⑥正极的电极反应式为Zn-2e-===Zn2+
A.①②③ B.③④⑤ C.④⑤⑥ D.②③④
B
4. 有 、 、 、 四种金属,有关的实验装置及部分实验结论如表所示:
实验装置
部分实验结论 极质量减小, 极质量增大 极有气体产生, 极无变化 电流从 极流
向 极
由此可判断这四种金属的活动性顺序是 ( )
A. B.
C. D.
C
原电池的构成条件——“两极一液一线一反应”
一般原电池
原电池中的三个方向
①电流方向:正极―→负极。
②电子流动方向(导线中):负极―→正极。
③电解质溶液中阴、阳离子移动方向
阳离子:移向正极;
阴离子:移向负极。
谢 谢 观 看
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
