重庆市2024届高三下学期4月普通高中学业水平选择性考试第二次联合诊断检测化学试题(PDF版含答案)
文档属性
| 名称 | 重庆市2024届高三下学期4月普通高中学业水平选择性考试第二次联合诊断检测化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 523.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-13 11:05:22 | ||
图片预览



文档简介
2024 年重庆市普通高中学业水平选择性考试
高三第二次联合诊断检测 化学
化学测试卷共 4 页,满分 100 分。考试时间 75 分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cr-52
一、选择题:本题共 14 个小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有一项符合题目要求。
1. 中华传统文化源远流长,下列有关说法不正确的是
A.青花瓷呈现的颜色与 Fe2O3 含量高有关 B.三星堆青铜神树所用青铜属于合金
C.丝绸云袖的主要成分是蛋白质 D.红山玉龙的成分之一 Al2O3 可用作耐火材料
2. 实验室可用反应 NH4Cl+NaNO2=NaCl+N2↑+2H2O 制取少量 N2。下列说法正确的是
A -.H2O 的空间填充模型为 B.NO2 的空间结构为 V 形
C -.Cl 的结构示意图为 .+18 2 8 8 D.N2 的电子式为 N . .N .
3 . 下列说法正确的是
A O +. 3 是由非极性键构成的非极性分子 B.酸性 KMnO4 溶液可检验 FeCl 22 溶液中的 Fe
C.铁和铝发生腐蚀均生成相应的氧化物 D.通过晶体的 X 射线衍射实验可获得键长和键角的数值
4. 下列化学方程式或离子方程式书写不正确的是
点燃
A.Mg 粉在 CO2 中点燃:2Mg+CO2 2MgO+C
B.少量 SO2 气体通入 Ca(ClO)2 溶液中:SO2+2ClO
-
+H2O=SO
2-
3 +2HClO
C + + +.铁氰化钾溶液检验 Fe2 :K +Fe2 +[Fe(CN)6]3
-
=KFe[Fe(CN)6]↓
D.NaHSO +4 溶液中滴入少量 Ba(HCO3)2 溶液:Ba2 +2HCO
- + 2-
3 +2H +SO4 =BaSO4↓+2CO2↑+2H2O
高温
5. “臭碱”(Na2S)广泛应用于冶金、电镀等工业。一种制备 Na2S 的方法为:Na2SO4+2C Na2S+2CO2↑。
已知 NA为阿伏加德罗常数的值。下列有关说法正确的是
A.12g 石墨中含有六元环数为 0.5NA B.1L 1mol·L
-1 Na2S 溶液中含有的离子数为 3NA
C.生成 22.4L CO2 转移的电子数为 4NA D.14.2g Na2SO4 晶体中含有的 σ 键数为 0.6NA
6. 一种合金催化剂催化 BH3NH3 水解释氢的反应机理如图所示。下列说法正确的是
H +H NH4 H H H [ O O ]-
+
H3N B H H -HO B [H ] O B NH4 H H
H O +
H 合金 O ① 合金 ② 合金 3H2
载体 载体 载体
A.使用催化剂增大反应的活化能和反应速率 B.反应过程中 B 原子杂化方式不变
C +.反应过程中无配位键断裂 D.若将 H2O 换成 D2O,则有 HD 和 NH3D 生成
7. 下列实验装置或操作能达到实验目的的是
2 滴 4 滴 8 滴 Cl2 0.1mol/L 0.1mol/L 0.1mol/L 饱和食盐水 + 外接电源 -
AgNO3 KI 溶液 Na2S
溶液 溶液
钢闸门 海水
2mL 酸性 辅助电极
H 0.1mol/L 电石 KMnO2 4 NaCl溶液 溶液
A.氯气在氢气中燃烧 B.验证沉淀转化 C.检验乙炔的性质 D.钢闸门防腐
第二次联合诊断检测(化学)第 1 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
8. 有机化合物Ⅱ是一种合成中间体,由有机物Ⅰ合成有机物Ⅱ的路线如下。下列说法不正确的是
A.有机物Ⅱ的分子式为 C7H7NO2 NH2OH·HCl HO CHO HO CH N OH
B.有机物Ⅰ可以形成分子内氢键 Na2CO3
C.有机物Ⅱ存在顺反异构体 Ⅰ Ⅱ
D.有机物Ⅰ在一定条件下能与 HCHO 发生缩聚反应
9. 根据下列实验操作和现象所得出的结论正确的是
选项 实验操作 现象 结论
将少量铁粉加入过量的氯水中,
A 溶液未变红色 氯水能氧化 SCN
-
并滴入 2 滴 KSCN 溶液
B 向 Na2S 溶液中滴加盐酸 产生臭鸡蛋气味的气体 非金属性:Cl>S
C 向丙烯醛(CH2=CHCHO)中加入溴水 溴水褪色 丙烯醛与 Br2 发生了加成反应
D 向酸性 KMnO4 溶液中滴入甲苯 紫红色褪去 甲基对苯环的性质有影响
10 .我国某有机所研究团队合成一种盐,其阴离子结构如下图所示。短周期主族元素 X、Y、Z、R 的原子序数依次增
大,X、Y、Z 的原子序数之和为 23,下列有关叙述不正确的是
A Z .电负性:Z>Y>R Z
Y
B X .简单氢化物的稳定性:Z>Y>X
Z R
C.RZ4 的键角和 XZ4 的键角相等 Y Y
D.X 的单质可能是共价晶体
11.实验测得体积相同,浓度均为 0.10mol L-· 1 的 CH3COOH 溶液和 CH3COONa 溶液的 pH 随温度的变化情况如图
所示。下列说法正确的是 pH
A b .b 点的 Kw 大于 a 点的 Kw CH3COONa
B.溶液中水的电离程度:a 点大于 b 点
7
C.溶液中离子总数:b 点大于 a 点 a
CH3COOH
D.升高温度 CH3COONa 溶液的 pH 减小,说明升温抑制水解 T1 温度/℃
12.用下图装置可以制取电池材料 LiNi 1 Co 1 Mn 1 O2的前驱体 Ni 1 Co 1 Mn 1 (OH)2。下列说法正确的是
3 3 3 3 3 3
A.a 为直流电源的负极 a b
石墨 纯钛
B A B 直流电源 .交换膜 、 均为阴离子交换膜 电极 电极
Ⅰ室 Ⅱ室 Ⅲ室
C - +.Ⅰ室发生的电极反应为:2H2O+4e =O 2↑+4H NiSO4
浓度均为 CoSO
D.产生 0.2mol Ni 1 Co 1 Mn
4
1 (OH)2时,理论上纯钛电极 Na2SO4 0.2mol/L MnSO Na2SO4
3 3 3 溶液 4 溶液
产生标准状态下 4.48L 气体 交换膜 A 交换膜 B 前驱体
13.由锆(Zr,+4 价,价层电子排布式为 4d25s2)和钨(W,+6 价)两种金属元素的氧化物组成的复合氧化物的
立方晶胞示意图如图所示。图中四面体中心是钨原子,均在晶胞中;
八面体中心是锆原子,位于晶胞顶角和面心。下列说法正确的是
2s 2p
A.基态 O 原子的价层电子排布图为 ↑ ↓ ↑↓ ↑ ↓
B.锆位于周期表中第五周期第ⅥB 族
C.该复合氧化物的化学式为 ZrW2O8
D.该晶体中每个 Zr 周围等距且紧邻的 Zr 有 8 个
第二次联合诊断检测(化学)第 2 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
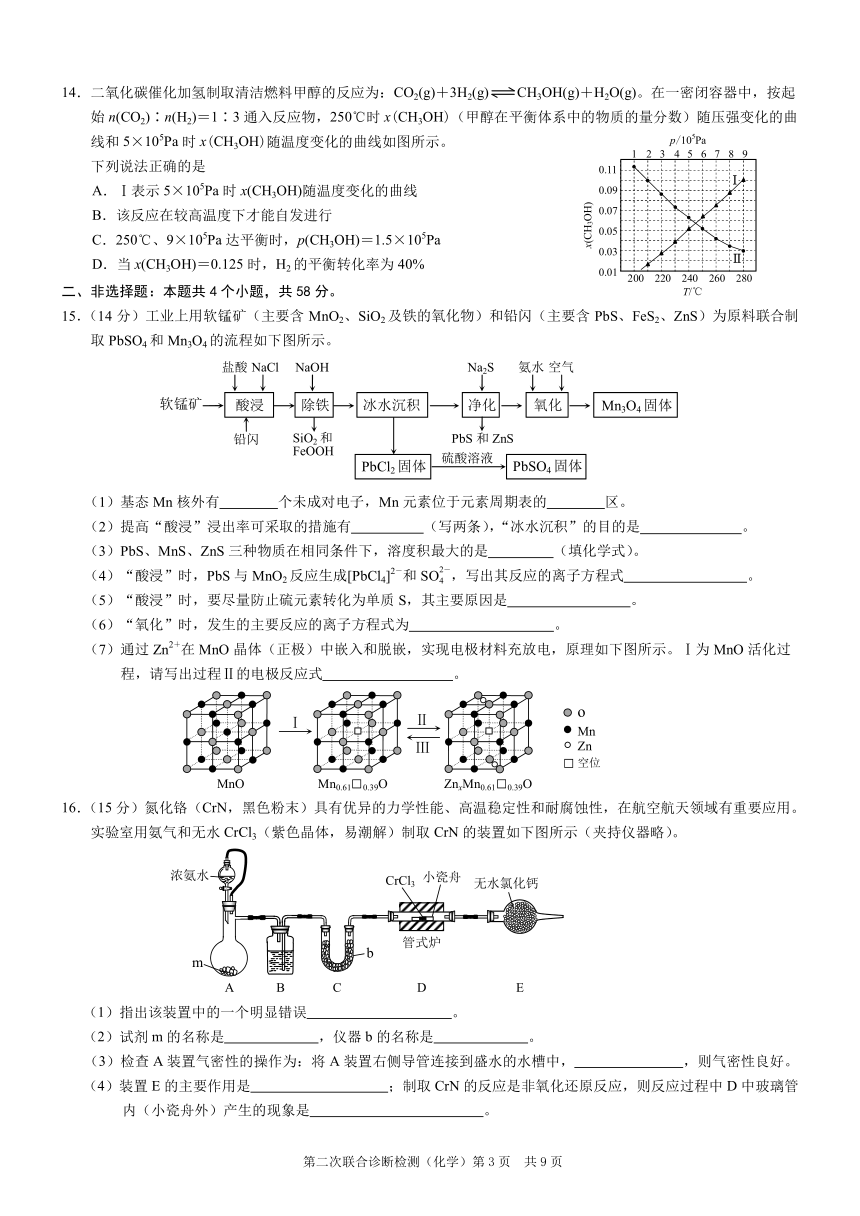
14.二氧化碳催化加氢制取清洁燃料甲醇的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。在一密闭容器中,按起
始 n(CO2)∶n(H2)=1∶3 通入反应物,250℃时 x(CH3OH)(甲醇在平衡体系中的物质的量分数)随压强变化的曲
线和 5×105Pa 时 x(CH3OH
5
)随温度变化的曲线如图所示。 p/10 Pa
1 2 3 4 5 6 7 8 9
下列说法正确的是 0.11
Ⅰ
A.Ⅰ表示 5×105Pa 时 x(CH3OH)随温度变化的曲线 0.09
B.该反应在较高温度下才能自发进行 0.07
0.05
C.250℃、9×105Pa 达平衡时,p(CH3OH)=1.5×105Pa
0.03
D.当 x(CH3OH)=0.125 时,H2 的平衡转化率为 40% Ⅱ 0.01 200 220 240 260 280
二、非选择题:本题共 4个小题,共 58 分。 T/℃
15.(14 分)工业上用软锰矿(主要含 MnO2、SiO2 及铁的氧化物)和铅闪(主要含 PbS、FeS2、ZnS)为原料联合制
取 PbSO4 和 Mn3O4 的流程如下图所示。
盐酸 NaCl NaOH Na2S 氨水 空气
软锰矿 酸浸 除铁 冰水沉积 净化 氧化 Mn3O4 固体
铅闪 SiO2 和 PbS 和 ZnS
FeOOH
PbCl 硫
酸溶液
2 固体 PbSO4 固体
(1)基态 Mn 核外有 个未成对电子,Mn 元素位于元素周期表的 区。
(2)提高“酸浸”浸出率可采取的措施有 (写两条),“冰水沉积”的目的是 。
(3)PbS、MnS、ZnS 三种物质在相同条件下,溶度积最大的是 (填化学式)。
(4)“酸浸”时,PbS 与 MnO - 2-2 反应生成[PbCl ]24 和 SO4 ,写出其反应的离子方程式 。
(5)“酸浸”时,要尽量防止硫元素转化为单质 S,其主要原因是 。
(6)“氧化”时,发生的主要反应的离子方程式为 。
(7)通过 Zn2+在 MnO 晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为 MnO 活化过
程,请写出过程Ⅱ的电极反应式 。
o
Ⅰ Ⅱ Mn
Ⅲ Zn
空位
MnO Mn0.61 0.39O ZnxMn0.61 0.39O
16.(15 分)氮化铬(CrN,黑色粉末)具有优异的力学性能、高温稳定性和耐腐蚀性,在航空航天领域有重要应用。
实验室用氨气和无水 CrCl3(紫色晶体,易潮解)制取 CrN 的装置如下图所示(夹持仪器略)。
浓氨水 CrCl3 小瓷舟 无水氯化钙
管式炉
b m
A B C D E
(1)指出该装置中的一个明显错误 。
(2)试剂 m 的名称是 ,仪器 b 的名称是 。
(3)检查 A 装置气密性的操作为:将 A 装置右侧导管连接到盛水的水槽中, ,则气密性良好。
(4)装置 E 的主要作用是 ;制取 CrN 的反应是非氧化还原反应,则反应过程中 D 中玻璃管
内(小瓷舟外)产生的现象是 。
第二次联合诊断检测(化学)第 3 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
x(CH3OH)
(5)在制得的 CrN 中含有少量 Cr2N 杂质,写出反应生成 Cr2N 的化学方程式 。
(6)取样品(只含有 Cr2N 杂质)38.9g 在空气中充分加热,得固体残渣(Cr2O3)的质量为 45.6g,则样品中 CrN
的质量分数为 %(保留一位小数)。
17.(14 分)丙烯是三大合成材料的基本原料之一。可以用丙烷直接脱氢、丙烷氧化脱氢和电解法制丙烯。已知下列
反应的热化学方程式:
直接脱氢ⅰ:CH3CH2CH3(g)
-1
CH2=CHCH3(g)+H2(g) ΔH1=+123.8kJ·mol
1
氧化脱氢ⅱ:CH3CH2CH3(g)+ O (g) CH =CHCH (g)+H O(g) ΔH 2 2 2 3 2 2
-ⅲ:2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6kJ·mol 1
(1)ΔH2= kJ·mol
-1。
(2)一定条件下,在装有锌基催化剂(ZnO)的恒压密闭容器中,发生直接脱氢反应,丙烯的平衡产率 x 与平衡
K
常数 Kp 的关系可表示为: x
2 p
K p ,式中 p 为系统总压。p 分别为 a MPa 和 b MPa 时(a>b),丙烯平衡 p
产率与温度的关系如图 1 所示。
①其中表示 bMPa 下的关系曲线是 (填“Ⅰ”或“Ⅱ”),T4℃时,Kp= MPa。
②实验证明,系统总压不变,在丙烷中混入一些水蒸气,丙烷的平衡转化率增大,其原因是 。
- - +③立方 ZnO 的晶胞如下图 2 所示,则该晶体中 O2 的配位数为 ;晶胞参数为 c pm,O2 与 Zn2 间的最
小距离为 pm。 太阳能电池
100 丙烯
a b O
(T4,80.0)
2
80 X
Y 60 Ⅰ Zn2+
Ⅱ
40 O
2-
20 CO2
0 T1 T2 T3 T4 温度/℃
质子交换膜
H2SO4溶液
图 1 图 2 图 3
(3)以惰性材料作电极,电解法制取丙烯的原理如图 3 所示。
①X 极为 极(填“阳”或“阴”)。
②若电解生成 1mol 丙烯,理论上阳极区溶液减少的质量为 g。
18.(15 分)有机化合物 M 是合成某种药物的中间体,M 的合成路线如下:
COOH COOCH3 COOCH3 COOCH3 COOCH3
CH3OH Fe/HCl CH3(CH2)2COCl
浓 HNO3 Fe/HCl
D
① ② 浓 H2SO4 ③
H2N
NO2 NO2 NH2 NHCO(CH2)2CH3 NHCO(CH2)2CH3
A B C E
NH2 N
一定条件 N 1)NaOH
N
C12H14N2O2 H N
+ N
H3COOC N 2)H G PPA N
H
F M H
(1)反应①的条件为 ,E 中的含氧官能团的名称是 ,B→C 的反应类型是 。
(2)C→D 的化学方程式为 。
(3)E 与足量 NaOH 溶液反应的化学方程式为 。
(4)有机物 G 在一定条件下反应生成 Q(C12H16N2O2),写出 2 种同时符合下列条件的化合物 Q 的同分异构体的
结构简式 、 。
①分子中含有苯环,且苯环上有 4 个取代基;②能发生银镜反应;③核磁共振氢谱有四组峰,且峰面积之比
为 3∶3∶1∶1。
NO2 N
(5)参照上述合成路线,设计由乙苯和 合成 的路线 (无机试剂任选)。
N N
H
第二次联合诊断检测(化学)第 4 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
丙烯的平衡产率/%
2024 年重庆市普通高中学业水平选择性考试
高三第二次联合诊断检测 化学参考答案
1~5ABDBA 6~10DBBAC 11~14CDCD
1.A。
【解析】A.氧化铁是红棕色,青花瓷是用含氧化钴的钴矿为原料制成。
2.B。
【解析】
A. 是 H2O 的球棍模型;
B.NO- -2 的价层电子对数为 3,有 1 对孤电子对,NO2 中的空间构型为 V 形;
C Cl-. 的核电荷数为 17,不是 18;
D.N2的电子式为 .N
..
.. N. 。
3.D。
【解析】
A.O3是由极性键构成的极性分子;
B Cl-. 也能还原酸性 KMnO4,不能用酸性 KMnO4检验 FeCl
+
2 溶液中的 Fe2 ;
C.铁和铝如果在酸性环境中发生化学腐蚀,生成的是盐,不是氧化物。
4.B。
【解析】
B 2-.离子方程式为:SO2+ClO-+H2O=SO4 +Cl
-+2H+。
5.A。
【解析】
A.石墨中 1 个碳原子被 3 个环共用,即 1 个六元环中含 2 个碳原子,12g 石墨中含有 1mol 碳原子,六环数为
0.5 NA;
B S2-.因 发生水解反应,离子数目大于 3NA;
C.未说明 CO2状态,无法计算;
D.1mol Na2SO4 晶体中只含有 4mol σ 键。
6.D。
【解析】
A.使用催化剂,降低反应活化能,加快反应速率;
B.①过程中 B 原子由 sp3杂化变为 sp2 杂化;
第二次联合诊断检测(化学)第 5 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
C.BH3NH3中,N 原子提供孤对电子与 B 原子形成配位键,反应过程中有配位键的断裂。
7.B。
【解析】
A.氯气不能点燃,应是将氢气点燃后伸入氯气瓶中燃烧;
C.制备的乙炔中含 H2S 等杂质,也可使高锰酸钾褪色;
D.钢闸门外接电源防腐应作阴极,接电源负极。
8.B。
【解析】
B.有机物Ⅰ中的羟基与醛基距离较远,不形成分子内氢键,只能形成分子间氢键;
C.有机物Ⅱ中含 C=N 双键,且碳原子连接的两个基团不同,存在顺反异构;
D.有机物Ⅰ中酚羟基的邻位可以与 HCHO 发生缩聚反应。
9.A。
【解析】
A 3.将少量铁粉加入过量的氯水中,肯定有 Fe +,滴入 KSCN 溶液,未变红色,说明氯水氧化了 SCN- ;
B.HCl 和 H2S 都不是含氧酸,由此不能比较 Cl 和 S 元素的非金属性强弱;
C.醛基能还原溴水,不能说明丙烯醛与 Br2 发生了加成反应;
D.只能说明苯环对甲基的性质有影响。
10.C。
【解析】根据形成共价键的数目 Z 为 1,X 为 4,R 为 6,Y 为 2,且 X、Y、Z 原子序数之和为 23,可推得 X、
Y、Z、R 分别为元素 C、O、F、S。
A.电负性 F>O>S;
B.简单氢化物稳定性 HF>H2O>CH4;
C.SF4 和 CF4 中 SF4 存在孤电子对,故键角较小;
D.碳的单质金刚石是共价晶体。
11.C。
【解析】
A.a、b 两点温度相同,Kw 相等;
B +.a 点醋酸电离出 H 抑制水的电离,b 点是醋酸钠,CH3COO
-
水解,促进水的电离;
C.b 点 CH3COONa 是盐,完全电离,a 点 CH3COOH 是弱电解质,电离程度小,离子总数少;
D.盐类水解是吸热反应,升高温度促进水解。
12.D。
【解析】由右侧生成 Ni 1 Co 1 Mn
-
1 (OH)2,说明纯钛电极上 H2O 得电子,放出 H2,产生 OH ,纯钛电极为阴极。 3 3 3
第二次联合诊断检测(化学)第 6 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
A.b 为电源的负极,a 为电源的正极;
B.交换膜 B 是阳离子交换膜;
C - +.石墨电极上发生电极反应为:2H2O-4e =O2↑+4H ,
- -
纯钛电极上发生的电极反应为 2H2O+2e =H2↑+2OH ;
D.产生 0.2mol Ni - 1 Co 1 Mn 1 (OH)2,需要 0.4mol OH ,产生 H2 0.2mol,标准状态下为 4.48L。 3 3 3
13.C。
【解析】
8 1 +6 1C.由晶胞结构可得,Zr 原子数目为 4,W 原子数目为 8,据锆与钨的化合价分别为+4 与+6,O
8 2
原子数目为 32,可得化学式为 ZrW2O8;
D.Zr 位于晶胞的顶角和面心的八面体中心,Zr 原子周围距离最近且相等的 Zr 原子有 12 个。
14.D。
【解析】
A.该反应是气体分子数减少的反应,甲醇在平衡体系中的物质的量分数随压强的增大而增大,Ⅰ表示甲醇
的物质的量分数随压强的变化曲线,Ⅱ表示甲醇的物质的量分数随温度的变化曲线;
B.温度升高 x(CH3OH)变小,说明该反应的正反应是放热反应,ΔH<0,该反应是气体分子数减少的反应,
ΔS<0,根据 ΔG=ΔH-TΔS 可知,该反应在较低的温度下能自发进行;
C.读图可知 250℃、9×105Pa 时,x(CH3OH)=0.1,p(CH OH)=0.1×9×1053 Pa=9×104Pa;
D.x(CH3OH)=0.125,设起始通入 a mol CO2和 3a mol H2,
CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
起始(mol) a 3a
转化(mol) ax 3ax ax ax
平衡(mol) a(1-x) a(3-3x) ax ax
n(总)=4a-2ax x 0.125,解得 x=0.4 H 3 0.4a, 2 的平衡转化率为 ×100% = 40% 。 4 2x 3a
15.(14 分)
【答案】
(1)5(1 分) d(1 分)
(2)延长浸取时间、不断搅拌、将原料粉碎等(2 分) 降低 PbCl2 的溶解度(1 分)
(3)MnS(1 分)
(4)PbS+4MnO2+4Cl
-
+8H+ - 2- +=[PbCl 24] +SO4 +4Mn
2 +4H2O(2 分)
(5)防止生成单质 S 覆盖在矿物表面,阻碍反应进行或方铅矿量一定时,提高 Mn2+浸出量(2 分)
第二次联合诊断检测(化学)第 7 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
(6)6Mn2+ ++O2+12NH3·H2O=2Mn3O4↓+12NH4 +6H2O(2 分)
(7)Mn0.61□0.39O+xZn2
+
+2xe-=ZnxMn0.61□0.39O(2 分)
16.(15 分)
【答案】
(1)装置 B 中左侧应连接长导管插入溶液中,右侧应连接短导管略露出塞子(2 分)
(2)氧化钙(或氢氧化钠、生石灰、碱石灰)(2 分) U 形管(1 分)
(3)微热烧瓶,水槽中导管口有气泡逸出,停止微热,导管内形成一段稳定的水柱(2 分)
(4)防止空气中的水蒸气进入 D 装置(2 分) 产生大量白烟(2 分)
(5)4CrCl 高温 高温 3+16NH3 2Cr2N+12NH4Cl+N2(或 4CrCl3+4NH3 2Cr2N+12HCl+N2)(2 分)
(6)84.8(2 分)
【解析】
(6)设样品中 CrN 和 Cr2N 的物质的量分别为 x mol、y mol Cr O n(Cr)
45.6
。 2 3 中 = 2 0.6mol , 152
x+2y=0.6
66x+118y=38.9 解得 x=0.5mol,y=0.05mol,
则样品中 CrN
0.5 66
的质量分数 100% 84.8% 。
38.9
17.(14 分)
【答案】
(1 )-118(2 分)
2 1 1.78b 16( )①Ⅰ( 分) (或 b )(2 分)
9
②该反应气体分子数增加,充入水蒸气,可降低反应体系中各组分的分压,有利于平衡正向移动(2 分)
③4(2 分) 3 c (2 分)
4
(3)①阴(1 分) ②162(2 分)
【解析】
1 1( )反应ⅰ+反应ⅲ×0.5=反应ⅱ,ΔH =123.8-483.6×0.5=-118 kJ mol-2 · 。
2 Kp
(2)①由关系式 x K p 可知,温度相同时,p 越大,x 越小,bMPa 下的关系曲线是Ⅰ; p
K
T 2 p 164℃,b MPa 时,丙烷平衡转化率 x=80%,根据关系式 x ,可计算 Kp b 1.78bK 。 p p 9
③O2-与 Zn2+ 3间的最小距离为晶胞体对线的四分之一,即 c pm。
4
(3)②阴极反应:3CO +18H+2 +18e- CH2=CHCH3+6H2O,阳极反应:2H2O-4e-=O2↑+4H+,生成 1mol
第二次联合诊断检测(化学)第 8 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
丙烯转移的电子为 18mol,阳极区溶液减少的质量为产生的 O2与转移的 H+即为电解水的质量,故为
18
18 162g 。
2
18.(15 分)
【答案】
(1)浓硫酸、加热(2 分) 酯基、酰胺基(2 分) 取代反应(1 分)
(2) (2 分)
(3) (2 分)
N OHC N CHO N OHC CHO OHC CHO
(4) O H C C H O N N (写两个,各 2 分) N N
N
OHC CHO N N
(5) (2 分)
H+
第二次联合诊断检测(化学)第 9 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
高三第二次联合诊断检测 化学
化学测试卷共 4 页,满分 100 分。考试时间 75 分钟。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cr-52
一、选择题:本题共 14 个小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有一项符合题目要求。
1. 中华传统文化源远流长,下列有关说法不正确的是
A.青花瓷呈现的颜色与 Fe2O3 含量高有关 B.三星堆青铜神树所用青铜属于合金
C.丝绸云袖的主要成分是蛋白质 D.红山玉龙的成分之一 Al2O3 可用作耐火材料
2. 实验室可用反应 NH4Cl+NaNO2=NaCl+N2↑+2H2O 制取少量 N2。下列说法正确的是
A -.H2O 的空间填充模型为 B.NO2 的空间结构为 V 形
C -.Cl 的结构示意图为 .+18 2 8 8 D.N2 的电子式为 N . .N .
3 . 下列说法正确的是
A O +. 3 是由非极性键构成的非极性分子 B.酸性 KMnO4 溶液可检验 FeCl 22 溶液中的 Fe
C.铁和铝发生腐蚀均生成相应的氧化物 D.通过晶体的 X 射线衍射实验可获得键长和键角的数值
4. 下列化学方程式或离子方程式书写不正确的是
点燃
A.Mg 粉在 CO2 中点燃:2Mg+CO2 2MgO+C
B.少量 SO2 气体通入 Ca(ClO)2 溶液中:SO2+2ClO
-
+H2O=SO
2-
3 +2HClO
C + + +.铁氰化钾溶液检验 Fe2 :K +Fe2 +[Fe(CN)6]3
-
=KFe[Fe(CN)6]↓
D.NaHSO +4 溶液中滴入少量 Ba(HCO3)2 溶液:Ba2 +2HCO
- + 2-
3 +2H +SO4 =BaSO4↓+2CO2↑+2H2O
高温
5. “臭碱”(Na2S)广泛应用于冶金、电镀等工业。一种制备 Na2S 的方法为:Na2SO4+2C Na2S+2CO2↑。
已知 NA为阿伏加德罗常数的值。下列有关说法正确的是
A.12g 石墨中含有六元环数为 0.5NA B.1L 1mol·L
-1 Na2S 溶液中含有的离子数为 3NA
C.生成 22.4L CO2 转移的电子数为 4NA D.14.2g Na2SO4 晶体中含有的 σ 键数为 0.6NA
6. 一种合金催化剂催化 BH3NH3 水解释氢的反应机理如图所示。下列说法正确的是
H +H NH4 H H H [ O O ]-
+
H3N B H H -HO B [H ] O B NH4 H H
H O +
H 合金 O ① 合金 ② 合金 3H2
载体 载体 载体
A.使用催化剂增大反应的活化能和反应速率 B.反应过程中 B 原子杂化方式不变
C +.反应过程中无配位键断裂 D.若将 H2O 换成 D2O,则有 HD 和 NH3D 生成
7. 下列实验装置或操作能达到实验目的的是
2 滴 4 滴 8 滴 Cl2 0.1mol/L 0.1mol/L 0.1mol/L 饱和食盐水 + 外接电源 -
AgNO3 KI 溶液 Na2S
溶液 溶液
钢闸门 海水
2mL 酸性 辅助电极
H 0.1mol/L 电石 KMnO2 4 NaCl溶液 溶液
A.氯气在氢气中燃烧 B.验证沉淀转化 C.检验乙炔的性质 D.钢闸门防腐
第二次联合诊断检测(化学)第 1 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
8. 有机化合物Ⅱ是一种合成中间体,由有机物Ⅰ合成有机物Ⅱ的路线如下。下列说法不正确的是
A.有机物Ⅱ的分子式为 C7H7NO2 NH2OH·HCl HO CHO HO CH N OH
B.有机物Ⅰ可以形成分子内氢键 Na2CO3
C.有机物Ⅱ存在顺反异构体 Ⅰ Ⅱ
D.有机物Ⅰ在一定条件下能与 HCHO 发生缩聚反应
9. 根据下列实验操作和现象所得出的结论正确的是
选项 实验操作 现象 结论
将少量铁粉加入过量的氯水中,
A 溶液未变红色 氯水能氧化 SCN
-
并滴入 2 滴 KSCN 溶液
B 向 Na2S 溶液中滴加盐酸 产生臭鸡蛋气味的气体 非金属性:Cl>S
C 向丙烯醛(CH2=CHCHO)中加入溴水 溴水褪色 丙烯醛与 Br2 发生了加成反应
D 向酸性 KMnO4 溶液中滴入甲苯 紫红色褪去 甲基对苯环的性质有影响
10 .我国某有机所研究团队合成一种盐,其阴离子结构如下图所示。短周期主族元素 X、Y、Z、R 的原子序数依次增
大,X、Y、Z 的原子序数之和为 23,下列有关叙述不正确的是
A Z .电负性:Z>Y>R Z
Y
B X .简单氢化物的稳定性:Z>Y>X
Z R
C.RZ4 的键角和 XZ4 的键角相等 Y Y
D.X 的单质可能是共价晶体
11.实验测得体积相同,浓度均为 0.10mol L-· 1 的 CH3COOH 溶液和 CH3COONa 溶液的 pH 随温度的变化情况如图
所示。下列说法正确的是 pH
A b .b 点的 Kw 大于 a 点的 Kw CH3COONa
B.溶液中水的电离程度:a 点大于 b 点
7
C.溶液中离子总数:b 点大于 a 点 a
CH3COOH
D.升高温度 CH3COONa 溶液的 pH 减小,说明升温抑制水解 T1 温度/℃
12.用下图装置可以制取电池材料 LiNi 1 Co 1 Mn 1 O2的前驱体 Ni 1 Co 1 Mn 1 (OH)2。下列说法正确的是
3 3 3 3 3 3
A.a 为直流电源的负极 a b
石墨 纯钛
B A B 直流电源 .交换膜 、 均为阴离子交换膜 电极 电极
Ⅰ室 Ⅱ室 Ⅲ室
C - +.Ⅰ室发生的电极反应为:2H2O+4e =O 2↑+4H NiSO4
浓度均为 CoSO
D.产生 0.2mol Ni 1 Co 1 Mn
4
1 (OH)2时,理论上纯钛电极 Na2SO4 0.2mol/L MnSO Na2SO4
3 3 3 溶液 4 溶液
产生标准状态下 4.48L 气体 交换膜 A 交换膜 B 前驱体
13.由锆(Zr,+4 价,价层电子排布式为 4d25s2)和钨(W,+6 价)两种金属元素的氧化物组成的复合氧化物的
立方晶胞示意图如图所示。图中四面体中心是钨原子,均在晶胞中;
八面体中心是锆原子,位于晶胞顶角和面心。下列说法正确的是
2s 2p
A.基态 O 原子的价层电子排布图为 ↑ ↓ ↑↓ ↑ ↓
B.锆位于周期表中第五周期第ⅥB 族
C.该复合氧化物的化学式为 ZrW2O8
D.该晶体中每个 Zr 周围等距且紧邻的 Zr 有 8 个
第二次联合诊断检测(化学)第 2 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
14.二氧化碳催化加氢制取清洁燃料甲醇的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。在一密闭容器中,按起
始 n(CO2)∶n(H2)=1∶3 通入反应物,250℃时 x(CH3OH)(甲醇在平衡体系中的物质的量分数)随压强变化的曲
线和 5×105Pa 时 x(CH3OH
5
)随温度变化的曲线如图所示。 p/10 Pa
1 2 3 4 5 6 7 8 9
下列说法正确的是 0.11
Ⅰ
A.Ⅰ表示 5×105Pa 时 x(CH3OH)随温度变化的曲线 0.09
B.该反应在较高温度下才能自发进行 0.07
0.05
C.250℃、9×105Pa 达平衡时,p(CH3OH)=1.5×105Pa
0.03
D.当 x(CH3OH)=0.125 时,H2 的平衡转化率为 40% Ⅱ 0.01 200 220 240 260 280
二、非选择题:本题共 4个小题,共 58 分。 T/℃
15.(14 分)工业上用软锰矿(主要含 MnO2、SiO2 及铁的氧化物)和铅闪(主要含 PbS、FeS2、ZnS)为原料联合制
取 PbSO4 和 Mn3O4 的流程如下图所示。
盐酸 NaCl NaOH Na2S 氨水 空气
软锰矿 酸浸 除铁 冰水沉积 净化 氧化 Mn3O4 固体
铅闪 SiO2 和 PbS 和 ZnS
FeOOH
PbCl 硫
酸溶液
2 固体 PbSO4 固体
(1)基态 Mn 核外有 个未成对电子,Mn 元素位于元素周期表的 区。
(2)提高“酸浸”浸出率可采取的措施有 (写两条),“冰水沉积”的目的是 。
(3)PbS、MnS、ZnS 三种物质在相同条件下,溶度积最大的是 (填化学式)。
(4)“酸浸”时,PbS 与 MnO - 2-2 反应生成[PbCl ]24 和 SO4 ,写出其反应的离子方程式 。
(5)“酸浸”时,要尽量防止硫元素转化为单质 S,其主要原因是 。
(6)“氧化”时,发生的主要反应的离子方程式为 。
(7)通过 Zn2+在 MnO 晶体(正极)中嵌入和脱嵌,实现电极材料充放电,原理如下图所示。Ⅰ为 MnO 活化过
程,请写出过程Ⅱ的电极反应式 。
o
Ⅰ Ⅱ Mn
Ⅲ Zn
空位
MnO Mn0.61 0.39O ZnxMn0.61 0.39O
16.(15 分)氮化铬(CrN,黑色粉末)具有优异的力学性能、高温稳定性和耐腐蚀性,在航空航天领域有重要应用。
实验室用氨气和无水 CrCl3(紫色晶体,易潮解)制取 CrN 的装置如下图所示(夹持仪器略)。
浓氨水 CrCl3 小瓷舟 无水氯化钙
管式炉
b m
A B C D E
(1)指出该装置中的一个明显错误 。
(2)试剂 m 的名称是 ,仪器 b 的名称是 。
(3)检查 A 装置气密性的操作为:将 A 装置右侧导管连接到盛水的水槽中, ,则气密性良好。
(4)装置 E 的主要作用是 ;制取 CrN 的反应是非氧化还原反应,则反应过程中 D 中玻璃管
内(小瓷舟外)产生的现象是 。
第二次联合诊断检测(化学)第 3 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
x(CH3OH)
(5)在制得的 CrN 中含有少量 Cr2N 杂质,写出反应生成 Cr2N 的化学方程式 。
(6)取样品(只含有 Cr2N 杂质)38.9g 在空气中充分加热,得固体残渣(Cr2O3)的质量为 45.6g,则样品中 CrN
的质量分数为 %(保留一位小数)。
17.(14 分)丙烯是三大合成材料的基本原料之一。可以用丙烷直接脱氢、丙烷氧化脱氢和电解法制丙烯。已知下列
反应的热化学方程式:
直接脱氢ⅰ:CH3CH2CH3(g)
-1
CH2=CHCH3(g)+H2(g) ΔH1=+123.8kJ·mol
1
氧化脱氢ⅱ:CH3CH2CH3(g)+ O (g) CH =CHCH (g)+H O(g) ΔH 2 2 2 3 2 2
-ⅲ:2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6kJ·mol 1
(1)ΔH2= kJ·mol
-1。
(2)一定条件下,在装有锌基催化剂(ZnO)的恒压密闭容器中,发生直接脱氢反应,丙烯的平衡产率 x 与平衡
K
常数 Kp 的关系可表示为: x
2 p
K p ,式中 p 为系统总压。p 分别为 a MPa 和 b MPa 时(a>b),丙烯平衡 p
产率与温度的关系如图 1 所示。
①其中表示 bMPa 下的关系曲线是 (填“Ⅰ”或“Ⅱ”),T4℃时,Kp= MPa。
②实验证明,系统总压不变,在丙烷中混入一些水蒸气,丙烷的平衡转化率增大,其原因是 。
- - +③立方 ZnO 的晶胞如下图 2 所示,则该晶体中 O2 的配位数为 ;晶胞参数为 c pm,O2 与 Zn2 间的最
小距离为 pm。 太阳能电池
100 丙烯
a b O
(T4,80.0)
2
80 X
Y 60 Ⅰ Zn2+
Ⅱ
40 O
2-
20 CO2
0 T1 T2 T3 T4 温度/℃
质子交换膜
H2SO4溶液
图 1 图 2 图 3
(3)以惰性材料作电极,电解法制取丙烯的原理如图 3 所示。
①X 极为 极(填“阳”或“阴”)。
②若电解生成 1mol 丙烯,理论上阳极区溶液减少的质量为 g。
18.(15 分)有机化合物 M 是合成某种药物的中间体,M 的合成路线如下:
COOH COOCH3 COOCH3 COOCH3 COOCH3
CH3OH Fe/HCl CH3(CH2)2COCl
浓 HNO3 Fe/HCl
D
① ② 浓 H2SO4 ③
H2N
NO2 NO2 NH2 NHCO(CH2)2CH3 NHCO(CH2)2CH3
A B C E
NH2 N
一定条件 N 1)NaOH
N
C12H14N2O2 H N
+ N
H3COOC N 2)H G PPA N
H
F M H
(1)反应①的条件为 ,E 中的含氧官能团的名称是 ,B→C 的反应类型是 。
(2)C→D 的化学方程式为 。
(3)E 与足量 NaOH 溶液反应的化学方程式为 。
(4)有机物 G 在一定条件下反应生成 Q(C12H16N2O2),写出 2 种同时符合下列条件的化合物 Q 的同分异构体的
结构简式 、 。
①分子中含有苯环,且苯环上有 4 个取代基;②能发生银镜反应;③核磁共振氢谱有四组峰,且峰面积之比
为 3∶3∶1∶1。
NO2 N
(5)参照上述合成路线,设计由乙苯和 合成 的路线 (无机试剂任选)。
N N
H
第二次联合诊断检测(化学)第 4 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
丙烯的平衡产率/%
2024 年重庆市普通高中学业水平选择性考试
高三第二次联合诊断检测 化学参考答案
1~5ABDBA 6~10DBBAC 11~14CDCD
1.A。
【解析】A.氧化铁是红棕色,青花瓷是用含氧化钴的钴矿为原料制成。
2.B。
【解析】
A. 是 H2O 的球棍模型;
B.NO- -2 的价层电子对数为 3,有 1 对孤电子对,NO2 中的空间构型为 V 形;
C Cl-. 的核电荷数为 17,不是 18;
D.N2的电子式为 .N
..
.. N. 。
3.D。
【解析】
A.O3是由极性键构成的极性分子;
B Cl-. 也能还原酸性 KMnO4,不能用酸性 KMnO4检验 FeCl
+
2 溶液中的 Fe2 ;
C.铁和铝如果在酸性环境中发生化学腐蚀,生成的是盐,不是氧化物。
4.B。
【解析】
B 2-.离子方程式为:SO2+ClO-+H2O=SO4 +Cl
-+2H+。
5.A。
【解析】
A.石墨中 1 个碳原子被 3 个环共用,即 1 个六元环中含 2 个碳原子,12g 石墨中含有 1mol 碳原子,六环数为
0.5 NA;
B S2-.因 发生水解反应,离子数目大于 3NA;
C.未说明 CO2状态,无法计算;
D.1mol Na2SO4 晶体中只含有 4mol σ 键。
6.D。
【解析】
A.使用催化剂,降低反应活化能,加快反应速率;
B.①过程中 B 原子由 sp3杂化变为 sp2 杂化;
第二次联合诊断检测(化学)第 5 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
C.BH3NH3中,N 原子提供孤对电子与 B 原子形成配位键,反应过程中有配位键的断裂。
7.B。
【解析】
A.氯气不能点燃,应是将氢气点燃后伸入氯气瓶中燃烧;
C.制备的乙炔中含 H2S 等杂质,也可使高锰酸钾褪色;
D.钢闸门外接电源防腐应作阴极,接电源负极。
8.B。
【解析】
B.有机物Ⅰ中的羟基与醛基距离较远,不形成分子内氢键,只能形成分子间氢键;
C.有机物Ⅱ中含 C=N 双键,且碳原子连接的两个基团不同,存在顺反异构;
D.有机物Ⅰ中酚羟基的邻位可以与 HCHO 发生缩聚反应。
9.A。
【解析】
A 3.将少量铁粉加入过量的氯水中,肯定有 Fe +,滴入 KSCN 溶液,未变红色,说明氯水氧化了 SCN- ;
B.HCl 和 H2S 都不是含氧酸,由此不能比较 Cl 和 S 元素的非金属性强弱;
C.醛基能还原溴水,不能说明丙烯醛与 Br2 发生了加成反应;
D.只能说明苯环对甲基的性质有影响。
10.C。
【解析】根据形成共价键的数目 Z 为 1,X 为 4,R 为 6,Y 为 2,且 X、Y、Z 原子序数之和为 23,可推得 X、
Y、Z、R 分别为元素 C、O、F、S。
A.电负性 F>O>S;
B.简单氢化物稳定性 HF>H2O>CH4;
C.SF4 和 CF4 中 SF4 存在孤电子对,故键角较小;
D.碳的单质金刚石是共价晶体。
11.C。
【解析】
A.a、b 两点温度相同,Kw 相等;
B +.a 点醋酸电离出 H 抑制水的电离,b 点是醋酸钠,CH3COO
-
水解,促进水的电离;
C.b 点 CH3COONa 是盐,完全电离,a 点 CH3COOH 是弱电解质,电离程度小,离子总数少;
D.盐类水解是吸热反应,升高温度促进水解。
12.D。
【解析】由右侧生成 Ni 1 Co 1 Mn
-
1 (OH)2,说明纯钛电极上 H2O 得电子,放出 H2,产生 OH ,纯钛电极为阴极。 3 3 3
第二次联合诊断检测(化学)第 6 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
A.b 为电源的负极,a 为电源的正极;
B.交换膜 B 是阳离子交换膜;
C - +.石墨电极上发生电极反应为:2H2O-4e =O2↑+4H ,
- -
纯钛电极上发生的电极反应为 2H2O+2e =H2↑+2OH ;
D.产生 0.2mol Ni - 1 Co 1 Mn 1 (OH)2,需要 0.4mol OH ,产生 H2 0.2mol,标准状态下为 4.48L。 3 3 3
13.C。
【解析】
8 1 +6 1C.由晶胞结构可得,Zr 原子数目为 4,W 原子数目为 8,据锆与钨的化合价分别为+4 与+6,O
8 2
原子数目为 32,可得化学式为 ZrW2O8;
D.Zr 位于晶胞的顶角和面心的八面体中心,Zr 原子周围距离最近且相等的 Zr 原子有 12 个。
14.D。
【解析】
A.该反应是气体分子数减少的反应,甲醇在平衡体系中的物质的量分数随压强的增大而增大,Ⅰ表示甲醇
的物质的量分数随压强的变化曲线,Ⅱ表示甲醇的物质的量分数随温度的变化曲线;
B.温度升高 x(CH3OH)变小,说明该反应的正反应是放热反应,ΔH<0,该反应是气体分子数减少的反应,
ΔS<0,根据 ΔG=ΔH-TΔS 可知,该反应在较低的温度下能自发进行;
C.读图可知 250℃、9×105Pa 时,x(CH3OH)=0.1,p(CH OH)=0.1×9×1053 Pa=9×104Pa;
D.x(CH3OH)=0.125,设起始通入 a mol CO2和 3a mol H2,
CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
起始(mol) a 3a
转化(mol) ax 3ax ax ax
平衡(mol) a(1-x) a(3-3x) ax ax
n(总)=4a-2ax x 0.125,解得 x=0.4 H 3 0.4a, 2 的平衡转化率为 ×100% = 40% 。 4 2x 3a
15.(14 分)
【答案】
(1)5(1 分) d(1 分)
(2)延长浸取时间、不断搅拌、将原料粉碎等(2 分) 降低 PbCl2 的溶解度(1 分)
(3)MnS(1 分)
(4)PbS+4MnO2+4Cl
-
+8H+ - 2- +=[PbCl 24] +SO4 +4Mn
2 +4H2O(2 分)
(5)防止生成单质 S 覆盖在矿物表面,阻碍反应进行或方铅矿量一定时,提高 Mn2+浸出量(2 分)
第二次联合诊断检测(化学)第 7 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
(6)6Mn2+ ++O2+12NH3·H2O=2Mn3O4↓+12NH4 +6H2O(2 分)
(7)Mn0.61□0.39O+xZn2
+
+2xe-=ZnxMn0.61□0.39O(2 分)
16.(15 分)
【答案】
(1)装置 B 中左侧应连接长导管插入溶液中,右侧应连接短导管略露出塞子(2 分)
(2)氧化钙(或氢氧化钠、生石灰、碱石灰)(2 分) U 形管(1 分)
(3)微热烧瓶,水槽中导管口有气泡逸出,停止微热,导管内形成一段稳定的水柱(2 分)
(4)防止空气中的水蒸气进入 D 装置(2 分) 产生大量白烟(2 分)
(5)4CrCl 高温 高温 3+16NH3 2Cr2N+12NH4Cl+N2(或 4CrCl3+4NH3 2Cr2N+12HCl+N2)(2 分)
(6)84.8(2 分)
【解析】
(6)设样品中 CrN 和 Cr2N 的物质的量分别为 x mol、y mol Cr O n(Cr)
45.6
。 2 3 中 = 2 0.6mol , 152
x+2y=0.6
66x+118y=38.9 解得 x=0.5mol,y=0.05mol,
则样品中 CrN
0.5 66
的质量分数 100% 84.8% 。
38.9
17.(14 分)
【答案】
(1 )-118(2 分)
2 1 1.78b 16( )①Ⅰ( 分) (或 b )(2 分)
9
②该反应气体分子数增加,充入水蒸气,可降低反应体系中各组分的分压,有利于平衡正向移动(2 分)
③4(2 分) 3 c (2 分)
4
(3)①阴(1 分) ②162(2 分)
【解析】
1 1( )反应ⅰ+反应ⅲ×0.5=反应ⅱ,ΔH =123.8-483.6×0.5=-118 kJ mol-2 · 。
2 Kp
(2)①由关系式 x K p 可知,温度相同时,p 越大,x 越小,bMPa 下的关系曲线是Ⅰ; p
K
T 2 p 164℃,b MPa 时,丙烷平衡转化率 x=80%,根据关系式 x ,可计算 Kp b 1.78bK 。 p p 9
③O2-与 Zn2+ 3间的最小距离为晶胞体对线的四分之一,即 c pm。
4
(3)②阴极反应:3CO +18H+2 +18e- CH2=CHCH3+6H2O,阳极反应:2H2O-4e-=O2↑+4H+,生成 1mol
第二次联合诊断检测(化学)第 8 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
丙烯转移的电子为 18mol,阳极区溶液减少的质量为产生的 O2与转移的 H+即为电解水的质量,故为
18
18 162g 。
2
18.(15 分)
【答案】
(1)浓硫酸、加热(2 分) 酯基、酰胺基(2 分) 取代反应(1 分)
(2) (2 分)
(3) (2 分)
N OHC N CHO N OHC CHO OHC CHO
(4) O H C C H O N N (写两个,各 2 分) N N
N
OHC CHO N N
(5) (2 分)
H+
第二次联合诊断检测(化学)第 9 页 共 9 页
{#{QQABaQKEggAgQJAAARgCAQGgCgMQkAGCCIoOhBAIIAAByBNABAA=}#}
同课章节目录
