培优课堂7 “工业生产调控”中速率、平衡图像题的分析 专项特训(含解析)2024年高考化学二轮复习
文档属性
| 名称 | 培优课堂7 “工业生产调控”中速率、平衡图像题的分析 专项特训(含解析)2024年高考化学二轮复习 |  | |
| 格式 | DOCX | ||
| 文件大小 | 424.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-13 19:29:34 | ||
图片预览



文档简介
培优课堂 “工业生产调控”中速率、平衡图像题的分析
1.(2023·惠州一模)丙烯与HBr发生加成反应的机理及反应体系中的能量变化如图所示,下列说法错误的是( )
A.曲线a表示的是反应2的能量变化图
B.反应2放出热量更多
C.对于反应1和反应2,第Ⅰ步都是反应的决速步骤
D.相同条件下反应2的速率比反应1大
2.用焦炭还原NO2的反应为2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C在不同容积的容器中发生反应,测得平衡时CO2和NO2的物质的量浓度与平衡总压的关系如图所示。下列描述正确的是( )
A.平衡常数:K(A)>K(C)
B.A、B、C三点中,C点NO2的转化率最低
C.B点时,若反应初始压强为12.8 MPa,则Kp=3.2
D.焦炭的用量越多,NO2的转化率越高
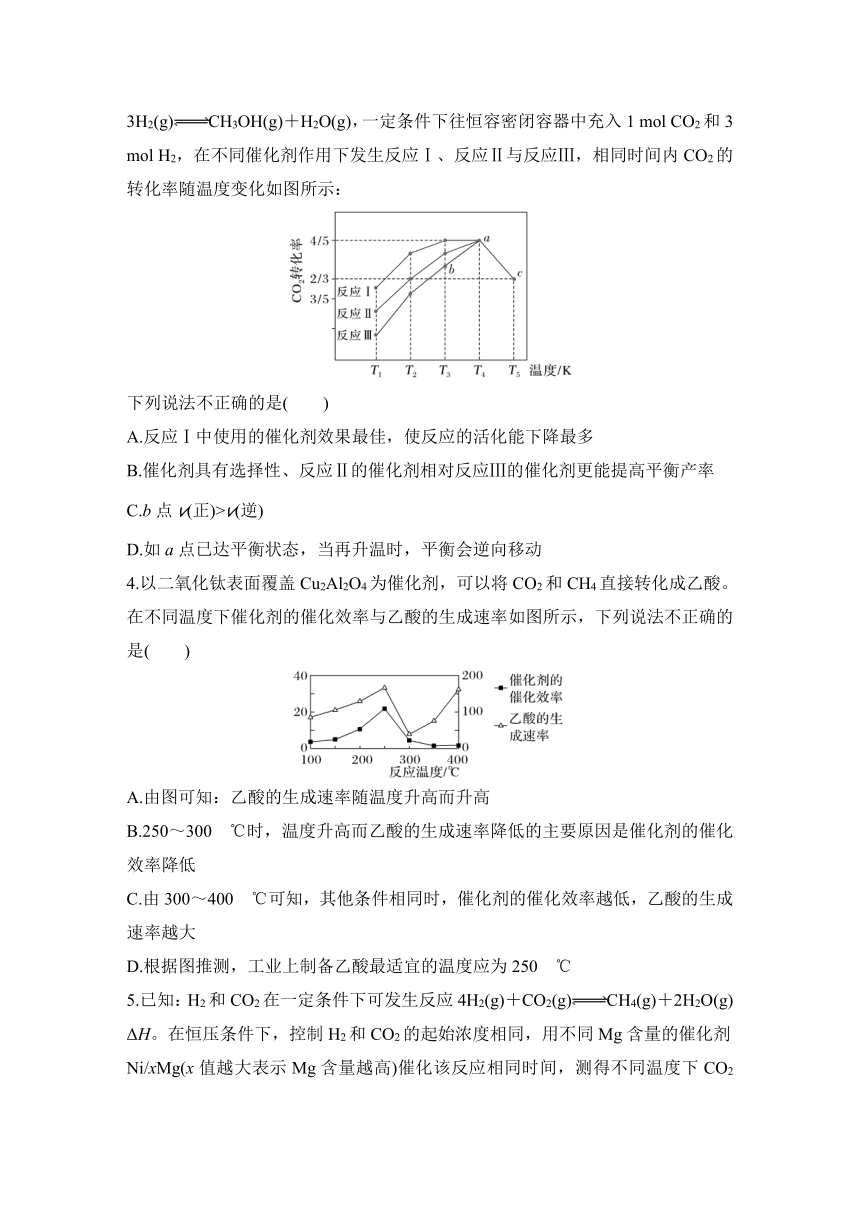
3.(2023·广州为明学校调研)利用工业废气中的CO2可以制取甲醇,CO2(g)+3H2(g)CH3OH(g)+H2O(g),一定条件下往恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如图所示:
下列说法不正确的是( )
A.反应Ⅰ中使用的催化剂效果最佳,使反应的活化能下降最多
B.催化剂具有选择性、反应Ⅱ的催化剂相对反应Ⅲ的催化剂更能提高平衡产率
C.b点v(正)>v(逆)
D.如a点已达平衡状态,当再升温时,平衡会逆向移动
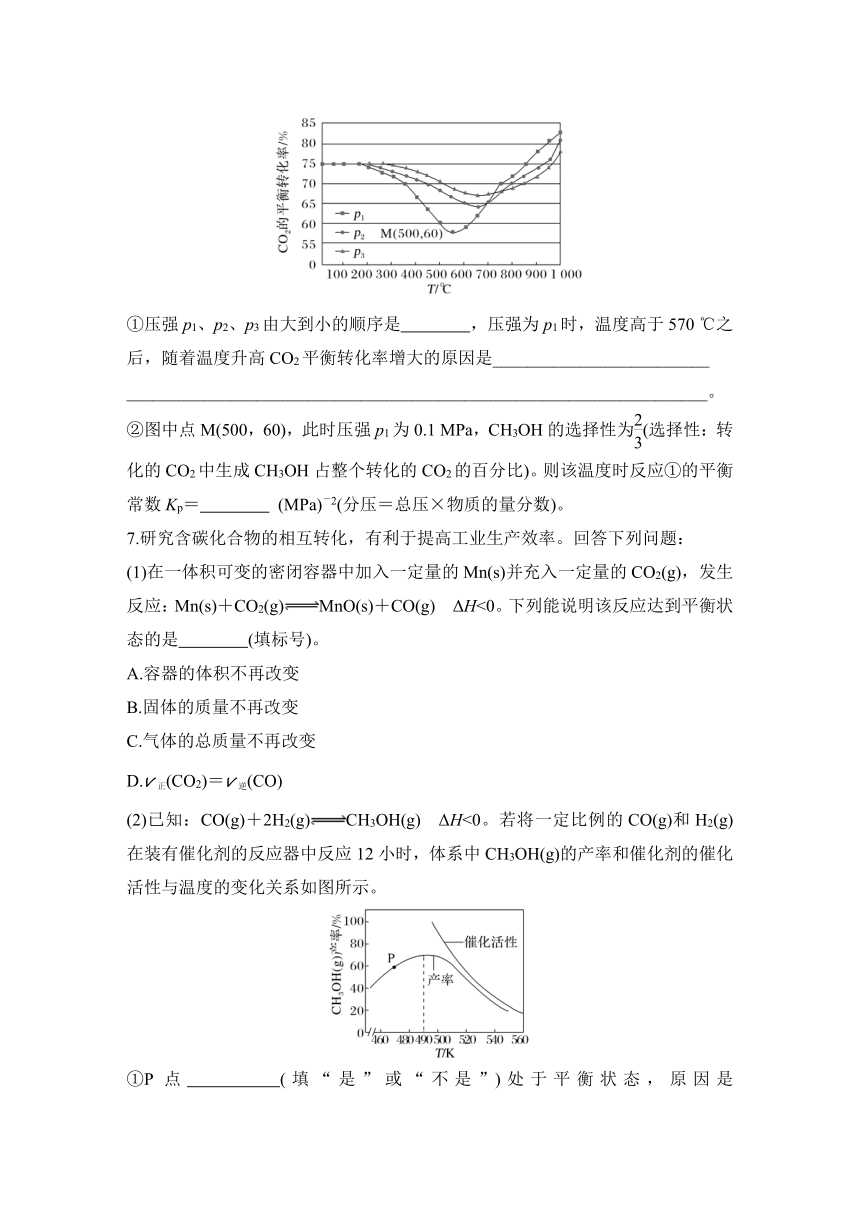
4.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法不正确的是( )
A.由图可知:乙酸的生成速率随温度升高而升高
B.250~300 ℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低
C.由300~400 ℃可知,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大
D.根据图推测,工业上制备乙酸最适宜的温度应为250 ℃
5.已知:H2和CO2在一定条件下可发生反应4H2(g)+CO2(g)CH4(g)+2H2O(g) ΔH。在恒压条件下,控制H2和CO2的起始浓度相同,用不同Mg含量的催化剂Ni/xMg(x值越大表示Mg含量越高)催化该反应相同时间,测得不同温度下CO2的转化率如图所示。下列说法正确的是( )
A.ΔH>0
B.延长W点的反应时间可提高CO2的转化率
C.相同条件下催化剂中Mg的含量越高,催化效率越高
D.当反应温度低于350 ℃时,使用合适的催化剂可以提高CO2的转化率
6.(2023·广州天河区期末)近年来我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”,将CO2转化为高附加值化学品成为科学家研究的重要课题。
Ⅰ.Cu-ZnO催化CO2和H2生产甲醇。
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
(1)已知:CO(g)+2H2(g)CH3OH(g) ΔH=-90.6 kJ·mol-1,则ΔH1= 。
(2)已知:反应①的正反应速率可表示为v正=k正·c(CO2)·c3(H2),逆反应速率可表示为v逆=k逆·c(CH3OH)·c(H2O),其中k正、k逆为速率常数。图中能够代表k逆的曲线为 (填“L1”,“L2”、“L3”或“L4”)。
(3)对于上述反应体系,下列说法正确的是 。
A.增大CO2的浓度,反应①、②的正反应速率均增加,逆反应速率均减小
B.恒容密闭容器中气体密度不变时,反应达到平衡状态
C.加入催化剂,H2的平衡转化率不变
D.温度为T1时,反应①的化学平衡常数K=1
(4)不同条件下,按照n(CO2)∶n(H2)=1∶3投料,CO2的平衡转化率如图所示。
①压强p1、p2、p3由大到小的顺序是 ,压强为p1时,温度高于570 ℃之后,随着温度升高CO2平衡转化率增大的原因是_________________________
___________________________________________________________________。
②图中点M(500,60),此时压强p1为0.1 MPa,CH3OH的选择性为(选择性:转化的CO2中生成CH3OH占整个转化的CO2的百分比)。则该温度时反应①的平衡常数Kp= (MPa)-2(分压=总压×物质的量分数)。
7.研究含碳化合物的相互转化,有利于提高工业生产效率。回答下列问题:
(1)在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),发生反应:Mn(s)+CO2(g)MnO(s)+CO(g) ΔH<0。下列能说明该反应达到平衡状态的是 (填标号)。
A.容器的体积不再改变
B.固体的质量不再改变
C.气体的总质量不再改变
D.v正(CO2)=v逆(CO)
(2)已知:CO(g)+2H2(g)CH3OH(g) ΔH<0。若将一定比例的CO(g)和H2(g)在装有催化剂的反应器中反应12小时,体系中CH3OH(g)的产率和催化剂的催化活性与温度的变化关系如图所示。
①P点 (填“是”或“不是”)处于平衡状态,原因是___________________________________________________________________
___________________________________________________________________。
②490 K之后,CH3OH(g)产率随温度升高而减小的原因可能是___________________________________________________________________,
___________________________________________________________________。
8.(1)T ℃时,在恒容密闭容器中充入1 mol CO2和n mol H2,在一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0。平衡后混合气体中CH3OH的体积分数与氢气的物质的量的关系如图1所示。图1中A、B、C三点对应的体系中,CO2的转化率最大的是 (填“A”“B”或“C”),x= 。
(2)现代制备乙烯常用乙烷氧化裂解法,主反应为C2H6(g)+O2(g)C2H4(g)+H2O(g) ΔH=-110 kJ· mol-1,反应时还会生成CH4、CO、CO2等副产物(副反应均为放热反应),如图2所示为温度对乙烷氧化裂解反应的影响。已知:乙烯选择性=×100%;乙烯收率=乙烷转化率×乙烯选择性。
①乙烷转化率随温度的升高而升高的原因是______________________________
____________________________________________________________________;
反应的最佳温度为 (填标号)。
A.650 ℃ B.700 ℃
C.775 ℃ D.850 ℃
②工业上,保持体系总压强恒定在100 kPa下进行该反应,且通常在乙烷和氧气的混合气体中掺入惰性气体(惰性气体的体积分数为70%),掺入惰性气体的目的是__________________________________________________________________
___________________________________________________________________。
9.血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度α(吸附O2的Hb或Mb的量与总Hb或Mb的量的比值)和氧气分压p(O2)密切相关。请回答下列问题:
(1)人体中的血红蛋白(Hb)能吸附O2、H+,相关反应的热化学方程式及平衡常数如下。
Ⅰ.Hb(aq)+H+(aq)HbH+(aq) ΔH1 K1
Ⅱ.HbH+(aq)+O2(g)HbO2(aq)+H+(aq) ΔH2 K2
Ⅲ.Hb(aq)+O2(g)HbO2(aq) ΔH3 K3
ΔH3= (用ΔH1、ΔH2表示),K3= (用K1、K2表示)。
(2)Hb与氧气的结合度受c(H+)的影响,相关反应为HbO2(aq)+H+(aq)HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度α的关系如图1所示,pH=7.6时对应的曲线为 (填“曲线A”或“曲线B”)。
(3)Mb与氧气结合的反应为Mb(aq)+O2(g)MbO2(aq) ΔH,37 ℃时,氧气分压p(O2)与达到平衡时Mb与氧气的结合度α的关系如图2所示。
①已知Mb与氧气结合的反应的平衡常数的表达式K=,则37 ℃时K= kPa-1。
②人正常呼吸时,体温约为37 ℃,氧气分压约为20.00 kPa,此时Mb与氧气的最大结合度为 (结果保留3位有效数字)。
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的ΔH (填“>”或“<”)0。
④已知37 ℃时,上述反应的正反应速率v正=k1·c(Mb)·p(O2),逆反应速率v逆=k2·c(MbO2),若k1=120 s-1·kPa-1,则k2= 。图2中C点时,= 。
10.二甲醚(CH3OCH3)重整制取H2具有无毒、无刺激性等优点。回答下列问题:
(1)CH3OCH3和O2发生反应Ⅰ:CH3OCH3(g)+O2(g)===2CO(g)+3H2(g) ΔH
已知:CH3OCH3(g)CO(g)+H2(g)+CH4(g) ΔH1
CH4(g)+O2(g)===CO(g)+2H2O(g) ΔH2
H2(g)+O2(g)===H2O(g) ΔH3
①则反应Ⅰ的ΔH= (用含ΔH1、ΔH2、ΔH3的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应Ⅰ。测得平衡时H2的体积分数与进料气中的关系如图甲所示。当>0.6时,H2的体积分数快速降低,其主要原因是 (填序号)。
A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C.>0.6时,平衡向逆反应方向移动
(2)T ℃时,在恒容密闭容器中通入CH3OCH3,发生反应Ⅱ:CH3OCH3(g)CO(g)+H2(g)+CH4(g),测得容器内p(CH3OCH3)的初始值为41.6 kPa,反应过程中反应速率v(CH3OCH3)与时间t和CH3OCH3分压p(CH3OCH3)的关系如图乙所示。
①t=400 s时,CH3OCH3的转化率为 (保留2位有效数字);反应速率满足v(CH3OCH3)=kpn(CH3OCH3),k= s-1;400 s时v(CH3OCH3)=
kPa·s-1。
②达到平衡时,测得体系的总压强p总=121.6 kPa,则该反应的平衡常数Kp=
kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是 ,其理由是________________________________________________
____________________________________________________________________。
培优课堂7 “工业生产调控”中速率、平衡图像题的分析
1.A [A.反应2为该加成反应的主反应,可知反应2较易发生,则反应2的活化能应低于反应1,因此曲线b表示反应2的能量变化图,故A错误;B.由图可知两反应的反应物能量相同,反应2即曲线b对应的产物能量更低,则放出的热量更多,故B正确;C.由图可知第Ⅰ步反应的活化能大于第Ⅱ步反应活化能,活化能越大反应速率越慢,慢反应决定总反应速率,则第Ⅰ步都是反应的决速步骤,故C正确;D.由图可知反应2的活化能低于反应1,因此相同条件下反应2的速率比反应1大,故D正确。]
2.C [A项,A、C两点温度相同,则平衡常数K(A)=K(C),错误。B项,增大压强,平衡逆向移动,则NO2的转化率降低,故A、B、C三点中,C点NO2的转化率最高,错误。C项,B点时c(NO2)=c(CO2),由方程式系数关系可知c(N2)=c(CO2),所以B点时,NO2、N2、CO2的分压分别为16 MPa×,16 MPa×,16 MPa×,该反应的压强平衡常数Kp==3.2,正确。D项,焦炭是固体,改变焦炭的用量,平衡不发生移动,NO2的转化率不变,错误。]
3.B [A.反应Ⅰ中相同时间内 CO2 的转化率最大,即反应速率最快,则使用的催化剂效果最佳,使反应的活化能下降最多,故A正确;B.催化剂具有选择性,催化剂只能改变速率,不能改变平衡,不能提高平衡产率,故B错误;C.b点反应还没有达到平衡,所以v(正)>v(逆),故C正确;D.如a点已达平衡状态,当再升温时,CO2的转化率降低,则平衡逆向移动,故D正确。]
4.C [由图可知:在催化剂催化活性不变的前提下,温度升高,乙酸的生成速率提高,所以乙酸的生成速率随温度升高而升高,A正确;在250~300 ℃时催化剂的活性随温度的升高而降低,因此导致乙酸的生成速率降低,B正确;由300~400 ℃可知,催化剂的催化效率降低,但由于反应物分子具有的能量高,更多的普通分子变为活化分子,所以反应速率增大,不是由于催化剂的催化效率低,乙酸的生成速率才越大,C错误;要提高反应速率,根据图可知在250 ℃时催化剂的催化效率高,乙酸生成速率大,所以可推测在工业上制备乙酸最适宜的温度应为250 ℃,D正确。]
5.D [A项,反应达到平衡后,升高温度,CO2的转化率减小,平衡逆向移动,则该反应的正反应是放热反应,ΔH<0,错误。B项,W点时反应已达到平衡,延长反应时间,CO2的转化率不变,错误。C项,由题图可知,在达到平衡前,催化剂Ni/0.05Mg的催化效率最高,并非Mg的含量越高催化效率越高,错误。D项,当反应温度低于350 ℃时,反应未达到平衡,此时CO2的转化率由反应速率决定,即反应速率越大,相同时间内CO2的转化率越大。因此,使用合适的催化剂,可以加快反应速率,从而提高CO2的转化率,正确。]
6.答案 (1)-49.4 kJ·mol-1 (2)L4 (3)CD
(4)①p3>p2>p1 反应①的正反应是放热反应,反应②的正反应是吸热反应,温度较低时温度对放热反应的影响大,随温度升高,反应①逆向移动,二氧化碳的平衡转化率减小,反应②正向移动,二氧化碳的平衡转化率增大,所以在570 ℃之前,二氧化碳平衡转化率减小的程度大于二氧化碳平衡转化率增大的程度,二氧化碳的平衡转化率降低,温度较高时则相反,所以压强一定时,温度高于570 ℃之后,随着温度升高CO2平衡转化率增大 ②150
解析 (1)已知:
②CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
③CO(g)+2H2(g)CH3OH(g) ΔH=-90.6 kJ·mol-1,
由盖斯定律可知,②+③得到反应①,则ΔH1=ΔH2+ΔH3=-90.6 kJ·mol-1+41.2 kJ·mol-1=-49.4 kJ·mol-1。
(2)温度升高,反应速率加快,速率常数也增大。反应①的正反应是放热反应,温度升高,平衡逆向移动,逆反应速率增大得更快,所以图中能够代表k逆的曲线为L4。
(3)A.增大CO2的浓度,反应物浓度增大,反应①、②的正逆反应速率均增加,A错误;B.恒容密闭容器,容器体积和气体总质量始终不变,则混合气体的密度始终不变,因此不能说明反应已达平衡,B错误;C.加入催化剂,加快反应速率,但是H2的平衡转化率不变,C正确;D.温度为T1时:k正=k逆,平衡时正逆反应速率相等,v正=k正·c(CO2)·c3(H2)=v逆=k逆·c(CH3OH)·c(H2O),K===1,反应①的化学平衡常数K=1,D正确。
(4)①反应①的正反应是气体体积减小的反应,增大压强,平衡正向移动,二氧化碳的平衡转化率增大,反应②反应前后体积不变,平衡不受压强影响,所以p3>p2>p1;反应①的正反应是放热反应,反应②的正反应是吸热反应,温度较低时温度对放热反应的影响大,随温度升高,反应①逆向移动,二氧化碳的平衡转化率减小,反应②正向移动,二氧化碳的平衡转化率增大,所以在570 ℃之前,二氧化碳平衡转化率减小的程度大于二氧化碳平衡转化率增大的程度,二氧化碳的平衡转化率降低,温度较高时则相反,所以压强一定时,温度高于570 ℃之后,随着温度升高CO2平衡转化率增大;②设起始时加入的二氧化碳的物质的量为1 mol,则氢气为3 mol,M点时,二氧化碳的平衡转化率为60%,则转化的二氧化碳为0.6 mol,甲醇的选择性为,则生成甲醇的二氧化碳为0.6 mol×=0.4 mol,在反应①中,同时消耗氢气1.2 mol,生成的甲醇和水蒸气均为0.4 mol,反应②转化的二氧化碳为0.2 mol,同时消耗氢气0.2 mol,生成的CO和水蒸气均为0.2 mol,所以平衡时二氧化碳为1 mol-0.4 mol-0.2 mol=0.4 mol,氢气为3 mol-1.2 mol-0.2 mol=1.6 mol,水蒸气为0.4 mol+0.2 mol=0.6 mol,气体总物质的量为0.4 mol+1.6 mol+0.6 mol+0.2 mol+0.2 mol=3.2 mol,则二氧化碳的分压为×0.1 MPa=0.012 5 MPa,氢气的分压为×0.1 MPa=0.05 MPa,甲醇的分压为×0.1 MPa=0.012 5 MPa,水蒸气的分压为×0.1 MPa=0.018 75 MPa,Kp==150 (MPa)-2。
7.答案 (1)BCD (2)①不是 若P点处于平衡状态,该反应放热,则随着温度升高,平衡逆向移动,CH3OH(g)产率应减小,与题图不符,说明P点不是处于平衡状态 ②升高温度,平衡逆向移动 催化剂的催化活性降低
解析 (1)该反应为反应前后气体分子数不变的放热反应,根据“变量不变达平衡”进行判断。A项,反应前后气体分子数不变,反应过程中容器的体积始终不变,为定量,不能作为平衡状态的判断依据。B项,该反应是一个固体质量增大的反应,当固体的质量不再改变,说明反应达到平衡状态。C项,该反应是一个气体质量减小的反应,当气体的总质量不再改变,说明反应达到平衡状态。D项,正、逆反应速率相等,说明反应达到平衡状态。(2)①若P点处于平衡状态,该反应放热,则随着温度升高,平衡逆向移动,CH3OH(g)产率应减小,与题图不符,说明P点不是处于平衡状态。②490 K之前,CH3OH(g)产率随着温度升高而增大的原因是温度越高,化学反应速率越大。490 K之后,反应达到平衡状态,该反应是放热反应,升高温度,平衡逆向移动,CH3OH(g)产率减小;由题图知催化剂的催化活性降低,使CH3OH(g)产率减小。
8.答案 (1)C 3 (2)①温度升高,反应速率增大,转化率升高 D ②促使平衡正向移动
解析 (1)未能真正理解决定CO2转化率大小的因素是n(H2)还是CH3OH的体积分数而出错。增大n(H2),CO2的转化率升高,所以C点对应体系中CO2的转化率最大。而CO2和H2按化学计量数之比投料时,生成的CH3OH的体积分数最大,即x=3。(2)①放热反应,温度升高,平衡逆向移动,乙烷转化率降低,但乙烷的转化率随温度升高而升高,说明反应均未达到平衡状态,则转化率受反应速率影响,随温度升高,反应速率增大,转化率升高。对比选项中4个温度发现,850 ℃时,对应乙烷的转化率较高,乙烯的选择性较高,副产物相对较少,且乙烯收率较高。②该反应的正反应是气体分子数增大的反应,恒压条件下充入惰性气体,相当于减小体系压强,有利于平衡正向移动,提高反应物的转化率。
9.答案 (1)ΔH1+ΔH2 K1·K2 (2)曲线A
(3)①2.00 ②97.6% ③< ④60 s-1 1
解析 (1)根据盖斯定律,Ⅰ+Ⅱ=Ⅲ,则ΔH3=ΔH1+ΔH2,K3=K1·K2。(2)与pH=7.4时相比,pH=7.6时, 氢离子浓度减小,平衡HbO2(aq)+H+(aq)HbH+(aq)+O2(g)逆向移动,c(HbO2)增大,Hb与氧气的结合度增大,故pH=7.6时对应的曲线为曲线A。(3)①对于反应Mb(aq)+O2(g)MbO2(aq),假设反应开始时Mb的浓度为1 mol·L-1,根据题图2可知p(O2)=2.00 kPa时,α=80.0%,则平衡时c(Mb)=0.2 mol·L-1,c(MbO2)=0.8 mol·L-1,K===2.00 kPa-1。②人正常呼吸时,体温约为37 ℃,则K=2.00 kPa-1,设反应开始时Mb的浓度为1 mol·L-1,当p(O2)=20.00 kPa时,2.00 kPa-1=,解得α≈97.6%。③体温升高,Mb与氧气的结合度降低,说明平衡逆向移动,则该反应的正反应为放热反应,ΔH<0。④当反应达到平衡时,v正=v逆,由于v正=k1·c(Mb)·p(O2),v逆=k2·c(MbO2),则平衡时有k1·c(Mb)·p(O2)=k2·c(MbO2),==K=2.00 kPa-1,若k1=120 s-1·kPa-1,则k2==60 s-1;题图2中的C点,反应处于平衡状态,则v正=v逆,故=1。
10.答案 (1)①ΔH1+ΔH2-2ΔH3 ②B
(2)①16% 4.4×10-4 1.54×10②3.8×104 ③增大反应物的压强 增大反应物的压强,化学反应速率加快
解析 (1)①已知:
ⅰ.CH3OCH3(g)CO(g)+H2(g)+CH4(g) ΔH1
ⅱ.CH4(g)+O2(g)===CO(g)+2H2O(g) ΔH2
ⅲ.H2(g)+O2(g)===H2O(g) ΔH3
根据盖斯定律,由ⅰ+ⅱ-ⅲ×2可得CH3OCH3(g)+O2(g)===2CO(g)+3H2(g) ΔH=ΔH1+ΔH2-2ΔH3。
②反应Ⅰ:CH3OCH3(g)+O2(g)===2CO(g)+3H2(g),由已知信息可知,过量的O2与H2会发生副反应生成H2O,使H2的体积分数快速降低,A、C选项不能解释H2体积分数快速降低的原因。
(2)①设起始时CH3OCH3的物质的量为n mol,400 s CH3OCH3的转化率为α,则400 s时气体总物质的量为(n+2nα) mol,根据等温等体积条件下,压强之比等于物质的量之比,有=,解得α≈0.16=16%;由图乙可知,当p(CH3OCH3)=10.0 kPa时,v(CH3OCH3)=4.4×10-3 kPa·s-1,由题图乙知v(CH3OCH3)=kpn(CH3OCH3),n=1,则k==4.4×10-4 s-1;由图乙可知,400 s时p(CH3OCH3)=35.0 kPa,则v(CH3OCH3)=4.4×10-4 s-1×35.0 kPa=1.54×10-2 kPa·s-1。②达到平衡时,测得体系的总压强p总=121.6 kPa,设CH3OCH3平衡转化率为α1,起始时CH3OCH3的物质的量为n mol,则
平衡时容器中总物质的量为(n+2nα1) mol,根据等温等体积条件下,压强之比等于物质的量之比,有=,解得α1≈0.96,则平衡时p(CH3OCH3)=p总≈1.67 kPa,p(CO)=p(H2)=p(CH4)=p总≈39.98 kPa,则该反应的平衡常数Kp=≈3.8×104 kPa2。③除使用催化剂外,增大反应物的压强也能加快化学反应速率。
1.(2023·惠州一模)丙烯与HBr发生加成反应的机理及反应体系中的能量变化如图所示,下列说法错误的是( )
A.曲线a表示的是反应2的能量变化图
B.反应2放出热量更多
C.对于反应1和反应2,第Ⅰ步都是反应的决速步骤
D.相同条件下反应2的速率比反应1大
2.用焦炭还原NO2的反应为2NO2(g)+2C(s)N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C在不同容积的容器中发生反应,测得平衡时CO2和NO2的物质的量浓度与平衡总压的关系如图所示。下列描述正确的是( )
A.平衡常数:K(A)>K(C)
B.A、B、C三点中,C点NO2的转化率最低
C.B点时,若反应初始压强为12.8 MPa,则Kp=3.2
D.焦炭的用量越多,NO2的转化率越高
3.(2023·广州为明学校调研)利用工业废气中的CO2可以制取甲醇,CO2(g)+3H2(g)CH3OH(g)+H2O(g),一定条件下往恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应Ⅰ、反应Ⅱ与反应Ⅲ,相同时间内CO2的转化率随温度变化如图所示:
下列说法不正确的是( )
A.反应Ⅰ中使用的催化剂效果最佳,使反应的活化能下降最多
B.催化剂具有选择性、反应Ⅱ的催化剂相对反应Ⅲ的催化剂更能提高平衡产率
C.b点v(正)>v(逆)
D.如a点已达平衡状态,当再升温时,平衡会逆向移动
4.以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法不正确的是( )
A.由图可知:乙酸的生成速率随温度升高而升高
B.250~300 ℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低
C.由300~400 ℃可知,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大
D.根据图推测,工业上制备乙酸最适宜的温度应为250 ℃
5.已知:H2和CO2在一定条件下可发生反应4H2(g)+CO2(g)CH4(g)+2H2O(g) ΔH。在恒压条件下,控制H2和CO2的起始浓度相同,用不同Mg含量的催化剂Ni/xMg(x值越大表示Mg含量越高)催化该反应相同时间,测得不同温度下CO2的转化率如图所示。下列说法正确的是( )
A.ΔH>0
B.延长W点的反应时间可提高CO2的转化率
C.相同条件下催化剂中Mg的含量越高,催化效率越高
D.当反应温度低于350 ℃时,使用合适的催化剂可以提高CO2的转化率
6.(2023·广州天河区期末)近年来我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳中和”,将CO2转化为高附加值化学品成为科学家研究的重要课题。
Ⅰ.Cu-ZnO催化CO2和H2生产甲醇。
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1
②CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
(1)已知:CO(g)+2H2(g)CH3OH(g) ΔH=-90.6 kJ·mol-1,则ΔH1= 。
(2)已知:反应①的正反应速率可表示为v正=k正·c(CO2)·c3(H2),逆反应速率可表示为v逆=k逆·c(CH3OH)·c(H2O),其中k正、k逆为速率常数。图中能够代表k逆的曲线为 (填“L1”,“L2”、“L3”或“L4”)。
(3)对于上述反应体系,下列说法正确的是 。
A.增大CO2的浓度,反应①、②的正反应速率均增加,逆反应速率均减小
B.恒容密闭容器中气体密度不变时,反应达到平衡状态
C.加入催化剂,H2的平衡转化率不变
D.温度为T1时,反应①的化学平衡常数K=1
(4)不同条件下,按照n(CO2)∶n(H2)=1∶3投料,CO2的平衡转化率如图所示。
①压强p1、p2、p3由大到小的顺序是 ,压强为p1时,温度高于570 ℃之后,随着温度升高CO2平衡转化率增大的原因是_________________________
___________________________________________________________________。
②图中点M(500,60),此时压强p1为0.1 MPa,CH3OH的选择性为(选择性:转化的CO2中生成CH3OH占整个转化的CO2的百分比)。则该温度时反应①的平衡常数Kp= (MPa)-2(分压=总压×物质的量分数)。
7.研究含碳化合物的相互转化,有利于提高工业生产效率。回答下列问题:
(1)在一体积可变的密闭容器中加入一定量的Mn(s)并充入一定量的CO2(g),发生反应:Mn(s)+CO2(g)MnO(s)+CO(g) ΔH<0。下列能说明该反应达到平衡状态的是 (填标号)。
A.容器的体积不再改变
B.固体的质量不再改变
C.气体的总质量不再改变
D.v正(CO2)=v逆(CO)
(2)已知:CO(g)+2H2(g)CH3OH(g) ΔH<0。若将一定比例的CO(g)和H2(g)在装有催化剂的反应器中反应12小时,体系中CH3OH(g)的产率和催化剂的催化活性与温度的变化关系如图所示。
①P点 (填“是”或“不是”)处于平衡状态,原因是___________________________________________________________________
___________________________________________________________________。
②490 K之后,CH3OH(g)产率随温度升高而减小的原因可能是___________________________________________________________________,
___________________________________________________________________。
8.(1)T ℃时,在恒容密闭容器中充入1 mol CO2和n mol H2,在一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0。平衡后混合气体中CH3OH的体积分数与氢气的物质的量的关系如图1所示。图1中A、B、C三点对应的体系中,CO2的转化率最大的是 (填“A”“B”或“C”),x= 。
(2)现代制备乙烯常用乙烷氧化裂解法,主反应为C2H6(g)+O2(g)C2H4(g)+H2O(g) ΔH=-110 kJ· mol-1,反应时还会生成CH4、CO、CO2等副产物(副反应均为放热反应),如图2所示为温度对乙烷氧化裂解反应的影响。已知:乙烯选择性=×100%;乙烯收率=乙烷转化率×乙烯选择性。
①乙烷转化率随温度的升高而升高的原因是______________________________
____________________________________________________________________;
反应的最佳温度为 (填标号)。
A.650 ℃ B.700 ℃
C.775 ℃ D.850 ℃
②工业上,保持体系总压强恒定在100 kPa下进行该反应,且通常在乙烷和氧气的混合气体中掺入惰性气体(惰性气体的体积分数为70%),掺入惰性气体的目的是__________________________________________________________________
___________________________________________________________________。
9.血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度α(吸附O2的Hb或Mb的量与总Hb或Mb的量的比值)和氧气分压p(O2)密切相关。请回答下列问题:
(1)人体中的血红蛋白(Hb)能吸附O2、H+,相关反应的热化学方程式及平衡常数如下。
Ⅰ.Hb(aq)+H+(aq)HbH+(aq) ΔH1 K1
Ⅱ.HbH+(aq)+O2(g)HbO2(aq)+H+(aq) ΔH2 K2
Ⅲ.Hb(aq)+O2(g)HbO2(aq) ΔH3 K3
ΔH3= (用ΔH1、ΔH2表示),K3= (用K1、K2表示)。
(2)Hb与氧气的结合度受c(H+)的影响,相关反应为HbO2(aq)+H+(aq)HbH+(aq)+O2(g)。37 ℃,pH分别为7.2、7.4、7.6时氧气分压p(O2)与达到平衡时Hb与氧气的结合度α的关系如图1所示,pH=7.6时对应的曲线为 (填“曲线A”或“曲线B”)。
(3)Mb与氧气结合的反应为Mb(aq)+O2(g)MbO2(aq) ΔH,37 ℃时,氧气分压p(O2)与达到平衡时Mb与氧气的结合度α的关系如图2所示。
①已知Mb与氧气结合的反应的平衡常数的表达式K=,则37 ℃时K= kPa-1。
②人正常呼吸时,体温约为37 ℃,氧气分压约为20.00 kPa,此时Mb与氧气的最大结合度为 (结果保留3位有效数字)。
③经测定,体温升高,Mb与氧气的结合度降低,则该反应的ΔH (填“>”或“<”)0。
④已知37 ℃时,上述反应的正反应速率v正=k1·c(Mb)·p(O2),逆反应速率v逆=k2·c(MbO2),若k1=120 s-1·kPa-1,则k2= 。图2中C点时,= 。
10.二甲醚(CH3OCH3)重整制取H2具有无毒、无刺激性等优点。回答下列问题:
(1)CH3OCH3和O2发生反应Ⅰ:CH3OCH3(g)+O2(g)===2CO(g)+3H2(g) ΔH
已知:CH3OCH3(g)CO(g)+H2(g)+CH4(g) ΔH1
CH4(g)+O2(g)===CO(g)+2H2O(g) ΔH2
H2(g)+O2(g)===H2O(g) ΔH3
①则反应Ⅰ的ΔH= (用含ΔH1、ΔH2、ΔH3的代数式表示)。
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应Ⅰ。测得平衡时H2的体积分数与进料气中的关系如图甲所示。当>0.6时,H2的体积分数快速降低,其主要原因是 (填序号)。
A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C.>0.6时,平衡向逆反应方向移动
(2)T ℃时,在恒容密闭容器中通入CH3OCH3,发生反应Ⅱ:CH3OCH3(g)CO(g)+H2(g)+CH4(g),测得容器内p(CH3OCH3)的初始值为41.6 kPa,反应过程中反应速率v(CH3OCH3)与时间t和CH3OCH3分压p(CH3OCH3)的关系如图乙所示。
①t=400 s时,CH3OCH3的转化率为 (保留2位有效数字);反应速率满足v(CH3OCH3)=kpn(CH3OCH3),k= s-1;400 s时v(CH3OCH3)=
kPa·s-1。
②达到平衡时,测得体系的总压强p总=121.6 kPa,则该反应的平衡常数Kp=
kPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是 ,其理由是________________________________________________
____________________________________________________________________。
培优课堂7 “工业生产调控”中速率、平衡图像题的分析
1.A [A.反应2为该加成反应的主反应,可知反应2较易发生,则反应2的活化能应低于反应1,因此曲线b表示反应2的能量变化图,故A错误;B.由图可知两反应的反应物能量相同,反应2即曲线b对应的产物能量更低,则放出的热量更多,故B正确;C.由图可知第Ⅰ步反应的活化能大于第Ⅱ步反应活化能,活化能越大反应速率越慢,慢反应决定总反应速率,则第Ⅰ步都是反应的决速步骤,故C正确;D.由图可知反应2的活化能低于反应1,因此相同条件下反应2的速率比反应1大,故D正确。]
2.C [A项,A、C两点温度相同,则平衡常数K(A)=K(C),错误。B项,增大压强,平衡逆向移动,则NO2的转化率降低,故A、B、C三点中,C点NO2的转化率最高,错误。C项,B点时c(NO2)=c(CO2),由方程式系数关系可知c(N2)=c(CO2),所以B点时,NO2、N2、CO2的分压分别为16 MPa×,16 MPa×,16 MPa×,该反应的压强平衡常数Kp==3.2,正确。D项,焦炭是固体,改变焦炭的用量,平衡不发生移动,NO2的转化率不变,错误。]
3.B [A.反应Ⅰ中相同时间内 CO2 的转化率最大,即反应速率最快,则使用的催化剂效果最佳,使反应的活化能下降最多,故A正确;B.催化剂具有选择性,催化剂只能改变速率,不能改变平衡,不能提高平衡产率,故B错误;C.b点反应还没有达到平衡,所以v(正)>v(逆),故C正确;D.如a点已达平衡状态,当再升温时,CO2的转化率降低,则平衡逆向移动,故D正确。]
4.C [由图可知:在催化剂催化活性不变的前提下,温度升高,乙酸的生成速率提高,所以乙酸的生成速率随温度升高而升高,A正确;在250~300 ℃时催化剂的活性随温度的升高而降低,因此导致乙酸的生成速率降低,B正确;由300~400 ℃可知,催化剂的催化效率降低,但由于反应物分子具有的能量高,更多的普通分子变为活化分子,所以反应速率增大,不是由于催化剂的催化效率低,乙酸的生成速率才越大,C错误;要提高反应速率,根据图可知在250 ℃时催化剂的催化效率高,乙酸生成速率大,所以可推测在工业上制备乙酸最适宜的温度应为250 ℃,D正确。]
5.D [A项,反应达到平衡后,升高温度,CO2的转化率减小,平衡逆向移动,则该反应的正反应是放热反应,ΔH<0,错误。B项,W点时反应已达到平衡,延长反应时间,CO2的转化率不变,错误。C项,由题图可知,在达到平衡前,催化剂Ni/0.05Mg的催化效率最高,并非Mg的含量越高催化效率越高,错误。D项,当反应温度低于350 ℃时,反应未达到平衡,此时CO2的转化率由反应速率决定,即反应速率越大,相同时间内CO2的转化率越大。因此,使用合适的催化剂,可以加快反应速率,从而提高CO2的转化率,正确。]
6.答案 (1)-49.4 kJ·mol-1 (2)L4 (3)CD
(4)①p3>p2>p1 反应①的正反应是放热反应,反应②的正反应是吸热反应,温度较低时温度对放热反应的影响大,随温度升高,反应①逆向移动,二氧化碳的平衡转化率减小,反应②正向移动,二氧化碳的平衡转化率增大,所以在570 ℃之前,二氧化碳平衡转化率减小的程度大于二氧化碳平衡转化率增大的程度,二氧化碳的平衡转化率降低,温度较高时则相反,所以压强一定时,温度高于570 ℃之后,随着温度升高CO2平衡转化率增大 ②150
解析 (1)已知:
②CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
③CO(g)+2H2(g)CH3OH(g) ΔH=-90.6 kJ·mol-1,
由盖斯定律可知,②+③得到反应①,则ΔH1=ΔH2+ΔH3=-90.6 kJ·mol-1+41.2 kJ·mol-1=-49.4 kJ·mol-1。
(2)温度升高,反应速率加快,速率常数也增大。反应①的正反应是放热反应,温度升高,平衡逆向移动,逆反应速率增大得更快,所以图中能够代表k逆的曲线为L4。
(3)A.增大CO2的浓度,反应物浓度增大,反应①、②的正逆反应速率均增加,A错误;B.恒容密闭容器,容器体积和气体总质量始终不变,则混合气体的密度始终不变,因此不能说明反应已达平衡,B错误;C.加入催化剂,加快反应速率,但是H2的平衡转化率不变,C正确;D.温度为T1时:k正=k逆,平衡时正逆反应速率相等,v正=k正·c(CO2)·c3(H2)=v逆=k逆·c(CH3OH)·c(H2O),K===1,反应①的化学平衡常数K=1,D正确。
(4)①反应①的正反应是气体体积减小的反应,增大压强,平衡正向移动,二氧化碳的平衡转化率增大,反应②反应前后体积不变,平衡不受压强影响,所以p3>p2>p1;反应①的正反应是放热反应,反应②的正反应是吸热反应,温度较低时温度对放热反应的影响大,随温度升高,反应①逆向移动,二氧化碳的平衡转化率减小,反应②正向移动,二氧化碳的平衡转化率增大,所以在570 ℃之前,二氧化碳平衡转化率减小的程度大于二氧化碳平衡转化率增大的程度,二氧化碳的平衡转化率降低,温度较高时则相反,所以压强一定时,温度高于570 ℃之后,随着温度升高CO2平衡转化率增大;②设起始时加入的二氧化碳的物质的量为1 mol,则氢气为3 mol,M点时,二氧化碳的平衡转化率为60%,则转化的二氧化碳为0.6 mol,甲醇的选择性为,则生成甲醇的二氧化碳为0.6 mol×=0.4 mol,在反应①中,同时消耗氢气1.2 mol,生成的甲醇和水蒸气均为0.4 mol,反应②转化的二氧化碳为0.2 mol,同时消耗氢气0.2 mol,生成的CO和水蒸气均为0.2 mol,所以平衡时二氧化碳为1 mol-0.4 mol-0.2 mol=0.4 mol,氢气为3 mol-1.2 mol-0.2 mol=1.6 mol,水蒸气为0.4 mol+0.2 mol=0.6 mol,气体总物质的量为0.4 mol+1.6 mol+0.6 mol+0.2 mol+0.2 mol=3.2 mol,则二氧化碳的分压为×0.1 MPa=0.012 5 MPa,氢气的分压为×0.1 MPa=0.05 MPa,甲醇的分压为×0.1 MPa=0.012 5 MPa,水蒸气的分压为×0.1 MPa=0.018 75 MPa,Kp==150 (MPa)-2。
7.答案 (1)BCD (2)①不是 若P点处于平衡状态,该反应放热,则随着温度升高,平衡逆向移动,CH3OH(g)产率应减小,与题图不符,说明P点不是处于平衡状态 ②升高温度,平衡逆向移动 催化剂的催化活性降低
解析 (1)该反应为反应前后气体分子数不变的放热反应,根据“变量不变达平衡”进行判断。A项,反应前后气体分子数不变,反应过程中容器的体积始终不变,为定量,不能作为平衡状态的判断依据。B项,该反应是一个固体质量增大的反应,当固体的质量不再改变,说明反应达到平衡状态。C项,该反应是一个气体质量减小的反应,当气体的总质量不再改变,说明反应达到平衡状态。D项,正、逆反应速率相等,说明反应达到平衡状态。(2)①若P点处于平衡状态,该反应放热,则随着温度升高,平衡逆向移动,CH3OH(g)产率应减小,与题图不符,说明P点不是处于平衡状态。②490 K之前,CH3OH(g)产率随着温度升高而增大的原因是温度越高,化学反应速率越大。490 K之后,反应达到平衡状态,该反应是放热反应,升高温度,平衡逆向移动,CH3OH(g)产率减小;由题图知催化剂的催化活性降低,使CH3OH(g)产率减小。
8.答案 (1)C 3 (2)①温度升高,反应速率增大,转化率升高 D ②促使平衡正向移动
解析 (1)未能真正理解决定CO2转化率大小的因素是n(H2)还是CH3OH的体积分数而出错。增大n(H2),CO2的转化率升高,所以C点对应体系中CO2的转化率最大。而CO2和H2按化学计量数之比投料时,生成的CH3OH的体积分数最大,即x=3。(2)①放热反应,温度升高,平衡逆向移动,乙烷转化率降低,但乙烷的转化率随温度升高而升高,说明反应均未达到平衡状态,则转化率受反应速率影响,随温度升高,反应速率增大,转化率升高。对比选项中4个温度发现,850 ℃时,对应乙烷的转化率较高,乙烯的选择性较高,副产物相对较少,且乙烯收率较高。②该反应的正反应是气体分子数增大的反应,恒压条件下充入惰性气体,相当于减小体系压强,有利于平衡正向移动,提高反应物的转化率。
9.答案 (1)ΔH1+ΔH2 K1·K2 (2)曲线A
(3)①2.00 ②97.6% ③< ④60 s-1 1
解析 (1)根据盖斯定律,Ⅰ+Ⅱ=Ⅲ,则ΔH3=ΔH1+ΔH2,K3=K1·K2。(2)与pH=7.4时相比,pH=7.6时, 氢离子浓度减小,平衡HbO2(aq)+H+(aq)HbH+(aq)+O2(g)逆向移动,c(HbO2)增大,Hb与氧气的结合度增大,故pH=7.6时对应的曲线为曲线A。(3)①对于反应Mb(aq)+O2(g)MbO2(aq),假设反应开始时Mb的浓度为1 mol·L-1,根据题图2可知p(O2)=2.00 kPa时,α=80.0%,则平衡时c(Mb)=0.2 mol·L-1,c(MbO2)=0.8 mol·L-1,K===2.00 kPa-1。②人正常呼吸时,体温约为37 ℃,则K=2.00 kPa-1,设反应开始时Mb的浓度为1 mol·L-1,当p(O2)=20.00 kPa时,2.00 kPa-1=,解得α≈97.6%。③体温升高,Mb与氧气的结合度降低,说明平衡逆向移动,则该反应的正反应为放热反应,ΔH<0。④当反应达到平衡时,v正=v逆,由于v正=k1·c(Mb)·p(O2),v逆=k2·c(MbO2),则平衡时有k1·c(Mb)·p(O2)=k2·c(MbO2),==K=2.00 kPa-1,若k1=120 s-1·kPa-1,则k2==60 s-1;题图2中的C点,反应处于平衡状态,则v正=v逆,故=1。
10.答案 (1)①ΔH1+ΔH2-2ΔH3 ②B
(2)①16% 4.4×10-4 1.54×10②3.8×104 ③增大反应物的压强 增大反应物的压强,化学反应速率加快
解析 (1)①已知:
ⅰ.CH3OCH3(g)CO(g)+H2(g)+CH4(g) ΔH1
ⅱ.CH4(g)+O2(g)===CO(g)+2H2O(g) ΔH2
ⅲ.H2(g)+O2(g)===H2O(g) ΔH3
根据盖斯定律,由ⅰ+ⅱ-ⅲ×2可得CH3OCH3(g)+O2(g)===2CO(g)+3H2(g) ΔH=ΔH1+ΔH2-2ΔH3。
②反应Ⅰ:CH3OCH3(g)+O2(g)===2CO(g)+3H2(g),由已知信息可知,过量的O2与H2会发生副反应生成H2O,使H2的体积分数快速降低,A、C选项不能解释H2体积分数快速降低的原因。
(2)①设起始时CH3OCH3的物质的量为n mol,400 s CH3OCH3的转化率为α,则400 s时气体总物质的量为(n+2nα) mol,根据等温等体积条件下,压强之比等于物质的量之比,有=,解得α≈0.16=16%;由图乙可知,当p(CH3OCH3)=10.0 kPa时,v(CH3OCH3)=4.4×10-3 kPa·s-1,由题图乙知v(CH3OCH3)=kpn(CH3OCH3),n=1,则k==4.4×10-4 s-1;由图乙可知,400 s时p(CH3OCH3)=35.0 kPa,则v(CH3OCH3)=4.4×10-4 s-1×35.0 kPa=1.54×10-2 kPa·s-1。②达到平衡时,测得体系的总压强p总=121.6 kPa,设CH3OCH3平衡转化率为α1,起始时CH3OCH3的物质的量为n mol,则
平衡时容器中总物质的量为(n+2nα1) mol,根据等温等体积条件下,压强之比等于物质的量之比,有=,解得α1≈0.96,则平衡时p(CH3OCH3)=p总≈1.67 kPa,p(CO)=p(H2)=p(CH4)=p总≈39.98 kPa,则该反应的平衡常数Kp=≈3.8×104 kPa2。③除使用催化剂外,增大反应物的压强也能加快化学反应速率。
同课章节目录
