选择题突破八 反应历程(机理)分析 专项特训(含解析)2024年高考化学二轮复习
文档属性
| 名称 | 选择题突破八 反应历程(机理)分析 专项特训(含解析)2024年高考化学二轮复习 |  | |
| 格式 | DOCX | ||
| 文件大小 | 797.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-13 19:32:25 | ||
图片预览


文档简介
选择题突破八 反应历程(机理)分析
A卷
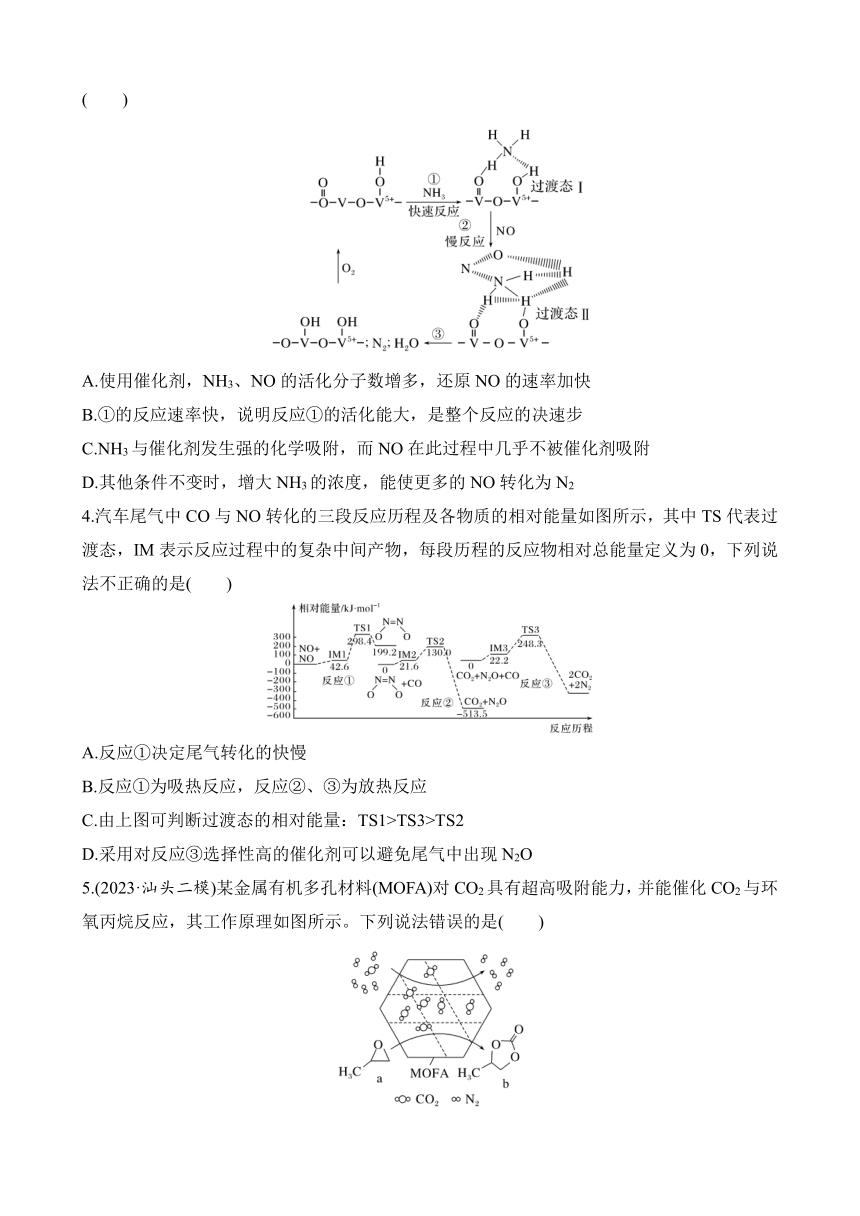
1.(2023·广东名校联盟联考)在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出的CO2的转化过程如图。下列说法正确的是( )
A.甲醇和甲酸乙酯中均含有σ键和π键
B.反应过程中,金属M的化合价未发生改变
C.基态铜元素的第二电离能大于基态锌元素的第二电离能
D.反应过程中,催化剂参与反应,改变了反应历程,降低了反应的焓
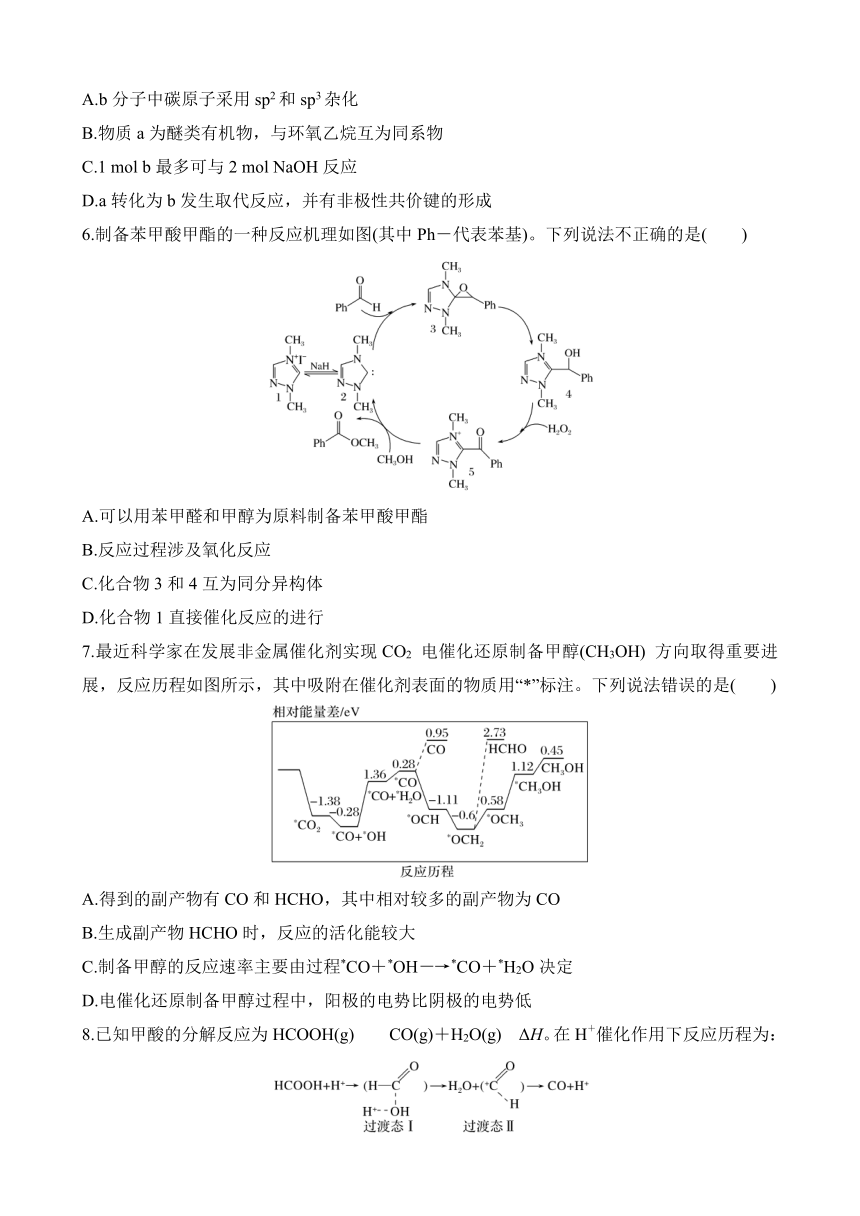
2.(2023·广东二模)我国科学家合成了一种新型Au15/MoC材料,实现了低温催化水煤气变换。反应历程如图所示,其中吸附在催化剂表面的物种用“*”标注,TS指过渡态。下列有关说法不正确的是( )
A.温度一定时,加压无法提高平衡转化率
B.分子从催化剂表面脱附的过程都是吸热的
C.反应历程中活化能最大的一步为CO*+2H2O*―→CO*+H2O*+OH*+H*
D.该过程有极性键的断裂和生成
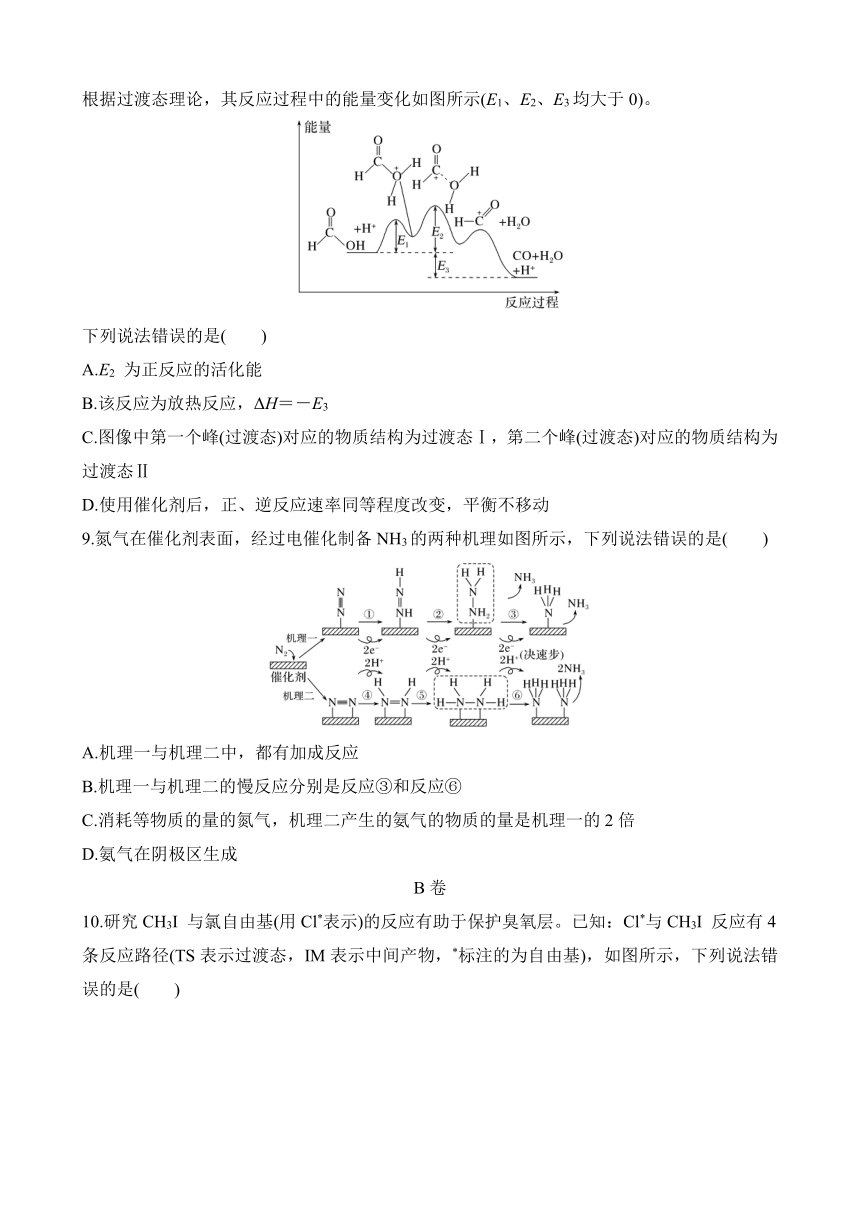
3.NH3选择性催化还原NO的反应为4NH3+6NO5N2+6H2O,其反应历程如图所示。一定温度下,向恒容密闭容器中充入一定量的NH3、NO和O2,发生反应。下列说法错误的是( )
A.使用催化剂,NH3、NO的活化分子数增多,还原NO的速率加快
B.①的反应速率快,说明反应①的活化能大,是整个反应的决速步
C.NH3与催化剂发生强的化学吸附,而NO在此过程中几乎不被催化剂吸附
D.其他条件不变时,增大NH3的浓度,能使更多的NO转化为N2
4.汽车尾气中CO与NO转化的三段反应历程及各物质的相对能量如图所示,其中TS代表过渡态,IM表示反应过程中的复杂中间产物,每段历程的反应物相对总能量定义为0,下列说法不正确的是( )
A.反应①决定尾气转化的快慢
B.反应①为吸热反应,反应②、③为放热反应
C.由上图可判断过渡态的相对能量:TS1>TS3>TS2
D.采用对反应③选择性高的催化剂可以避免尾气中出现N2O
5.(2023·汕头二模)某金属有机多孔材料(MOFA)对CO2具有超高吸附能力,并能催化CO2与环氧丙烷反应,其工作原理如图所示。下列说法错误的是( )
A.b分子中碳原子采用sp2和sp3杂化
B.物质a为醚类有机物,与环氧乙烷互为同系物
C.1 mol b最多可与2 mol NaOH反应
D.a转化为b发生取代反应,并有非极性共价键的形成
6.制备苯甲酸甲酯的一种反应机理如图(其中Ph-代表苯基)。下列说法不正确的是( )
A.可以用苯甲醛和甲醇为原料制备苯甲酸甲酯
B.反应过程涉及氧化反应
C.化合物3和4互为同分异构体
D.化合物1直接催化反应的进行
7.最近科学家在发展非金属催化剂实现CO2 电催化还原制备甲醇(CH3OH) 方向取得重要进展,反应历程如图所示,其中吸附在催化剂表面的物质用“*”标注。下列说法错误的是( )
A.得到的副产物有CO和HCHO,其中相对较多的副产物为CO
B.生成副产物HCHO时,反应的活化能较大
C.制备甲醇的反应速率主要由过程*CO+*OH―→*CO+*H2O决定
D.电催化还原制备甲醇过程中,阳极的电势比阴极的电势低
8.已知甲酸的分解反应为HCOOH(g)??CO(g)+H2O(g) ΔH。在H+催化作用下反应历程为:
根据过渡态理论,其反应过程中的能量变化如图所示(E1、E2、E3均大于0)。
下列说法错误的是( )
A.E2 为正反应的活化能
B.该反应为放热反应,ΔH=-E3
C.图像中第一个峰(过渡态)对应的物质结构为过渡态Ⅰ,第二个峰(过渡态)对应的物质结构为过渡态Ⅱ
D.使用催化剂后,正、逆反应速率同等程度改变,平衡不移动
9.氮气在催化剂表面,经过电催化制备NH3的两种机理如图所示,下列说法错误的是( )
A.机理一与机理二中,都有加成反应
B.机理一与机理二的慢反应分别是反应③和反应⑥
C.消耗等物质的量的氮气,机理二产生的氨气的物质的量是机理一的2倍
D.氨气在阴极区生成
B卷
10.研究CH3I 与氯自由基(用Cl*表示)的反应有助于保护臭氧层。已知:Cl*与CH3I 反应有4条反应路径(TS表示过渡态,IM表示中间产物,*标注的为自由基),如图所示,下列说法错误的是( )
A.路径①的ΔH>0
B.路径②是基元反应
C.路径③的反应速率最大
D.逆反应的活化能路径④的最大
11.二甲醚(CH3OCH3) 被称为21世纪的“清洁能源”。科学家研究在酸性条件下,用甲醇可合成二甲醚,反应历程中相对能量变化如图所示。
下列叙述错误的是( )
A.循环过程中,催化剂参与了中间反应
B.该历程中最小的能垒(基元反应活化能)为1.31 kJ·mol-1
C.决定总反应速率的基元反应为―→CH3OCH3+H+
D. 总反应的化学方程式为2CH3OHCH3OCH3+H2O
12.某种制备H2O2 的反应机理如图。下列说法不正确的是( )
A.总反应可表示为H2+O2H2O2
B.该过程中Pd有0和+2两种化合价
C.①、②、③均为氧化还原反应
D.HCl 和Cl- 可循环利用
13.某科研团队合作开发了活性位点催化剂,先“吸氢”再将硝基化合物转化为氨基化合物,反应历程和每步的活化能如图所示:
下列说法正确的是( )
A.—S—Co—是该反应历程的中间产物
B.提高Ⅲ→Ⅳ的反应速率,对快速提升总反应速率起决定性作用
C.I→Ⅱ→Ⅲ→Ⅳ的转化过程中,N元素的化合价逐渐降低
D.总反应为+4—S—Co—+2H2O
14.乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列叙述正确的是( )
A.总反应为放热反应,故此反应不需要加热就能发生
B.①②步反应属于加成反应
C.总反应速率由第②步反应决定
D.该反应过程中有极性键形成
15.随着节能环保问题的提出,人们开始关注逆水煤气反应(RWGS)的研究。单一分子RWGS在Fe3O4催化剂表面的反应历程如下图所示,主要有:氧化还原历程[TS1-TS2-TS3-TS4-CO(a)+H2O(a)]和中间物种分解历程[TS1-TS6-TS7-TS5-HCOO(a)+H(a)][已知(a)表示物质吸附在催化剂表面的状态]。下列说法正确的是( )
A.该反应为放热反应
B.RWGS在Fe3O4催化剂表面反应的主要历程是中间物种分解历程
C.氧化还原历程控速步骤为CO(a)+H2O(a)===CO(g)+H2O(g)
D.使用高效催化剂,加快化学反应速率,从而提高平衡转化率
16.在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列叙述错误的是( )
A.催化剂可以同时产生多种反应历程
B.含C微粒参与的反应均有元素化合价变化
C.增大NO的量,反应热和平衡产率不变
D.当主要发生包含②的历程时,最终生成的水量改变
17.(2023·湛江二模)吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步脱氢产物及其相对能量如图,下列说法错误的是( )
A.甲醇脱氢生成CO的过程中有极性键的断裂
B.b→c的反应式为(—CH2OH)top→CH2O+H
C.a→i与a→j的过程中均有π键的形成
D.b→c与b→d的过程均断裂了氢氧键
选择题突破八 反应历程(机理)分析
1.C [A.甲醇分子式为CH3OH,结构中只有单键,即只有σ键,没有π键,A错误;B.由反应①知二氧化碳中碳元素化合价降低,所以金属M化合价发生变化,B错误;C.Cu+价电子排布式为3d10,Zn+价电子排布式为3d104s1,又Cu+的3d10全满稳定且3d能量低于4s能量,所以基态铜元素的第二电离能大于基态锌元素的第二电离能,C正确;D.催化剂参与反应可以加快反应速率,降低反应的活化能,改变反应历程,但不改变焓变,D错误。]
2.B [A.该反应为CO(g)+H2O(g)CO2(g)+H2(g),该反应为等体积反应,温度一定时加压化学平衡不移动,平衡转化率不变,A正确;B.从图中可知并不是所有分子从催化剂表面脱附的过程都是吸热的,如CO+H2O*+2H*转化为CO2+H2O*+2H*的过程就是放热的,B错误;C.从图中可知,过渡态TS1的相对能量最大,此时的活化能最大,因此反应历程中活化能最大的一步为CO*+2H2O*―→CO*+H2O*+OH*+H*,C正确;D.该过程中H2O中的O—H键断裂,同时也有CO2中C=O键的生成,D正确。]
3.B [A.使用催化剂能降低反应的活化能,活化分子数增多,反应速率加快,A正确;B.反应①的反应速率快,说明反应①的活化能小,反应的决速步是反应速率最慢的反应②,B错误;C.由反应历程图可知,在反应过程中,NH3与催化剂发生强的化学吸附,而NO与NH3结合,NO几乎不被催化剂吸附,C正确;D.其他条件不变时,增大NH3的浓度,平衡正向移动,能使更多的NO转化为N2,D正确。]
4.D [A.由图可知,反应①的活化能最高,为298.4 kJ·mol-1-42.6 kJ·mol-1=255.8 kJ·mol-1,反应②、③的活化能分别为108.4 kJ·mol-1、226.1 kJ·mol-1,活化能越高反应速率越慢,慢反应决定整个反应的速率,故反应①决定尾气转化的快慢,A正确;B.由图可知,反应①为吸热反应,反应②、③为放热反应,B正确;C.图中可知三个过渡态的能量分别为298.4 kJ·mol-1、130.0 kJ·mol-1、248.3 kJ·mol-1,故过渡态的相对能量:TS1>TS3>TS2,C正确;D.采用对反应③选择性高的催化剂不代表反应②的产物N2O会完全消耗,无法避免尾气中不出现N2O,D错误。]
5.D [A.b分子中存在单键碳,采用sp3杂化,羰基中的C原子采用sp2杂化,故A正确;B.物质a为醚类有机物,与环氧乙烷结构相似,且组成上相差1个CH2,两者互为同系物,故B正确;C.由b的结构简式可知1 mol b中等同于含有2 mol酯基,最多可消耗2 mol NaOH,故C正确;D.a转化为b发生加成反应,由断键过程可知该转化过程中只形成了极性键,故D错误。]
6.D [A.由图中信息可知,苯甲醛和甲醇分子在化合物2的催化作用下,参与催化循环,最后得到产物苯甲酸甲酯,故A项正确;B.由图中信息可知,化合物4在H2O2的作用下转化为化合物5,即醇转化为酮,该过程是失氢的氧化反应,故B项正确;C.化合物3和化合物4所含原子种类及数目均相同,结构不同,两者互为同分异构体,故C项正确;D.由图中信息可知,化合物1在NaH的作用下形成化合物2,化合物2再参与催化循环,所以直接进行催化反应的是化合物2,化合物1间接进行催化反应,故D项错误。]
7.D [主要产物是甲醇,由题图可知,得到的副产物有CO 和HCHO ,生成副产物HCHO 时反应的活化能较大,反应进行较慢,生成的量相对较少;生成副产物CO 时反应的活化能较小,反应进行较快,生成的量相对较多,A正确。由题图可知,生成副产物HCHO 时,反应的活化能较大,B正确。由题图可知合成甲醇的反应历程中,过程*CO+*OH―→*CO+*H2O活化能最大,反应速率最慢,决定反应速率,C正确。电催化还原制备甲醇过程中,阳极的电势比阴极的电势高,D错误。]
8.C [从题图像可看出,E2 是正反应的活化能,A正确;从题图像可看出,反应物的总能量大于生成物的总能量,该反应为放热反应,ΔH=-E3 ,B正确;由题图像可知,过渡态Ⅱ为第三个峰所对应的物质,C错误;催化剂能同等程度地改变正、逆反应速率,使用催化剂,平衡不移动,D正确。]
9.C [A项,反应①和反应④中氮氮三键变为氮氮双键,反应②和反应⑤中氮氮双键变为氮氮单键,故机理一与机理二中都有加成反应,正确;B项,由题图可知,反应③和反应⑥都是决速步,故反应③和反应⑥分别是机理一和机理二的慢反应,正确;C项,由题图知,机理一中,若1 mol N2参与反应,可产生2 mol NH3。机理二中,若1 mol N2参与反应,可产生 2 mol NH3,即消耗等物质的量的 N2 产生的 NH3 的物质的量相等,错误;D项,不会从反应物和生成物的化合价进行分析而出错。 N2 转化为 NH3 ,N 的化合价降低,发生还原反应,故 NH3 在阴极区生成,正确。 ]
10.B [路径①中,生成物的总能量大于反应物的总能量,则ΔH>0 ,A项正确;基元反应是指在反应中一步直接转化为产物的反应,路径②中存在中间产物,路径②不属于基元反应,B项错误;路径③的活化能最小,反应速率最大,C项正确;由题图可知,逆反应的活化能路径④的最大,D项正确。]
11.B [A项,整个过程中H+是催化剂,参与了中间反应,正确;B项,由题图可知该历程中最小的能垒(基元反应活化能)为131 kJ·mol-1 ,错误;C项,决定总反应速率的是能垒最高的基元反应,由题图可知,该基元反应为―→CH3OCH3+H+,正确;D项,整个过程消耗甲醇,生成二甲醚和水,总反应为2CH3OHCH3OCH3+H2O ,正确。]
12.C [由反应机理可知,氢气和氧气在[PdCl4]2-的作用下生成过氧化氢,反应的化学方程式为H2+O2H2O2 ,A正确;Pd 元素在[PdCl4]2- 、[PdCl2O2]2-中的化合价均为+2 价,Pd 单质中Pd 元素为0价,B正确;由反应机理可知,①、②均为氧化还原反应,③为非氧化还原反应,C错误;由反应机理可知,HCl 和Cl- 均可循环利用,D正确。]
13.C [A.由题目中先“吸氢”再转化和图示可知,反应的第一步是—S—Co—与氢气结合,反应最后又生成,故—S—Co—是催化剂,选项A错误;B.根据图中各步活化能可知,生成物质Ⅰ活化能最高,所以对总反应速率起决定性作用的是生成物质Ⅰ的反应,选项B错误;C.反应历程中,物质Ⅰ→物质Ⅱ加氢,物质Ⅱ→物质Ⅲ去氧,物质Ⅲ→物质Ⅳ去氧,均为还原反应,N元素化合价逐渐降低,选项C正确;D.总反应为+3H2+2H2O,选项D错误。]
14.D [反应物的总能量比生成物的总能量高,所以总反应为放热反应,但无法据此确定是否需要加热才能发生,A错误;由题图可知,第①步反应为加成反应,第②步反应不是加成反应,B错误;第①步反应活化能最大,总反应速率由第①步反应决定,C错误;该反应过程中有C—O 键、C—H 键形成,均为极性键,D正确。]
15.C [由图可知,逆水煤气反应是反应物总能量小于生成物总能量的吸热反应,A错误;中间物种分解历程的各步活化能均高于氧化还原历程的各步活化能,所以RWGS在Fe3O4催化剂表面反应的主要历程是氧化还原历程,B错误;氧化还原历程中最后一步反应的活化能最大,反应速率最慢,是氧化还原历程的控速步骤,反应的方程式为CO(a)+H2O(a)===CO(g)+H2O(g),C正确;使用高效催化剂,能降低反应的活化能,加快化学反应速率,但化学平衡不移动,平衡转化率不变,D错误。]
16.D [A.由图可知NO可同时参与反应①和反应②过程,由此可知催化剂可以同时产生多种反应历程,故A正确;B.由图可知含C微粒参与的反应均存在电子得失,有元素化合价变化,故B正确;C.NO为催化剂,增大NO的量,对反应热和化学平衡无影响,故C正确;D.无论反应经过①还是②,总反应都是丙烷和氧气生成丙烯和水,最终生成的水不变,故D错误。]
17.D [甲醇脱氢过程中有C—H键,O—H键等极性键断裂,A正确;由图可知,b-c的反应式为(—CH2OH)top→CH2O+H,B正确;a→i、a→j的过程中均形成C≡O键,故均有π键的形成,C正确;b-d的过程中断裂的为碳氢键,D错误。]
A卷
1.(2023·广东名校联盟联考)在二氧化碳合成甲醇的研究中,催化剂是研究的关键。目前国内外研究主要集中于铜基催化剂,有学者提出的CO2的转化过程如图。下列说法正确的是( )
A.甲醇和甲酸乙酯中均含有σ键和π键
B.反应过程中,金属M的化合价未发生改变
C.基态铜元素的第二电离能大于基态锌元素的第二电离能
D.反应过程中,催化剂参与反应,改变了反应历程,降低了反应的焓
2.(2023·广东二模)我国科学家合成了一种新型Au15/MoC材料,实现了低温催化水煤气变换。反应历程如图所示,其中吸附在催化剂表面的物种用“*”标注,TS指过渡态。下列有关说法不正确的是( )
A.温度一定时,加压无法提高平衡转化率
B.分子从催化剂表面脱附的过程都是吸热的
C.反应历程中活化能最大的一步为CO*+2H2O*―→CO*+H2O*+OH*+H*
D.该过程有极性键的断裂和生成
3.NH3选择性催化还原NO的反应为4NH3+6NO5N2+6H2O,其反应历程如图所示。一定温度下,向恒容密闭容器中充入一定量的NH3、NO和O2,发生反应。下列说法错误的是( )
A.使用催化剂,NH3、NO的活化分子数增多,还原NO的速率加快
B.①的反应速率快,说明反应①的活化能大,是整个反应的决速步
C.NH3与催化剂发生强的化学吸附,而NO在此过程中几乎不被催化剂吸附
D.其他条件不变时,增大NH3的浓度,能使更多的NO转化为N2
4.汽车尾气中CO与NO转化的三段反应历程及各物质的相对能量如图所示,其中TS代表过渡态,IM表示反应过程中的复杂中间产物,每段历程的反应物相对总能量定义为0,下列说法不正确的是( )
A.反应①决定尾气转化的快慢
B.反应①为吸热反应,反应②、③为放热反应
C.由上图可判断过渡态的相对能量:TS1>TS3>TS2
D.采用对反应③选择性高的催化剂可以避免尾气中出现N2O
5.(2023·汕头二模)某金属有机多孔材料(MOFA)对CO2具有超高吸附能力,并能催化CO2与环氧丙烷反应,其工作原理如图所示。下列说法错误的是( )
A.b分子中碳原子采用sp2和sp3杂化
B.物质a为醚类有机物,与环氧乙烷互为同系物
C.1 mol b最多可与2 mol NaOH反应
D.a转化为b发生取代反应,并有非极性共价键的形成
6.制备苯甲酸甲酯的一种反应机理如图(其中Ph-代表苯基)。下列说法不正确的是( )
A.可以用苯甲醛和甲醇为原料制备苯甲酸甲酯
B.反应过程涉及氧化反应
C.化合物3和4互为同分异构体
D.化合物1直接催化反应的进行
7.最近科学家在发展非金属催化剂实现CO2 电催化还原制备甲醇(CH3OH) 方向取得重要进展,反应历程如图所示,其中吸附在催化剂表面的物质用“*”标注。下列说法错误的是( )
A.得到的副产物有CO和HCHO,其中相对较多的副产物为CO
B.生成副产物HCHO时,反应的活化能较大
C.制备甲醇的反应速率主要由过程*CO+*OH―→*CO+*H2O决定
D.电催化还原制备甲醇过程中,阳极的电势比阴极的电势低
8.已知甲酸的分解反应为HCOOH(g)??CO(g)+H2O(g) ΔH。在H+催化作用下反应历程为:
根据过渡态理论,其反应过程中的能量变化如图所示(E1、E2、E3均大于0)。
下列说法错误的是( )
A.E2 为正反应的活化能
B.该反应为放热反应,ΔH=-E3
C.图像中第一个峰(过渡态)对应的物质结构为过渡态Ⅰ,第二个峰(过渡态)对应的物质结构为过渡态Ⅱ
D.使用催化剂后,正、逆反应速率同等程度改变,平衡不移动
9.氮气在催化剂表面,经过电催化制备NH3的两种机理如图所示,下列说法错误的是( )
A.机理一与机理二中,都有加成反应
B.机理一与机理二的慢反应分别是反应③和反应⑥
C.消耗等物质的量的氮气,机理二产生的氨气的物质的量是机理一的2倍
D.氨气在阴极区生成
B卷
10.研究CH3I 与氯自由基(用Cl*表示)的反应有助于保护臭氧层。已知:Cl*与CH3I 反应有4条反应路径(TS表示过渡态,IM表示中间产物,*标注的为自由基),如图所示,下列说法错误的是( )
A.路径①的ΔH>0
B.路径②是基元反应
C.路径③的反应速率最大
D.逆反应的活化能路径④的最大
11.二甲醚(CH3OCH3) 被称为21世纪的“清洁能源”。科学家研究在酸性条件下,用甲醇可合成二甲醚,反应历程中相对能量变化如图所示。
下列叙述错误的是( )
A.循环过程中,催化剂参与了中间反应
B.该历程中最小的能垒(基元反应活化能)为1.31 kJ·mol-1
C.决定总反应速率的基元反应为―→CH3OCH3+H+
D. 总反应的化学方程式为2CH3OHCH3OCH3+H2O
12.某种制备H2O2 的反应机理如图。下列说法不正确的是( )
A.总反应可表示为H2+O2H2O2
B.该过程中Pd有0和+2两种化合价
C.①、②、③均为氧化还原反应
D.HCl 和Cl- 可循环利用
13.某科研团队合作开发了活性位点催化剂,先“吸氢”再将硝基化合物转化为氨基化合物,反应历程和每步的活化能如图所示:
下列说法正确的是( )
A.—S—Co—是该反应历程的中间产物
B.提高Ⅲ→Ⅳ的反应速率,对快速提升总反应速率起决定性作用
C.I→Ⅱ→Ⅲ→Ⅳ的转化过程中,N元素的化合价逐渐降低
D.总反应为+4—S—Co—+2H2O
14.乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列叙述正确的是( )
A.总反应为放热反应,故此反应不需要加热就能发生
B.①②步反应属于加成反应
C.总反应速率由第②步反应决定
D.该反应过程中有极性键形成
15.随着节能环保问题的提出,人们开始关注逆水煤气反应(RWGS)的研究。单一分子RWGS在Fe3O4催化剂表面的反应历程如下图所示,主要有:氧化还原历程[TS1-TS2-TS3-TS4-CO(a)+H2O(a)]和中间物种分解历程[TS1-TS6-TS7-TS5-HCOO(a)+H(a)][已知(a)表示物质吸附在催化剂表面的状态]。下列说法正确的是( )
A.该反应为放热反应
B.RWGS在Fe3O4催化剂表面反应的主要历程是中间物种分解历程
C.氧化还原历程控速步骤为CO(a)+H2O(a)===CO(g)+H2O(g)
D.使用高效催化剂,加快化学反应速率,从而提高平衡转化率
16.在NO催化下,丙烷与氧气反应制备丙烯的部分反应机理如图所示。下列叙述错误的是( )
A.催化剂可以同时产生多种反应历程
B.含C微粒参与的反应均有元素化合价变化
C.增大NO的量,反应热和平衡产率不变
D.当主要发生包含②的历程时,最终生成的水量改变
17.(2023·湛江二模)吸附在催化剂表面的甲醇分子逐步脱氢得到CO,四步脱氢产物及其相对能量如图,下列说法错误的是( )
A.甲醇脱氢生成CO的过程中有极性键的断裂
B.b→c的反应式为(—CH2OH)top→CH2O+H
C.a→i与a→j的过程中均有π键的形成
D.b→c与b→d的过程均断裂了氢氧键
选择题突破八 反应历程(机理)分析
1.C [A.甲醇分子式为CH3OH,结构中只有单键,即只有σ键,没有π键,A错误;B.由反应①知二氧化碳中碳元素化合价降低,所以金属M化合价发生变化,B错误;C.Cu+价电子排布式为3d10,Zn+价电子排布式为3d104s1,又Cu+的3d10全满稳定且3d能量低于4s能量,所以基态铜元素的第二电离能大于基态锌元素的第二电离能,C正确;D.催化剂参与反应可以加快反应速率,降低反应的活化能,改变反应历程,但不改变焓变,D错误。]
2.B [A.该反应为CO(g)+H2O(g)CO2(g)+H2(g),该反应为等体积反应,温度一定时加压化学平衡不移动,平衡转化率不变,A正确;B.从图中可知并不是所有分子从催化剂表面脱附的过程都是吸热的,如CO+H2O*+2H*转化为CO2+H2O*+2H*的过程就是放热的,B错误;C.从图中可知,过渡态TS1的相对能量最大,此时的活化能最大,因此反应历程中活化能最大的一步为CO*+2H2O*―→CO*+H2O*+OH*+H*,C正确;D.该过程中H2O中的O—H键断裂,同时也有CO2中C=O键的生成,D正确。]
3.B [A.使用催化剂能降低反应的活化能,活化分子数增多,反应速率加快,A正确;B.反应①的反应速率快,说明反应①的活化能小,反应的决速步是反应速率最慢的反应②,B错误;C.由反应历程图可知,在反应过程中,NH3与催化剂发生强的化学吸附,而NO与NH3结合,NO几乎不被催化剂吸附,C正确;D.其他条件不变时,增大NH3的浓度,平衡正向移动,能使更多的NO转化为N2,D正确。]
4.D [A.由图可知,反应①的活化能最高,为298.4 kJ·mol-1-42.6 kJ·mol-1=255.8 kJ·mol-1,反应②、③的活化能分别为108.4 kJ·mol-1、226.1 kJ·mol-1,活化能越高反应速率越慢,慢反应决定整个反应的速率,故反应①决定尾气转化的快慢,A正确;B.由图可知,反应①为吸热反应,反应②、③为放热反应,B正确;C.图中可知三个过渡态的能量分别为298.4 kJ·mol-1、130.0 kJ·mol-1、248.3 kJ·mol-1,故过渡态的相对能量:TS1>TS3>TS2,C正确;D.采用对反应③选择性高的催化剂不代表反应②的产物N2O会完全消耗,无法避免尾气中不出现N2O,D错误。]
5.D [A.b分子中存在单键碳,采用sp3杂化,羰基中的C原子采用sp2杂化,故A正确;B.物质a为醚类有机物,与环氧乙烷结构相似,且组成上相差1个CH2,两者互为同系物,故B正确;C.由b的结构简式可知1 mol b中等同于含有2 mol酯基,最多可消耗2 mol NaOH,故C正确;D.a转化为b发生加成反应,由断键过程可知该转化过程中只形成了极性键,故D错误。]
6.D [A.由图中信息可知,苯甲醛和甲醇分子在化合物2的催化作用下,参与催化循环,最后得到产物苯甲酸甲酯,故A项正确;B.由图中信息可知,化合物4在H2O2的作用下转化为化合物5,即醇转化为酮,该过程是失氢的氧化反应,故B项正确;C.化合物3和化合物4所含原子种类及数目均相同,结构不同,两者互为同分异构体,故C项正确;D.由图中信息可知,化合物1在NaH的作用下形成化合物2,化合物2再参与催化循环,所以直接进行催化反应的是化合物2,化合物1间接进行催化反应,故D项错误。]
7.D [主要产物是甲醇,由题图可知,得到的副产物有CO 和HCHO ,生成副产物HCHO 时反应的活化能较大,反应进行较慢,生成的量相对较少;生成副产物CO 时反应的活化能较小,反应进行较快,生成的量相对较多,A正确。由题图可知,生成副产物HCHO 时,反应的活化能较大,B正确。由题图可知合成甲醇的反应历程中,过程*CO+*OH―→*CO+*H2O活化能最大,反应速率最慢,决定反应速率,C正确。电催化还原制备甲醇过程中,阳极的电势比阴极的电势高,D错误。]
8.C [从题图像可看出,E2 是正反应的活化能,A正确;从题图像可看出,反应物的总能量大于生成物的总能量,该反应为放热反应,ΔH=-E3 ,B正确;由题图像可知,过渡态Ⅱ为第三个峰所对应的物质,C错误;催化剂能同等程度地改变正、逆反应速率,使用催化剂,平衡不移动,D正确。]
9.C [A项,反应①和反应④中氮氮三键变为氮氮双键,反应②和反应⑤中氮氮双键变为氮氮单键,故机理一与机理二中都有加成反应,正确;B项,由题图可知,反应③和反应⑥都是决速步,故反应③和反应⑥分别是机理一和机理二的慢反应,正确;C项,由题图知,机理一中,若1 mol N2参与反应,可产生2 mol NH3。机理二中,若1 mol N2参与反应,可产生 2 mol NH3,即消耗等物质的量的 N2 产生的 NH3 的物质的量相等,错误;D项,不会从反应物和生成物的化合价进行分析而出错。 N2 转化为 NH3 ,N 的化合价降低,发生还原反应,故 NH3 在阴极区生成,正确。 ]
10.B [路径①中,生成物的总能量大于反应物的总能量,则ΔH>0 ,A项正确;基元反应是指在反应中一步直接转化为产物的反应,路径②中存在中间产物,路径②不属于基元反应,B项错误;路径③的活化能最小,反应速率最大,C项正确;由题图可知,逆反应的活化能路径④的最大,D项正确。]
11.B [A项,整个过程中H+是催化剂,参与了中间反应,正确;B项,由题图可知该历程中最小的能垒(基元反应活化能)为131 kJ·mol-1 ,错误;C项,决定总反应速率的是能垒最高的基元反应,由题图可知,该基元反应为―→CH3OCH3+H+,正确;D项,整个过程消耗甲醇,生成二甲醚和水,总反应为2CH3OHCH3OCH3+H2O ,正确。]
12.C [由反应机理可知,氢气和氧气在[PdCl4]2-的作用下生成过氧化氢,反应的化学方程式为H2+O2H2O2 ,A正确;Pd 元素在[PdCl4]2- 、[PdCl2O2]2-中的化合价均为+2 价,Pd 单质中Pd 元素为0价,B正确;由反应机理可知,①、②均为氧化还原反应,③为非氧化还原反应,C错误;由反应机理可知,HCl 和Cl- 均可循环利用,D正确。]
13.C [A.由题目中先“吸氢”再转化和图示可知,反应的第一步是—S—Co—与氢气结合,反应最后又生成,故—S—Co—是催化剂,选项A错误;B.根据图中各步活化能可知,生成物质Ⅰ活化能最高,所以对总反应速率起决定性作用的是生成物质Ⅰ的反应,选项B错误;C.反应历程中,物质Ⅰ→物质Ⅱ加氢,物质Ⅱ→物质Ⅲ去氧,物质Ⅲ→物质Ⅳ去氧,均为还原反应,N元素化合价逐渐降低,选项C正确;D.总反应为+3H2+2H2O,选项D错误。]
14.D [反应物的总能量比生成物的总能量高,所以总反应为放热反应,但无法据此确定是否需要加热才能发生,A错误;由题图可知,第①步反应为加成反应,第②步反应不是加成反应,B错误;第①步反应活化能最大,总反应速率由第①步反应决定,C错误;该反应过程中有C—O 键、C—H 键形成,均为极性键,D正确。]
15.C [由图可知,逆水煤气反应是反应物总能量小于生成物总能量的吸热反应,A错误;中间物种分解历程的各步活化能均高于氧化还原历程的各步活化能,所以RWGS在Fe3O4催化剂表面反应的主要历程是氧化还原历程,B错误;氧化还原历程中最后一步反应的活化能最大,反应速率最慢,是氧化还原历程的控速步骤,反应的方程式为CO(a)+H2O(a)===CO(g)+H2O(g),C正确;使用高效催化剂,能降低反应的活化能,加快化学反应速率,但化学平衡不移动,平衡转化率不变,D错误。]
16.D [A.由图可知NO可同时参与反应①和反应②过程,由此可知催化剂可以同时产生多种反应历程,故A正确;B.由图可知含C微粒参与的反应均存在电子得失,有元素化合价变化,故B正确;C.NO为催化剂,增大NO的量,对反应热和化学平衡无影响,故C正确;D.无论反应经过①还是②,总反应都是丙烷和氧气生成丙烯和水,最终生成的水不变,故D错误。]
17.D [甲醇脱氢过程中有C—H键,O—H键等极性键断裂,A正确;由图可知,b-c的反应式为(—CH2OH)top→CH2O+H,B正确;a→i、a→j的过程中均形成C≡O键,故均有π键的形成,C正确;b-d的过程中断裂的为碳氢键,D错误。]
同课章节目录
