选择题突破六 电化学 专项特训(含解析)2024年高考化学二轮复习
文档属性
| 名称 | 选择题突破六 电化学 专项特训(含解析)2024年高考化学二轮复习 |  | |
| 格式 | DOCX | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-13 19:38:35 | ||
图片预览



文档简介
选择题突破六 电化学
A卷
1.(2023·广州三模)文物的腐蚀是指出土前由于自然的侵蚀、损坏而破坏文物的原貌,电化学腐蚀也是重要因素之一。三星堆是中华文明的重要组成部分,下列出土文物可能涉及电化学腐蚀的是( )
A B C D
青铜神树 玉璋 陶瓷马头 黄金面罩
2.(2023·汕头质监)下图是某宝上销售的家用消毒液发生器,可产生消毒液来清除冰箱异味、对厨具消毒等。操作时只需往瓶内加入少许氯化钠和水,按下开关即可。下列有关说法错误的是( )
A.该装置可实现随制随用,且理论上不会有氯气逸出
B.通电时,Cl-发生还原反应
C.通电时,瓶内会产生氢气,使用时应避开火源
D.瓶内可能发生反应:Cl2+2NaOH===NaClO+NaCl+H2O
3.(2023·茂名二模)将裹有锌片的铁钉放入含有酚酞-饱和NaCl琼脂溶液中,滴加少量酚酞溶液,下列说法不正确的是( )
A.a处溶液会变红
B.b处c(Zn2+)增大
C.c处产生较多无色气泡
D.该实验说明Fe受到保护
4.(2023·深圳二调)直接NaBH4-H2O2燃料电池具有比能量高等优点,该电池正、负极区域电解质溶液分别为H2SO4溶液、NaOH溶液,并采用阳离子交换膜,放电时( )
A.负极上BH被还原
B. 正极发生的反应为H2O2+2e-===2OH-
C.Na+由负极移向正极
D. 正极区溶液中c(SO)保持不变
5.工业上用双极膜电解槽电解糠醛溶液同时制备糠醇和糠酸盐,电解过程如图所示。下列说法不正确的是( )
A.电解时,阴极反应为+2e-+2H+===
B.理论上外电路中迁移2 mol电子,消耗1 mol糠醛
C.电解时,MnO2和MnOOH在电极与糠醛之间传递电子
D.生成糠酸盐的离子反应方程式为+2MnO2+OH-―→+2MnOOH
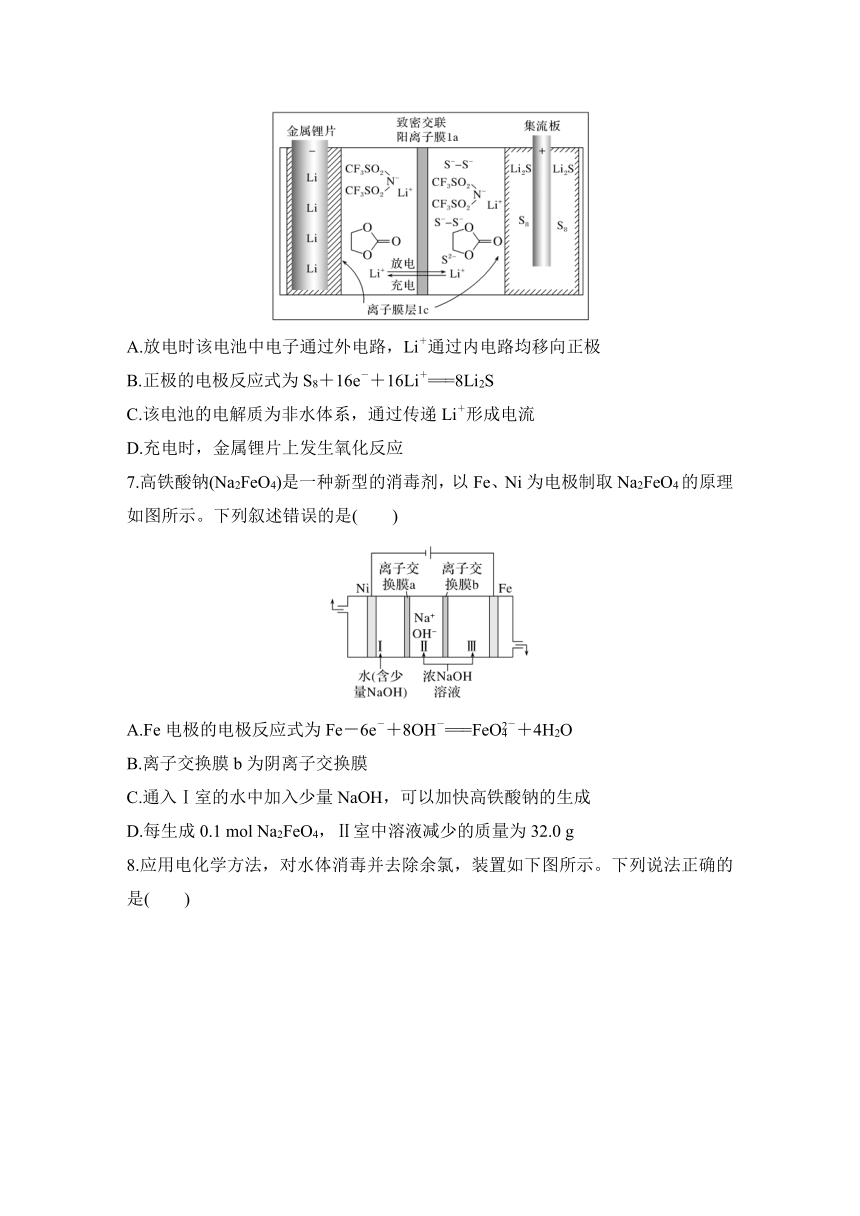
6.(2023·湛江模拟)如图是我国发明的超大容量锂硫电池。下列说法不正确的是( )
A.放电时该电池中电子通过外电路,Li+通过内电路均移向正极
B.正极的电极反应式为S8+16e-+16Li+===8Li2S
C.该电池的电解质为非水体系,通过传递Li+形成电流
D.充电时,金属锂片上发生氧化反应
7.高铁酸钠(Na2FeO4)是一种新型的消毒剂,以Fe、Ni为电极制取Na2FeO4的原理如图所示。下列叙述错误的是( )
A.Fe电极的电极反应式为Fe-6e-+8OH-===FeO+4H2O
B.离子交换膜b为阴离子交换膜
C.通入Ⅰ室的水中加入少量NaOH,可以加快高铁酸钠的生成
D.每生成0.1 mol Na2FeO4,Ⅱ室中溶液减少的质量为32.0 g
8.应用电化学方法,对水体消毒并去除余氯,装置如下图所示。下列说法正确的是( )
A.闭合K1后,可对池中的水杀菌消毒
B.断开K1,闭合K2时,e-由M极流出
C.断开K1,闭合K2后,N极金属Na不断累积
D.钠离子交换膜可用质子交换膜代替
B卷
9.(2023·深圳光明区期末)用金属Pt和Ti为电极电解0.1 mol/L KOH溶液与0.1 mol/L甘油(用C3H8O3表示)的混合液可制备甲酸钾(HCOOK)。下列说法正确的是( )
A.HCOOK的水溶液呈中性
B.基态钛原子的价电子排布式为3d34s1
C.阳极反应为C3H8O3-8e-+11OH-===3HCOO-+8H2O
D.一段时间后,电解质溶液的碱性增强
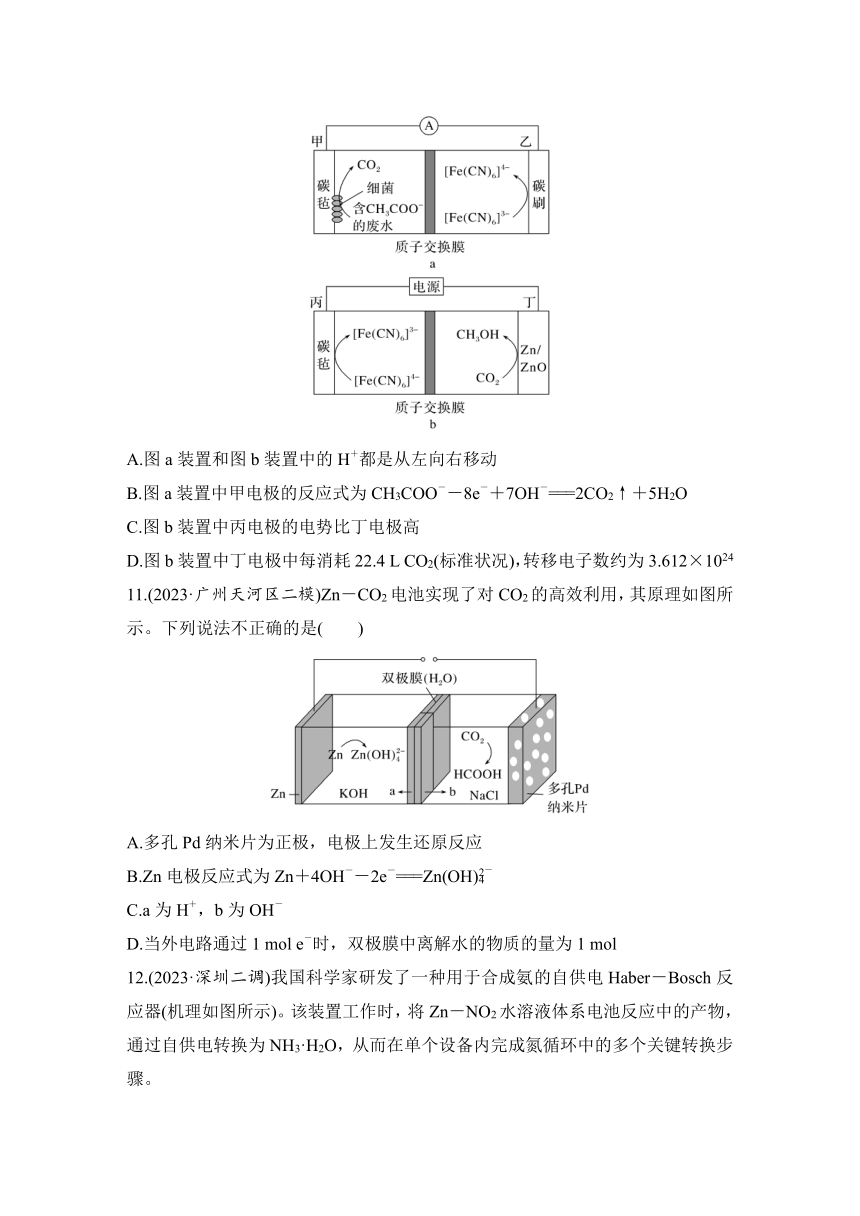
10.(2023·广东大湾区联考)利用[Fe(CN)6]4-/[Fe(CN)6]3-介质耦合微生物电化学系统与电催化还原CO2系统,既能净化废水,又能使CO2向高附加值产物转化,其工作原理示意图如图a和图b所示,下列说法错误的是( )
A.图a装置和图b装置中的H+都是从左向右移动
B.图a装置中甲电极的反应式为CH3COO--8e-+7OH-===2CO2↑+5H2O
C.图b装置中丙电极的电势比丁电极高
D.图b装置中丁电极中每消耗22.4 L CO2(标准状况),转移电子数约为3.612×1024
11.(2023·广州天河区二模)Zn-CO2电池实现了对CO2的高效利用,其原理如图所示。下列说法不正确的是( )
A.多孔Pd纳米片为正极,电极上发生还原反应
B.Zn电极反应式为Zn+4OH--2e-===Zn(OH)
C.a为H+,b为OH-
D.当外电路通过1 mol e-时,双极膜中离解水的物质的量为1 mol
12.(2023·深圳二调)我国科学家研发了一种用于合成氨的自供电Haber-Bosch反应器(机理如图所示)。该装置工作时,将Zn-NO2水溶液体系电池反应中的产物,通过自供电转换为NH3·H2O,从而在单个设备内完成氮循环中的多个关键转换步骤。
下列说法正确的是( )
A.b电极为Zn电极
B.放电过程中,负极发生的反应为NO2+e-===NO
C.电解过程中,阴极区溶液的pH逐渐减小
D.理论上,每得到1 mol NH3·H2O,至少需要消耗195 g Zn
13.(2023·梅州二模)一种清洁、低成本的三步法氯碱工艺的工作原理如图所示。下列说法不正确的是( )
A.与传统氯碱工艺相比,该方法可避免使用离子交换膜
B.第一步中的阳极反应为Na0.44MnO2-xe-===Na0.44-xMnO2+xNa+
C.第二步放电结束后,电解质溶液中NaCl的含量增大
D.第三步,Cl2在阳极产生
14.(2023·汕头二模)间接电解法可对大气污染物NO进行无害化处理。其工作原理如图所示(质子膜只允许H+通过)。下列有关说法错误的是( )
A.电极b接电源正极,电解过程中附近溶液的pH增大
B.电极a的电极反应式为2HSO+2e-+2H+===S2O+2H2O
C.电解过程中右侧Na2SO4的浓度增大
D.电解过程中有4 mol H+通过质子膜时,可处理60 g NO
15.(2023·广东省实验中学模拟)科研小组设计用电化学原理进行废水脱硫,放电时工作原理示意图如图所示。下列说法正确的是( )
A.放电时,负极电极的反应S2-+4H2O-8e-===SO+8H+
B.放电时,H2SO4溶液的浓度不断减小
C.充电时,阳极区需补充适量水以保持溶液浓度不变
D.充电时,导线中流过8 mol e-同时有6 mol H+通过交换膜
16.(2023·茂名一中模拟)某科研团队设计的酶—光电化学电池可同时在电池两室分别实现两种酶催化转化,原理如图所示。下列说法错误的是( )
A.该电池工作过程中实现了光能转化为化学能
B.氢离子从ITO电极向Mo∶BiVO4电极方向迁移
C.Mo∶BiVO4电极上的反应式为2H2O-2e-===H2O2+2H+
D.消耗1 mol 同时生成1 mol
选择题突破六 电化学
1.A [A.青铜神树中含有Sn和Cu,可能涉及电化学腐蚀,故A符合题意;B.玉璋属于玉器,主要成分为无机物,不涉及电化学腐蚀,故B不符合题意;C.陶瓷马头以粘土为主要原料制成,不涉及电化学腐蚀,故C不符合题意;D.黄金面罩由黄金制成,只含有金,不涉及电化学腐蚀,故D不符合题意。]
2.B [瓶中为氯化钠溶液,通电时为电解氯化钠溶液,阳极氯离子失去电子生成氯气,阴极水得电子生成氢气和氢氧化钠,氯气与生成的氢氧化钠反应生成次氯酸钠和水。A.该装置点击开关,电解反应可进行,关闭开关,反应停止,该瓶子为密闭装置,理论上氯气不会逸出,A正确;B.通电时,氯离子失去电子生成氯气,发生氧化反应,B错误;C.根据分析,通电时阴极水得电子生成氢气和氢氧化钠,氢气易燃,故使用时应避开火源,C正确;D.根据分析,氯气与生成的氢氧化钠反应生成次氯酸钠和水,D正确。]
3.C [裹有锌片的铁钉放入含有酚酞-饱和NaCl琼脂溶液中,发生电化学腐蚀,锌片为负极,发生反应:Zn-2e-===Zn2+,铁钉为正极:O2+4e-+2H2O===4OH-,在铁钉附近酚酞溶液变红。A.a为铁钉,为原电池正极,发生反应O2+4e-+2H2O===4OH-,产生OH-,酚酞溶液变红,A正确;B.b处为锌片,锌片为负极,发生反应:Zn-2e-===Zn2+,所以b处c(Zn2+)增大,B正确;C.c处为铁钉,发生反应O2+4e-+2H2O===4OH-,不会产生气泡,C错误;D.铁为正极,不发生反应,被保护起来,D正确。]
4.C [由题干信息可知,该电池正、负极区域电解质溶液分别为H2SO4溶液、NaOH溶液,放电时,负极发生氧化反应,电极反应式为BH-8e-+8OH-===BO+6H2O,正极发生还原反应,电极反应式为H2O2+2H++2e-===2H2O,据此分析解题。A.负极发生氧化反应,电极反应式为BH-8e-+8OH-===BO+6H2O,即负极上BH被氧化,A错误;B.由分析可知,电极反应式为H2O2+2H++2e-===2H2O,B错误;C.原电池内部电解质溶液中阳离子移向正极,阴离子移向负极,即Na+由负极移向正极,C正确;D.由分析可知,电极反应式为H2O2+2H++2e-===2H2O,反应生成H2O,则正极区溶液中c(SO)减小,D错误。]
5.B [根据图示,阳极室中,MnOOH失电子变为MnO2;阴极室中,糠醛得电子生成糠醇。双极膜将水解离为H+和OH-,并实现其定向通过。据图可知电解时,阴极反应为+2e-+2H+===,A正确;理论上外电路中迁移2 mol电子,阳极室和阴极室各需要消耗1 mol糠醛,共需要消耗2 mol糠醛,B错误;电解时,MnO2和MnOOH在电极与糠醛之间传递电子,C正确;据图可知在阳极室糠醛生成糠酸盐的离子反应方程式为+2MnO2+OH-―→+2MnOOH,D正确。]
6.D [A.放电时该电池中电子通过外电路,Li+通过内电路均移向正极,A正确;B.由图中信息可知,正极S8放电生成Li2S,正极的电极反应式为S8+16e-+16Li+===8Li2S,B正确;C.锂和水能反应,锂硫电池中电解质不能为水溶液,该电池的电解质为非水体系,通过传递Li+形成电流,C正确;D.金属锂片为负极,充电时,金属锂片连接外加电源的负极,金属锂片上发生Li+得电子的过程,属于还原反应,D错误。]
7.D [该装置以Fe、Ni为电极制取Na2FeO4,为电解池装置,Fe电极为阳极,Ni电极为阴极,阳极电极反应式为Fe-6e-+8OH-===FeO+4H2O,OH-移动向Ⅲ室,阴极电极反应式为2H2O+2e-===H2↑+2OH-,Na+应移动向Ⅰ室。A项,Fe电极为阳极,Fe失电子生成FeO,电极反应式为Fe-6e-+8OH-===FeO+4H2O,故A正确;B项,Fe电极为阳极,Ni电极为阴极,Ⅱ室中的Na+移动向Ⅰ室,OH-移动向Ⅲ室,故离子交换膜a、b分别为阳离子交换膜、阴离子交换膜,故B正确;C项,通入Ⅰ室的水中加入少量NaOH,可以增强溶液的导电性,可以加快高铁酸钠的生成,故C正确;D项,每生成0.1 mol Na2FeO4,外电路中通过0.6 mol电子,则Ⅱ室溶液中减少的NaOH的物质的量为0.6 mol,质量为24.0 g,故D错误;故选D。]
8.A [A.闭合K1后,构成电解池装置,M极为阳极,电极反应式:2Cl--2e-===Cl2↑,氯气进入水池消毒,A正确;B.断开K1,闭合K2时,构成原电池装置,M极为正极,N极为负极,e-由N极流出,B错误;C.断开K1,闭合K2后,构成原电池装置,N极为负极,电极反应式:Na-e-===Na+,N极金属Na不断减少,C错误;D.钠离子交换膜换成质子交换膜后H+会穿过膜与N极的Na反应,故不可换为质子交换膜,D错误。]
9.C [A.HCOOK为强碱弱酸盐,其水溶液呈碱性,A项错误;B.钛为22号元素,基态钛原子的价电子排布式为3d24s2,B项错误;C.阳极上发生氧化反应:C3H8O3-8e-+11OH-===3HCOO-+8H2O,C项正确;D.阴极发生反应8H2O+8e-===4H2↑+8OH-,由两电极反应可知总反应消耗OH-,一段时间后,电解质溶液的碱性减弱,D项错误。]
10.B [A.a中氢离子向正极右侧迁移,b中氢离子向阴极右侧迁移,故A说法正确;B.a装置中甲电极上乙酸根离子失去电子发生氧化反应生成二氧化碳,反应式为CH3COO--8e-+2H2O===2CO2↑+7H+,故B说法错误; C.图b装置中丙电极为阳极、丁电极为阴极,则丙的电势比丁电极高,故C说法正确;D.图b装置中丁电极二氧化碳转化为甲醇,电子转移情况为CO2~6e-,则每消耗22.4 L CO2(标准状况下为1 mol),转移电子数约为6×6.02×1023=3.612×1024,故D说法正确。]
11.C [由图可知,锌发生氧化反应为负极,则多孔Pd纳米片为正极;A.由分析可知,多孔Pd纳米片为正极,电极上发生还原反应,A正确;B.Zn电极锌失去电子生成Zn(OH),反应式为Zn+4OH--2e-===Zn(OH),B正确;C.原电池中阳离子向正极移动、阴离子向负极移动,故b为H+,a为OH-,C错误;D.当外电路通过1 mol e-时,由电荷守恒可知,双极膜中离解水的物质的量为1 mol,产生1 mol氢离子、1 mol氢氧根离子,D正确。]
12.D [由题干图示信息可知,TiO2电极将NO转化为NH3·H2O可知TiO2电极为阴极,电极反应式为NO+7H++6e-===NH3·H2O+H2O,石墨电极为阳极,电极反应为2H2O-4e-===4H++O2↑,故a电极为负极,发生氧化反应,即Zn为负极,电极反应式为Zn-2e-===Zn2+,b电极为正极,发生还原反应,电极反应式为NO2+e-===NO,据此分析解题。A.由分析可知,a电极为Zn电极是负极,A错误;B.放电过程中,负极发生氧化反应,电极反应式为Zn-2e-===Zn2+,B错误;C.由分析可知,电解过程中,TiO2电极为阴极,电极反应式为NO+7H++6e-===NH3·H2O+H2O,则阴极区溶液的pH逐渐增大,C错误;D.由分析可知,理论上,每得到1 mol NH3·H2O,需得到6 mol电子,故至少需要消耗Zn的质量为×65 g·mol-1=195 g,D正确。]
13.C [传统氯碱工艺使用阳离子交换膜,防止阳极生成的Cl2与阴极生成的NaOH反应,而该工艺的各步装置中均不需要使用离子交换膜,A项正确;第一步生产NaOH的装置为电解池,阳极反应为Na0.44MnO2-xe-===Na0.44-xMnO2+xNa+,B项正确;第二步提取Na+和Cl-的装置为原电池,负极反应为Ag-e-+Cl-===AgCl,正极反应为Na0.44-xMnO2+xNa++xe-===Na0.44MnO2,则溶液中NaCl的含量减小,C项错误;第三步生成Cl2的阳极反应为2Cl--2e-===Cl2↑,D项正确。]
14.A [A.由装置可知电极b上水放电生成氧气,电极反应式为2H2O-4e-===O2↑+4H+,电极b附近溶液的pH值减小,故A错误;B.电极a上发生反应HSO转化为S2O,电极反应式为2HSO+2e-+2H+===S2O+2H2O,故B正确;C.由电解反应可知电极b上水放电生成氧气,反应生成的氢离子通过质子膜进入左侧,电解过程中损失水,则右侧Na2SO4的浓度增大,故C正确;D.由电极反应可知电解过程中有4 mol H+通过质子膜时,电路中转移4 mol电子,则生成2 mol S2O,S2O与NO反应生成氮气和HSO,反应方程式为2S2O+2NO+2H2O===4HSO+N2,2 mol S2O可处理2 mol NO,质量为60 g,故D正确。]
15.C [A.放电时,由题图得,Mn2+离子被氧化,故A错误;B.放电时,正极区中的氢离子被还原生成氢气,负极区中的氢离子会透过质子交换膜流向正极区,硫酸浓度不变,故B错误;C.充电时,阳极区中的水被氧化,2H2O-4e-===O2↑+4H+,需补充适量水来维持浓度,故C正确;D.充电时,根据C中方程式,导线中流过8 mol电子时,应有8 mol氢离子穿过质子穿透膜,故D错误。]
16.B [该结构是酶-光电化学电池,由电子移动的方向可知ITO电极为正极,Mo∶BiVO4电极为负极,FMN(H2)在正极转化为FMN,H2O在负极失去电子生成H2O2和H+,以此解答。A.该电池是光电化学电池,工作过程中实现了光能转化为化学能,故A正确;B.原电池结构中,阳离子向正极移动,则氢离子从Mo∶BiVO4电极向ITO电极移动,故B错误;C.由分析可知,Mo∶BiVO4电极为负极,H2O在负极失去电子生成H2O2和H+,电极方程式为:2H2O-2e-===H2O2+2H+,故C正确;D.由图可知,正极和H2反应生成,负极和H2O2反应生成,而生成1 mol H2和1 mol H2O2转移的电子数相等,则消耗1 mol 同时生成1 mol ,故D正确。]
A卷
1.(2023·广州三模)文物的腐蚀是指出土前由于自然的侵蚀、损坏而破坏文物的原貌,电化学腐蚀也是重要因素之一。三星堆是中华文明的重要组成部分,下列出土文物可能涉及电化学腐蚀的是( )
A B C D
青铜神树 玉璋 陶瓷马头 黄金面罩
2.(2023·汕头质监)下图是某宝上销售的家用消毒液发生器,可产生消毒液来清除冰箱异味、对厨具消毒等。操作时只需往瓶内加入少许氯化钠和水,按下开关即可。下列有关说法错误的是( )
A.该装置可实现随制随用,且理论上不会有氯气逸出
B.通电时,Cl-发生还原反应
C.通电时,瓶内会产生氢气,使用时应避开火源
D.瓶内可能发生反应:Cl2+2NaOH===NaClO+NaCl+H2O
3.(2023·茂名二模)将裹有锌片的铁钉放入含有酚酞-饱和NaCl琼脂溶液中,滴加少量酚酞溶液,下列说法不正确的是( )
A.a处溶液会变红
B.b处c(Zn2+)增大
C.c处产生较多无色气泡
D.该实验说明Fe受到保护
4.(2023·深圳二调)直接NaBH4-H2O2燃料电池具有比能量高等优点,该电池正、负极区域电解质溶液分别为H2SO4溶液、NaOH溶液,并采用阳离子交换膜,放电时( )
A.负极上BH被还原
B. 正极发生的反应为H2O2+2e-===2OH-
C.Na+由负极移向正极
D. 正极区溶液中c(SO)保持不变
5.工业上用双极膜电解槽电解糠醛溶液同时制备糠醇和糠酸盐,电解过程如图所示。下列说法不正确的是( )
A.电解时,阴极反应为+2e-+2H+===
B.理论上外电路中迁移2 mol电子,消耗1 mol糠醛
C.电解时,MnO2和MnOOH在电极与糠醛之间传递电子
D.生成糠酸盐的离子反应方程式为+2MnO2+OH-―→+2MnOOH
6.(2023·湛江模拟)如图是我国发明的超大容量锂硫电池。下列说法不正确的是( )
A.放电时该电池中电子通过外电路,Li+通过内电路均移向正极
B.正极的电极反应式为S8+16e-+16Li+===8Li2S
C.该电池的电解质为非水体系,通过传递Li+形成电流
D.充电时,金属锂片上发生氧化反应
7.高铁酸钠(Na2FeO4)是一种新型的消毒剂,以Fe、Ni为电极制取Na2FeO4的原理如图所示。下列叙述错误的是( )
A.Fe电极的电极反应式为Fe-6e-+8OH-===FeO+4H2O
B.离子交换膜b为阴离子交换膜
C.通入Ⅰ室的水中加入少量NaOH,可以加快高铁酸钠的生成
D.每生成0.1 mol Na2FeO4,Ⅱ室中溶液减少的质量为32.0 g
8.应用电化学方法,对水体消毒并去除余氯,装置如下图所示。下列说法正确的是( )
A.闭合K1后,可对池中的水杀菌消毒
B.断开K1,闭合K2时,e-由M极流出
C.断开K1,闭合K2后,N极金属Na不断累积
D.钠离子交换膜可用质子交换膜代替
B卷
9.(2023·深圳光明区期末)用金属Pt和Ti为电极电解0.1 mol/L KOH溶液与0.1 mol/L甘油(用C3H8O3表示)的混合液可制备甲酸钾(HCOOK)。下列说法正确的是( )
A.HCOOK的水溶液呈中性
B.基态钛原子的价电子排布式为3d34s1
C.阳极反应为C3H8O3-8e-+11OH-===3HCOO-+8H2O
D.一段时间后,电解质溶液的碱性增强
10.(2023·广东大湾区联考)利用[Fe(CN)6]4-/[Fe(CN)6]3-介质耦合微生物电化学系统与电催化还原CO2系统,既能净化废水,又能使CO2向高附加值产物转化,其工作原理示意图如图a和图b所示,下列说法错误的是( )
A.图a装置和图b装置中的H+都是从左向右移动
B.图a装置中甲电极的反应式为CH3COO--8e-+7OH-===2CO2↑+5H2O
C.图b装置中丙电极的电势比丁电极高
D.图b装置中丁电极中每消耗22.4 L CO2(标准状况),转移电子数约为3.612×1024
11.(2023·广州天河区二模)Zn-CO2电池实现了对CO2的高效利用,其原理如图所示。下列说法不正确的是( )
A.多孔Pd纳米片为正极,电极上发生还原反应
B.Zn电极反应式为Zn+4OH--2e-===Zn(OH)
C.a为H+,b为OH-
D.当外电路通过1 mol e-时,双极膜中离解水的物质的量为1 mol
12.(2023·深圳二调)我国科学家研发了一种用于合成氨的自供电Haber-Bosch反应器(机理如图所示)。该装置工作时,将Zn-NO2水溶液体系电池反应中的产物,通过自供电转换为NH3·H2O,从而在单个设备内完成氮循环中的多个关键转换步骤。
下列说法正确的是( )
A.b电极为Zn电极
B.放电过程中,负极发生的反应为NO2+e-===NO
C.电解过程中,阴极区溶液的pH逐渐减小
D.理论上,每得到1 mol NH3·H2O,至少需要消耗195 g Zn
13.(2023·梅州二模)一种清洁、低成本的三步法氯碱工艺的工作原理如图所示。下列说法不正确的是( )
A.与传统氯碱工艺相比,该方法可避免使用离子交换膜
B.第一步中的阳极反应为Na0.44MnO2-xe-===Na0.44-xMnO2+xNa+
C.第二步放电结束后,电解质溶液中NaCl的含量增大
D.第三步,Cl2在阳极产生
14.(2023·汕头二模)间接电解法可对大气污染物NO进行无害化处理。其工作原理如图所示(质子膜只允许H+通过)。下列有关说法错误的是( )
A.电极b接电源正极,电解过程中附近溶液的pH增大
B.电极a的电极反应式为2HSO+2e-+2H+===S2O+2H2O
C.电解过程中右侧Na2SO4的浓度增大
D.电解过程中有4 mol H+通过质子膜时,可处理60 g NO
15.(2023·广东省实验中学模拟)科研小组设计用电化学原理进行废水脱硫,放电时工作原理示意图如图所示。下列说法正确的是( )
A.放电时,负极电极的反应S2-+4H2O-8e-===SO+8H+
B.放电时,H2SO4溶液的浓度不断减小
C.充电时,阳极区需补充适量水以保持溶液浓度不变
D.充电时,导线中流过8 mol e-同时有6 mol H+通过交换膜
16.(2023·茂名一中模拟)某科研团队设计的酶—光电化学电池可同时在电池两室分别实现两种酶催化转化,原理如图所示。下列说法错误的是( )
A.该电池工作过程中实现了光能转化为化学能
B.氢离子从ITO电极向Mo∶BiVO4电极方向迁移
C.Mo∶BiVO4电极上的反应式为2H2O-2e-===H2O2+2H+
D.消耗1 mol 同时生成1 mol
选择题突破六 电化学
1.A [A.青铜神树中含有Sn和Cu,可能涉及电化学腐蚀,故A符合题意;B.玉璋属于玉器,主要成分为无机物,不涉及电化学腐蚀,故B不符合题意;C.陶瓷马头以粘土为主要原料制成,不涉及电化学腐蚀,故C不符合题意;D.黄金面罩由黄金制成,只含有金,不涉及电化学腐蚀,故D不符合题意。]
2.B [瓶中为氯化钠溶液,通电时为电解氯化钠溶液,阳极氯离子失去电子生成氯气,阴极水得电子生成氢气和氢氧化钠,氯气与生成的氢氧化钠反应生成次氯酸钠和水。A.该装置点击开关,电解反应可进行,关闭开关,反应停止,该瓶子为密闭装置,理论上氯气不会逸出,A正确;B.通电时,氯离子失去电子生成氯气,发生氧化反应,B错误;C.根据分析,通电时阴极水得电子生成氢气和氢氧化钠,氢气易燃,故使用时应避开火源,C正确;D.根据分析,氯气与生成的氢氧化钠反应生成次氯酸钠和水,D正确。]
3.C [裹有锌片的铁钉放入含有酚酞-饱和NaCl琼脂溶液中,发生电化学腐蚀,锌片为负极,发生反应:Zn-2e-===Zn2+,铁钉为正极:O2+4e-+2H2O===4OH-,在铁钉附近酚酞溶液变红。A.a为铁钉,为原电池正极,发生反应O2+4e-+2H2O===4OH-,产生OH-,酚酞溶液变红,A正确;B.b处为锌片,锌片为负极,发生反应:Zn-2e-===Zn2+,所以b处c(Zn2+)增大,B正确;C.c处为铁钉,发生反应O2+4e-+2H2O===4OH-,不会产生气泡,C错误;D.铁为正极,不发生反应,被保护起来,D正确。]
4.C [由题干信息可知,该电池正、负极区域电解质溶液分别为H2SO4溶液、NaOH溶液,放电时,负极发生氧化反应,电极反应式为BH-8e-+8OH-===BO+6H2O,正极发生还原反应,电极反应式为H2O2+2H++2e-===2H2O,据此分析解题。A.负极发生氧化反应,电极反应式为BH-8e-+8OH-===BO+6H2O,即负极上BH被氧化,A错误;B.由分析可知,电极反应式为H2O2+2H++2e-===2H2O,B错误;C.原电池内部电解质溶液中阳离子移向正极,阴离子移向负极,即Na+由负极移向正极,C正确;D.由分析可知,电极反应式为H2O2+2H++2e-===2H2O,反应生成H2O,则正极区溶液中c(SO)减小,D错误。]
5.B [根据图示,阳极室中,MnOOH失电子变为MnO2;阴极室中,糠醛得电子生成糠醇。双极膜将水解离为H+和OH-,并实现其定向通过。据图可知电解时,阴极反应为+2e-+2H+===,A正确;理论上外电路中迁移2 mol电子,阳极室和阴极室各需要消耗1 mol糠醛,共需要消耗2 mol糠醛,B错误;电解时,MnO2和MnOOH在电极与糠醛之间传递电子,C正确;据图可知在阳极室糠醛生成糠酸盐的离子反应方程式为+2MnO2+OH-―→+2MnOOH,D正确。]
6.D [A.放电时该电池中电子通过外电路,Li+通过内电路均移向正极,A正确;B.由图中信息可知,正极S8放电生成Li2S,正极的电极反应式为S8+16e-+16Li+===8Li2S,B正确;C.锂和水能反应,锂硫电池中电解质不能为水溶液,该电池的电解质为非水体系,通过传递Li+形成电流,C正确;D.金属锂片为负极,充电时,金属锂片连接外加电源的负极,金属锂片上发生Li+得电子的过程,属于还原反应,D错误。]
7.D [该装置以Fe、Ni为电极制取Na2FeO4,为电解池装置,Fe电极为阳极,Ni电极为阴极,阳极电极反应式为Fe-6e-+8OH-===FeO+4H2O,OH-移动向Ⅲ室,阴极电极反应式为2H2O+2e-===H2↑+2OH-,Na+应移动向Ⅰ室。A项,Fe电极为阳极,Fe失电子生成FeO,电极反应式为Fe-6e-+8OH-===FeO+4H2O,故A正确;B项,Fe电极为阳极,Ni电极为阴极,Ⅱ室中的Na+移动向Ⅰ室,OH-移动向Ⅲ室,故离子交换膜a、b分别为阳离子交换膜、阴离子交换膜,故B正确;C项,通入Ⅰ室的水中加入少量NaOH,可以增强溶液的导电性,可以加快高铁酸钠的生成,故C正确;D项,每生成0.1 mol Na2FeO4,外电路中通过0.6 mol电子,则Ⅱ室溶液中减少的NaOH的物质的量为0.6 mol,质量为24.0 g,故D错误;故选D。]
8.A [A.闭合K1后,构成电解池装置,M极为阳极,电极反应式:2Cl--2e-===Cl2↑,氯气进入水池消毒,A正确;B.断开K1,闭合K2时,构成原电池装置,M极为正极,N极为负极,e-由N极流出,B错误;C.断开K1,闭合K2后,构成原电池装置,N极为负极,电极反应式:Na-e-===Na+,N极金属Na不断减少,C错误;D.钠离子交换膜换成质子交换膜后H+会穿过膜与N极的Na反应,故不可换为质子交换膜,D错误。]
9.C [A.HCOOK为强碱弱酸盐,其水溶液呈碱性,A项错误;B.钛为22号元素,基态钛原子的价电子排布式为3d24s2,B项错误;C.阳极上发生氧化反应:C3H8O3-8e-+11OH-===3HCOO-+8H2O,C项正确;D.阴极发生反应8H2O+8e-===4H2↑+8OH-,由两电极反应可知总反应消耗OH-,一段时间后,电解质溶液的碱性减弱,D项错误。]
10.B [A.a中氢离子向正极右侧迁移,b中氢离子向阴极右侧迁移,故A说法正确;B.a装置中甲电极上乙酸根离子失去电子发生氧化反应生成二氧化碳,反应式为CH3COO--8e-+2H2O===2CO2↑+7H+,故B说法错误; C.图b装置中丙电极为阳极、丁电极为阴极,则丙的电势比丁电极高,故C说法正确;D.图b装置中丁电极二氧化碳转化为甲醇,电子转移情况为CO2~6e-,则每消耗22.4 L CO2(标准状况下为1 mol),转移电子数约为6×6.02×1023=3.612×1024,故D说法正确。]
11.C [由图可知,锌发生氧化反应为负极,则多孔Pd纳米片为正极;A.由分析可知,多孔Pd纳米片为正极,电极上发生还原反应,A正确;B.Zn电极锌失去电子生成Zn(OH),反应式为Zn+4OH--2e-===Zn(OH),B正确;C.原电池中阳离子向正极移动、阴离子向负极移动,故b为H+,a为OH-,C错误;D.当外电路通过1 mol e-时,由电荷守恒可知,双极膜中离解水的物质的量为1 mol,产生1 mol氢离子、1 mol氢氧根离子,D正确。]
12.D [由题干图示信息可知,TiO2电极将NO转化为NH3·H2O可知TiO2电极为阴极,电极反应式为NO+7H++6e-===NH3·H2O+H2O,石墨电极为阳极,电极反应为2H2O-4e-===4H++O2↑,故a电极为负极,发生氧化反应,即Zn为负极,电极反应式为Zn-2e-===Zn2+,b电极为正极,发生还原反应,电极反应式为NO2+e-===NO,据此分析解题。A.由分析可知,a电极为Zn电极是负极,A错误;B.放电过程中,负极发生氧化反应,电极反应式为Zn-2e-===Zn2+,B错误;C.由分析可知,电解过程中,TiO2电极为阴极,电极反应式为NO+7H++6e-===NH3·H2O+H2O,则阴极区溶液的pH逐渐增大,C错误;D.由分析可知,理论上,每得到1 mol NH3·H2O,需得到6 mol电子,故至少需要消耗Zn的质量为×65 g·mol-1=195 g,D正确。]
13.C [传统氯碱工艺使用阳离子交换膜,防止阳极生成的Cl2与阴极生成的NaOH反应,而该工艺的各步装置中均不需要使用离子交换膜,A项正确;第一步生产NaOH的装置为电解池,阳极反应为Na0.44MnO2-xe-===Na0.44-xMnO2+xNa+,B项正确;第二步提取Na+和Cl-的装置为原电池,负极反应为Ag-e-+Cl-===AgCl,正极反应为Na0.44-xMnO2+xNa++xe-===Na0.44MnO2,则溶液中NaCl的含量减小,C项错误;第三步生成Cl2的阳极反应为2Cl--2e-===Cl2↑,D项正确。]
14.A [A.由装置可知电极b上水放电生成氧气,电极反应式为2H2O-4e-===O2↑+4H+,电极b附近溶液的pH值减小,故A错误;B.电极a上发生反应HSO转化为S2O,电极反应式为2HSO+2e-+2H+===S2O+2H2O,故B正确;C.由电解反应可知电极b上水放电生成氧气,反应生成的氢离子通过质子膜进入左侧,电解过程中损失水,则右侧Na2SO4的浓度增大,故C正确;D.由电极反应可知电解过程中有4 mol H+通过质子膜时,电路中转移4 mol电子,则生成2 mol S2O,S2O与NO反应生成氮气和HSO,反应方程式为2S2O+2NO+2H2O===4HSO+N2,2 mol S2O可处理2 mol NO,质量为60 g,故D正确。]
15.C [A.放电时,由题图得,Mn2+离子被氧化,故A错误;B.放电时,正极区中的氢离子被还原生成氢气,负极区中的氢离子会透过质子交换膜流向正极区,硫酸浓度不变,故B错误;C.充电时,阳极区中的水被氧化,2H2O-4e-===O2↑+4H+,需补充适量水来维持浓度,故C正确;D.充电时,根据C中方程式,导线中流过8 mol电子时,应有8 mol氢离子穿过质子穿透膜,故D错误。]
16.B [该结构是酶-光电化学电池,由电子移动的方向可知ITO电极为正极,Mo∶BiVO4电极为负极,FMN(H2)在正极转化为FMN,H2O在负极失去电子生成H2O2和H+,以此解答。A.该电池是光电化学电池,工作过程中实现了光能转化为化学能,故A正确;B.原电池结构中,阳离子向正极移动,则氢离子从Mo∶BiVO4电极向ITO电极移动,故B错误;C.由分析可知,Mo∶BiVO4电极为负极,H2O在负极失去电子生成H2O2和H+,电极方程式为:2H2O-2e-===H2O2+2H+,故C正确;D.由图可知,正极和H2反应生成,负极和H2O2反应生成,而生成1 mol H2和1 mol H2O2转移的电子数相等,则消耗1 mol 同时生成1 mol ,故D正确。]
同课章节目录
