选择题突破七 化学反应速率与化学平衡 专项特训(含解析)2024年高考化学二轮复习
文档属性
| 名称 | 选择题突破七 化学反应速率与化学平衡 专项特训(含解析)2024年高考化学二轮复习 |  | |
| 格式 | DOCX | ||
| 文件大小 | 396.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-13 20:00:07 | ||
图片预览



文档简介
选择题突破七 化学反应速率与化学平衡
A卷
1.(2023·广州天河区二模)臭氧分解2O33O2的反应历程包括以下反应:
反应①:O3→O2+O· (快)
反应②:O3+O·→2O2 (慢)
大气中的氯氟烃光解产生的氯自由基(Cl·)能够催化O3分解,加速臭氧层的破坏。下列说法正确的是( )
A.活化能:反应①>反应②
B.O3分解为O2的速率主要由反应②决定
C.Cl·主要参与反应①,改变O3分解的反应历程
D.Cl·参与反应提高了O3分解为O2的平衡转化率
2.(2023·广州模拟)氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为
第一步 I2(g)2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·c0.5(I2)(k为速率常数)。下列表述正确的是( )
A.N2O分解反应中,k(含碘)>k(无碘)
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步小
D.I2浓度与N2O分解速率无关
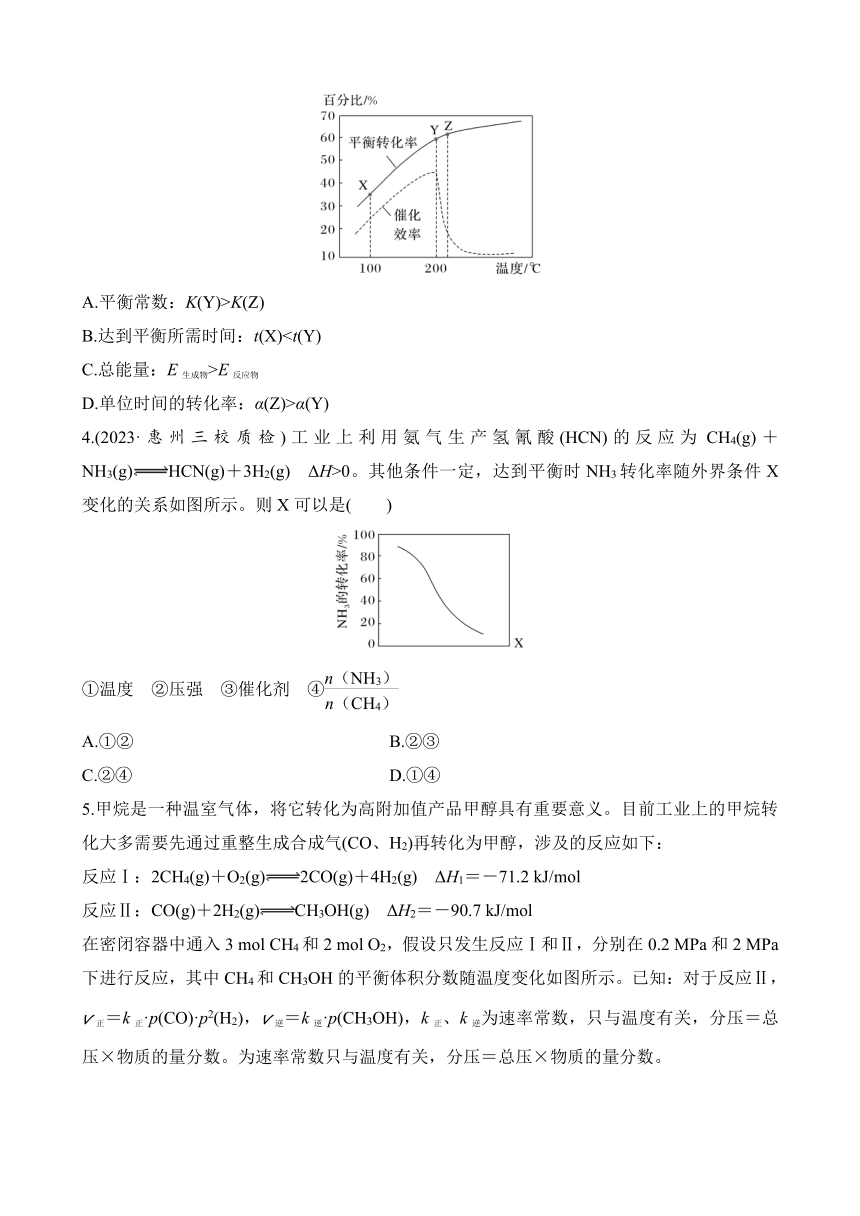
3.(2023·湛江二模)一定条件下热解制取H2:2H2S(g)+CH4(g)CS2(g)+4H2(g)。已知其他条件不变时,温度对H2S的平衡转化率和催化剂催化效率的影响如图所示。下列说法一定正确的是( )
A.平衡常数:K(Y)>K(Z)
B.达到平衡所需时间:t(X)C.总能量:E生成物>E反应物
D.单位时间的转化率:α(Z)>α(Y)
4.(2023·惠州三校质检)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)HCN(g)+3H2(g) ΔH>0。其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是( )
①温度 ②压强 ③催化剂 ④
A.①② B.②③
C.②④ D.①④
5.甲烷是一种温室气体,将它转化为高附加值产品甲醇具有重要意义。目前工业上的甲烷转化大多需要先通过重整生成合成气(CO、H2)再转化为甲醇,涉及的反应如下:
反应Ⅰ:2CH4(g)+O2(g)2CO(g)+4H2(g) ΔH1=-71.2 kJ/mol
反应Ⅱ:CO(g)+2H2(g)CH3OH(g) ΔH2=-90.7 kJ/mol
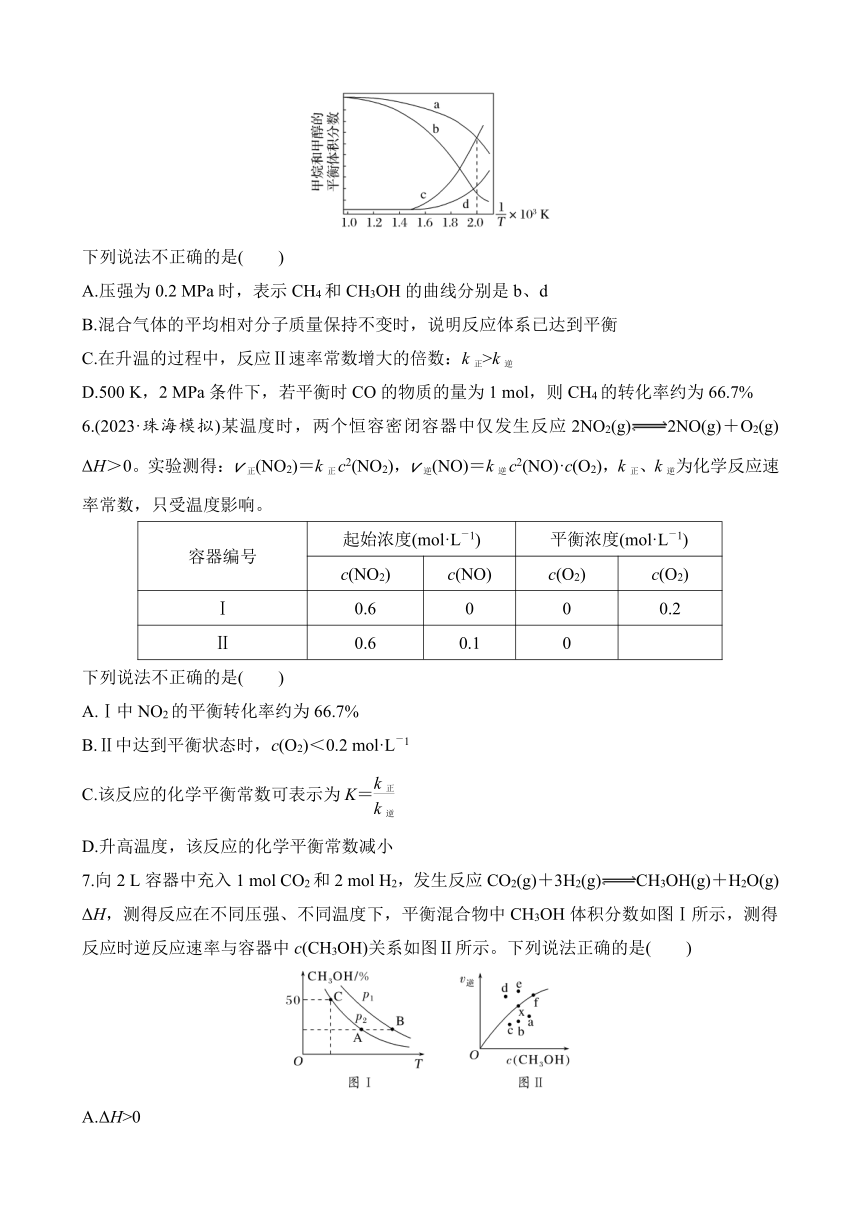
在密闭容器中通入3 mol CH4和2 mol O2,假设只发生反应Ⅰ和Ⅱ,分别在0.2 MPa和2 MPa下进行反应,其中CH4和CH3OH的平衡体积分数随温度变化如图所示。已知:对于反应Ⅱ,v正=k正·p(CO)·p2(H2),v逆=k逆·p(CH3OH),k正、k逆为速率常数,只与温度有关,分压=总压×物质的量分数。为速率常数只与温度有关,分压=总压×物质的量分数。
下列说法不正确的是( )
A.压强为0.2 MPa时,表示CH4和CH3OH的曲线分别是b、d
B.混合气体的平均相对分子质量保持不变时,说明反应体系已达到平衡
C.在升温的过程中,反应Ⅱ速率常数增大的倍数:k正>k逆
D.500 K,2 MPa条件下,若平衡时CO的物质的量为1 mol,则CH4的转化率约为66.7%
6.(2023·珠海模拟)某温度时,两个恒容密闭容器中仅发生反应2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:v正(NO2)=k正c2(NO2),v逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器编号 起始浓度(mol·L-1) 平衡浓度(mol·L-1)
c(NO2) c(NO) c(O2) c(O2)
Ⅰ 0.6 0 0 0.2
Ⅱ 0.6 0.1 0
下列说法不正确的是( )
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L-1
C.该反应的化学平衡常数可表示为K=
D.升高温度,该反应的化学平衡常数减小
7.向2 L容器中充入1 mol CO2和2 mol H2,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH,测得反应在不同压强、不同温度下,平衡混合物中CH3OH体积分数如图Ⅰ所示,测得反应时逆反应速率与容器中c(CH3OH)关系如图Ⅱ所示。下列说法正确的是( )
A.ΔH>0
B.p1C.K(C)>K(A)=K(B)
D.图Ⅱ中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是d
8.(2023·深圳外国语学校模拟)某温度时两个恒容密闭容器中仅发生反应2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:v正=k正·c2(NO2),v逆=k逆·c2(NO)·c(O2),k正、k逆为速率常数,只受温度影响。
容器编号 起始浓度/(mol·L-1) 平衡浓度/(mol·L-1)
c(NO2) c(NO) c(O2) c(O2)
Ⅰ 0.6 0 0 0.2
Ⅱ 0.6 0.1 0
下列说法正确的是( )
A.升高温度,该反应的化学平衡常数减小
B.Ⅰ中的NO2平衡转化率约为33.3%
C.Ⅱ中达到平衡状态时,c(O2)>0.2 mol·L-1
D.该反应的化学平衡常数可表示为K=
9.(2023·江门联考)某化学兴趣小组在一定条件下的绝热恒容密闭容器中探究反应:2A(g)B(g) ΔH,在一定温度和压强下可自发进行,反应起始时仅通入一定量的A(g),根据实验测得的数据,绘制的c-t图像如图。下列有关说法错误的是( )
A.曲线b表示反应物A的浓度变化
B.ΔH>0,2 mol A(g)的总键能大于1 mol B(g)的总键能
C.t1时表示c(A)=c(B),但反应未达到平衡状态
D.其他条件不变时,在恒温条件下反应时A(g)的平衡转化率大于在绝热条件下反应时A(g)的平衡转化率
B卷
10.(2023·汕头二模)实验小组为探究反应:2NO2(g)N2O4(g),ΔH<0进行如下操作:在T ℃(各物质均为气态)时,将一定量的NO2充入注射器中后封口,图乙是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列有关说法错误的是( )
A.d点处:v正B.由图乙可知注射器的移动轨迹为N→P→M
C.若注射器隔热导致反应温度发生变化,则b、c两点的平衡常数Kb>Kc
D.平衡时维持体积不变,再充入一定量NO2,则NO2的物质的量分数比原来小
11.(2023·广州二中模拟)一定条件下,在容积为10 L的固定容器中发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0,反应过程如下图。下列说法正确的是( )
A.t1 min时,正、逆反应速率相等
B.曲线X表示NH3的物质的量随时间变化的关系
C.0~8 min,H2的化学反应速率v(H2)=0.75 mol·L-1·min-1
D.10~12 min,N2的化学反应速率v(N2)=0.25 mol·L-1·min-1
12.(2023·东莞期末)催化制氢是目前大规模制取氢气的方法之一:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41.2 kJ/mol研究表明,此反应的速率方程为v=k[x(CO)·x(H2O)-],式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示相应的物质的量分数,Kp为平衡常数,
k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。下列有关说法正确的是( )
A.温度越低,Kp越小
B.温度升高,反应速率增大
C.此反应速率只受温度影响
D.T>Tm时,Kp减小对反应速率的影响大于k增大的影响
13.(2023·揭阳联考)纳米二氧化钛催化剂可用于工业上合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH,按=2投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图所示。下列说法错误的是( )
A.ΔH<0
B.p1>p2>p3
C.N点CO转化率、平衡常数均大于M点
D.T1 ℃、p3压强下,Q点对应的v正>v逆
14.(2023·佛山顺德区质检)一定温度下,在刚性容器中加入等物质的量的H2(g)与NO(g)发生反应:2H2(g)+2NO(g)N2(g)+2H2O(g) ΔH<0,测得H2(g)与H2O(g)的分压随时间变化如图所示。下列说法正确的是( )
A.当气体密度不再变化时,反应达到平衡
B.体系中气体总物质的量:n初始∶n平衡=5∶4
C.升高温度,反应速率:v正降低,v逆增加
D.该反应的活化能:E正>E逆
15.甲烷部分催化氧化制备乙炔是目前研究的热点之一,反应原理为:2CH4(g)C2H2(g)+3H2(g),一定温度下,将1 mol CH4充入10 L的固定容积容器中发生上述反应,实验测得反应前容器内压强为p0kPa,容器内各气体分压与时间的关系如图所示,t1min时反应达到平衡。下列说法错误的是( )
A.气体密度不变不能说明反应已达平衡状态
B.用H2浓度变化表示0~t1时间内的平均反应速率v(H2)=mol·L-1·min-1
C.t1时刻充入He,反应仍处于平衡状态,甲烷的分压保持不变
D.反应的平衡常数K=0.012
16.(2023·茂名二模)一定温度下,向2 L密闭容器中加入2 mol N2O5发生反应①2N2O5(g)===4NO2(g)+O2(g),②2NO2(g)N2O4(g),反应体系中N2O5、NO2、O2的物质的量随反应时间t的部分变化曲线如图所示,下列说法正确的是( )
A.曲线Ⅱ表示n(NO2)随t的变化
B.0~2 min内,2v(N2O5)=v(O2)=1 mol·L-1·min-1
C.3 min后,充入NO2,容器的气体颜色先变深后变浅
D.3 min后,充入O2,容器的气体颜色变浅
17.(2023·清远清新区联考)T ℃时,含等浓度的AgNO3与Fe(NO3)2的混合溶液中发生反应Fe2+(aq)+Ag+(aq)Fe3+(aq)+Ag(s) ΔH<0,t1时刻,改变某一外界条件继续反应至t2(t2=4t1)时刻,溶液中c(Ag+)和c(Fe3+)随时间的变化关系如图所示。下列说法正确的是( )
已知:T ℃时,该反应的化学平衡常数K=1。
A.若t1时刻未改变外界条件,则此时该反应:v正>v逆
B.若t2时刻反应达到平衡,则t1时刻改变的条件可能为升温
C.若始终保持温度不变,则平均反应速率:vt1>vt2(vt1表示0~t1 s内Fe2+的平均反应速率,vt2表示0~t2 s内Fe2+的平均反应速率)
D.0~t2 s内Ag+的平均反应速率为 mol·L-1·s-1
18.(2023·深圳二调)恒温、恒压下,向密闭容器中充入少量正丁烷,可同时发生以下反应:
已知:ln K=-+C,其中R、C均为常数。反应1和反应2的ln K随变化关系曲线如图所示,下列说法正确的是( )
A.ΔH1<0,ΔH2<0
B.稳定性:反-2-丁烯>顺-2-丁烯
C.a为反应3中ln K随的变化曲线
D.再向平衡体系中充入少量Ar,反应3的平衡常数增大
19.在一定温度下,以I2为催化剂,氯苯和Cl2在CS2溶液中发生反应。
反应①:C6H5Cl+Cl2C6H4Cl2(邻二氯苯)+HCl ΔH1<0
反应②:C6H5Cl+Cl2C6H4Cl2(对二氯苯)+HCl ΔH2<0
反应①和②存在的速率方程:v1正=k1正·c(C6H5Cl)·c(Cl2)和v2正=k2正·c(C6H5Cl)·c(Cl2),k1正、k2正为速率常数,只与温度有关,反应①和②的ln k~曲线如图所示。下列说法错误的是( )
A.若对二氯苯比邻二氯苯稳定,则ΔH1<ΔH2
B.保持反应体系温度恒定,体系中两种有机产物的浓度之比保持不变
C.通过改变催化剂可以提高产物中对二氯苯的比例
D.相同时间内,v正(C6H5Cl)=v正(对二氯苯)+v正(邻二氯苯)
20.(2023·揭阳普通高中期末)向恒容密闭容器中充入物质的量之比为1∶3的CO2和H2,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),反应相同时间,体系中甲醇的百分含量(α)和温度(T)的关系如图所示。下列说法正确的是( )
A.该反应的ΔH>0
B.反应速率:vA=vB
C.容器内总压强p:pA>pC
D.化学平衡常数K:KA>KB=KC
选择题突破七 化学反应速率与化学平衡
1.B [A.活化能越大,反应速率越慢,反应②速率慢,则②活化能大,活化能:反应②>反应①,故A错误;B.化学反应速率由反应速率慢的一步反应决定,则O3分解为O2的速率主要由反应②决定,故B正确;C.氯自由基(Cl·)能够催化O3分解,加速臭氧层的破坏,催化剂可降低最大的活化能来增大速率,则Cl·主要参与反应②,故C错误;D.Cl·是催化剂,只改变反应历程,不影响平衡,则O3分解为O2的平衡转化率不变,故D错误。]
2.A [A.由题意可知,碘的存在能提高N2O的分解速率,v=k·c(N2O)·c 0.5(I2)中v与k成正比,则k(含碘)>k(无碘),A正确;B.慢反应对总反应速率起决定作用,则第二步起决定作用,B错误;C.反应的活化能越大,反应发生消耗的能量就越高,反应就越难发生,反应速率就越慢,第二步反应慢,因此该步反应的活化能比第三步大,C错误;D.根据N2O分解速率方程v=k·c(N2O)·c0.5(I2),I2浓度与N2O分解速率有关,D错误。]
3.C [A.由图像知,随温度的升高,硫化氢的平衡转化率增大,说明升高温度时该反应的平衡向右移动,该反应属于吸热反应,温度越高,平衡常数越大,故A错误;B.Y比X的温度高,且Y比X的催化剂催化效率高,因此,Y比X的反应速率快,达到平衡所需时间:t(X)>t(Y),故B错误;C.该反应属于吸热反应,生成物总能量大于反应物总能量,故C正确;D.由图像知,Z点的温度略高于Y点,但Z点催化剂催化效率远低于Y点,所以,Z比Y的反应速率慢,单位时间的转化率:α(Z)<α(Y),故D错误。]
4.C [图像趋势为平衡时NH3的转化率随外界条件X增大而减小;①反应是吸热反应,升高温度平衡正向移动,NH3转化率随温度的升高而增大,故①错误;②反应是气体体积增大的反应,增大压强平衡逆向移动,NH3转化率随压强增大而减小,故②正确;③催化剂不影响平衡,故③错误;④越大,代表NH3的量越多,有利于平衡正向移动,但是NH3的转化率随着NH3的增多而减小,故④正确;故②④正确。]
5.C [C中当v正=v逆时,既达到化学平衡态,此时k正/k逆=Kp,因反应是放热反应,升温Kp减小,所以升高温度k正/k逆变小,所以k逆增加的倍数更大。]
6.D [用三段式法计算出实验Ⅰ中各组分的改变浓度和平衡浓度:
2NO2(g)2NO(g)+O2(g)
起始mol/L 0.6 0 0
变化mol/L 0.4 0.4 0.2
平衡mol/L 0.2 0.4 0.2
Ⅰ中NO2的平衡转化率为×100%≈66.7%,故A正确;Ⅰ中平衡时c(O2)=0.2 mol·L-1,实验Ⅱ相当于在Ⅰ基础上再加入NO,平衡会逆向移动,c(O2)<0.2 mol·L-1,故B正确;平衡时v正(NO2)=v逆(NO),即k正c2(NO2)=k逆c2(NO)·c(O2),得==K,故C正确;该反应为吸热反应,升高温度,K值增大,故D错误。]
7.D [A.根据图Ⅰ可知升高温度甲醇的含量降低,说明温度升高平衡逆向进行,反应为放热反应,ΔH<0,A错误;B.正反应气体体积减小,温度不变时增大压强平衡正向进行,甲醇含量增大,所以p1>p2,B错误;C.升高温度,平衡向逆反应方向移动,化学平衡常数减小,由图可知,反应温度:B>A>C,则A、B、C三点对应的平衡常数K(A)、K(B)、K(C)由大到小的顺序排列为K(C)>K(A)>K(B),C错误;D.升高温度,正、逆反应速率均增大,反应为放热反应,平衡向逆反应方向移动,甲醇的浓度减小,则新平衡点可能是图中d点,D正确。]
8.D [A.该反应是吸热反应,升高温度,平衡正向移动,该反应的化学平衡常数增大,故A错误;B.I中平衡时氧气浓度为0.2 mol·L-1,则二氧化氮浓度改变了0.4 mol·L-1,则NO2平衡转化率约为×100%≈66.7%,故B错误;C.Ⅱ相当于在Ⅰ平衡时的基础上充入一氧化氮0.1 mol·L-1,平衡逆向移动,因此Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L-1,故C错误;D.达到平衡时v正=k正·c2(NO2)=v逆=k逆·c2(NO)·c(O2),变形得到K=,因此该反应的化学平衡常数可表示为K=,故D正确。]
9.B [A.反应起始时仅通入一定量的A(g),随着反应进行,c(A)逐渐减小,则曲线b代表物质A的浓度变化,A正确;B.2A(g)B(g) ΔS<0,在一定温度和压强下可自发进行,ΔH<0,反应物的总键能小于生成物的总键能,B错误;C.t1时表示c(A)=c(B),但t1后,反应物A的浓度仍然减小,则反应未达到平衡状态,C正确;D.在绝热条件下反应时,该反应是放热反应,降低温度平衡正向移动,则恒温条件下反应向正反应方向移动,在恒温条件下反应时A(g)的平衡转化率大于在绝热条件下反应时A(g)的平衡转化率,D正确。]
10.B [A.透光率先是突然减小后缓慢增大,说明b点后操作是压缩注射器,导致NO2浓度突然增大,压缩注射器,相当于是增大压强,平衡正向移动,达到平衡,后续透光率突然变大,说明此时是拉伸注射器,导致NO2浓度突然减小,拉伸注射器,相当于是减小压强,平衡逆向移动,d点是v正Kc,故C正确;D.充入NO2,相当于是增大压强,平衡正向移动,NO2平衡转化率增大,达到新的平衡时物质的量分数要比原来更小,故D正确。]
11.B [根据图知,随着反应的进行,X的物质的量增大、Y的物质的量减少,反应达到平衡状态时,X、Y的物质的量变化量分别为Δn(X)=(0.6-0) mol=0.6 mol,Δn(Y)=(1.2-0.3) mol=0.9 mol,X、Y的物质的量变化量之比等于其计量数之比=0.6 mol∶0.9 mol=2∶3,则X是NH3、Y是H2。A.可逆反应达到平衡状态时正逆反应速率相等,没有达到平衡状态时正逆反应速率不等,根据图知,t1 min时,NH3和H2的物质的量仍然在变化,没有保持不变,则该反应没有达到平衡状态,所以正逆反应速率不等,A项错误;B.根据以上分析知,X曲线表示NH3的物质的量随时间变化的关系,B项正确;C. 0~8 min,H2的平均反应速率为v(H2)===0.011 25 mol/(L·min),C项错误;D. 10~12 min,NH3的平均反应速,v(NH3)===0.005 mol/(L·min),再根据同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比计算氮气反应速率为0.002 5 mol·L-1·min-1,D项错误。]
12.D [A.该反应的正反应是放热反应,温度降低,化学平衡正向移动,导致化学平衡常数Kp增大,A错误;B.根据图像可知:当温度T>Tm时,温度升高,化学反应速率反而减小,B错误;C.浓度、压强、催化剂对反应速率都有影响,C错误;D.根据速率方程分析,当温度:T>Tm时,v=k[x(CO)·x(H2O)-]逐渐减小的原因是Kp减小对速率的降低大于k增大对速率的提高,D正确。]
13.C [由图可知,T增大,CO的平衡转化率降低,平衡逆向移动,说明是放热反应,ΔH<0,A项正确;根据勒夏特列原理,增大压强向体积减少的方向移动,压强越大,CO的平衡转化率也越大,p1、p2、p3关系是p3v逆,D项正确。]
14.B [A.根据质量守恒,气体总质量不变,容器体积不变,气体密度一直保持不变,不能判断反应是否达到平衡,A错误;B.由三段式
则体系中气体总物质的量:n初始∶n平衡=5∶4,B正确;C.升高温度,正、逆反应速率都增加,C错误;D.该反应为放热反应,正反应活化能小于逆反应活化能,D错误。]
15.D [A.恒温恒容下,根据质量守恒,气体质量始终不变,体积始终不变,故密度始终不变,密度不变不能作为平衡的标志,A正确;B.起始充入CH4的物质的量为1 mol,压强为p0kPa,由图可知,平衡时由压强比等于物质的量之比推知平衡时CH4的物质的量和H2相等,均为C2H2的3倍,则有:
2CH4(g)C2H2(g)+3H2(g)
起始量(mol) 1 0 0
转化量(mol) 2x x 3x
平衡量(mol) 1-2x x 3x
即1-2x=3x,解得x=0.2,故平衡时CH4、C2H2、H2的物质的量分别为0.6 mol、0.2 mol、0.6 mol,则0~t1时间内v(H2)==mol/(L·min),B正确;C.恒温恒容,充入He,反应体系的各物质浓度不变,平衡不发生移动,所以甲烷的分压保持不变,C正确;D.根据B选项列出的三段式,反应的平衡常数K===0.001 2,D错误。]
16.C [向2 L密闭容器中加入2 mol N2O5发生反应①2N2O5(g)===4NO2(g)+O2(g),②2NO2(g)N2O4(g),反应体系中N2O5、NO2、O2的物质的量随反应时间t的部分变化曲线如图所示,反应过程中N2O5的物质的量减小,则曲线Ⅲ表示n(N2O5)随t的变化, NO2和O2的物质的量增大,且生成NO2的物质的量更多,则曲线Ⅰ表示n(NO2)随t的变化,曲线Ⅱ表示n(O2)随t的变化,以此解答。A.由分析可知,曲线Ⅱ表示n(O2)随t的变化,故A错误;B.曲线Ⅲ表示n(N2O5)随t的变化,结合方程式2N2O5(g)===4NO2(g)+O2(g) 可知,0~2 min内,==v(O2)=0.25 mol·L-1·min-1,故B错误;C.3 min后,充入NO2,NO2的浓度增大,容器的气体颜色变深,然后平衡2NO2(g)??N2O4(g)正向移动,容器的气体颜色变浅,故C正确;D.反应①2N2O5(g)===4NO2(g)+O2(g)不是可逆反应,3 min后,充入O2,NO2的浓度不变,容器的气体颜色不变,故D错误。]
17.C [A.因为混合溶液中AgNO3与Fe(NO3)2等浓度,因此Ag+与Fe2+浓度相等,根据反应式可知,Ag+、Fe2+、Fe3+三者系数比为1∶1∶1,即三者变化量相等。若t1时刻未改变外界条件,则浓度商Q===1=K,因此此时该反应处于平衡状态, v正=v逆,A错误;B.该反应为放热反应,升温会导致平衡逆向移动,根据图像可知,t1时刻改变条件后,平衡正向移动,因此t1时刻改变的条件不是升温,B错误;C.因为Ag+、Fe2+系数比为1∶1,因此v(Fe2+)=v(Ag+),且t2=4t1,根据图像,vt1=,vt2==,因此vt1>vt2,C正确;D.根据图像,0~t2 s内Ag+的平均反应速率为 mol·L-1·s-1,D错误。]
18.B [A.由题干图示信息可知,反应1和反应2的ln K随增大而减小,故ΔH1>0,ΔH2>0,A错误;B.由题干图示信息可知,相同时反应2的ln K更大,则有ΔH1>ΔH2,反应3=反应2-反应1,则ΔH3=ΔH2-ΔH1小于0,即顺-2-丁烯具有的总能量高于反-2-丁烯,能量越高越不稳定,故稳定性:反-2-丁烯>顺-2-丁烯,B正确;C.由B项分析可知ΔH3<0,则ln K随的增大而增大,故a不为反应3中ln K随的变化曲线,C错误;D.平衡常数仅仅是温度的函数,温度不变平衡常数不变,故再向平衡体系中充入少量Ar,反应3的平衡常数不变,D错误。]
19.A [A.反应①和反应②均为放热反应,即ΔH1<0、ΔH2<0,又知对二氯苯比邻二氯苯稳定,则反应②放出的热量更多,即ΔH1>ΔH2,选项A错误;B.速率大小由v1正=k1正·c(C6H5Cl)·c(Cl2)和v2正=k2正·c(C6H5Cl)·c(Cl2)判断,影响因素只与k1正、k2正有关,温度恒定时,k1正、k2正保持不变,则两种有机产物的浓度之比保持不变,选项B正确;C.改变催化剂可改变选择性,可提高产物中对二氯苯的比例,选项C正确;D.反应①和反应②中C6H5Cl转化为对二氯苯和邻二氯苯均为1∶1进行,则v正(C6H5Cl)=v正(对二氯苯)+v正(邻二氯苯)成立,选项D正确。]
20.D [A.反应相同时间,体系中甲醇的百分含量(α)随着温度升高而升高,平衡后升温,甲醇百分含量下降,说明升温平衡逆向移动,该反应为放热反应,ΔH<0,A错误;B.B点温度高,反应速率快,反应速率:vA<vB,B错误;C.A、B甲醇含量相同,B点温度高,故容器内总压强:pB>pA,C点未达到平衡,且向B点移动,甲醇含量升高,正方向为体积分子数减小的方向,故pC>pB,故pC>pA,C错误;D.该反应为放热反应,升温K值减小,化学平衡常数K:KA>KB=KC,D正确。]
A卷
1.(2023·广州天河区二模)臭氧分解2O33O2的反应历程包括以下反应:
反应①:O3→O2+O· (快)
反应②:O3+O·→2O2 (慢)
大气中的氯氟烃光解产生的氯自由基(Cl·)能够催化O3分解,加速臭氧层的破坏。下列说法正确的是( )
A.活化能:反应①>反应②
B.O3分解为O2的速率主要由反应②决定
C.Cl·主要参与反应①,改变O3分解的反应历程
D.Cl·参与反应提高了O3分解为O2的平衡转化率
2.(2023·广州模拟)氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。碘蒸气的存在能大幅度提高N2O的分解速率,反应历程为
第一步 I2(g)2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·c0.5(I2)(k为速率常数)。下列表述正确的是( )
A.N2O分解反应中,k(含碘)>k(无碘)
B.第一步对总反应速率起决定作用
C.第二步活化能比第三步小
D.I2浓度与N2O分解速率无关
3.(2023·湛江二模)一定条件下热解制取H2:2H2S(g)+CH4(g)CS2(g)+4H2(g)。已知其他条件不变时,温度对H2S的平衡转化率和催化剂催化效率的影响如图所示。下列说法一定正确的是( )
A.平衡常数:K(Y)>K(Z)
B.达到平衡所需时间:t(X)
D.单位时间的转化率:α(Z)>α(Y)
4.(2023·惠州三校质检)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g)HCN(g)+3H2(g) ΔH>0。其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。则X可以是( )
①温度 ②压强 ③催化剂 ④
A.①② B.②③
C.②④ D.①④
5.甲烷是一种温室气体,将它转化为高附加值产品甲醇具有重要意义。目前工业上的甲烷转化大多需要先通过重整生成合成气(CO、H2)再转化为甲醇,涉及的反应如下:
反应Ⅰ:2CH4(g)+O2(g)2CO(g)+4H2(g) ΔH1=-71.2 kJ/mol
反应Ⅱ:CO(g)+2H2(g)CH3OH(g) ΔH2=-90.7 kJ/mol
在密闭容器中通入3 mol CH4和2 mol O2,假设只发生反应Ⅰ和Ⅱ,分别在0.2 MPa和2 MPa下进行反应,其中CH4和CH3OH的平衡体积分数随温度变化如图所示。已知:对于反应Ⅱ,v正=k正·p(CO)·p2(H2),v逆=k逆·p(CH3OH),k正、k逆为速率常数,只与温度有关,分压=总压×物质的量分数。为速率常数只与温度有关,分压=总压×物质的量分数。
下列说法不正确的是( )
A.压强为0.2 MPa时,表示CH4和CH3OH的曲线分别是b、d
B.混合气体的平均相对分子质量保持不变时,说明反应体系已达到平衡
C.在升温的过程中,反应Ⅱ速率常数增大的倍数:k正>k逆
D.500 K,2 MPa条件下,若平衡时CO的物质的量为1 mol,则CH4的转化率约为66.7%
6.(2023·珠海模拟)某温度时,两个恒容密闭容器中仅发生反应2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:v正(NO2)=k正c2(NO2),v逆(NO)=k逆c2(NO)·c(O2),k正、k逆为化学反应速率常数,只受温度影响。
容器编号 起始浓度(mol·L-1) 平衡浓度(mol·L-1)
c(NO2) c(NO) c(O2) c(O2)
Ⅰ 0.6 0 0 0.2
Ⅱ 0.6 0.1 0
下列说法不正确的是( )
A.Ⅰ中NO2的平衡转化率约为66.7%
B.Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L-1
C.该反应的化学平衡常数可表示为K=
D.升高温度,该反应的化学平衡常数减小
7.向2 L容器中充入1 mol CO2和2 mol H2,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH,测得反应在不同压强、不同温度下,平衡混合物中CH3OH体积分数如图Ⅰ所示,测得反应时逆反应速率与容器中c(CH3OH)关系如图Ⅱ所示。下列说法正确的是( )
A.ΔH>0
B.p1
D.图Ⅱ中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是d
8.(2023·深圳外国语学校模拟)某温度时两个恒容密闭容器中仅发生反应2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:v正=k正·c2(NO2),v逆=k逆·c2(NO)·c(O2),k正、k逆为速率常数,只受温度影响。
容器编号 起始浓度/(mol·L-1) 平衡浓度/(mol·L-1)
c(NO2) c(NO) c(O2) c(O2)
Ⅰ 0.6 0 0 0.2
Ⅱ 0.6 0.1 0
下列说法正确的是( )
A.升高温度,该反应的化学平衡常数减小
B.Ⅰ中的NO2平衡转化率约为33.3%
C.Ⅱ中达到平衡状态时,c(O2)>0.2 mol·L-1
D.该反应的化学平衡常数可表示为K=
9.(2023·江门联考)某化学兴趣小组在一定条件下的绝热恒容密闭容器中探究反应:2A(g)B(g) ΔH,在一定温度和压强下可自发进行,反应起始时仅通入一定量的A(g),根据实验测得的数据,绘制的c-t图像如图。下列有关说法错误的是( )
A.曲线b表示反应物A的浓度变化
B.ΔH>0,2 mol A(g)的总键能大于1 mol B(g)的总键能
C.t1时表示c(A)=c(B),但反应未达到平衡状态
D.其他条件不变时,在恒温条件下反应时A(g)的平衡转化率大于在绝热条件下反应时A(g)的平衡转化率
B卷
10.(2023·汕头二模)实验小组为探究反应:2NO2(g)N2O4(g),ΔH<0进行如下操作:在T ℃(各物质均为气态)时,将一定量的NO2充入注射器中后封口,图乙是在拉伸或压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列有关说法错误的是( )
A.d点处:v正
C.若注射器隔热导致反应温度发生变化,则b、c两点的平衡常数Kb>Kc
D.平衡时维持体积不变,再充入一定量NO2,则NO2的物质的量分数比原来小
11.(2023·广州二中模拟)一定条件下,在容积为10 L的固定容器中发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0,反应过程如下图。下列说法正确的是( )
A.t1 min时,正、逆反应速率相等
B.曲线X表示NH3的物质的量随时间变化的关系
C.0~8 min,H2的化学反应速率v(H2)=0.75 mol·L-1·min-1
D.10~12 min,N2的化学反应速率v(N2)=0.25 mol·L-1·min-1
12.(2023·东莞期末)催化制氢是目前大规模制取氢气的方法之一:CO(g)+H2O(g)CO2(g)+H2(g) ΔH=-41.2 kJ/mol研究表明,此反应的速率方程为v=k[x(CO)·x(H2O)-],式中x(CO)、x(H2O)、x(CO2)、x(H2)分别表示相应的物质的量分数,Kp为平衡常数,
k为反应的速率常数,温度升高时k值增大。在气体组成和催化剂一定的情况下,反应速率随温度变化的曲线如图所示。下列有关说法正确的是( )
A.温度越低,Kp越小
B.温度升高,反应速率增大
C.此反应速率只受温度影响
D.T>Tm时,Kp减小对反应速率的影响大于k增大的影响
13.(2023·揭阳联考)纳米二氧化钛催化剂可用于工业上合成甲醇:CO(g)+2H2(g)CH3OH(g) ΔH,按=2投料比将H2与CO充入V L恒容密闭容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图所示。下列说法错误的是( )
A.ΔH<0
B.p1>p2>p3
C.N点CO转化率、平衡常数均大于M点
D.T1 ℃、p3压强下,Q点对应的v正>v逆
14.(2023·佛山顺德区质检)一定温度下,在刚性容器中加入等物质的量的H2(g)与NO(g)发生反应:2H2(g)+2NO(g)N2(g)+2H2O(g) ΔH<0,测得H2(g)与H2O(g)的分压随时间变化如图所示。下列说法正确的是( )
A.当气体密度不再变化时,反应达到平衡
B.体系中气体总物质的量:n初始∶n平衡=5∶4
C.升高温度,反应速率:v正降低,v逆增加
D.该反应的活化能:E正>E逆
15.甲烷部分催化氧化制备乙炔是目前研究的热点之一,反应原理为:2CH4(g)C2H2(g)+3H2(g),一定温度下,将1 mol CH4充入10 L的固定容积容器中发生上述反应,实验测得反应前容器内压强为p0kPa,容器内各气体分压与时间的关系如图所示,t1min时反应达到平衡。下列说法错误的是( )
A.气体密度不变不能说明反应已达平衡状态
B.用H2浓度变化表示0~t1时间内的平均反应速率v(H2)=mol·L-1·min-1
C.t1时刻充入He,反应仍处于平衡状态,甲烷的分压保持不变
D.反应的平衡常数K=0.012
16.(2023·茂名二模)一定温度下,向2 L密闭容器中加入2 mol N2O5发生反应①2N2O5(g)===4NO2(g)+O2(g),②2NO2(g)N2O4(g),反应体系中N2O5、NO2、O2的物质的量随反应时间t的部分变化曲线如图所示,下列说法正确的是( )
A.曲线Ⅱ表示n(NO2)随t的变化
B.0~2 min内,2v(N2O5)=v(O2)=1 mol·L-1·min-1
C.3 min后,充入NO2,容器的气体颜色先变深后变浅
D.3 min后,充入O2,容器的气体颜色变浅
17.(2023·清远清新区联考)T ℃时,含等浓度的AgNO3与Fe(NO3)2的混合溶液中发生反应Fe2+(aq)+Ag+(aq)Fe3+(aq)+Ag(s) ΔH<0,t1时刻,改变某一外界条件继续反应至t2(t2=4t1)时刻,溶液中c(Ag+)和c(Fe3+)随时间的变化关系如图所示。下列说法正确的是( )
已知:T ℃时,该反应的化学平衡常数K=1。
A.若t1时刻未改变外界条件,则此时该反应:v正>v逆
B.若t2时刻反应达到平衡,则t1时刻改变的条件可能为升温
C.若始终保持温度不变,则平均反应速率:vt1>vt2(vt1表示0~t1 s内Fe2+的平均反应速率,vt2表示0~t2 s内Fe2+的平均反应速率)
D.0~t2 s内Ag+的平均反应速率为 mol·L-1·s-1
18.(2023·深圳二调)恒温、恒压下,向密闭容器中充入少量正丁烷,可同时发生以下反应:
已知:ln K=-+C,其中R、C均为常数。反应1和反应2的ln K随变化关系曲线如图所示,下列说法正确的是( )
A.ΔH1<0,ΔH2<0
B.稳定性:反-2-丁烯>顺-2-丁烯
C.a为反应3中ln K随的变化曲线
D.再向平衡体系中充入少量Ar,反应3的平衡常数增大
19.在一定温度下,以I2为催化剂,氯苯和Cl2在CS2溶液中发生反应。
反应①:C6H5Cl+Cl2C6H4Cl2(邻二氯苯)+HCl ΔH1<0
反应②:C6H5Cl+Cl2C6H4Cl2(对二氯苯)+HCl ΔH2<0
反应①和②存在的速率方程:v1正=k1正·c(C6H5Cl)·c(Cl2)和v2正=k2正·c(C6H5Cl)·c(Cl2),k1正、k2正为速率常数,只与温度有关,反应①和②的ln k~曲线如图所示。下列说法错误的是( )
A.若对二氯苯比邻二氯苯稳定,则ΔH1<ΔH2
B.保持反应体系温度恒定,体系中两种有机产物的浓度之比保持不变
C.通过改变催化剂可以提高产物中对二氯苯的比例
D.相同时间内,v正(C6H5Cl)=v正(对二氯苯)+v正(邻二氯苯)
20.(2023·揭阳普通高中期末)向恒容密闭容器中充入物质的量之比为1∶3的CO2和H2,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g),反应相同时间,体系中甲醇的百分含量(α)和温度(T)的关系如图所示。下列说法正确的是( )
A.该反应的ΔH>0
B.反应速率:vA=vB
C.容器内总压强p:pA>pC
D.化学平衡常数K:KA>KB=KC
选择题突破七 化学反应速率与化学平衡
1.B [A.活化能越大,反应速率越慢,反应②速率慢,则②活化能大,活化能:反应②>反应①,故A错误;B.化学反应速率由反应速率慢的一步反应决定,则O3分解为O2的速率主要由反应②决定,故B正确;C.氯自由基(Cl·)能够催化O3分解,加速臭氧层的破坏,催化剂可降低最大的活化能来增大速率,则Cl·主要参与反应②,故C错误;D.Cl·是催化剂,只改变反应历程,不影响平衡,则O3分解为O2的平衡转化率不变,故D错误。]
2.A [A.由题意可知,碘的存在能提高N2O的分解速率,v=k·c(N2O)·c 0.5(I2)中v与k成正比,则k(含碘)>k(无碘),A正确;B.慢反应对总反应速率起决定作用,则第二步起决定作用,B错误;C.反应的活化能越大,反应发生消耗的能量就越高,反应就越难发生,反应速率就越慢,第二步反应慢,因此该步反应的活化能比第三步大,C错误;D.根据N2O分解速率方程v=k·c(N2O)·c0.5(I2),I2浓度与N2O分解速率有关,D错误。]
3.C [A.由图像知,随温度的升高,硫化氢的平衡转化率增大,说明升高温度时该反应的平衡向右移动,该反应属于吸热反应,温度越高,平衡常数越大,故A错误;B.Y比X的温度高,且Y比X的催化剂催化效率高,因此,Y比X的反应速率快,达到平衡所需时间:t(X)>t(Y),故B错误;C.该反应属于吸热反应,生成物总能量大于反应物总能量,故C正确;D.由图像知,Z点的温度略高于Y点,但Z点催化剂催化效率远低于Y点,所以,Z比Y的反应速率慢,单位时间的转化率:α(Z)<α(Y),故D错误。]
4.C [图像趋势为平衡时NH3的转化率随外界条件X增大而减小;①反应是吸热反应,升高温度平衡正向移动,NH3转化率随温度的升高而增大,故①错误;②反应是气体体积增大的反应,增大压强平衡逆向移动,NH3转化率随压强增大而减小,故②正确;③催化剂不影响平衡,故③错误;④越大,代表NH3的量越多,有利于平衡正向移动,但是NH3的转化率随着NH3的增多而减小,故④正确;故②④正确。]
5.C [C中当v正=v逆时,既达到化学平衡态,此时k正/k逆=Kp,因反应是放热反应,升温Kp减小,所以升高温度k正/k逆变小,所以k逆增加的倍数更大。]
6.D [用三段式法计算出实验Ⅰ中各组分的改变浓度和平衡浓度:
2NO2(g)2NO(g)+O2(g)
起始mol/L 0.6 0 0
变化mol/L 0.4 0.4 0.2
平衡mol/L 0.2 0.4 0.2
Ⅰ中NO2的平衡转化率为×100%≈66.7%,故A正确;Ⅰ中平衡时c(O2)=0.2 mol·L-1,实验Ⅱ相当于在Ⅰ基础上再加入NO,平衡会逆向移动,c(O2)<0.2 mol·L-1,故B正确;平衡时v正(NO2)=v逆(NO),即k正c2(NO2)=k逆c2(NO)·c(O2),得==K,故C正确;该反应为吸热反应,升高温度,K值增大,故D错误。]
7.D [A.根据图Ⅰ可知升高温度甲醇的含量降低,说明温度升高平衡逆向进行,反应为放热反应,ΔH<0,A错误;B.正反应气体体积减小,温度不变时增大压强平衡正向进行,甲醇含量增大,所以p1>p2,B错误;C.升高温度,平衡向逆反应方向移动,化学平衡常数减小,由图可知,反应温度:B>A>C,则A、B、C三点对应的平衡常数K(A)、K(B)、K(C)由大到小的顺序排列为K(C)>K(A)>K(B),C错误;D.升高温度,正、逆反应速率均增大,反应为放热反应,平衡向逆反应方向移动,甲醇的浓度减小,则新平衡点可能是图中d点,D正确。]
8.D [A.该反应是吸热反应,升高温度,平衡正向移动,该反应的化学平衡常数增大,故A错误;B.I中平衡时氧气浓度为0.2 mol·L-1,则二氧化氮浓度改变了0.4 mol·L-1,则NO2平衡转化率约为×100%≈66.7%,故B错误;C.Ⅱ相当于在Ⅰ平衡时的基础上充入一氧化氮0.1 mol·L-1,平衡逆向移动,因此Ⅱ中达到平衡状态时,c(O2)<0.2 mol·L-1,故C错误;D.达到平衡时v正=k正·c2(NO2)=v逆=k逆·c2(NO)·c(O2),变形得到K=,因此该反应的化学平衡常数可表示为K=,故D正确。]
9.B [A.反应起始时仅通入一定量的A(g),随着反应进行,c(A)逐渐减小,则曲线b代表物质A的浓度变化,A正确;B.2A(g)B(g) ΔS<0,在一定温度和压强下可自发进行,ΔH<0,反应物的总键能小于生成物的总键能,B错误;C.t1时表示c(A)=c(B),但t1后,反应物A的浓度仍然减小,则反应未达到平衡状态,C正确;D.在绝热条件下反应时,该反应是放热反应,降低温度平衡正向移动,则恒温条件下反应向正反应方向移动,在恒温条件下反应时A(g)的平衡转化率大于在绝热条件下反应时A(g)的平衡转化率,D正确。]
10.B [A.透光率先是突然减小后缓慢增大,说明b点后操作是压缩注射器,导致NO2浓度突然增大,压缩注射器,相当于是增大压强,平衡正向移动,达到平衡,后续透光率突然变大,说明此时是拉伸注射器,导致NO2浓度突然减小,拉伸注射器,相当于是减小压强,平衡逆向移动,d点是v正
11.B [根据图知,随着反应的进行,X的物质的量增大、Y的物质的量减少,反应达到平衡状态时,X、Y的物质的量变化量分别为Δn(X)=(0.6-0) mol=0.6 mol,Δn(Y)=(1.2-0.3) mol=0.9 mol,X、Y的物质的量变化量之比等于其计量数之比=0.6 mol∶0.9 mol=2∶3,则X是NH3、Y是H2。A.可逆反应达到平衡状态时正逆反应速率相等,没有达到平衡状态时正逆反应速率不等,根据图知,t1 min时,NH3和H2的物质的量仍然在变化,没有保持不变,则该反应没有达到平衡状态,所以正逆反应速率不等,A项错误;B.根据以上分析知,X曲线表示NH3的物质的量随时间变化的关系,B项正确;C. 0~8 min,H2的平均反应速率为v(H2)===0.011 25 mol/(L·min),C项错误;D. 10~12 min,NH3的平均反应速,v(NH3)===0.005 mol/(L·min),再根据同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比计算氮气反应速率为0.002 5 mol·L-1·min-1,D项错误。]
12.D [A.该反应的正反应是放热反应,温度降低,化学平衡正向移动,导致化学平衡常数Kp增大,A错误;B.根据图像可知:当温度T>Tm时,温度升高,化学反应速率反而减小,B错误;C.浓度、压强、催化剂对反应速率都有影响,C错误;D.根据速率方程分析,当温度:T>Tm时,v=k[x(CO)·x(H2O)-]逐渐减小的原因是Kp减小对速率的降低大于k增大对速率的提高,D正确。]
13.C [由图可知,T增大,CO的平衡转化率降低,平衡逆向移动,说明是放热反应,ΔH<0,A项正确;根据勒夏特列原理,增大压强向体积减少的方向移动,压强越大,CO的平衡转化率也越大,p1、p2、p3关系是p3
14.B [A.根据质量守恒,气体总质量不变,容器体积不变,气体密度一直保持不变,不能判断反应是否达到平衡,A错误;B.由三段式
则体系中气体总物质的量:n初始∶n平衡=5∶4,B正确;C.升高温度,正、逆反应速率都增加,C错误;D.该反应为放热反应,正反应活化能小于逆反应活化能,D错误。]
15.D [A.恒温恒容下,根据质量守恒,气体质量始终不变,体积始终不变,故密度始终不变,密度不变不能作为平衡的标志,A正确;B.起始充入CH4的物质的量为1 mol,压强为p0kPa,由图可知,平衡时由压强比等于物质的量之比推知平衡时CH4的物质的量和H2相等,均为C2H2的3倍,则有:
2CH4(g)C2H2(g)+3H2(g)
起始量(mol) 1 0 0
转化量(mol) 2x x 3x
平衡量(mol) 1-2x x 3x
即1-2x=3x,解得x=0.2,故平衡时CH4、C2H2、H2的物质的量分别为0.6 mol、0.2 mol、0.6 mol,则0~t1时间内v(H2)==mol/(L·min),B正确;C.恒温恒容,充入He,反应体系的各物质浓度不变,平衡不发生移动,所以甲烷的分压保持不变,C正确;D.根据B选项列出的三段式,反应的平衡常数K===0.001 2,D错误。]
16.C [向2 L密闭容器中加入2 mol N2O5发生反应①2N2O5(g)===4NO2(g)+O2(g),②2NO2(g)N2O4(g),反应体系中N2O5、NO2、O2的物质的量随反应时间t的部分变化曲线如图所示,反应过程中N2O5的物质的量减小,则曲线Ⅲ表示n(N2O5)随t的变化, NO2和O2的物质的量增大,且生成NO2的物质的量更多,则曲线Ⅰ表示n(NO2)随t的变化,曲线Ⅱ表示n(O2)随t的变化,以此解答。A.由分析可知,曲线Ⅱ表示n(O2)随t的变化,故A错误;B.曲线Ⅲ表示n(N2O5)随t的变化,结合方程式2N2O5(g)===4NO2(g)+O2(g) 可知,0~2 min内,==v(O2)=0.25 mol·L-1·min-1,故B错误;C.3 min后,充入NO2,NO2的浓度增大,容器的气体颜色变深,然后平衡2NO2(g)??N2O4(g)正向移动,容器的气体颜色变浅,故C正确;D.反应①2N2O5(g)===4NO2(g)+O2(g)不是可逆反应,3 min后,充入O2,NO2的浓度不变,容器的气体颜色不变,故D错误。]
17.C [A.因为混合溶液中AgNO3与Fe(NO3)2等浓度,因此Ag+与Fe2+浓度相等,根据反应式可知,Ag+、Fe2+、Fe3+三者系数比为1∶1∶1,即三者变化量相等。若t1时刻未改变外界条件,则浓度商Q===1=K,因此此时该反应处于平衡状态, v正=v逆,A错误;B.该反应为放热反应,升温会导致平衡逆向移动,根据图像可知,t1时刻改变条件后,平衡正向移动,因此t1时刻改变的条件不是升温,B错误;C.因为Ag+、Fe2+系数比为1∶1,因此v(Fe2+)=v(Ag+),且t2=4t1,根据图像,vt1=,vt2==,因此vt1>vt2,C正确;D.根据图像,0~t2 s内Ag+的平均反应速率为 mol·L-1·s-1,D错误。]
18.B [A.由题干图示信息可知,反应1和反应2的ln K随增大而减小,故ΔH1>0,ΔH2>0,A错误;B.由题干图示信息可知,相同时反应2的ln K更大,则有ΔH1>ΔH2,反应3=反应2-反应1,则ΔH3=ΔH2-ΔH1小于0,即顺-2-丁烯具有的总能量高于反-2-丁烯,能量越高越不稳定,故稳定性:反-2-丁烯>顺-2-丁烯,B正确;C.由B项分析可知ΔH3<0,则ln K随的增大而增大,故a不为反应3中ln K随的变化曲线,C错误;D.平衡常数仅仅是温度的函数,温度不变平衡常数不变,故再向平衡体系中充入少量Ar,反应3的平衡常数不变,D错误。]
19.A [A.反应①和反应②均为放热反应,即ΔH1<0、ΔH2<0,又知对二氯苯比邻二氯苯稳定,则反应②放出的热量更多,即ΔH1>ΔH2,选项A错误;B.速率大小由v1正=k1正·c(C6H5Cl)·c(Cl2)和v2正=k2正·c(C6H5Cl)·c(Cl2)判断,影响因素只与k1正、k2正有关,温度恒定时,k1正、k2正保持不变,则两种有机产物的浓度之比保持不变,选项B正确;C.改变催化剂可改变选择性,可提高产物中对二氯苯的比例,选项C正确;D.反应①和反应②中C6H5Cl转化为对二氯苯和邻二氯苯均为1∶1进行,则v正(C6H5Cl)=v正(对二氯苯)+v正(邻二氯苯)成立,选项D正确。]
20.D [A.反应相同时间,体系中甲醇的百分含量(α)随着温度升高而升高,平衡后升温,甲醇百分含量下降,说明升温平衡逆向移动,该反应为放热反应,ΔH<0,A错误;B.B点温度高,反应速率快,反应速率:vA<vB,B错误;C.A、B甲醇含量相同,B点温度高,故容器内总压强:pB>pA,C点未达到平衡,且向B点移动,甲醇含量升高,正方向为体积分子数减小的方向,故pC>pB,故pC>pA,C错误;D.该反应为放热反应,升温K值减小,化学平衡常数K:KA>KB=KC,D正确。]
同课章节目录
