培优课堂4 “隔膜”电化学装置分析 专项特训(含解析)2024年高考化学二轮复习
文档属性
| 名称 | 培优课堂4 “隔膜”电化学装置分析 专项特训(含解析)2024年高考化学二轮复习 |  | |
| 格式 | DOCX | ||
| 文件大小 | 466.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-13 19:53:25 | ||
图片预览

文档简介
培优课堂 “隔膜”电化学装置分析
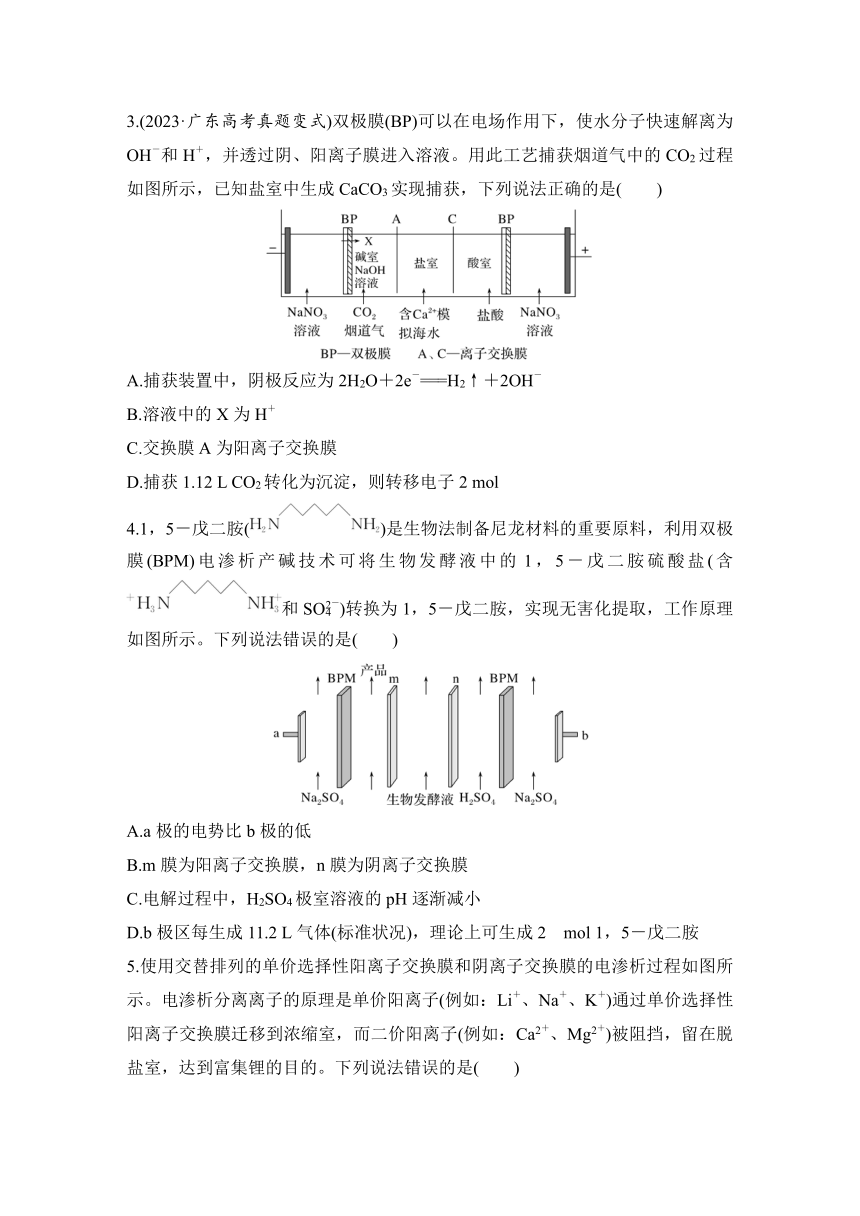
1.(2023·深圳调研)一种高压可充电Zn-PbO2电池工作原理如图所示,通过复合膜ab与复合膜ba反向放置,分隔两室电解液,复合膜间是少量H2O,复合膜ab与ba交界处离子不能通过,复合膜中a膜是阳离子交换膜,b膜是阴离子交换膜。下列说法错误的是( )
A.放电时,K+穿过a膜移向复合膜ab间
B.放电时,复合膜ba间发生了H2O解离出H+和OH-的变化
C.充电时的总反应式为PbSO4+Zn(OH)===Zn+PbO2+2H2O+SO
D.充电时的阳极电极反应式为PbSO4+4OH--2e-===PbO2+ SO+2H2O
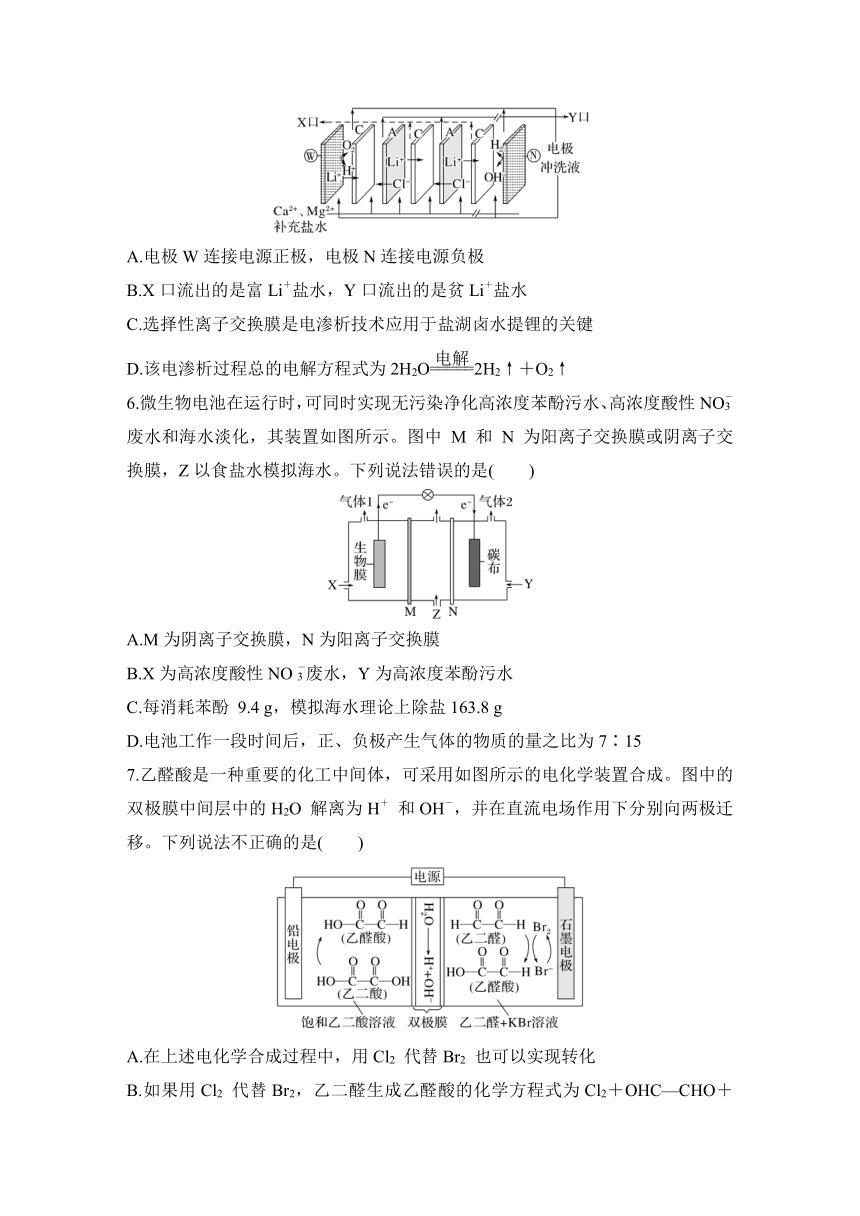
2.(2023·广州二中周测)“电解法”制备氢碘酸的装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电作用下复合层间的H2O解离成H+和OH-(少量I-会因为浓度差通过BPM膜)。下列说法正确的是( )
A.a极的电势比b极的低
B.A、B膜均为阳离子交换膜
C.若撤去A膜,对该电解池的工作无影响
D.电解过程中,图中三处H2SO4溶液的c(H2SO4)均不变
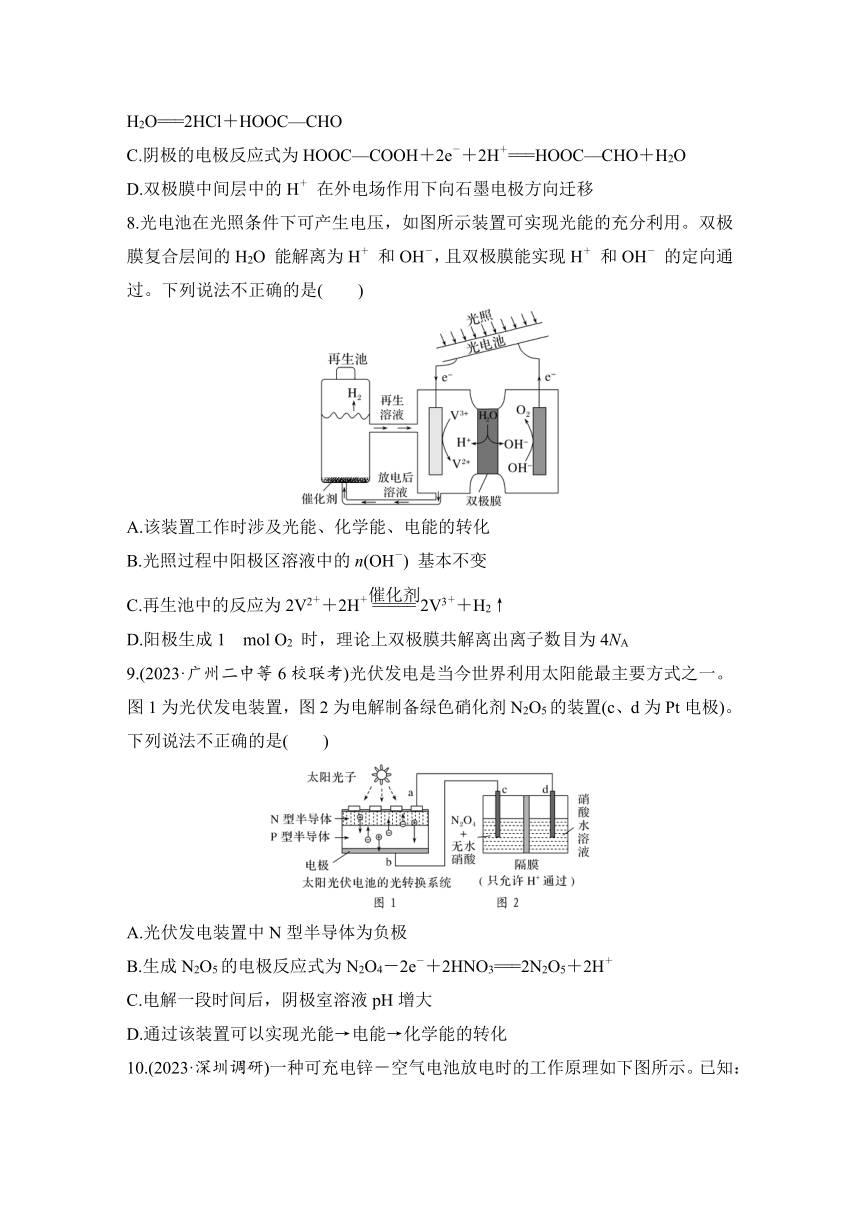
3.(2023·广东高考真题变式)双极膜(BP)可以在电场作用下,使水分子快速解离为OH-和H+,并透过阴、阳离子膜进入溶液。用此工艺捕获烟道气中的CO2过程如图所示,已知盐室中生成CaCO3实现捕获,下列说法正确的是( )
A.捕获装置中,阴极反应为2H2O+2e-===H2↑+2OH-
B.溶液中的X为H+
C.交换膜A为阳离子交换膜
D.捕获1.12 L CO2转化为沉淀,则转移电子2 mol
4.1,5-戊二胺()是生物法制备尼龙材料的重要原料,利用双极膜(BPM)电渗析产碱技术可将生物发酵液中的1,5-戊二胺硫酸盐(含和SO)转换为1,5-戊二胺,实现无害化提取,工作原理如图所示。下列说法错误的是( )
A.a极的电势比b极的低
B.m膜为阳离子交换膜,n膜为阴离子交换膜
C.电解过程中,H2SO4极室溶液的pH逐渐减小
D.b极区每生成11.2 L气体(标准状况),理论上可生成2 mol 1,5-戊二胺
5.使用交替排列的单价选择性阳离子交换膜和阴离子交换膜的电渗析过程如图所示。电渗析分离离子的原理是单价阳离子(例如:Li+、Na+、K+)通过单价选择性阳离子交换膜迁移到浓缩室,而二价阳离子(例如:Ca2+、Mg2+)被阻挡,留在脱盐室,达到富集锂的目的。下列说法错误的是( )
A.电极W连接电源正极,电极N连接电源负极
B.X口流出的是富Li+盐水,Y口流出的是贫Li+盐水
C.选择性离子交换膜是电渗析技术应用于盐湖卤水提锂的关键
D.该电渗析过程总的电解方程式为2H2O2H2↑+O2↑
6.微生物电池在运行时,可同时实现无污染净化高浓度苯酚污水、高浓度酸性NO废水和海水淡化,其装置如图所示。图中 M 和 N 为阳离子交换膜或阴离子交换膜,Z以食盐水模拟海水。下列说法错误的是( )
A.M为阴离子交换膜,N为阳离子交换膜
B.X为高浓度酸性NO废水,Y为高浓度苯酚污水
C.每消耗苯酚 9.4 g,模拟海水理论上除盐163.8 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为7∶15
7.乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O 解离为H+ 和OH-,并在直流电场作用下分别向两极迁移。下列说法不正确的是( )
A.在上述电化学合成过程中,用Cl2 代替Br2 也可以实现转化
B.如果用Cl2 代替Br2,乙二醛生成乙醛酸的化学方程式为Cl2+OHC—CHO+H2O===2HCl+HOOC—CHO
C.阴极的电极反应式为HOOC—COOH+2e-+2H+===HOOC—CHO+H2O
D.双极膜中间层中的H+ 在外电场作用下向石墨电极方向迁移
8.光电池在光照条件下可产生电压,如图所示装置可实现光能的充分利用。双极膜复合层间的H2O 能解离为H+ 和OH-,且双极膜能实现H+ 和OH- 的定向通过。下列说法不正确的是( )
A.该装置工作时涉及光能、化学能、电能的转化
B.光照过程中阳极区溶液中的n(OH-) 基本不变
C.再生池中的反应为2V2++2H+2V3++H2↑
D.阳极生成1 mol O2 时,理论上双极膜共解离出离子数目为4NA
9.(2023·广州二中等6校联考)光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏发电装置,图2为电解制备绿色硝化剂N2O5的装置(c、d为Pt电极)。下列说法不正确的是( )
A.光伏发电装置中N型半导体为负极
B.生成N2O5的电极反应式为N2O4-2e-+2HNO3===2N2O5+2H+
C.电解一段时间后,阴极室溶液pH增大
D.通过该装置可以实现光能→电能→化学能的转化
10.(2023·深圳调研)一种可充电锌-空气电池放电时的工作原理如下图所示。已知:Ⅰ室溶液中,锌主要以[Zn(H2O)6]2+的形式存在,并存在[Zn(H2O)6]2+??[Zn(H2O)5(OH)]++H+。下列说法正确的是( )
A.放电时,Ⅰ室溶液pH增大
B.放电时,该装置Ⅱ室可实现海水淡化
C.充电时,Zn电极反应为Zn+6H2O-2e-===[Zn(H2O)6]2+
D.充电时,每生成1 mol O2,Ⅲ室溶液质量理论上减少32 g
11.(2023·茂名二模)一款可充放电固态卤离子穿梭电池工作时原理如图所示,Ⅰ室、Ⅱ室、Ⅲ室均为HGPE凝胶聚合物电解质,下列说法正确的是( )
A.放电时,b为正极,发生还原反应
B.放电时,a电极反应为:FeOCl+e-===FeO+Cl-
C.交换膜1、2分别为氯离子交换膜和阳离子交换膜
D.充电时,每转移1 mol电子,b电极增重35.5 g
培优课堂4 “隔膜”电化学装置分析
1.D [A.放电时,原电池“同性相吸”,则K+穿过阳离子交换膜即a膜移向复合膜ab间,故A正确;B.放电时,负极不断消耗氢氧根,复合膜ba间发生了H2O解离出H+和OH-的反应,解离出的OH-穿过阴离子交换膜即b膜向负极移动,解离出的H+穿过阳离子交换膜即a膜向正极移动,故B正确;C.根据题中信息得到负极是锌失去电子变为Zn(OH),正极是二氧化铅得到电子变为硫酸铅,则充电时的总反应式为PbSO4+Zn(OH)===Zn+PbO2+2H2O+SO,故C正确;D.放电时正极反应式为PbO2+ SO+4H++2e-===PbSO4+2H2O,则充电时的阳极电极反应式为PbSO4+2H2O -2e-===PbO2+ SO+4H+,故D错误。]
2.B [根据题中信息B膜右边生成NaOH,说明钠离子穿过B膜进入到右边,根据电解质“异性相吸”,则b极为阴极,a为阳极。A.根据前面分析a极为阳极,b为阴极,则a极的电势比b极的高,故A错误;B.钠离子穿过B膜进入到右边,因此B膜为阳离子交换膜,a为阳极,水中的氢氧根失去电子生成氧气,氢离子穿过A膜进入到右边,因此A、B膜均为阳离子交换膜,故B正确;C.若撤去A膜,由于少量的碘离子在a极失去电子变为碘单质,因此对该电解池的工作有影响,故C错误;D.电解过程中,a电极是阳极,水中失去电子生成氧气和氢离子,氢离子穿过A膜进入右边,溶液体积减小,则H2SO4溶液的c(H2SO4)增大,故D错误。]
3.A [A.阴极发生还原反应,溶液中H+放电,为2H2O+2e-===H2↑+2OH-,A正确;B.碱室是CO2转化为CO,应由双极膜产生OH-不断补充,保持碱的浓度,X应为OH-,B错误;C.盐室生成CaCO3,就需要CO穿过交换膜A,所以交换膜A为阴离子交换膜,C错误;D.捕获1.12 L CO2,未指明标准状况,无法计算转移电子数,D错误。]
4.D [根据工作原理图,可知生物发酵液中通过m膜进入产品室,a极附近BPM中的OH-进入产品室,两者反应生成1,5-戊二胺,则a极为阴极,发生反应2H2O+2e-===2OH-+H2↑,阴极的电势比阳极的低,A项正确;生物发酵液中的通过m膜进入产品室,则m膜为阳离子交换膜,b极为阳极,则生物发酵液中的SO通过n膜进入H2SO4极室,则n膜为阴离子交换膜,B项正确;b极为阳极,b极附近BPM中的H+进入H2SO4极室,使溶液pH逐渐减小,C项正确;b极反应为2H2O-4e-===O2↑+4H+,则b极区每生成11.2 L气体(标准状况),转移电子的物质的量为2 mol,有1 mol 进入产品室,可生成1 mol 1,5-戊二胺,D项错误。]
5.B [由图可知,Cl-向W电极方向移动,Li+向N电极方向移动,则W极是和电源正极相连的阳极,N极是和电源负极相连的阴极,A正确;X口流出盐水所对应的两个交换膜之间,所含的Li+通过单价选择性阳离子交换膜移向右边隔壁的两个膜之间,则X口流出的是贫Li+盐水,而Y口流出盐水所对应的两个交换膜之间,则多了左边两个膜之间渗透移动过来的Li+,则Y口流出的是富Li+盐水,B错误;通过对图分析,从盐湖卤水提锂,可利用图中的单价选择性阳离子交换膜和阴离子交换膜通过电渗析法使盐湖卤水中所含的锂离子富集起来,然后再提取锂,C正确;从W电极和N电极的产物结合电解池电极离子的放电顺序可知,W电极是OH-放电,N电极是H+放电,而OH-和H+均来自水分子的电离,则整个电渗析过程中,被电解的是水,D正确。]
6.B [由图中所示电子流向可知,生物膜为负极,发生氧化反应,则X是高浓度苯酚污水,气体1是CO2;电子流入碳布,发生还原反应,为正极,则Y是高浓度酸性NO废水,气体2是N2;海水得到淡化,则食盐水作为电解质溶液,Na+向正极移动,N是阳离子交换膜,Cl-向负极移动,M是阴离子交换膜,故A正确,B错误;负极苯酚生成CO2,有关系:~6CO2~28e-,每消耗苯酚 9.4 g,物质的量为0.1 mol,则转移电子2.8 mol,海水除盐2.8 mol NaCl,质量为163.8 g,C正确;据分析,正极产生N2,有关系:2NO~N2~10e-,负极有:~6CO2~28e-,电池工作一段时间后,转移电子数相等,则正、负极产生气体的物质的量之比为2.8∶6=7∶15,D正确。]
7.D [题给装置通电时,乙二酸被还原为乙醛酸,因此铅电极为阴极,石墨电极为阳极,阳极上Br- 失电子生成Br2,Br2 将乙二醛氧化为乙醛酸,而Cl2 与Br2 化学性质相似,故A、B正确;电解过程中阴极发生还原反应,乙二酸转化成乙醛酸,电极反应式为HOOC—COOH+2e-+2H+===HOOC—CHO+H2O,故C正确;双极膜中间层的H+ 在外电场作用下移向阴极,即H+ 移向铅电极,故D错误。]
8.D [在光照条件下光电池将光能转化为电能,电解池中电能又转化为化学能,故A正确;光照过程中,阳极反应消耗氢氧根离子,双极膜可将水解离为氢离子和氢氧根离子,水解离生成的氢氧根离子移向阳极,阳极区溶液中的n(OH-) 基本不变,故B正确;再生池中的反应为2V2++2H+2V3++H2↑,故C正确;阳极生成1 mol O2 时,转移4 mol 电子,消耗4 mol OH-,由于阳极区溶液中的n(OH-) 基本不变,理论上双极膜共解离出4 mol OH-和4 mol H+,即解离出的离子数目为8NA,故D错误。]
9.C [A.图1中负电荷由P型半导体移向N型半导体,因此N型半导体为负极,P型半导体为正极,故A正确;B.b电极是正极,因此c电极是阳极,发生失去电子的氧化反应,电极反应式为N2O4-2e-+2HNO3===2N2O5+2H+,故B正确;C.d电极与a电极相连,作阴极,氢离子放电,但同时阳极室产生的氢离子通过隔膜移向阴极室,导致溶液中氢离子浓度不变,溶液的pH不变,故C错误;D.图1中光能转化为电能,图2是电解池,电能又转化为化学能,所以通过该装置可以实现光能→电能→化学能的转化,故D正确。]
10.B [原电池中通入O2的一极是正极,则Pt/C电极是正极,电极方程式为O2+4e-+2H2O===4OH-,Zn电极为负极,已知:Ⅰ室溶液中,锌主要以[Zn(H2O)6]2+的形式存在,电极方程式为:Zn+6H2O-2e-===[Zn(H2O)6]2+,以此解答。A.由分析可知,Zn电极为负极,电极方程式为Zn+6H2O-2e-===[Zn(H2O)6]2+,[Zn(H2O)6]2+浓度增大,平衡[Zn(H2O)6]2+??[Zn(H2O)5(OH)]++H+正向移动,H+浓度增大,Ⅰ室溶液pH减小,故A错误;B.放电时,该装置Ⅱ室中Na+通过阳离子交换膜进入Ⅲ室,Cl-通过阴离子交换膜进入Ⅰ室,可实现海水淡化,故B正确;C.放电时,Zn电极反应为Zn+6H2O-2e-===[Zn(H2O)6]2+,则充电时,Zn电极反应为[Zn(H2O)6]2++2e-===Zn+6H2O,故C错误;D.充电时,Ⅲ室为阳极,电极方程式为4OH--4e-===O2↑+2H2O,每生成1 mol O2转移4 mol电子,同时有4 mol Na+通过阳离子交换膜进入Ⅱ室,Ⅲ室溶液质量理论上减少32 g+4 mol×23 g/mol=124 g,故D错误。]
11.B [如图,Ⅲ室中b极为锂电极,为放电时的负极,发生反应:Li-e-+Cl-===LiCl,Cl-通过交换膜2移向Ⅲ室,交换膜2为阴离子交换膜,a极为放电时的正极,发生反应:FeOCl+e-===FeO+Cl-,Cl-通过交换膜1移向Ⅱ室。A.b极为锂电极,为放电时的负极,发生氧化反应,A错误;B.a极为放电时的正极,发生反应:FeOCl+e-===FeO+Cl-,B正确;C.交换膜1和交换膜2均为氯离子交换膜,C错误;D.充电时,b发生反应:LiCl+e-===Li+Cl-,LiCl→Li,质量减少,每转移1 mol电子,b电极减少35.5 g,D错误。]
1.(2023·深圳调研)一种高压可充电Zn-PbO2电池工作原理如图所示,通过复合膜ab与复合膜ba反向放置,分隔两室电解液,复合膜间是少量H2O,复合膜ab与ba交界处离子不能通过,复合膜中a膜是阳离子交换膜,b膜是阴离子交换膜。下列说法错误的是( )
A.放电时,K+穿过a膜移向复合膜ab间
B.放电时,复合膜ba间发生了H2O解离出H+和OH-的变化
C.充电时的总反应式为PbSO4+Zn(OH)===Zn+PbO2+2H2O+SO
D.充电时的阳极电极反应式为PbSO4+4OH--2e-===PbO2+ SO+2H2O
2.(2023·广州二中周测)“电解法”制备氢碘酸的装置如图所示。其中双极膜(BPM)是阴、阳复合膜,在直流电作用下复合层间的H2O解离成H+和OH-(少量I-会因为浓度差通过BPM膜)。下列说法正确的是( )
A.a极的电势比b极的低
B.A、B膜均为阳离子交换膜
C.若撤去A膜,对该电解池的工作无影响
D.电解过程中,图中三处H2SO4溶液的c(H2SO4)均不变
3.(2023·广东高考真题变式)双极膜(BP)可以在电场作用下,使水分子快速解离为OH-和H+,并透过阴、阳离子膜进入溶液。用此工艺捕获烟道气中的CO2过程如图所示,已知盐室中生成CaCO3实现捕获,下列说法正确的是( )
A.捕获装置中,阴极反应为2H2O+2e-===H2↑+2OH-
B.溶液中的X为H+
C.交换膜A为阳离子交换膜
D.捕获1.12 L CO2转化为沉淀,则转移电子2 mol
4.1,5-戊二胺()是生物法制备尼龙材料的重要原料,利用双极膜(BPM)电渗析产碱技术可将生物发酵液中的1,5-戊二胺硫酸盐(含和SO)转换为1,5-戊二胺,实现无害化提取,工作原理如图所示。下列说法错误的是( )
A.a极的电势比b极的低
B.m膜为阳离子交换膜,n膜为阴离子交换膜
C.电解过程中,H2SO4极室溶液的pH逐渐减小
D.b极区每生成11.2 L气体(标准状况),理论上可生成2 mol 1,5-戊二胺
5.使用交替排列的单价选择性阳离子交换膜和阴离子交换膜的电渗析过程如图所示。电渗析分离离子的原理是单价阳离子(例如:Li+、Na+、K+)通过单价选择性阳离子交换膜迁移到浓缩室,而二价阳离子(例如:Ca2+、Mg2+)被阻挡,留在脱盐室,达到富集锂的目的。下列说法错误的是( )
A.电极W连接电源正极,电极N连接电源负极
B.X口流出的是富Li+盐水,Y口流出的是贫Li+盐水
C.选择性离子交换膜是电渗析技术应用于盐湖卤水提锂的关键
D.该电渗析过程总的电解方程式为2H2O2H2↑+O2↑
6.微生物电池在运行时,可同时实现无污染净化高浓度苯酚污水、高浓度酸性NO废水和海水淡化,其装置如图所示。图中 M 和 N 为阳离子交换膜或阴离子交换膜,Z以食盐水模拟海水。下列说法错误的是( )
A.M为阴离子交换膜,N为阳离子交换膜
B.X为高浓度酸性NO废水,Y为高浓度苯酚污水
C.每消耗苯酚 9.4 g,模拟海水理论上除盐163.8 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为7∶15
7.乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。图中的双极膜中间层中的H2O 解离为H+ 和OH-,并在直流电场作用下分别向两极迁移。下列说法不正确的是( )
A.在上述电化学合成过程中,用Cl2 代替Br2 也可以实现转化
B.如果用Cl2 代替Br2,乙二醛生成乙醛酸的化学方程式为Cl2+OHC—CHO+H2O===2HCl+HOOC—CHO
C.阴极的电极反应式为HOOC—COOH+2e-+2H+===HOOC—CHO+H2O
D.双极膜中间层中的H+ 在外电场作用下向石墨电极方向迁移
8.光电池在光照条件下可产生电压,如图所示装置可实现光能的充分利用。双极膜复合层间的H2O 能解离为H+ 和OH-,且双极膜能实现H+ 和OH- 的定向通过。下列说法不正确的是( )
A.该装置工作时涉及光能、化学能、电能的转化
B.光照过程中阳极区溶液中的n(OH-) 基本不变
C.再生池中的反应为2V2++2H+2V3++H2↑
D.阳极生成1 mol O2 时,理论上双极膜共解离出离子数目为4NA
9.(2023·广州二中等6校联考)光伏发电是当今世界利用太阳能最主要方式之一。图1为光伏发电装置,图2为电解制备绿色硝化剂N2O5的装置(c、d为Pt电极)。下列说法不正确的是( )
A.光伏发电装置中N型半导体为负极
B.生成N2O5的电极反应式为N2O4-2e-+2HNO3===2N2O5+2H+
C.电解一段时间后,阴极室溶液pH增大
D.通过该装置可以实现光能→电能→化学能的转化
10.(2023·深圳调研)一种可充电锌-空气电池放电时的工作原理如下图所示。已知:Ⅰ室溶液中,锌主要以[Zn(H2O)6]2+的形式存在,并存在[Zn(H2O)6]2+??[Zn(H2O)5(OH)]++H+。下列说法正确的是( )
A.放电时,Ⅰ室溶液pH增大
B.放电时,该装置Ⅱ室可实现海水淡化
C.充电时,Zn电极反应为Zn+6H2O-2e-===[Zn(H2O)6]2+
D.充电时,每生成1 mol O2,Ⅲ室溶液质量理论上减少32 g
11.(2023·茂名二模)一款可充放电固态卤离子穿梭电池工作时原理如图所示,Ⅰ室、Ⅱ室、Ⅲ室均为HGPE凝胶聚合物电解质,下列说法正确的是( )
A.放电时,b为正极,发生还原反应
B.放电时,a电极反应为:FeOCl+e-===FeO+Cl-
C.交换膜1、2分别为氯离子交换膜和阳离子交换膜
D.充电时,每转移1 mol电子,b电极增重35.5 g
培优课堂4 “隔膜”电化学装置分析
1.D [A.放电时,原电池“同性相吸”,则K+穿过阳离子交换膜即a膜移向复合膜ab间,故A正确;B.放电时,负极不断消耗氢氧根,复合膜ba间发生了H2O解离出H+和OH-的反应,解离出的OH-穿过阴离子交换膜即b膜向负极移动,解离出的H+穿过阳离子交换膜即a膜向正极移动,故B正确;C.根据题中信息得到负极是锌失去电子变为Zn(OH),正极是二氧化铅得到电子变为硫酸铅,则充电时的总反应式为PbSO4+Zn(OH)===Zn+PbO2+2H2O+SO,故C正确;D.放电时正极反应式为PbO2+ SO+4H++2e-===PbSO4+2H2O,则充电时的阳极电极反应式为PbSO4+2H2O -2e-===PbO2+ SO+4H+,故D错误。]
2.B [根据题中信息B膜右边生成NaOH,说明钠离子穿过B膜进入到右边,根据电解质“异性相吸”,则b极为阴极,a为阳极。A.根据前面分析a极为阳极,b为阴极,则a极的电势比b极的高,故A错误;B.钠离子穿过B膜进入到右边,因此B膜为阳离子交换膜,a为阳极,水中的氢氧根失去电子生成氧气,氢离子穿过A膜进入到右边,因此A、B膜均为阳离子交换膜,故B正确;C.若撤去A膜,由于少量的碘离子在a极失去电子变为碘单质,因此对该电解池的工作有影响,故C错误;D.电解过程中,a电极是阳极,水中失去电子生成氧气和氢离子,氢离子穿过A膜进入右边,溶液体积减小,则H2SO4溶液的c(H2SO4)增大,故D错误。]
3.A [A.阴极发生还原反应,溶液中H+放电,为2H2O+2e-===H2↑+2OH-,A正确;B.碱室是CO2转化为CO,应由双极膜产生OH-不断补充,保持碱的浓度,X应为OH-,B错误;C.盐室生成CaCO3,就需要CO穿过交换膜A,所以交换膜A为阴离子交换膜,C错误;D.捕获1.12 L CO2,未指明标准状况,无法计算转移电子数,D错误。]
4.D [根据工作原理图,可知生物发酵液中通过m膜进入产品室,a极附近BPM中的OH-进入产品室,两者反应生成1,5-戊二胺,则a极为阴极,发生反应2H2O+2e-===2OH-+H2↑,阴极的电势比阳极的低,A项正确;生物发酵液中的通过m膜进入产品室,则m膜为阳离子交换膜,b极为阳极,则生物发酵液中的SO通过n膜进入H2SO4极室,则n膜为阴离子交换膜,B项正确;b极为阳极,b极附近BPM中的H+进入H2SO4极室,使溶液pH逐渐减小,C项正确;b极反应为2H2O-4e-===O2↑+4H+,则b极区每生成11.2 L气体(标准状况),转移电子的物质的量为2 mol,有1 mol 进入产品室,可生成1 mol 1,5-戊二胺,D项错误。]
5.B [由图可知,Cl-向W电极方向移动,Li+向N电极方向移动,则W极是和电源正极相连的阳极,N极是和电源负极相连的阴极,A正确;X口流出盐水所对应的两个交换膜之间,所含的Li+通过单价选择性阳离子交换膜移向右边隔壁的两个膜之间,则X口流出的是贫Li+盐水,而Y口流出盐水所对应的两个交换膜之间,则多了左边两个膜之间渗透移动过来的Li+,则Y口流出的是富Li+盐水,B错误;通过对图分析,从盐湖卤水提锂,可利用图中的单价选择性阳离子交换膜和阴离子交换膜通过电渗析法使盐湖卤水中所含的锂离子富集起来,然后再提取锂,C正确;从W电极和N电极的产物结合电解池电极离子的放电顺序可知,W电极是OH-放电,N电极是H+放电,而OH-和H+均来自水分子的电离,则整个电渗析过程中,被电解的是水,D正确。]
6.B [由图中所示电子流向可知,生物膜为负极,发生氧化反应,则X是高浓度苯酚污水,气体1是CO2;电子流入碳布,发生还原反应,为正极,则Y是高浓度酸性NO废水,气体2是N2;海水得到淡化,则食盐水作为电解质溶液,Na+向正极移动,N是阳离子交换膜,Cl-向负极移动,M是阴离子交换膜,故A正确,B错误;负极苯酚生成CO2,有关系:~6CO2~28e-,每消耗苯酚 9.4 g,物质的量为0.1 mol,则转移电子2.8 mol,海水除盐2.8 mol NaCl,质量为163.8 g,C正确;据分析,正极产生N2,有关系:2NO~N2~10e-,负极有:~6CO2~28e-,电池工作一段时间后,转移电子数相等,则正、负极产生气体的物质的量之比为2.8∶6=7∶15,D正确。]
7.D [题给装置通电时,乙二酸被还原为乙醛酸,因此铅电极为阴极,石墨电极为阳极,阳极上Br- 失电子生成Br2,Br2 将乙二醛氧化为乙醛酸,而Cl2 与Br2 化学性质相似,故A、B正确;电解过程中阴极发生还原反应,乙二酸转化成乙醛酸,电极反应式为HOOC—COOH+2e-+2H+===HOOC—CHO+H2O,故C正确;双极膜中间层的H+ 在外电场作用下移向阴极,即H+ 移向铅电极,故D错误。]
8.D [在光照条件下光电池将光能转化为电能,电解池中电能又转化为化学能,故A正确;光照过程中,阳极反应消耗氢氧根离子,双极膜可将水解离为氢离子和氢氧根离子,水解离生成的氢氧根离子移向阳极,阳极区溶液中的n(OH-) 基本不变,故B正确;再生池中的反应为2V2++2H+2V3++H2↑,故C正确;阳极生成1 mol O2 时,转移4 mol 电子,消耗4 mol OH-,由于阳极区溶液中的n(OH-) 基本不变,理论上双极膜共解离出4 mol OH-和4 mol H+,即解离出的离子数目为8NA,故D错误。]
9.C [A.图1中负电荷由P型半导体移向N型半导体,因此N型半导体为负极,P型半导体为正极,故A正确;B.b电极是正极,因此c电极是阳极,发生失去电子的氧化反应,电极反应式为N2O4-2e-+2HNO3===2N2O5+2H+,故B正确;C.d电极与a电极相连,作阴极,氢离子放电,但同时阳极室产生的氢离子通过隔膜移向阴极室,导致溶液中氢离子浓度不变,溶液的pH不变,故C错误;D.图1中光能转化为电能,图2是电解池,电能又转化为化学能,所以通过该装置可以实现光能→电能→化学能的转化,故D正确。]
10.B [原电池中通入O2的一极是正极,则Pt/C电极是正极,电极方程式为O2+4e-+2H2O===4OH-,Zn电极为负极,已知:Ⅰ室溶液中,锌主要以[Zn(H2O)6]2+的形式存在,电极方程式为:Zn+6H2O-2e-===[Zn(H2O)6]2+,以此解答。A.由分析可知,Zn电极为负极,电极方程式为Zn+6H2O-2e-===[Zn(H2O)6]2+,[Zn(H2O)6]2+浓度增大,平衡[Zn(H2O)6]2+??[Zn(H2O)5(OH)]++H+正向移动,H+浓度增大,Ⅰ室溶液pH减小,故A错误;B.放电时,该装置Ⅱ室中Na+通过阳离子交换膜进入Ⅲ室,Cl-通过阴离子交换膜进入Ⅰ室,可实现海水淡化,故B正确;C.放电时,Zn电极反应为Zn+6H2O-2e-===[Zn(H2O)6]2+,则充电时,Zn电极反应为[Zn(H2O)6]2++2e-===Zn+6H2O,故C错误;D.充电时,Ⅲ室为阳极,电极方程式为4OH--4e-===O2↑+2H2O,每生成1 mol O2转移4 mol电子,同时有4 mol Na+通过阳离子交换膜进入Ⅱ室,Ⅲ室溶液质量理论上减少32 g+4 mol×23 g/mol=124 g,故D错误。]
11.B [如图,Ⅲ室中b极为锂电极,为放电时的负极,发生反应:Li-e-+Cl-===LiCl,Cl-通过交换膜2移向Ⅲ室,交换膜2为阴离子交换膜,a极为放电时的正极,发生反应:FeOCl+e-===FeO+Cl-,Cl-通过交换膜1移向Ⅱ室。A.b极为锂电极,为放电时的负极,发生氧化反应,A错误;B.a极为放电时的正极,发生反应:FeOCl+e-===FeO+Cl-,B正确;C.交换膜1和交换膜2均为氯离子交换膜,C错误;D.充电时,b发生反应:LiCl+e-===Li+Cl-,LiCl→Li,质量减少,每转移1 mol电子,b电极减少35.5 g,D错误。]
同课章节目录
