广西省钦州市第四中学2023-2024学年高三下学期4月测试化学试卷(含答案)
文档属性
| 名称 | 广西省钦州市第四中学2023-2024学年高三下学期4月测试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-13 20:41:14 | ||
图片预览


文档简介
钦州市第四中学2023-2024学年高三下学期4月测试化学试卷
(考试时间:75分钟 试卷满分:100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Fe-56 Cu-64
第I卷 (选择题,共45分)
一、单选题(共15题,每题3分)
1.在实验室用物质的量浓度为的溶液与纯锌反应制取,下列措施可加快产生速率的是
A.将锌块换成铁块 B.改用硫酸
C.改用硝酸 D.滴加少量溶液
2.反应4A(s)+3B(g)=2C(g)+D(g),经,B的浓度减少。对该反应速率的表示,下列说法正确的是
A.用A表示的反应速率是
B.用B、C 、D表示的反应速率之比为3∶2∶1
C.在末,用B表示的反应速率是
D.在内用B表示的反应速率逐渐减小,用C表示的反应速率逐渐增大
3.在一定温度下,对于可逆反应A(g)+3B(g)2C(g)达到平衡状态的标志是
A.反应停止了B.单位时间内生成nmolA,同时生成3nmolB
C.A、B、C的浓度不再变化 D.A、B、C的分子数之比为1:2:3
4.据文献显示:催化合成DMC的一种反应机理如图所示。下列叙述正确的是
A.是反应中间体B.①②③中均有的断裂
C.可有效提高DMC的产率
D.合成DMC的反应为
5.对于反应,下列表示中反应速率最大的是
A. mol L s B. mol L s
C. mol L s D. mol L min
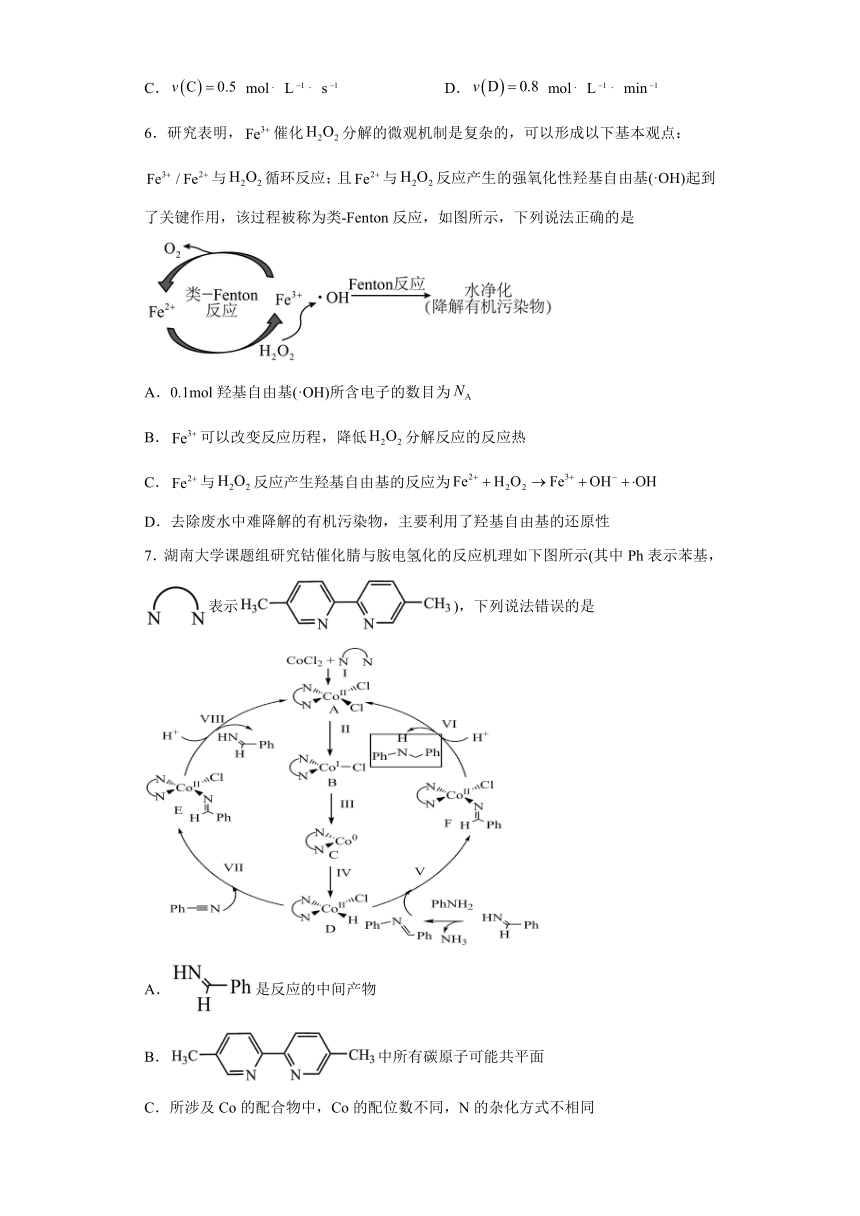
6.研究表明,催化分解的微观机制是复杂的,可以形成以下基本观点:与循环反应;且与反应产生的强氧化性羟基自由基(·OH)起到了关键作用,该过程被称为类-Fenton反应,如图所示,下列说法正确的是
A.0.1mol羟基自由基(·OH)所含电子的数目为
B.可以改变反应历程,降低分解反应的反应热
C.与反应产生羟基自由基的反应为
D.去除废水中难降解的有机污染物,主要利用了羟基自由基的还原性
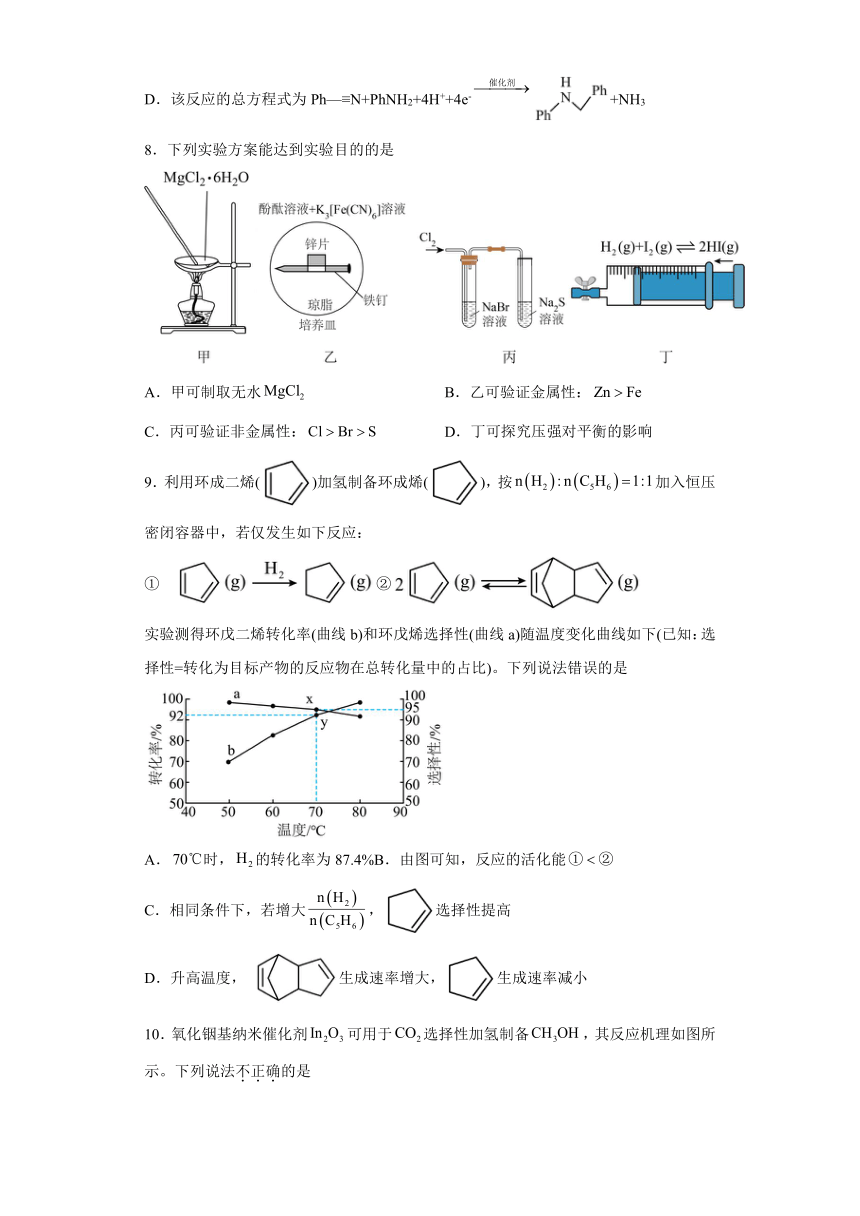
7.湖南大学课题组研究钴催化腈与胺电氢化的反应机理如下图所示(其中Ph表示苯基,表示),下列说法错误的是
是反应的中间产物
B.中所有碳原子可能共平面
C.所涉及Co的配合物中,Co的配位数不同,N的杂化方式不相同
D.该反应的总方程式为Ph—≡N+PhNH2+4H++4e-+NH3
8.下列实验方案能达到实验目的的是
A.甲可制取无水 B.乙可验证金属性:
C.丙可验证非金属性: D.丁可探究压强对平衡的影响
9.利用环成二烯()加氢制备环成烯(),按加入恒压密闭容器中,若仅发生如下反应:
① ②
实验测得环戊二烯转化率(曲线b)和环戊烯选择性(曲线a)随温度变化曲线如下(已知:选择性=转化为目标产物的反应物在总转化量中的占比)。下列说法错误的是
A.时,的转化率为87.4%B.由图可知,反应的活化能
C.相同条件下,若增大,选择性提高
D.升高温度, 生成速率增大,生成速率减小
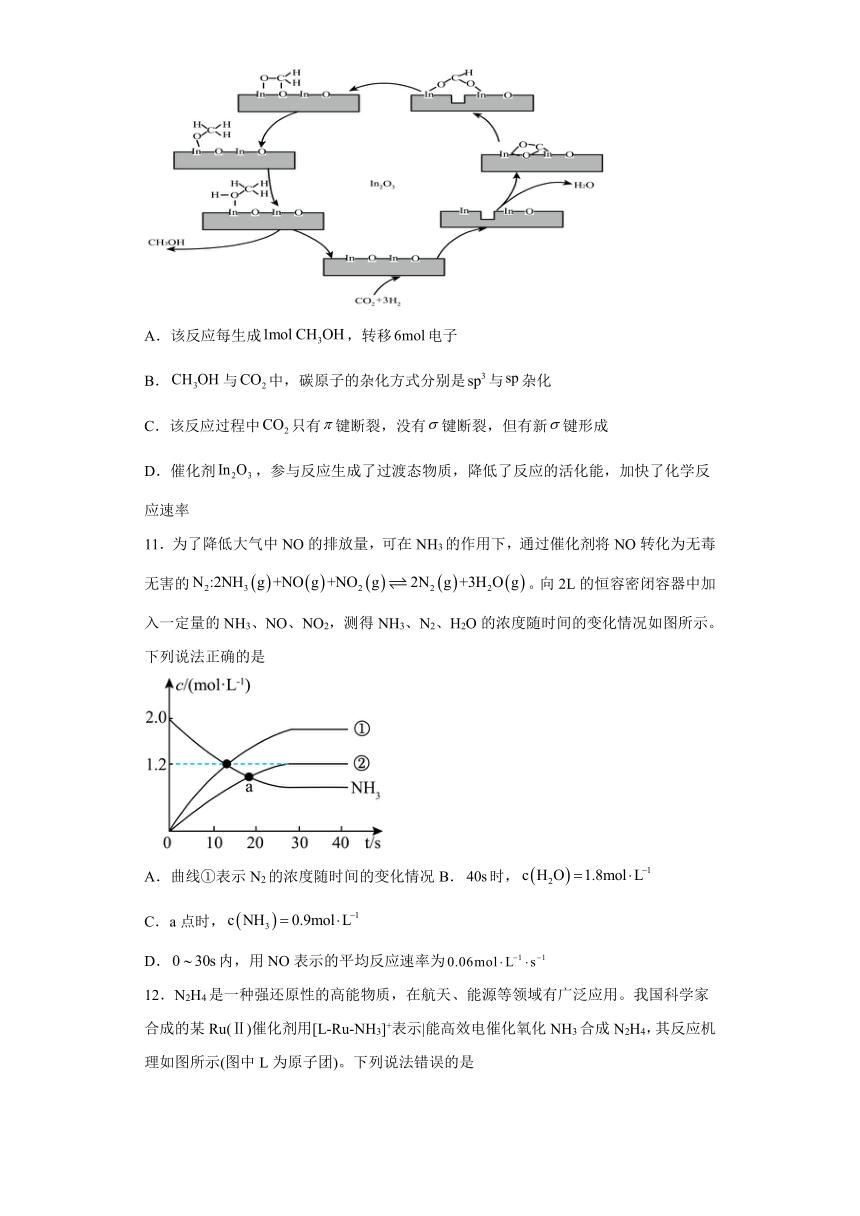
10.氧化铟基纳米催化剂可用于选择性加氢制备,其反应机理如图所示。下列说法不正确的是
A.该反应每生成,转移电子
B.与中,碳原子的杂化方式分别是与杂化
C.该反应过程中只有键断裂,没有键断裂,但有新键形成
D.催化剂,参与反应生成了过渡态物质,降低了反应的活化能,加快了化学反应速率
11.为了降低大气中NO的排放量,可在NH3的作用下,通过催化剂将NO转化为无毒无害的。向2L的恒容密闭容器中加入一定量的NH3、NO、NO2,测得NH3、N2、H2O的浓度随时间的变化情况如图所示。下列说法正确的是
A.曲线①表示N2的浓度随时间的变化情况B.时,
C.a点时,
D.内,用NO表示的平均反应速率为
12.N2H4是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某Ru(Ⅱ)催化剂用[L-Ru-NH3]+表示|能高效电催化氧化NH3合成N2H4,其反应机理如图所示(图中L为原子团)。下列说法错误的是
A.[L-Ru-NH3]2+中Ru的化合价为+3B.反应Ⅳ中有非极性键的断裂与形成
C.电催化氧化NH3合成N2H4发生在电解池阳极区
D.N2H4与NH3中 N 原子的 VSEPR 模型均为四面体形
13.氮及其化合物的转化过程如图所示。下列分析不合理的是
A.催化剂a表面发生了极性共价键的断裂和形成
B.与反应生成的原子利用率(期望产物的总质量与生成物的总质量之比)为100%
C.在催化剂b表面形成氮氧键时,涉及电子转移
D.使用催化剂a、b均可以提高单位时间内生成物的产量
14.逆水煤气变换反应是一种转化和利用的重要途径,发生的反应有
反应Ⅰ: kJ·mol
反应Ⅱ: kJ mol
反应Ⅲ:
常压下,向密闭容器中投入1 mol 和2 mol ,达平衡时和含碳物质的物质的量随温度的变化如题图所示。下列说法正确的是
A.kJ molB.649℃时,反应Ⅰ的平衡常数
C.其他条件不变,在250℃~900℃范围内,随着温度的升高,平衡时不断增大
D.800℃时,适当增大体系压强,保持不变
15.将等物质的量浓度等体积的甘氨酸溶液与盐酸混合,发生反应:,取上述溶液(含0.04mol ),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以的形式存在)。
下列说法不正确的是
A.中解离出的能力:
B.b点溶液pH<7,推测中解离出的程度大于-COO-水解的程度
C.c点溶液中存在:c()
D.由d点可知:的
第II卷 (非选择题,共55分)
16.二氧化碳的开发利用是化学家和化学工作者一直关注的热门话题,试回答:
(1)在恒容密闭容器中投入和发生反应,实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。
①该反应的正反应为 反应,从大到小的关系排序为 。
②M点对应的平衡常数 ,在及时,图中N点 (填“>”“<”或“=”)。
(2)二氧化碳催化加氢合成乙烯是综合利用的热点研究领域,化学方程式为。理论计算表明,原料初始组成,在体系压强为,反应达到平衡,四种组分的物质的量分数x随温度T的变化如图所示。回答下列问题:
①图中,表示变化的曲线分别是 。催化加氢合成反应的 0(填“大于”或“小于”)。
②根据图中点,计算该温度时反应的平衡常数 (列出计算式。以分压表示,分压=总压×物质的量分数)。
17.雾霾天气多次肆虐我国中东部地区,汽车尾气(含NO、NO2)和燃堞尾气(含SO2)是造成空气污染的原因之一。汽车尾气净化的主要原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示,回答以下问题。
(1)C、N、O三种元素的第一电离能由大到小的顺序是 。
(2)若反应中转移lmol电子,标况下消耗NO气体的体积 。
(3)该反应的△H 0(填“>”或“<”),△S 0(填“>”或“<”),是 (填“高温自发”、“低温自发”或“不自发”)反应。
(4)在T1温度下,0~2s内的平均反应速率v(N2)= 。
(5)M点、N点的化学平衡常数:KM KN(填“>”或“<”或“=”)
(6)能说明该反应达化学平衡状态的是 (不定项)。
A.容器内气体的密度不再变化 B.v正(CO2)=v逆(CO)
C.密闭容器内的压强不再变化 D.K保持不变
(7)当催化剂质量一定时,若增大催化剂的表面积,则CO转化率 (填“增大”,“减少”或“不变”),并说明v正和v逆如何变化
18.能源是现代文明的动力,科学家致力于开辟新能源和提高能源的利用率。如图所示的过程是目前直接利用太阳能的研究热点,人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
(1)在如图构想的物质和能量循环中,太阳能最终转化为 能。
(2)甲烷是重要的燃料,在空气中燃烧发生反应:。
已知:完全燃烧时生成和时放出热量;其中,破坏键、键分别需要吸收的能量,形成键能释放的能量
①如图能正确表示甲烷燃烧这一反应中能量变化的是 (填或)。
②形成键能释放 的能量(用含的式子表示)。
(3)用人工光合作用得到的甲烷、氧气和溶液制作燃料电池。装置如图所示:
①甲烷应通入该燃料电池的 极(填“正”或“负”)。
②正极发生的电极反应式为 。
③当转移电子时,需要消耗标况下的氧气体积是 。
(4)人工光合作用的途径之一就是在一定条件下,将和转化为甲醇,该反应的化学方程式为。一定条件下,在密闭容器中进行上述反应,测得随时间的变化如表所示。则用表示内该反应的平均反应速率为 。
时间 0 1 2 3 4 5
0 0.040 0.070 0.080 0.085 0.085
19.硅元素更是无机非金属材料的主角,无机非金属材料与人类社会的发展与进步息息相关。
Ⅰ.建筑领域的基石材料-硅酸盐
(1)烧制普通玻璃的原料是 ,使用HF溶液刻蚀玻璃的化学方程式: 。
(2)实验室不用带玻璃塞的试剂瓶盛装氢氧化钠溶液,写出相关原理反应的离子方程式: 。
(3)制备陶瓷和普通水泥都需要以黏土为原料,黏土的主要成分是铝硅酸盐,可以将其使用氧化物形式表示,例如Na2SiO3,其氧化物形式为Na2O·SiO2。某种黏土的主要成分为Na[AlSi3O8],将其表示为氧化物的形式为aNa2O·bAl2O3·cSiO2,则a:b:c= 。(最简整数比)
Ⅱ.现代信息的明星材料-硅
业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
(4)工业上用石英砂和过量焦炭在电弧炉中高温加热生成粗硅,当有1molC参与反应时,该反应转移的电子数是 。
(5)为提高流化床反应器中的反应速率,可以采取的操作有: 。(填2个)
(6)还原炉中发生的化学反应方程式为 。
(7)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有 。
(8)已知反应,一定温度下,向2L恒容密闭器中充入一定量的、和Si(s)发生反应,经过10min达到后,体系中H2、SiHCl3(g)的物质的量浓度分别为2mol·L-1、1mol·L-1。则,从反应开始到10min时SiCl4的平均速率为 。
参考答案:
1.D2.B3.C4.D5.A6.C7.C8.B9.D10.C11.B12.B13.A14.D15.C
16.(1) 放热 >
(2) 小于 或
17.(1)N>O>C(2)11.2L(3) < < 低温自发(4)0.05mol/(L s)(5)>(6)B
(7) 不变 v正和v逆同等倍数的增大
18.(1)热能(2)
(3) 负 1.12(4)
19.(1) 纯碱、石灰石和石英砂 SiO2+4HF=SiF4+2H2O(2)2OH-+SiO2=SiO+H2O
(3)1:1:6(4)2NA
(5)升温、粗硅粉碎、增大HCl气流(浓度)、搅拌、加入催化剂、加压等任写其2
(6)SiHCl3+H2Si+3HCl(7)H2、HCl(8)0.075mol·L-1·min-1
(考试时间:75分钟 试卷满分:100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Fe-56 Cu-64
第I卷 (选择题,共45分)
一、单选题(共15题,每题3分)
1.在实验室用物质的量浓度为的溶液与纯锌反应制取,下列措施可加快产生速率的是
A.将锌块换成铁块 B.改用硫酸
C.改用硝酸 D.滴加少量溶液
2.反应4A(s)+3B(g)=2C(g)+D(g),经,B的浓度减少。对该反应速率的表示,下列说法正确的是
A.用A表示的反应速率是
B.用B、C 、D表示的反应速率之比为3∶2∶1
C.在末,用B表示的反应速率是
D.在内用B表示的反应速率逐渐减小,用C表示的反应速率逐渐增大
3.在一定温度下,对于可逆反应A(g)+3B(g)2C(g)达到平衡状态的标志是
A.反应停止了B.单位时间内生成nmolA,同时生成3nmolB
C.A、B、C的浓度不再变化 D.A、B、C的分子数之比为1:2:3
4.据文献显示:催化合成DMC的一种反应机理如图所示。下列叙述正确的是
A.是反应中间体B.①②③中均有的断裂
C.可有效提高DMC的产率
D.合成DMC的反应为
5.对于反应,下列表示中反应速率最大的是
A. mol L s B. mol L s
C. mol L s D. mol L min
6.研究表明,催化分解的微观机制是复杂的,可以形成以下基本观点:与循环反应;且与反应产生的强氧化性羟基自由基(·OH)起到了关键作用,该过程被称为类-Fenton反应,如图所示,下列说法正确的是
A.0.1mol羟基自由基(·OH)所含电子的数目为
B.可以改变反应历程,降低分解反应的反应热
C.与反应产生羟基自由基的反应为
D.去除废水中难降解的有机污染物,主要利用了羟基自由基的还原性
7.湖南大学课题组研究钴催化腈与胺电氢化的反应机理如下图所示(其中Ph表示苯基,表示),下列说法错误的是
是反应的中间产物
B.中所有碳原子可能共平面
C.所涉及Co的配合物中,Co的配位数不同,N的杂化方式不相同
D.该反应的总方程式为Ph—≡N+PhNH2+4H++4e-+NH3
8.下列实验方案能达到实验目的的是
A.甲可制取无水 B.乙可验证金属性:
C.丙可验证非金属性: D.丁可探究压强对平衡的影响
9.利用环成二烯()加氢制备环成烯(),按加入恒压密闭容器中,若仅发生如下反应:
① ②
实验测得环戊二烯转化率(曲线b)和环戊烯选择性(曲线a)随温度变化曲线如下(已知:选择性=转化为目标产物的反应物在总转化量中的占比)。下列说法错误的是
A.时,的转化率为87.4%B.由图可知,反应的活化能
C.相同条件下,若增大,选择性提高
D.升高温度, 生成速率增大,生成速率减小
10.氧化铟基纳米催化剂可用于选择性加氢制备,其反应机理如图所示。下列说法不正确的是
A.该反应每生成,转移电子
B.与中,碳原子的杂化方式分别是与杂化
C.该反应过程中只有键断裂,没有键断裂,但有新键形成
D.催化剂,参与反应生成了过渡态物质,降低了反应的活化能,加快了化学反应速率
11.为了降低大气中NO的排放量,可在NH3的作用下,通过催化剂将NO转化为无毒无害的。向2L的恒容密闭容器中加入一定量的NH3、NO、NO2,测得NH3、N2、H2O的浓度随时间的变化情况如图所示。下列说法正确的是
A.曲线①表示N2的浓度随时间的变化情况B.时,
C.a点时,
D.内,用NO表示的平均反应速率为
12.N2H4是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某Ru(Ⅱ)催化剂用[L-Ru-NH3]+表示|能高效电催化氧化NH3合成N2H4,其反应机理如图所示(图中L为原子团)。下列说法错误的是
A.[L-Ru-NH3]2+中Ru的化合价为+3B.反应Ⅳ中有非极性键的断裂与形成
C.电催化氧化NH3合成N2H4发生在电解池阳极区
D.N2H4与NH3中 N 原子的 VSEPR 模型均为四面体形
13.氮及其化合物的转化过程如图所示。下列分析不合理的是
A.催化剂a表面发生了极性共价键的断裂和形成
B.与反应生成的原子利用率(期望产物的总质量与生成物的总质量之比)为100%
C.在催化剂b表面形成氮氧键时,涉及电子转移
D.使用催化剂a、b均可以提高单位时间内生成物的产量
14.逆水煤气变换反应是一种转化和利用的重要途径,发生的反应有
反应Ⅰ: kJ·mol
反应Ⅱ: kJ mol
反应Ⅲ:
常压下,向密闭容器中投入1 mol 和2 mol ,达平衡时和含碳物质的物质的量随温度的变化如题图所示。下列说法正确的是
A.kJ molB.649℃时,反应Ⅰ的平衡常数
C.其他条件不变,在250℃~900℃范围内,随着温度的升高,平衡时不断增大
D.800℃时,适当增大体系压强,保持不变
15.将等物质的量浓度等体积的甘氨酸溶液与盐酸混合,发生反应:,取上述溶液(含0.04mol ),滴加NaOH溶液,pH的变化如下图所示(注:b点溶液中甘氨酸以的形式存在)。
下列说法不正确的是
A.中解离出的能力:
B.b点溶液pH<7,推测中解离出的程度大于-COO-水解的程度
C.c点溶液中存在:c()
D.由d点可知:的
第II卷 (非选择题,共55分)
16.二氧化碳的开发利用是化学家和化学工作者一直关注的热门话题,试回答:
(1)在恒容密闭容器中投入和发生反应,实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示。
①该反应的正反应为 反应,从大到小的关系排序为 。
②M点对应的平衡常数 ,在及时,图中N点 (填“>”“<”或“=”)。
(2)二氧化碳催化加氢合成乙烯是综合利用的热点研究领域,化学方程式为。理论计算表明,原料初始组成,在体系压强为,反应达到平衡,四种组分的物质的量分数x随温度T的变化如图所示。回答下列问题:
①图中,表示变化的曲线分别是 。催化加氢合成反应的 0(填“大于”或“小于”)。
②根据图中点,计算该温度时反应的平衡常数 (列出计算式。以分压表示,分压=总压×物质的量分数)。
17.雾霾天气多次肆虐我国中东部地区,汽车尾气(含NO、NO2)和燃堞尾气(含SO2)是造成空气污染的原因之一。汽车尾气净化的主要原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示,回答以下问题。
(1)C、N、O三种元素的第一电离能由大到小的顺序是 。
(2)若反应中转移lmol电子,标况下消耗NO气体的体积 。
(3)该反应的△H 0(填“>”或“<”),△S 0(填“>”或“<”),是 (填“高温自发”、“低温自发”或“不自发”)反应。
(4)在T1温度下,0~2s内的平均反应速率v(N2)= 。
(5)M点、N点的化学平衡常数:KM KN(填“>”或“<”或“=”)
(6)能说明该反应达化学平衡状态的是 (不定项)。
A.容器内气体的密度不再变化 B.v正(CO2)=v逆(CO)
C.密闭容器内的压强不再变化 D.K保持不变
(7)当催化剂质量一定时,若增大催化剂的表面积,则CO转化率 (填“增大”,“减少”或“不变”),并说明v正和v逆如何变化
18.能源是现代文明的动力,科学家致力于开辟新能源和提高能源的利用率。如图所示的过程是目前直接利用太阳能的研究热点,人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
(1)在如图构想的物质和能量循环中,太阳能最终转化为 能。
(2)甲烷是重要的燃料,在空气中燃烧发生反应:。
已知:完全燃烧时生成和时放出热量;其中,破坏键、键分别需要吸收的能量,形成键能释放的能量
①如图能正确表示甲烷燃烧这一反应中能量变化的是 (填或)。
②形成键能释放 的能量(用含的式子表示)。
(3)用人工光合作用得到的甲烷、氧气和溶液制作燃料电池。装置如图所示:
①甲烷应通入该燃料电池的 极(填“正”或“负”)。
②正极发生的电极反应式为 。
③当转移电子时,需要消耗标况下的氧气体积是 。
(4)人工光合作用的途径之一就是在一定条件下,将和转化为甲醇,该反应的化学方程式为。一定条件下,在密闭容器中进行上述反应,测得随时间的变化如表所示。则用表示内该反应的平均反应速率为 。
时间 0 1 2 3 4 5
0 0.040 0.070 0.080 0.085 0.085
19.硅元素更是无机非金属材料的主角,无机非金属材料与人类社会的发展与进步息息相关。
Ⅰ.建筑领域的基石材料-硅酸盐
(1)烧制普通玻璃的原料是 ,使用HF溶液刻蚀玻璃的化学方程式: 。
(2)实验室不用带玻璃塞的试剂瓶盛装氢氧化钠溶液,写出相关原理反应的离子方程式: 。
(3)制备陶瓷和普通水泥都需要以黏土为原料,黏土的主要成分是铝硅酸盐,可以将其使用氧化物形式表示,例如Na2SiO3,其氧化物形式为Na2O·SiO2。某种黏土的主要成分为Na[AlSi3O8],将其表示为氧化物的形式为aNa2O·bAl2O3·cSiO2,则a:b:c= 。(最简整数比)
Ⅱ.现代信息的明星材料-硅
业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
(4)工业上用石英砂和过量焦炭在电弧炉中高温加热生成粗硅,当有1molC参与反应时,该反应转移的电子数是 。
(5)为提高流化床反应器中的反应速率,可以采取的操作有: 。(填2个)
(6)还原炉中发生的化学反应方程式为 。
(7)上述工艺生产中循环使用的物质除Si、SiHCl3外,还有 。
(8)已知反应,一定温度下,向2L恒容密闭器中充入一定量的、和Si(s)发生反应,经过10min达到后,体系中H2、SiHCl3(g)的物质的量浓度分别为2mol·L-1、1mol·L-1。则,从反应开始到10min时SiCl4的平均速率为 。
参考答案:
1.D2.B3.C4.D5.A6.C7.C8.B9.D10.C11.B12.B13.A14.D15.C
16.(1) 放热 >
(2) 小于 或
17.(1)N>O>C(2)11.2L(3) < < 低温自发(4)0.05mol/(L s)(5)>(6)B
(7) 不变 v正和v逆同等倍数的增大
18.(1)热能(2)
(3) 负 1.12(4)
19.(1) 纯碱、石灰石和石英砂 SiO2+4HF=SiF4+2H2O(2)2OH-+SiO2=SiO+H2O
(3)1:1:6(4)2NA
(5)升温、粗硅粉碎、增大HCl气流(浓度)、搅拌、加入催化剂、加压等任写其2
(6)SiHCl3+H2Si+3HCl(7)H2、HCl(8)0.075mol·L-1·min-1
同课章节目录
