化学人教版(2019)必修第二册5.2.1氮气与氮的氧化物(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.2.1氮气与氮的氧化物(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 49.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-13 23:43:19 | ||
图片预览










文档简介
(共30张PPT)
走进奇妙的化学世界
2023-2024
必修第二册
第五章
化工生产中的重要非金属
第二节
氮及其化合物
位置
第二周期、第VA族
结构
性质
既不容易得3个电子
也不容易失5个电子
N一般通过共用电子对与其他原子相互结合构成物质
氮是自然界各种生物体生命体活动不可缺少的重要元素,自然界中氮元素是怎样存在的呢?
主要化合价:-3、0、+2、+4、+5
氮元素在自然界中有两种存在形态:
游离态:主要以氮分子的形式存在于空气中。
(78%) 氮气
氧气 (21%)
空气的成分(按体积)
化合态:部分存在于动植物体内的蛋白质中;部分存在于土壤、海洋里的的硝酸盐和铵盐中。
其他1%
(1)物理性质:无色、无味的气体,密度与空气接近,难溶于水
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
思考
对比氧气和氮气的沸点,如何从空气中获得氮气?
一、氮气与氮的固定
1. 氮气
氧气
熔点:-218.4 ℃
沸点:-183 ℃
密度:1.25 g/L
空气(气态)
低温
加压
空气(液态)
N2(气态)
O2(液态)
【思考】氮气在低温加压可以液化成液氮,液氮汽化会吸热使温度降低,
你知道液氮有什么用途么?
医疗上可在液氮冷冻
麻醉下做手术
液氮食品
低温超导
(2)分子组成与结构:
分子式:
电子式:
结构式:
空间结构:
球棍模型:
N2
直线型
氮分子内两个氮原子间以共价三键(N≡N)结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,通常情况下很难与其他物质发生化学反应,但在高温、放电等条件下能和一些物质发生化学反应。
(3)氮气的化学性质:
①与金属单质(Mg、Li、Ca、Sr、Ba、Al等)反应 需要加热才能发生
N2 + 3Mg Mg3N2
氧化性
Mg3N2 +6H2O=3Mg(OH)2↓+2NH3↑
②与非金属单质(O2、H2、B、Si等)反应
N2 + O2 2NO
还原性
N2 + 3H2 2NH3
氧化性
自然固氮
人工固氮:
高能固氮(如雷雨天气N2转化为NO)
生物固氮(如豆科植物的根瘤菌固氮)
合成氨(工业上合成氨)、仿生固氮(某些金属有机化合物可起到根瘤菌的作用)
将大气中游离态的氮转化为氮的化合物的过程叫做氮的固定
离子化合物
氮元素
动植物蛋白质
土壤海洋中硝酸盐和铵盐
空气中的氮气
自然界中的氮元素
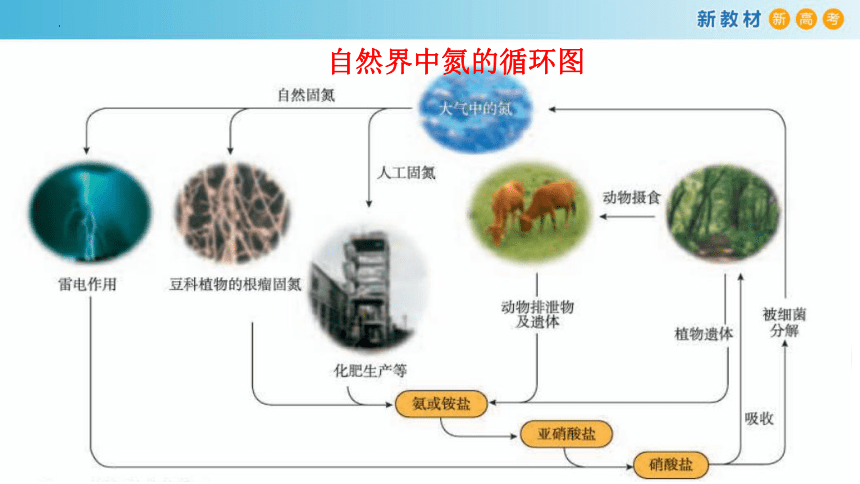
氮是自然界各种生物体生命活动不可缺少的重要元素,自然界是怎样通过氮的循环为生物体提供氮元素的呢?
自然界中氮的循环图
(4)氮气的制备:
①工业制法:工业上由液态空气分馏来获得氮气
②实验室制法:
NH4Cl+NaNO2 NaCl+N2+2H2O
===
加热
(5)氮气的用途:
①氨气是合成氨、制硝酸的重要材料
硝酸
②氮气常用作保护气,用于焊接金属、填充灯泡、保护食品等
注意焊接金属镁时不能用氮气做保护气
③液氮可用作制冷剂,应用于医学、科技等领域
科学史话
例 1-1 (2021广东茂名期中)下列关于自然界中氮循环(如图5-2-1)的说法不正确的是()
A. 氮元素均被氧化B.工业合成氨属于人工固氮C.含氮无机物和含氮有机物可相互转化D. 碳、氢、氧三种元素也参与了氮循环
A
1.(浙江嘉兴一中期中)下列过程不属于氮的固定的是 ( )
A.闪电时大气中氮的氧化物的生成
B.由NH3制备NH4Cl
C.用N2和H2合成氨
D.豆科植物的根瘤菌把大气中的氮气转化成NH
B
例 1-2 (2021 江苏宿迁期中)下列关于氮气的说法错误的是
A.氮气在通常情况下不燃烧,也不支持燃烧,不能供给呼吸
B.液氮可用于医学和科技领域,制造低温环境
C.利用氮气的稳定性,工业上用来替代稀有气体作焊接金属的保护气
D.在高温、高压、催化剂条件下与氢气反应时,氮气作还原剂
D
据说在新疆与青海两省区交界处有一狭长山谷,这里经常在风和日丽的晴天顷刻电闪雷鸣,下起雷雨,奇怪的是这里牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。为什么魔鬼谷牧草旺盛
有句谚语“雷雨发庄稼”,
你明白其中的化学道理吗
思维拓展
雷雨发庄稼,将N2转化为硝酸盐要经过几步转化,每一步转化分别是什么?
+O2
+O2
+H2O
+NH3
N2 NO NO2 HNO3
NH4NO3
NO和NO2具有哪些性质?
【思考】
氮的氧化物
氧化物 NO N2O3 N2O5
对应氮的化合价
N2O
NO2
N2O4
+3
①N2O俗称笑气,具有麻醉作用
②N2O3亚硝酸的酸酐,不稳定
③N2O5硝酸的酸酐,白色固体
+1
+2
+4
+4
+5
上述氮的氧化物中属于酸性氧化物的是 。
N2O5和N2O3
物质 颜色 状态 气味 水溶性 收集方法 特性
NO 气体 ___溶于水
NO2 气体 ___溶于水
无色
无味
不
排水法
NO
NO2
红棕色
刺激性
易
向上排空气
二、一氧化氮和二氧化氮
1. NO和NO2的物理性质
易液化
注意:①NO有毒,使人中毒原理与CO相似,但是NO是人体内的“信号分子”可以舒张血管,抗氧化
②NO2在常温下为气体,但是在标况下为液体
2. NO和NO2的化学性质
(1)NO
2NO+O2=2NO2 (红棕色)
NO
【思考】实验室如何收集,检验NO的存在?
收集:排水法
检验:向无色气体中通入氧气或空气,若气体变为红棕色则无色气体为NO
(2)NO2
3NO2+H2O=2HNO3+NO
NO2
+4 +5 +2
(工业上利用这一原理生产硝酸,NO2既是氧化剂又是还原剂)
【实验5-5】NO2溶于水实验
实验装置 实验操作 在一支50 mL的注射器里充入20mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。 打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹,观察现象,然后振荡注射器,再观察现象。
现象 振荡前:
振荡后:
化学方程式
无明显现象
无色气体变红棕色
红棕色变为无色
NO
NO2
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
结论:在一定条件下,NO与NO2可以相互转化
如果要将注射器中的NO充分转化,可以采取什么措施?
提示 可以用注射器不断吸入空气,然后使注射器里的气体充分与水反应
【思考讨论】
①2NO+O2=2NO2
②3NO2+H2O=2HNO3+NO
【想一想】上述实验对工业上生产硝酸有什么启示?
硝酸工业在吸收反应进行过程中,需要补充一些空气,使生成的NO被氧化成NO2,NO2溶于水又生成硝酸和NO,经过多次氧化和吸收,NO可以完全转化为硝酸,减少环境污染。
①X3+②X2:
4NO+3O2+2H2O=4HNO3
①+②X2:
4NO2+O2+2H2O=4HNO3
3. NO、NO2溶于水的计算
(1)反应原理
3NO2+H2O=2HNO3+NO ①
2NO+O2=2NO2 ②
反应①×2+② 4NO2+O2+2H2O=4HNO3 ③
反应①×2+②×3 4NO+3O2+2H2O=4HNO3 ④
②NO2和O2的混合气体溶于水时涉及反应:
4NO2+O2+2H2O== 4HNO3,其计算如下表:
【例1】向盛有15mlNO2气体,倒立于水槽的试管A中通入O2,充分反应,试管中还剩余气体3ml,则通入O2体积可能是多少
剩余气体只能是NO或O2,不可能是NO2
①NO2过量→剩余气体为NO
3NO2+H2O=2HNO3+NO
3ml
9ml
4NO2+O2+2H2O=4HNO3
6ml
1.5ml
则通入氧气体积可能为1.5ml
②剩余气体为O2
4NO2+O2+2H2O=4HNO3
15ml
3.75ml
3.75ml+3ml=6.75ml
则通入氧气体积可能为6.75ml
③NO和O2的混合气体溶于水时涉及反应:
4NO+3O2+2H2O===4HNO3,其计算如下表:
【例2】向盛有15mlNO气体,倒立于水槽的试管A中通入O2,充分反应,试管中还剩余气体3ml,则通入O2体积可能是多少
剩余气体只能是NO或O2,不可能是NO2
①剩余气体为NO
4NO+3O2+2H2O=4HNO3
4 3
15ml-3ml
9ml
则通入氧气体积可能为9ml
②剩余气体为O2
4NO+3O2+2H2O=4HNO3
4 3
15ml
11.25ml
11.25ml+3ml=14.25ml
则通入氧气体积可能为14.25ml
NO NO2
颜色 无色 红棕色
毒性 有毒 有毒
溶解性 难溶于水 易溶于水
与O2或与H2O反应 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
实验室制备 铜与稀硝酸反应 铜与浓硝酸反应
收集方法 排水法 向上排空气法
与人体、 环境的关系 ①与血红蛋白结合,使人中毒;②形成酸雨、光化学烟雾 形成酸雨、光化学烟雾
NO和NO2性质比较
将混合气体通入盛有水的洗气瓶,然后重新收集气体。
如何除去NO气体中混有的少量NO2气体杂质?
【思考】
NO2、NO均是污染性气体,如何尾气处理?
①碱液吸收法
2NO2+2NaOH NaNO3+NaNO2+H2O
NO2+NO+2NaOH 2NaNO2+H2O
②催化转化法
2NOx+2XCO N2+2XCO2
催化剂
4.氮氧化物对环境的污染
(1)NOX的来源
石油产品和煤燃烧的产物
汽车尾气
制硝酸的工厂
(2)危害
①光化学烟雾:在紫外线作用下,NOx与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾
②硝酸型酸雨:3NO2+H2O=2HNO3+NO
硫酸/硝酸型酸雨的形成过程相互交织
NO2+SO2=NO+SO3
③破坏臭氧层:NOx 可使平流层中的臭氧减少,导致地面紫外线辐射量增加
g.mol-1
M=m/n
Na
6.02X1023mol-1
n=N/M
摩尔(mol)
n
M
走进奇妙的化学世界
2023-2024
必修第二册
第五章
化工生产中的重要非金属
第二节
氮及其化合物
位置
第二周期、第VA族
结构
性质
既不容易得3个电子
也不容易失5个电子
N一般通过共用电子对与其他原子相互结合构成物质
氮是自然界各种生物体生命体活动不可缺少的重要元素,自然界中氮元素是怎样存在的呢?
主要化合价:-3、0、+2、+4、+5
氮元素在自然界中有两种存在形态:
游离态:主要以氮分子的形式存在于空气中。
(78%) 氮气
氧气 (21%)
空气的成分(按体积)
化合态:部分存在于动植物体内的蛋白质中;部分存在于土壤、海洋里的的硝酸盐和铵盐中。
其他1%
(1)物理性质:无色、无味的气体,密度与空气接近,难溶于水
氮气
熔点:-210 ℃
沸点:-196 ℃
密度:1.25 g/L
思考
对比氧气和氮气的沸点,如何从空气中获得氮气?
一、氮气与氮的固定
1. 氮气
氧气
熔点:-218.4 ℃
沸点:-183 ℃
密度:1.25 g/L
空气(气态)
低温
加压
空气(液态)
N2(气态)
O2(液态)
【思考】氮气在低温加压可以液化成液氮,液氮汽化会吸热使温度降低,
你知道液氮有什么用途么?
医疗上可在液氮冷冻
麻醉下做手术
液氮食品
低温超导
(2)分子组成与结构:
分子式:
电子式:
结构式:
空间结构:
球棍模型:
N2
直线型
氮分子内两个氮原子间以共价三键(N≡N)结合,断开该化学键需要较多的能量,所以氮气的化学性质很稳定,通常情况下很难与其他物质发生化学反应,但在高温、放电等条件下能和一些物质发生化学反应。
(3)氮气的化学性质:
①与金属单质(Mg、Li、Ca、Sr、Ba、Al等)反应 需要加热才能发生
N2 + 3Mg Mg3N2
氧化性
Mg3N2 +6H2O=3Mg(OH)2↓+2NH3↑
②与非金属单质(O2、H2、B、Si等)反应
N2 + O2 2NO
还原性
N2 + 3H2 2NH3
氧化性
自然固氮
人工固氮:
高能固氮(如雷雨天气N2转化为NO)
生物固氮(如豆科植物的根瘤菌固氮)
合成氨(工业上合成氨)、仿生固氮(某些金属有机化合物可起到根瘤菌的作用)
将大气中游离态的氮转化为氮的化合物的过程叫做氮的固定
离子化合物
氮元素
动植物蛋白质
土壤海洋中硝酸盐和铵盐
空气中的氮气
自然界中的氮元素
氮是自然界各种生物体生命活动不可缺少的重要元素,自然界是怎样通过氮的循环为生物体提供氮元素的呢?
自然界中氮的循环图
(4)氮气的制备:
①工业制法:工业上由液态空气分馏来获得氮气
②实验室制法:
NH4Cl+NaNO2 NaCl+N2+2H2O
===
加热
(5)氮气的用途:
①氨气是合成氨、制硝酸的重要材料
硝酸
②氮气常用作保护气,用于焊接金属、填充灯泡、保护食品等
注意焊接金属镁时不能用氮气做保护气
③液氮可用作制冷剂,应用于医学、科技等领域
科学史话
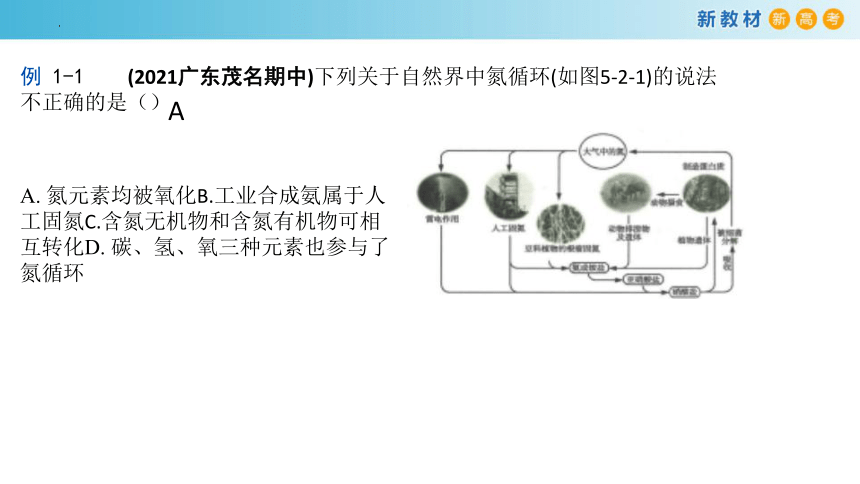
例 1-1 (2021广东茂名期中)下列关于自然界中氮循环(如图5-2-1)的说法不正确的是()
A. 氮元素均被氧化B.工业合成氨属于人工固氮C.含氮无机物和含氮有机物可相互转化D. 碳、氢、氧三种元素也参与了氮循环
A
1.(浙江嘉兴一中期中)下列过程不属于氮的固定的是 ( )
A.闪电时大气中氮的氧化物的生成
B.由NH3制备NH4Cl
C.用N2和H2合成氨
D.豆科植物的根瘤菌把大气中的氮气转化成NH
B
例 1-2 (2021 江苏宿迁期中)下列关于氮气的说法错误的是
A.氮气在通常情况下不燃烧,也不支持燃烧,不能供给呼吸
B.液氮可用于医学和科技领域,制造低温环境
C.利用氮气的稳定性,工业上用来替代稀有气体作焊接金属的保护气
D.在高温、高压、催化剂条件下与氢气反应时,氮气作还原剂
D
据说在新疆与青海两省区交界处有一狭长山谷,这里经常在风和日丽的晴天顷刻电闪雷鸣,下起雷雨,奇怪的是这里牧草茂盛,四季常青,被当地牧民称为“魔鬼谷”。为什么魔鬼谷牧草旺盛
有句谚语“雷雨发庄稼”,
你明白其中的化学道理吗
思维拓展
雷雨发庄稼,将N2转化为硝酸盐要经过几步转化,每一步转化分别是什么?
+O2
+O2
+H2O
+NH3
N2 NO NO2 HNO3
NH4NO3
NO和NO2具有哪些性质?
【思考】
氮的氧化物
氧化物 NO N2O3 N2O5
对应氮的化合价
N2O
NO2
N2O4
+3
①N2O俗称笑气,具有麻醉作用
②N2O3亚硝酸的酸酐,不稳定
③N2O5硝酸的酸酐,白色固体
+1
+2
+4
+4
+5
上述氮的氧化物中属于酸性氧化物的是 。
N2O5和N2O3
物质 颜色 状态 气味 水溶性 收集方法 特性
NO 气体 ___溶于水
NO2 气体 ___溶于水
无色
无味
不
排水法
NO
NO2
红棕色
刺激性
易
向上排空气
二、一氧化氮和二氧化氮
1. NO和NO2的物理性质
易液化
注意:①NO有毒,使人中毒原理与CO相似,但是NO是人体内的“信号分子”可以舒张血管,抗氧化
②NO2在常温下为气体,但是在标况下为液体
2. NO和NO2的化学性质
(1)NO
2NO+O2=2NO2 (红棕色)
NO
【思考】实验室如何收集,检验NO的存在?
收集:排水法
检验:向无色气体中通入氧气或空气,若气体变为红棕色则无色气体为NO
(2)NO2
3NO2+H2O=2HNO3+NO
NO2
+4 +5 +2
(工业上利用这一原理生产硝酸,NO2既是氧化剂又是还原剂)
【实验5-5】NO2溶于水实验
实验装置 实验操作 在一支50 mL的注射器里充入20mLNO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。 打开弹簧夹,快速吸入10 mL空气后夹上弹簧夹,观察现象,然后振荡注射器,再观察现象。
现象 振荡前:
振荡后:
化学方程式
无明显现象
无色气体变红棕色
红棕色变为无色
NO
NO2
2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
结论:在一定条件下,NO与NO2可以相互转化
如果要将注射器中的NO充分转化,可以采取什么措施?
提示 可以用注射器不断吸入空气,然后使注射器里的气体充分与水反应
【思考讨论】
①2NO+O2=2NO2
②3NO2+H2O=2HNO3+NO
【想一想】上述实验对工业上生产硝酸有什么启示?
硝酸工业在吸收反应进行过程中,需要补充一些空气,使生成的NO被氧化成NO2,NO2溶于水又生成硝酸和NO,经过多次氧化和吸收,NO可以完全转化为硝酸,减少环境污染。
①X3+②X2:
4NO+3O2+2H2O=4HNO3
①+②X2:
4NO2+O2+2H2O=4HNO3
3. NO、NO2溶于水的计算
(1)反应原理
3NO2+H2O=2HNO3+NO ①
2NO+O2=2NO2 ②
反应①×2+② 4NO2+O2+2H2O=4HNO3 ③
反应①×2+②×3 4NO+3O2+2H2O=4HNO3 ④
②NO2和O2的混合气体溶于水时涉及反应:
4NO2+O2+2H2O== 4HNO3,其计算如下表:
【例1】向盛有15mlNO2气体,倒立于水槽的试管A中通入O2,充分反应,试管中还剩余气体3ml,则通入O2体积可能是多少
剩余气体只能是NO或O2,不可能是NO2
①NO2过量→剩余气体为NO
3NO2+H2O=2HNO3+NO
3ml
9ml
4NO2+O2+2H2O=4HNO3
6ml
1.5ml
则通入氧气体积可能为1.5ml
②剩余气体为O2
4NO2+O2+2H2O=4HNO3
15ml
3.75ml
3.75ml+3ml=6.75ml
则通入氧气体积可能为6.75ml
③NO和O2的混合气体溶于水时涉及反应:
4NO+3O2+2H2O===4HNO3,其计算如下表:
【例2】向盛有15mlNO气体,倒立于水槽的试管A中通入O2,充分反应,试管中还剩余气体3ml,则通入O2体积可能是多少
剩余气体只能是NO或O2,不可能是NO2
①剩余气体为NO
4NO+3O2+2H2O=4HNO3
4 3
15ml-3ml
9ml
则通入氧气体积可能为9ml
②剩余气体为O2
4NO+3O2+2H2O=4HNO3
4 3
15ml
11.25ml
11.25ml+3ml=14.25ml
则通入氧气体积可能为14.25ml
NO NO2
颜色 无色 红棕色
毒性 有毒 有毒
溶解性 难溶于水 易溶于水
与O2或与H2O反应 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
实验室制备 铜与稀硝酸反应 铜与浓硝酸反应
收集方法 排水法 向上排空气法
与人体、 环境的关系 ①与血红蛋白结合,使人中毒;②形成酸雨、光化学烟雾 形成酸雨、光化学烟雾
NO和NO2性质比较
将混合气体通入盛有水的洗气瓶,然后重新收集气体。
如何除去NO气体中混有的少量NO2气体杂质?
【思考】
NO2、NO均是污染性气体,如何尾气处理?
①碱液吸收法
2NO2+2NaOH NaNO3+NaNO2+H2O
NO2+NO+2NaOH 2NaNO2+H2O
②催化转化法
2NOx+2XCO N2+2XCO2
催化剂
4.氮氧化物对环境的污染
(1)NOX的来源
石油产品和煤燃烧的产物
汽车尾气
制硝酸的工厂
(2)危害
①光化学烟雾:在紫外线作用下,NOx与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾
②硝酸型酸雨:3NO2+H2O=2HNO3+NO
硫酸/硝酸型酸雨的形成过程相互交织
NO2+SO2=NO+SO3
③破坏臭氧层:NOx 可使平流层中的臭氧减少,导致地面紫外线辐射量增加
g.mol-1
M=m/n
Na
6.02X1023mol-1
n=N/M
摩尔(mol)
n
M
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
