达州市高级中学校2023-2024学年高二下学期3月月考化学试卷(含解析)
文档属性
| 名称 | 达州市高级中学校2023-2024学年高二下学期3月月考化学试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 673.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-14 09:59:43 | ||
图片预览


文档简介
达州市高级中学校2023-2024学年高二下学期3月月考化学试卷
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关原子结构相关内容表述正确的是( )
A.电子排布图,不满足泡利原则
B.s轨道的形状为哑铃形
C.Fe(26号元素)原子的价层电子排布式为
D.LED灯的发光是因为核外电子从基态到激发态以光的形式释放能量
2.下列离子的VSEPR模型与离子的空间立体构型一致的是( )
A. B. C. D.
3.下列各组性质的比较中,不正确的是( )
A.碱性:NaOH> B.原子半径:Cl>S
C.金属性:K>Na D.热稳定性:>
4.已知反应:,为阿伏伽德罗常数的值,若消耗(标准状况),下列叙述错误的是( )
A.转移的电子数为 B.生成的质量为
C.乙生成的氧化产物分子数为 D.生成的含有孤电子对数为
5.元素周期表中元素“钴”的方格中注明“”,由此可以推断( )
A.元素钴是一种过渡元素
B.它的基态原子价电子排布式为
C.的电子排布式为
D.它位于元素周期表的第四周期第ⅧB族
6.在分子中,C—Cl键采用的成键轨道是( )
A.sp-p B. C. D.
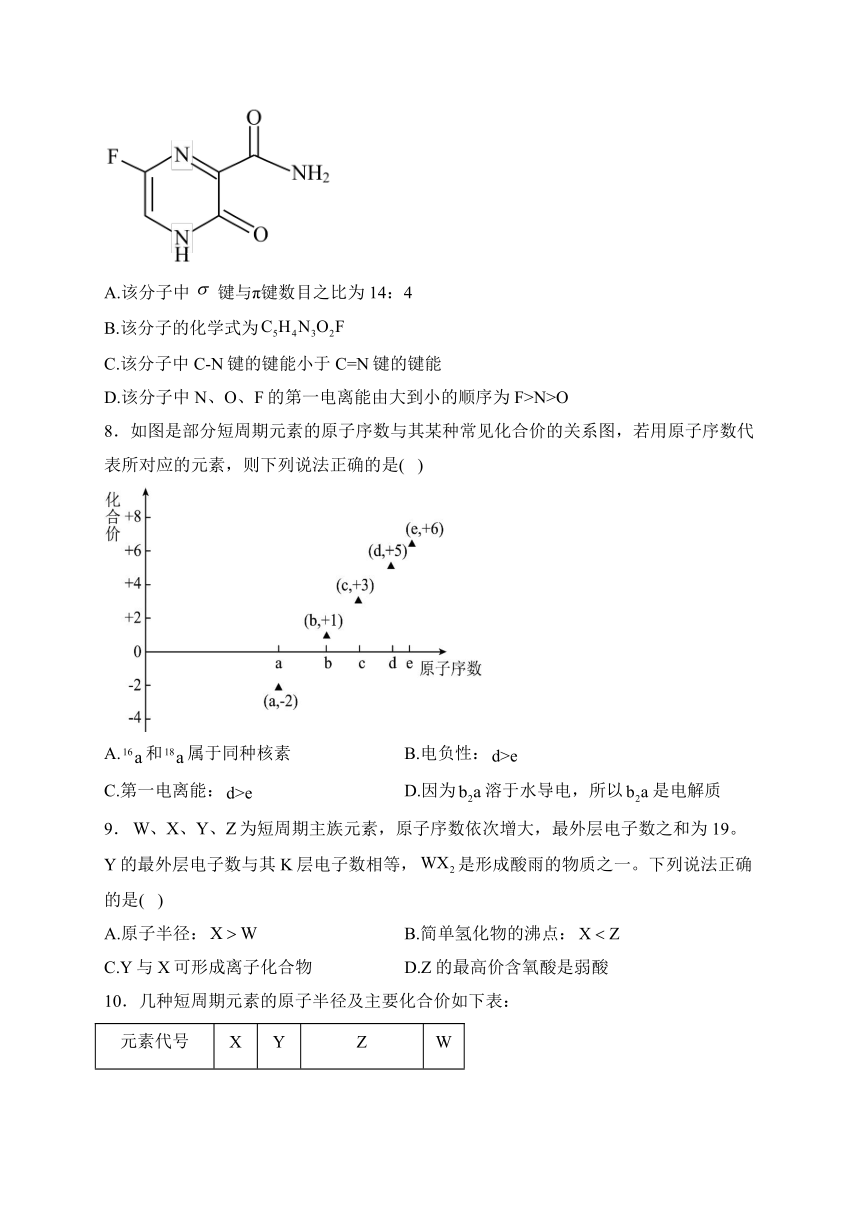
7.法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法不正确的是( )
A.该分子中键与π键数目之比为14:4
B.该分子的化学式为
C.该分子中C-N键的键能小于C=N键的键能
D.该分子中N、O、F的第一电离能由大到小的顺序为F>N>O
8.如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
A.和属于同种核素 B.电负性:
C.第一电离能: D.因为溶于水导电,所以是电解质
9.为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,是形成酸雨的物质之一。下列说法正确的是( )
A.原子半径: B.简单氢化物的沸点:
C.Y与X可形成离子化合物 D.Z的最高价含氧酸是弱酸
10.几种短周期元素的原子半径及主要化合价如下表:
元素代号 X Y Z W
原子半径/ 160 143 70 66
主要化合价 、、
下列叙述正确的是( )
A.X、Y元素的金属性:
B.Y的氧化物是碱性氧化物
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,Y单质可以与Z的最高价氧化物对应的水化物反应
11.下面两表分别列出了CO和的某些性质及相关键能,有关说法不正确的是( )
表1
分子 熔点/℃ 沸点/℃ 常温时在水中溶解度
CO -205.05 -191.49 2.3mL
-210.00 -195.81 1.6mL
表2
CO C-O C=O
键能() 357.7 798.9 1071.9
N-N N=N
键能() 193 418 946
A.CO与的价电子总数相等
B.由表2可知,CO的活泼性不及
C.由表1可知,CO的熔沸点高于,是因为CO分子间作用力大于
D.由表1可知,室温时,CO在水中的溶解性大于,是因为CO分子有弱极性
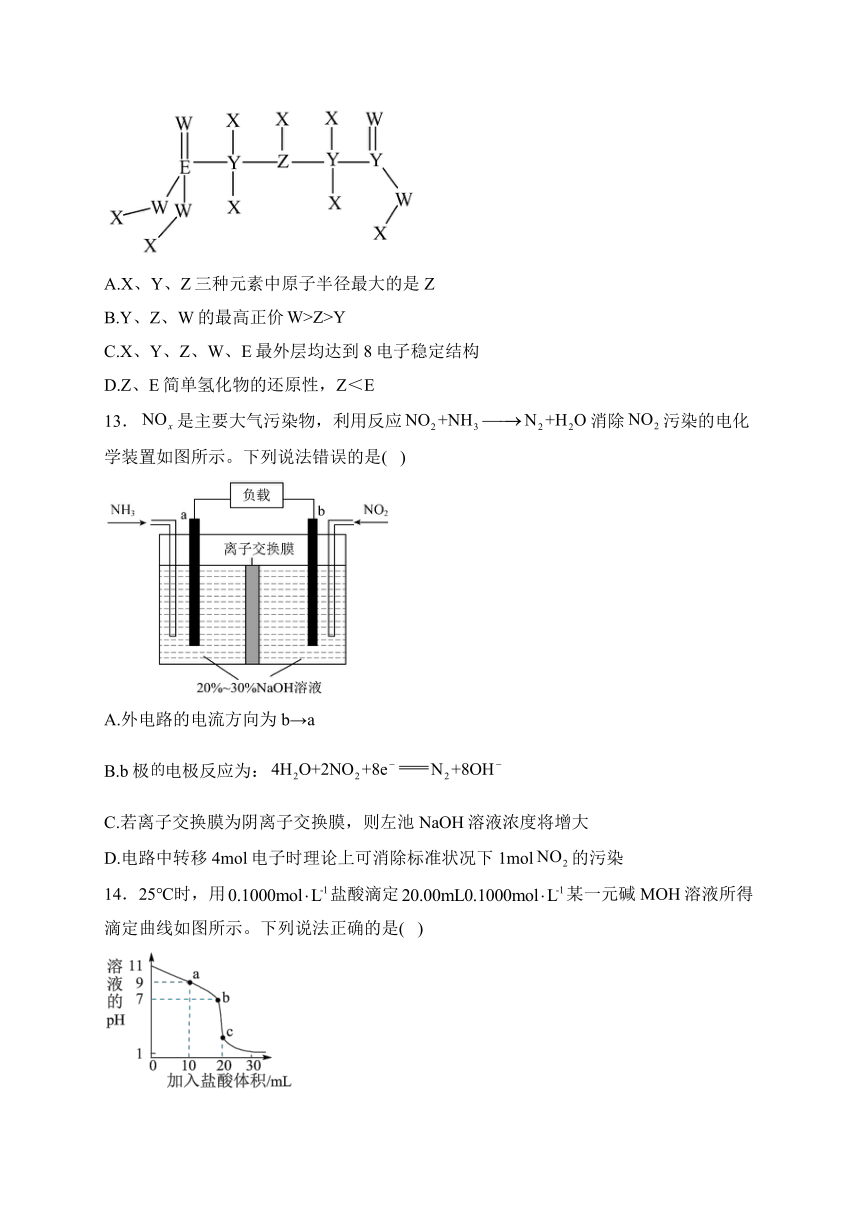
12.草甘膦,是一种有机膦类除草剂,其结构式如图。其中X、Y、X、W、E为原子序数依次增大的短周期主族元素。其中X只有s能级上有电子,E原子的电子总数为价层电子数三倍,W的电子排布式中有三对成对电子。下列说法正确的是( )
A.X、Y、Z三种元素中原子半径最大的是Z
B.Y、Z、W的最高正价
C.X、Y、Z、W、E最外层均达到8电子稳定结构
D.Z、E简单氢化物的还原性,Z<E
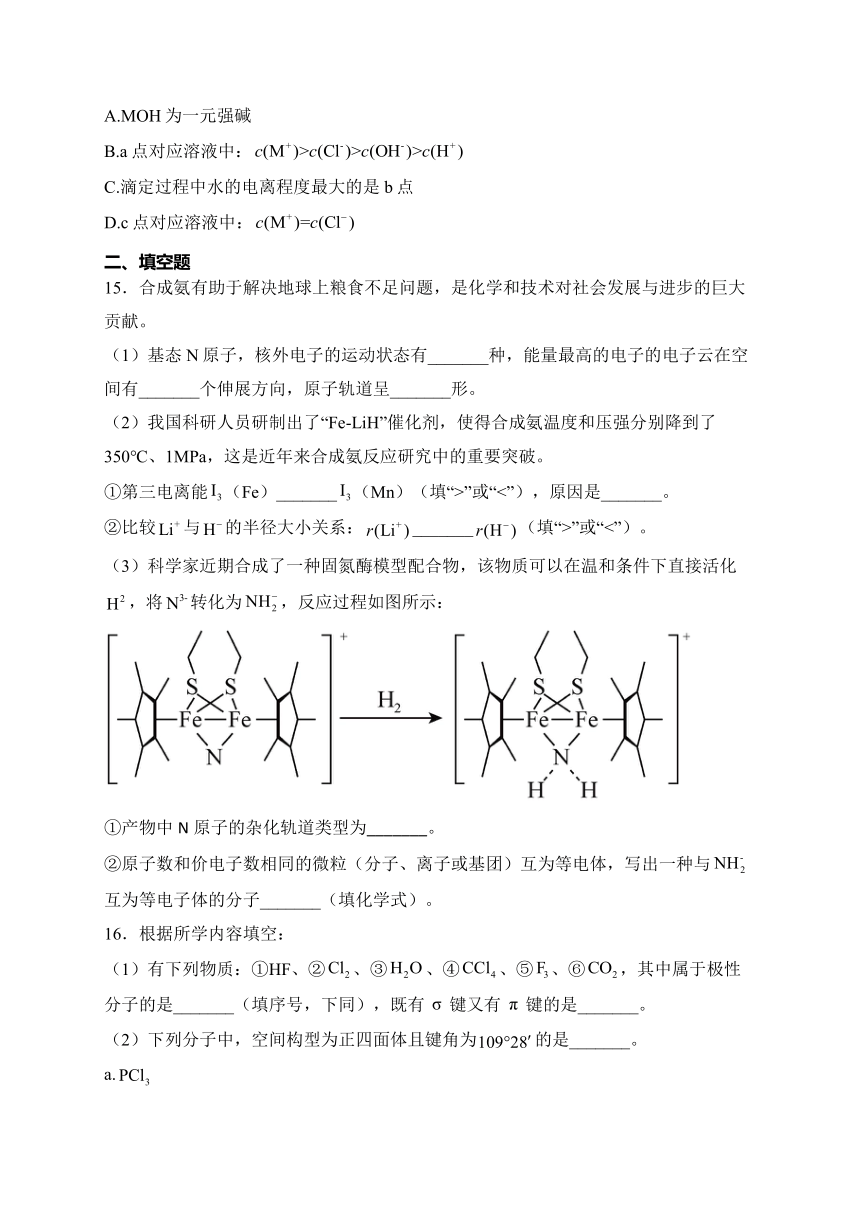
13.是主要大气污染物,利用反应消除污染的电化学装置如图所示。下列说法错误的是( )
A.外电路的电流方向为b→a
B.b极电极反应为:
C.若离子交换膜为阴离子交换膜,则左池NaOH溶液浓度将增大
D.电路中转移4mol电子时理论上可消除标准状况下1mol的污染
14.25℃时,用盐酸滴定某一元碱MOH溶液所得滴定曲线如图所示。下列说法正确的是( )
A.MOH为一元强碱
B.a点对应溶液中:
C.滴定过程中水的电离程度最大的是b点
D.c点对应溶液中:
二、填空题
15.合成氨有助于解决地球上粮食不足问题,是化学和技术对社会发展与进步的巨大贡献。
(1)基态N原子,核外电子的运动状态有_______种,能量最高的电子的电子云在空间有_______个伸展方向,原子轨道呈_______形。
(2)我国科研人员研制出了“Fe-LiH”催化剂,使得合成氨温度和压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①第三电离能(Fe)_______(Mn)(填“>”或“<”),原因是_______。
②比较与的半径大小关系:_______(填“>”或“<”)。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化,将转化为,反应过程如图所示:
①产物中N原子的杂化轨道类型为_______。
②原子数和价电子数相同的微粒(分子、离子或基团)互为等电体,写出一种与互为等电子体的分子_______(填化学式)。
16.根据所学内容填空:
(1)有下列物质:①HF、②、③、④、⑤、⑥,其中属于极性分子的是_______(填序号,下同),既有键又有键的是_______。
(2)下列分子中,空间构型为正四面体且键角为的是_______。
a.
b.
c.
d.
e.
f.
(3)、、、的气态分子中,中心原子价层电子对数不同于其他分子的是_______。
(4)丙烯晴分子()中碳原子杂化轨道类型为_______。
(5)ⅥA族元素氧、硫、硒()的化合物在研究和生产中有许多重要用途。
①离子的空间构型为_______。
②如图所示,每条折线表示周期表ⅣA—ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______(化学式)。
17.当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)用合成燃料甲醇()是碳减排的新方向,可能涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
则:反应Ⅲ的=___________
(2)绝热恒容的条件下,向密闭容器通入和进行反应,若只进行反应Ⅱ:,下面能说明反应已达到平衡状态的是___________;
A.
B.容器内压强不变
C.单位时间内每形成1molH—H键,同时形成2molO—H键
D.容器内的值保持不变
(3)某温度下的密闭容器中,充入1mol和3mol,发生反应Ⅰ:。现测得和的浓度随时间变化如下图所示。
从反应开始到4min时,氢气的平均反应速率=___________;平衡时,的转化率为___________。
(4)光催化技术具有高效、节能的优点,利用钛酸锶光催化还原有利于实现“碳中和”,其原理如图2所示,写出铂电极的电极反应式___________。当有2mol___________(填“从右向左”或“从左向右”)迁移时,电池左侧生成的氧气在标况下的体积为___________。
三、实验题
18.工业生产上从电解精炼铜的阳极泥中获得金、硒和胆矾的工艺流程如图所示。已知阳极泥中含有Au、、FeS、、等不反应的杂质。回答下列问题:
(1)焙烧时需要将阳极泥洪干并粉醉成粉末,粉碎成粉末的目的是_______。
(2)将焙烧产生的烟气通入冷水中可制得Se,说明具有_______性。
(3)已知焙烧的烧碴中主要含有Au、、和,写出浸铜过程中溶解的离子方程式_______。
(4)浸铜液调pH值的目的是_______,调pH值加入的物质可以是_______,操作①的操作过程是蒸发浓缩、_______过滤、洗涤、干燥。
(5)浸金液中含有,用亚硫酸钠还原可制取Au,写出该反应的离子方程式_______。
参考答案
1.答案:C
解析:
A.泡利原理:一个轨道里最多只能容纳两个电子且电旋方向相反这个原理称为泡利原理,洪特规则:当电子排布在同一能级的不同轨道时总是优先单独占据一个轨道,而且自旋方向相同,则该排布图不符合洪特规则,A错误;
B.s轨道为球形,B错误;
C.Fe为26号元素,价层电子排布为,C正确;
D.Led灯的作用是激发电子由低能态转变成高能态,当高能态返回低能态时,多余的能量可能就会以光等形式释放,D错误;
故答案为:C。
2.答案:B
解析:
A.写中价层电子对个数且含有一个孤电子对,所以VSEPR模型为四面体结构,实际为三角锥形结构,故A错误;
B.中价层电子对个数且不含孤电子对,所以离子的VSEPR模型与离子的空间立体构型一致都是正四面体结构,故B正确;
C.中价层电子对个数且含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V形,故C错误;
D.中价层电子对且含有一个孤电子对,所以VSEPR模型是四面体结构,实际空间构型为三角锥形,故D错误;
故选:B。
3.答案:B
解析:
A.同一周期元素的原子,从左到右,最高价氧化物对应水化物的碱的碱性逐渐减弱,所以碱性:,故A正确;
B.同一周期元素的原子,从左到右,原子半径逐渐减小,所以原子半径:ClC.同一主族元素,从上到下,金属性逐渐增强,则金属性:K>Na,故C正确;
D.同主族元素的原子,从下到上,得电子能力逐渐增强,气态氢化物稳定性逐渐增强,所以稳定性:,故D正确;
故选B。
4.答案:C
解析:
A.反应中F的化合价由0价转化为-1价,0的化合价由-2价变为+2价,转移电子数,若消耗44.8L(标准状况)即,故转移的电子数为,A正确;
B.根据反应,每消耗2mol生成的NaF质量为,B正确;
C.根据反应,可知反应生成的氧化产物为,每消耗2mol生成的氧化产物为,C错误;
D.根据反应可知,每消耗2mol生成的物质的量为2mol,又知1个中含孤电子对,即生成的含有孤电子对数为2,D正确;
故答案为C。
5.答案:A
解析:
A.分子中价层电子对个数,采用即杂化:且含2个孤电子对,所以其空间构型是V型结构,分子中价层电子对个数,采用sp杂化,且不含孤电子对,所以其空间构型为直线型结构,故A错误;
B.:分子中价层电子对个数,采用sp杂化,且不含有孤电子对,所以其空间构型为直线形结构,分子中价层电子对个数,采用杂化,且含有1个弧电子对,所以其空间构型为V形结构,故B错误
C.分子中价层电子对个数,采用杂化,且不含孤电子对,所以其空间构型为平面三角形结构,分子中价层电子对个数,采用杂化,且含1个孤电子对,所以其空间构型为三角锥形结构,故C错误;
D.分子中价;;层电子对个数,采用杂化,且不含有孤电子对,所以其空间构型为平面三角形结构,中价层电子对个数,采用杂化,且不含孤电子对,所以其空间构型为平面三角形结构,故D正确;
答案为D。
6.答案:C
解析:
ClCH=CHCl中,每个C原子含有3个键和1个π键,所以价层电子对个数是3,采用杂化,Cl原子中未成对电子为3p电子,所以C-Cl键采用的成键轨道是。
故选:C。
7.答案:A
解析:
A.该分子中含有键15个,双键中含有1个π键,π键数目为4个,键与π键数目之比为15:4,故A错误;
B.该物质结构简式为,化学式为,故B正确;
C.C-N的键长比的键长长,键能小,故该分子中C-N键的键能小于键的键能,故C正确;
D.同周期原子从左到右第一电离能依次增大,N的价电子是半充满状态能量低稳定,第ⅤA族的N第一电离能大于ⅥA族的O, N、O、的第一电离能由大到小的顺序为F>N>O,故D正确;
故答案为A。
8.答案:C
解析:
由图可知,a只有-2价,a为O元素;c的最高价为+6价,e为S元素;结合原子序数可知,b、c、d均为第三周期元素,b为+1价、c为+3价、d为+5价,则b为Na元素、c为Al元素、d为P元素,以此来解答。
A.和属于不同核素,质子数均为8,中子数不同,故A错误;
B.同周期主族元素原子序数增大,电负性增大,则电负性:PC.P的3p电子半满为较稳定结构,其第一电离能大于相邻元素的第一电离能,则第一电离能:P>S,故C正确;
D.溶于水生成NaOH,NaOH电离使溶液导电,熔融状态下氧化钠可发生电离而导电,则氧化钠属于电解质,因果关系不合理,故D错误;
故选:C。
9.答案:C
解析:
同周期主族元素从左到右原子半径依次减小,即,A错误;
分子间形成了氢键,故的沸点比的沸点高,B错误;
MgO为离子化合物,C正确;
是强酸,D错误。
10.答案:D
解析:
11.答案:B
解析:
A.CO与属于等电子体结构相似,CO与的价电子总数相等为14,故A正确;
B.根据氮气分子结构知,一个CO分子中含有2个π键,根据表中键能知,CO中第一个π键的键能是,中第一个π键的键能是,CO中第一个π键的键能较小,所以CO的第一个π键比更容易断,所以一氧化碳比氮气活泼,故B错误;
C.一氧化碳和氮气形成晶体为分子晶体,分子间作用力越大,沸点越高,由表1可知,CO的熔沸点高于,是因为CO分子间作用力大于,故C正确;
D.水是极性溶剂,氮气为非极性分子,一氧化碳为极性分子,由表1可知,室温时,CO在水中的溶解性大于,是因为CO分子有弱极性,故D正确;
故选:B。
12.答案:D
解析:
由题干信息可知,X、Y、X、W、E为原子序数依次增大的短周期主族元素,其中X只有a能级上有电子且形成共价键,则X为H,W的电子排布式中有三对成对电子且W周围形成2个共价键,则W为O,Y形成4个共价键,Z形成3个共价键,E形成5个共价键,E原子的电子总数为价层电子数三倍,则Y为C,Z为N,E为P,据此分析解题。
A.由分析可知,X为H、Y为C、Z为N,根据同一周期从左往右原子半径依次减小可知,X、Y、Z三种元素中原子半径最大的是C即Y,A错误;
B.由分析可知,Y为C、Z为N、W为O,O没有最高正价,故Y、Z、W的最高正价Z>Y,B错误;
C.由分析可知,X为H、Y为C、Z为N、W为O、E为P,结合题干物质结构式可知,H、P未达到8电子稳定结构,其余原子C、N、O最外层均达到8电子稳定结构,C错误;
D.由分析可知,Z为N、E为P,系同一主族元素,从上往下单质的氧化性依次减弱,则对应简单氢化物的还原性依次增强,即Z、E简单氢化物的还原性即Z故答案为:D。
13.答案:C
解析:
14.答案:B
解析:
15.答案:(1)①7;②三;③哑铃
(2)①<
②铁元素失去的第三个电子是上的电子,而容易失去一个电子形成比较稳定的半满状态,而Mn的价电子排布式为,失去的第三个电子是上的电子,这是比较稳定的半充满状态,所以难失去
③<
(3)①杂化
②
解析:
(1)已知N是7号元素,根据鲍利原理可知,原子核外没有运动状态完全相同的电子,故基态N原子,核外电子的运动状态有7种,其基态原子核外电子排布式为:,则其能量最高的电子在2p能级上,p能级的电子云在空间有三个伸展方向,原子轨道呈哑铃形,故答案为:7;三;哑铃。
(2)①铁元素失去的第三个电子是上的电子,而容易失去一个电子形成比较稳定的半满状态,而Mn的价电子排布式为,失去的第三个电子是上的电子,这是比较稳定的半充满状态,所以难失去,故第三电离能,故答案为:<;铁元素失去的第三个电子是上的电子,而容易失去一个电子形成比较稳定的半满状态,而Mn的价电子排布式为,失去的第三个电子是上的电子,这是比较稳定的半充满状态,所以难失去;
②与具有相同的电子层数,原子序数越小,离子半径越大,则离子半径:,故答案为:<;
(3)①由结构简式可知,产物中氨原子的价层电子对数为4,原子的杂化方式为杂化,故答案为:杂化;
②水分子和氨基阴离子的原子个数都为3、价电子数都为8,互为等电子体,故答案为:。
16.答案:(1)①③;⑥
(2)be
(3)
(4)sp、
(5)①正四面体形
②
解析:
(1)①HF为A-B型双原子分子,属于极性分子,②为A-A型双原子分子,属于非极性分子,③为V形,属于极性分子,④为正四面体形,属于非极性分子,⑤为平面三角形,属于非极性分子,⑥为直线形,属于非极性分子,所以属于极性分子的是①③,既有键又有π键的必须含有双键或三键,结构为O=C=O,符合题意,故答案为:①③;⑥;
(2)空间构型为正四面体且键角为的是或类似CH4具有组成的物质,如、、、等,故答案为:be;
(3)中中心原子价层电子对数,中中心原子价层电子对数,中中心原子价层电子对数,中心原子价层电子对数,所以中心原子价层电子对数不同于其他分子的是,故答案为:;
(4)丙烯腈分子()中双键碳原子的键数均为3,孤电子对数为0,价层电子对数为3+0=3,碳原子杂化轨道类型均为杂化,三键碳原子的键数为2,孤电子对数为0,价层电子对数为2+0=2,碳原子杂化轨道类型均为sp杂化,故答案为:sp、;
(5)①离子中中心原子周围的价层电子对数,根据价层电子对互斥理论可知,其空间构型为正四面体形,故答案为:正四面体形;
②如图所示,每条折线表示周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点所在的折线没有沸点反常的物质,即为第ⅣA族元素的氢化物,根据结构与组成的物质,相对分子质量越大,熔沸点越高可知,a点代表的是,故答案为:。
17.答案:(1)-90.8
(2)BC
(3)①
②75%
(4)①
②从左向右
③11.2L
解析:
18.答案:(1)增大与氧气的接触面积,加快焙烧的速率
(2)氧化
(3)
(4)①除去
②CuO、、
③蒸发浓缩,冷却结晶
(5)
解析:
阳极泥中含有Au、、FeS、、等杂质,阳极泥焙烧后生成、,、和水反应生成Se;焙烧后的烧渣加酸、双氧水进行浸铜后得浸铜渣和浸铜液,浸铜渣加入、HCl得到浸金液,再加入,还原得到Au;浸铜液中含有铁离子杂质,通过调节溶液pH,将铁离子转化为氢氧化铁沉淀出去,继而进行蒸发浓缩,冷却结晶,过滤一系列步骤制得胆矾,据此分析解题。
(1)增大反应物之间的接触面积可提高反应速率,故粉碎成粉末的目的是增大与氧气的接面积,加快焙烧的速率,故答案为:增大与氧气的接触面积,加快焙烧的速率;
(2)焙烧产生的烟气通入冷水中可制得Se,的化合价降低,说明具有氧化性,故答案为:氧化;
(3)浸铜过程中溶解的离子方程式为:,故答案为:
(4)浸铜液调pH值的目的是除去,调pH值加入的物质可以是CuO、、,等,操作①的操作过程是蒸发浓缩,冷却结晶,故答案为:除去;CuO、、;蒸发浓缩,冷却结晶;
(5)用亚硫酸钠还原制取金的离子方程式为:,故答案为:。
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列有关原子结构相关内容表述正确的是( )
A.电子排布图,不满足泡利原则
B.s轨道的形状为哑铃形
C.Fe(26号元素)原子的价层电子排布式为
D.LED灯的发光是因为核外电子从基态到激发态以光的形式释放能量
2.下列离子的VSEPR模型与离子的空间立体构型一致的是( )
A. B. C. D.
3.下列各组性质的比较中,不正确的是( )
A.碱性:NaOH> B.原子半径:Cl>S
C.金属性:K>Na D.热稳定性:>
4.已知反应:,为阿伏伽德罗常数的值,若消耗(标准状况),下列叙述错误的是( )
A.转移的电子数为 B.生成的质量为
C.乙生成的氧化产物分子数为 D.生成的含有孤电子对数为
5.元素周期表中元素“钴”的方格中注明“”,由此可以推断( )
A.元素钴是一种过渡元素
B.它的基态原子价电子排布式为
C.的电子排布式为
D.它位于元素周期表的第四周期第ⅧB族
6.在分子中,C—Cl键采用的成键轨道是( )
A.sp-p B. C. D.
7.法匹拉韦是治疗新冠肺炎的一种药物,其结构简式如图所示。下列说法不正确的是( )
A.该分子中键与π键数目之比为14:4
B.该分子的化学式为
C.该分子中C-N键的键能小于C=N键的键能
D.该分子中N、O、F的第一电离能由大到小的顺序为F>N>O
8.如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是( )
A.和属于同种核素 B.电负性:
C.第一电离能: D.因为溶于水导电,所以是电解质
9.为短周期主族元素,原子序数依次增大,最外层电子数之和为19。Y的最外层电子数与其K层电子数相等,是形成酸雨的物质之一。下列说法正确的是( )
A.原子半径: B.简单氢化物的沸点:
C.Y与X可形成离子化合物 D.Z的最高价含氧酸是弱酸
10.几种短周期元素的原子半径及主要化合价如下表:
元素代号 X Y Z W
原子半径/ 160 143 70 66
主要化合价 、、
下列叙述正确的是( )
A.X、Y元素的金属性:
B.Y的氧化物是碱性氧化物
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,Y单质可以与Z的最高价氧化物对应的水化物反应
11.下面两表分别列出了CO和的某些性质及相关键能,有关说法不正确的是( )
表1
分子 熔点/℃ 沸点/℃ 常温时在水中溶解度
CO -205.05 -191.49 2.3mL
-210.00 -195.81 1.6mL
表2
CO C-O C=O
键能() 357.7 798.9 1071.9
N-N N=N
键能() 193 418 946
A.CO与的价电子总数相等
B.由表2可知,CO的活泼性不及
C.由表1可知,CO的熔沸点高于,是因为CO分子间作用力大于
D.由表1可知,室温时,CO在水中的溶解性大于,是因为CO分子有弱极性
12.草甘膦,是一种有机膦类除草剂,其结构式如图。其中X、Y、X、W、E为原子序数依次增大的短周期主族元素。其中X只有s能级上有电子,E原子的电子总数为价层电子数三倍,W的电子排布式中有三对成对电子。下列说法正确的是( )
A.X、Y、Z三种元素中原子半径最大的是Z
B.Y、Z、W的最高正价
C.X、Y、Z、W、E最外层均达到8电子稳定结构
D.Z、E简单氢化物的还原性,Z<E
13.是主要大气污染物,利用反应消除污染的电化学装置如图所示。下列说法错误的是( )
A.外电路的电流方向为b→a
B.b极电极反应为:
C.若离子交换膜为阴离子交换膜,则左池NaOH溶液浓度将增大
D.电路中转移4mol电子时理论上可消除标准状况下1mol的污染
14.25℃时,用盐酸滴定某一元碱MOH溶液所得滴定曲线如图所示。下列说法正确的是( )
A.MOH为一元强碱
B.a点对应溶液中:
C.滴定过程中水的电离程度最大的是b点
D.c点对应溶液中:
二、填空题
15.合成氨有助于解决地球上粮食不足问题,是化学和技术对社会发展与进步的巨大贡献。
(1)基态N原子,核外电子的运动状态有_______种,能量最高的电子的电子云在空间有_______个伸展方向,原子轨道呈_______形。
(2)我国科研人员研制出了“Fe-LiH”催化剂,使得合成氨温度和压强分别降到了350℃、1MPa,这是近年来合成氨反应研究中的重要突破。
①第三电离能(Fe)_______(Mn)(填“>”或“<”),原因是_______。
②比较与的半径大小关系:_______(填“>”或“<”)。
(3)科学家近期合成了一种固氮酶模型配合物,该物质可以在温和条件下直接活化,将转化为,反应过程如图所示:
①产物中N原子的杂化轨道类型为_______。
②原子数和价电子数相同的微粒(分子、离子或基团)互为等电体,写出一种与互为等电子体的分子_______(填化学式)。
16.根据所学内容填空:
(1)有下列物质:①HF、②、③、④、⑤、⑥,其中属于极性分子的是_______(填序号,下同),既有键又有键的是_______。
(2)下列分子中,空间构型为正四面体且键角为的是_______。
a.
b.
c.
d.
e.
f.
(3)、、、的气态分子中,中心原子价层电子对数不同于其他分子的是_______。
(4)丙烯晴分子()中碳原子杂化轨道类型为_______。
(5)ⅥA族元素氧、硫、硒()的化合物在研究和生产中有许多重要用途。
①离子的空间构型为_______。
②如图所示,每条折线表示周期表ⅣA—ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是_______(化学式)。
17.当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
(1)用合成燃料甲醇()是碳减排的新方向,可能涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
则:反应Ⅲ的=___________
(2)绝热恒容的条件下,向密闭容器通入和进行反应,若只进行反应Ⅱ:,下面能说明反应已达到平衡状态的是___________;
A.
B.容器内压强不变
C.单位时间内每形成1molH—H键,同时形成2molO—H键
D.容器内的值保持不变
(3)某温度下的密闭容器中,充入1mol和3mol,发生反应Ⅰ:。现测得和的浓度随时间变化如下图所示。
从反应开始到4min时,氢气的平均反应速率=___________;平衡时,的转化率为___________。
(4)光催化技术具有高效、节能的优点,利用钛酸锶光催化还原有利于实现“碳中和”,其原理如图2所示,写出铂电极的电极反应式___________。当有2mol___________(填“从右向左”或“从左向右”)迁移时,电池左侧生成的氧气在标况下的体积为___________。
三、实验题
18.工业生产上从电解精炼铜的阳极泥中获得金、硒和胆矾的工艺流程如图所示。已知阳极泥中含有Au、、FeS、、等不反应的杂质。回答下列问题:
(1)焙烧时需要将阳极泥洪干并粉醉成粉末,粉碎成粉末的目的是_______。
(2)将焙烧产生的烟气通入冷水中可制得Se,说明具有_______性。
(3)已知焙烧的烧碴中主要含有Au、、和,写出浸铜过程中溶解的离子方程式_______。
(4)浸铜液调pH值的目的是_______,调pH值加入的物质可以是_______,操作①的操作过程是蒸发浓缩、_______过滤、洗涤、干燥。
(5)浸金液中含有,用亚硫酸钠还原可制取Au,写出该反应的离子方程式_______。
参考答案
1.答案:C
解析:
A.泡利原理:一个轨道里最多只能容纳两个电子且电旋方向相反这个原理称为泡利原理,洪特规则:当电子排布在同一能级的不同轨道时总是优先单独占据一个轨道,而且自旋方向相同,则该排布图不符合洪特规则,A错误;
B.s轨道为球形,B错误;
C.Fe为26号元素,价层电子排布为,C正确;
D.Led灯的作用是激发电子由低能态转变成高能态,当高能态返回低能态时,多余的能量可能就会以光等形式释放,D错误;
故答案为:C。
2.答案:B
解析:
A.写中价层电子对个数且含有一个孤电子对,所以VSEPR模型为四面体结构,实际为三角锥形结构,故A错误;
B.中价层电子对个数且不含孤电子对,所以离子的VSEPR模型与离子的空间立体构型一致都是正四面体结构,故B正确;
C.中价层电子对个数且含有一个孤电子对,所以其VSEPR模型是平面三角形,实际上是V形,故C错误;
D.中价层电子对且含有一个孤电子对,所以VSEPR模型是四面体结构,实际空间构型为三角锥形,故D错误;
故选:B。
3.答案:B
解析:
A.同一周期元素的原子,从左到右,最高价氧化物对应水化物的碱的碱性逐渐减弱,所以碱性:,故A正确;
B.同一周期元素的原子,从左到右,原子半径逐渐减小,所以原子半径:Cl
D.同主族元素的原子,从下到上,得电子能力逐渐增强,气态氢化物稳定性逐渐增强,所以稳定性:,故D正确;
故选B。
4.答案:C
解析:
A.反应中F的化合价由0价转化为-1价,0的化合价由-2价变为+2价,转移电子数,若消耗44.8L(标准状况)即,故转移的电子数为,A正确;
B.根据反应,每消耗2mol生成的NaF质量为,B正确;
C.根据反应,可知反应生成的氧化产物为,每消耗2mol生成的氧化产物为,C错误;
D.根据反应可知,每消耗2mol生成的物质的量为2mol,又知1个中含孤电子对,即生成的含有孤电子对数为2,D正确;
故答案为C。
5.答案:A
解析:
A.分子中价层电子对个数,采用即杂化:且含2个孤电子对,所以其空间构型是V型结构,分子中价层电子对个数,采用sp杂化,且不含孤电子对,所以其空间构型为直线型结构,故A错误;
B.:分子中价层电子对个数,采用sp杂化,且不含有孤电子对,所以其空间构型为直线形结构,分子中价层电子对个数,采用杂化,且含有1个弧电子对,所以其空间构型为V形结构,故B错误
C.分子中价层电子对个数,采用杂化,且不含孤电子对,所以其空间构型为平面三角形结构,分子中价层电子对个数,采用杂化,且含1个孤电子对,所以其空间构型为三角锥形结构,故C错误;
D.分子中价;;层电子对个数,采用杂化,且不含有孤电子对,所以其空间构型为平面三角形结构,中价层电子对个数,采用杂化,且不含孤电子对,所以其空间构型为平面三角形结构,故D正确;
答案为D。
6.答案:C
解析:
ClCH=CHCl中,每个C原子含有3个键和1个π键,所以价层电子对个数是3,采用杂化,Cl原子中未成对电子为3p电子,所以C-Cl键采用的成键轨道是。
故选:C。
7.答案:A
解析:
A.该分子中含有键15个,双键中含有1个π键,π键数目为4个,键与π键数目之比为15:4,故A错误;
B.该物质结构简式为,化学式为,故B正确;
C.C-N的键长比的键长长,键能小,故该分子中C-N键的键能小于键的键能,故C正确;
D.同周期原子从左到右第一电离能依次增大,N的价电子是半充满状态能量低稳定,第ⅤA族的N第一电离能大于ⅥA族的O, N、O、的第一电离能由大到小的顺序为F>N>O,故D正确;
故答案为A。
8.答案:C
解析:
由图可知,a只有-2价,a为O元素;c的最高价为+6价,e为S元素;结合原子序数可知,b、c、d均为第三周期元素,b为+1价、c为+3价、d为+5价,则b为Na元素、c为Al元素、d为P元素,以此来解答。
A.和属于不同核素,质子数均为8,中子数不同,故A错误;
B.同周期主族元素原子序数增大,电负性增大,则电负性:P
D.溶于水生成NaOH,NaOH电离使溶液导电,熔融状态下氧化钠可发生电离而导电,则氧化钠属于电解质,因果关系不合理,故D错误;
故选:C。
9.答案:C
解析:
同周期主族元素从左到右原子半径依次减小,即,A错误;
分子间形成了氢键,故的沸点比的沸点高,B错误;
MgO为离子化合物,C正确;
是强酸,D错误。
10.答案:D
解析:
11.答案:B
解析:
A.CO与属于等电子体结构相似,CO与的价电子总数相等为14,故A正确;
B.根据氮气分子结构知,一个CO分子中含有2个π键,根据表中键能知,CO中第一个π键的键能是,中第一个π键的键能是,CO中第一个π键的键能较小,所以CO的第一个π键比更容易断,所以一氧化碳比氮气活泼,故B错误;
C.一氧化碳和氮气形成晶体为分子晶体,分子间作用力越大,沸点越高,由表1可知,CO的熔沸点高于,是因为CO分子间作用力大于,故C正确;
D.水是极性溶剂,氮气为非极性分子,一氧化碳为极性分子,由表1可知,室温时,CO在水中的溶解性大于,是因为CO分子有弱极性,故D正确;
故选:B。
12.答案:D
解析:
由题干信息可知,X、Y、X、W、E为原子序数依次增大的短周期主族元素,其中X只有a能级上有电子且形成共价键,则X为H,W的电子排布式中有三对成对电子且W周围形成2个共价键,则W为O,Y形成4个共价键,Z形成3个共价键,E形成5个共价键,E原子的电子总数为价层电子数三倍,则Y为C,Z为N,E为P,据此分析解题。
A.由分析可知,X为H、Y为C、Z为N,根据同一周期从左往右原子半径依次减小可知,X、Y、Z三种元素中原子半径最大的是C即Y,A错误;
B.由分析可知,Y为C、Z为N、W为O,O没有最高正价,故Y、Z、W的最高正价Z>Y,B错误;
C.由分析可知,X为H、Y为C、Z为N、W为O、E为P,结合题干物质结构式可知,H、P未达到8电子稳定结构,其余原子C、N、O最外层均达到8电子稳定结构,C错误;
D.由分析可知,Z为N、E为P,系同一主族元素,从上往下单质的氧化性依次减弱,则对应简单氢化物的还原性依次增强,即Z、E简单氢化物的还原性即Z
13.答案:C
解析:
14.答案:B
解析:
15.答案:(1)①7;②三;③哑铃
(2)①<
②铁元素失去的第三个电子是上的电子,而容易失去一个电子形成比较稳定的半满状态,而Mn的价电子排布式为,失去的第三个电子是上的电子,这是比较稳定的半充满状态,所以难失去
③<
(3)①杂化
②
解析:
(1)已知N是7号元素,根据鲍利原理可知,原子核外没有运动状态完全相同的电子,故基态N原子,核外电子的运动状态有7种,其基态原子核外电子排布式为:,则其能量最高的电子在2p能级上,p能级的电子云在空间有三个伸展方向,原子轨道呈哑铃形,故答案为:7;三;哑铃。
(2)①铁元素失去的第三个电子是上的电子,而容易失去一个电子形成比较稳定的半满状态,而Mn的价电子排布式为,失去的第三个电子是上的电子,这是比较稳定的半充满状态,所以难失去,故第三电离能,故答案为:<;铁元素失去的第三个电子是上的电子,而容易失去一个电子形成比较稳定的半满状态,而Mn的价电子排布式为,失去的第三个电子是上的电子,这是比较稳定的半充满状态,所以难失去;
②与具有相同的电子层数,原子序数越小,离子半径越大,则离子半径:,故答案为:<;
(3)①由结构简式可知,产物中氨原子的价层电子对数为4,原子的杂化方式为杂化,故答案为:杂化;
②水分子和氨基阴离子的原子个数都为3、价电子数都为8,互为等电子体,故答案为:。
16.答案:(1)①③;⑥
(2)be
(3)
(4)sp、
(5)①正四面体形
②
解析:
(1)①HF为A-B型双原子分子,属于极性分子,②为A-A型双原子分子,属于非极性分子,③为V形,属于极性分子,④为正四面体形,属于非极性分子,⑤为平面三角形,属于非极性分子,⑥为直线形,属于非极性分子,所以属于极性分子的是①③,既有键又有π键的必须含有双键或三键,结构为O=C=O,符合题意,故答案为:①③;⑥;
(2)空间构型为正四面体且键角为的是或类似CH4具有组成的物质,如、、、等,故答案为:be;
(3)中中心原子价层电子对数,中中心原子价层电子对数,中中心原子价层电子对数,中心原子价层电子对数,所以中心原子价层电子对数不同于其他分子的是,故答案为:;
(4)丙烯腈分子()中双键碳原子的键数均为3,孤电子对数为0,价层电子对数为3+0=3,碳原子杂化轨道类型均为杂化,三键碳原子的键数为2,孤电子对数为0,价层电子对数为2+0=2,碳原子杂化轨道类型均为sp杂化,故答案为:sp、;
(5)①离子中中心原子周围的价层电子对数,根据价层电子对互斥理论可知,其空间构型为正四面体形,故答案为:正四面体形;
②如图所示,每条折线表示周期表ⅣA~ⅦA族中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点所在的折线没有沸点反常的物质,即为第ⅣA族元素的氢化物,根据结构与组成的物质,相对分子质量越大,熔沸点越高可知,a点代表的是,故答案为:。
17.答案:(1)-90.8
(2)BC
(3)①
②75%
(4)①
②从左向右
③11.2L
解析:
18.答案:(1)增大与氧气的接触面积,加快焙烧的速率
(2)氧化
(3)
(4)①除去
②CuO、、
③蒸发浓缩,冷却结晶
(5)
解析:
阳极泥中含有Au、、FeS、、等杂质,阳极泥焙烧后生成、,、和水反应生成Se;焙烧后的烧渣加酸、双氧水进行浸铜后得浸铜渣和浸铜液,浸铜渣加入、HCl得到浸金液,再加入,还原得到Au;浸铜液中含有铁离子杂质,通过调节溶液pH,将铁离子转化为氢氧化铁沉淀出去,继而进行蒸发浓缩,冷却结晶,过滤一系列步骤制得胆矾,据此分析解题。
(1)增大反应物之间的接触面积可提高反应速率,故粉碎成粉末的目的是增大与氧气的接面积,加快焙烧的速率,故答案为:增大与氧气的接触面积,加快焙烧的速率;
(2)焙烧产生的烟气通入冷水中可制得Se,的化合价降低,说明具有氧化性,故答案为:氧化;
(3)浸铜过程中溶解的离子方程式为:,故答案为:
(4)浸铜液调pH值的目的是除去,调pH值加入的物质可以是CuO、、,等,操作①的操作过程是蒸发浓缩,冷却结晶,故答案为:除去;CuO、、;蒸发浓缩,冷却结晶;
(5)用亚硫酸钠还原制取金的离子方程式为:,故答案为:。
同课章节目录
