2024年中考化学二轮复习专题:计算题(含解析)
文档属性
| 名称 | 2024年中考化学二轮复习专题:计算题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 354.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-14 22:20:15 | ||
图片预览



文档简介
2024年中考化学二轮复习专题:计算题
1.某保健食品主要成分为碳酸钙,请完成下列问题:
(1)碳酸钙的化学式为CaCO3,它是由 种元素组成的,其相对分子质量为 。
(2)计算碳酸钙中钙、碳、氧元素的质量比。(写出计算过程,下同)
(3)碳酸钙中钙元素的质量分数是多少?
2.将干燥、纯净的氯酸钾和二氧化锰的混合物15g装入大试管中,加热制取氧气。待完全反应后,将试管冷却、称量,得到10.2g固体物质。
(1)制得氧气 g.
(2)混合物中二氧化锰是多少g?(写出具体的计算步骤)
3.为测定某MgSO4溶液中溶质的质量分数,某化学兴趣小组同学取MgSO4溶液100g,向其中加入一定溶质质量分数的NaOH溶液80g,二者恰好完全反应生成沉淀5.8g。计算该MgSO4溶液中溶质的质量分数。
4.晓燕同学查阅资料获悉,正常成年人每分钟大约需要吸入氧气。已知在标准状况下氧气密度约为,空气密度氧气的体积含量按计算
请问:
(1)在标准状况下,正常成年人每分钟需要空气的质量为多少克?请写出计算过程
(2)容积为的集气瓶内有的水,用该瓶去收集纯净的氧气所得到的瓶内氧气的体积分数为 用百分数表示。
5.为测定某种贝壳中碳酸钙的含量,取12.5g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示。(已知杂质不参与反应也不溶于水)。
请计算:
(1)这种贝壳中碳酸钙的质量分数 。
(2)12.5g贝壳与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数 (写出计算过程)。
6.为了测定金属镁样品中镁的质量分数(杂质不含镁元素,不溶于水,也不与其它物质发生反应),用一稀盐酸进行了如下实验;
请回答下列问题:
(1)搅拌的目的是 ;
(2)C中固液混合物的质量是 ;
(3)计算镁样品中镁的质量分数 。
7.尿素(CO(NH2)2)是氮肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。计算:
(1)一个尿素分子中共含有几个原子?
(2)计算含氮元素56kg的尿素的质量。(写出计算过程)
8.过氧化钠(Na2O2)能与二氧化碳反应产生氧气,因此可用于呼吸面具或潜水艇中作为氧气的来源。现有2g过氧化钠样品(杂质不参加反应),与一定量的二氧化碳完全反应,生成气体质量与时间的关系如图所示,发生反应的化学方程式为2Na2O3+2CO2═2Na2CO3+O2。请计算:
(1)生成氧气的质量是 g。
(2)样品中过氧化钠的质量。
9.“液态阳光”技术可助力中国完成碳达峰、碳中和目标。2020年1月,“液态阳光”示范项目投料试车,该项目若满负荷运行,每年可生产甲醇1500t,计算理论上每年可减排二氧化碳的质量是多少?主要反应为:。
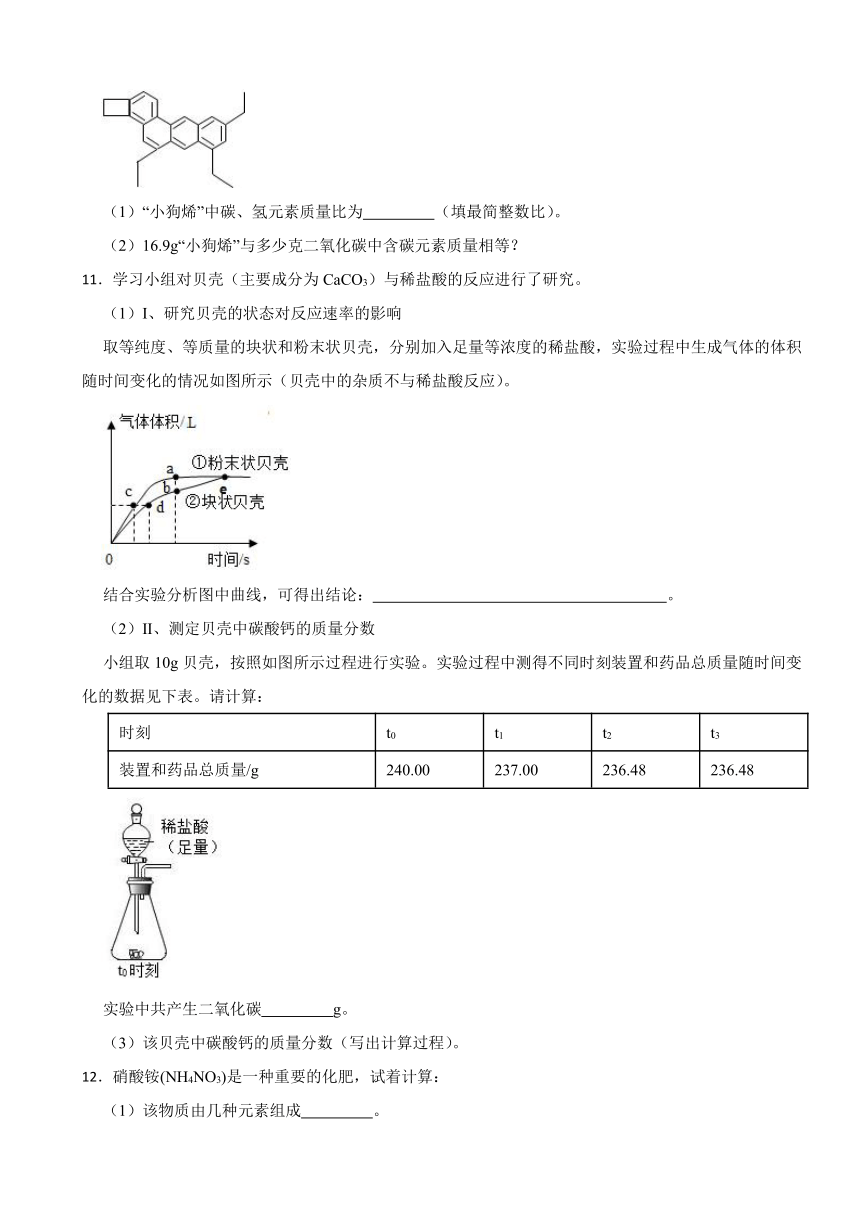
10.化学家将如图所示,分子结构简式像小狗的某物质,取名为“小狗烯”。其化学式为C26H26请计算:
(1)“小狗烯”中碳、氢元素质量比为 (填最简整数比)。
(2)16.9g“小狗烯”与多少克二氧化碳中含碳元素质量相等?
11.学习小组对贝壳(主要成分为CaCO3)与稀盐酸的反应进行了研究。
(1)Ⅰ、研究贝壳的状态对反应速率的影响
取等纯度、等质量的块状和粉末状贝壳,分别加入足量等浓度的稀盐酸,实验过程中生成气体的体积随时间变化的情况如图所示(贝壳中的杂质不与稀盐酸反应)。
结合实验分析图中曲线,可得出结论: 。
(2)Ⅱ、测定贝壳中碳酸钙的质量分数
小组取10g贝壳,按照如图所示过程进行实验。实验过程中测得不同时刻装置和药品总质量随时间变化的数据见下表。请计算:
时刻 t0 t1 t2 t3
装置和药品总质量/g 240.00 237.00 236.48 236.48
实验中共产生二氧化碳 g。
(3)该贝壳中碳酸钙的质量分数(写出计算过程)。
12.硝酸铵(NH4NO3)是一种重要的化肥,试着计算:
(1)该物质由几种元素组成 。
(2)NH4NO3中氮元素和氧元素的质量比 ;
(3)NH4NO3中氮元素的质量分数 。
13.医学上常用双氧水(过氧化氢和水的混合物)来清洗伤口和局部抗菌。某同学取136.0g医用双氧水放入烧杯中,然后加入4.0g二氧化锰,放在电子秤上,每隔一分钟观察一次并记录,烧杯中的剩余物质质量如下表所示,直到实验结束。
称量时间/min 0 1 2 3 4 5 6
物质质量/g 140.0 138.5 137.5 137.0 136.8 m 136.8
请回答下列问题:
(1)从表格中可知,m的数值是 。
(2)求136.0g该医用双氧水中过氧化氢的质量是多少?(写出计算过程)。
14.为测定所用盐酸的溶质质量分数,某实验小组取50g碳酸钙粉末于锥形瓶(瓶身100g)中,现将146g稀盐酸分4次逐渐加入装有碳酸钙粉末的锥形瓶,充分反应后,稀盐酸、锥形瓶与药品的总质量如图所示:
(1)最终生成气体的质量为 g。
(2)加入第 次稀盐酸时恰好完全反应。
(3)请求出该盐酸的溶质质量分数。
(4)请画出产生气体的质量与加入盐酸的质量的变化曲线图 。
15.现有某铁样品5.6g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如图所示。
(1)则下列结论正确的是 (填序号)。
①恰好完全反应时,一定没有固体剩余
②x的值为0.2
③铁样品中可能含有镁
④M点对应的溶液中含有2种或3种溶质
(2)用含Fe2O360%的赤铁矿石800t,理论上可炼出含铁98%的生铁 吨。
(3)已知某铁的氧化物可表示为FeaOb=xFeO yFe2O3。经测:15.2克的某铁的氧化物中铁元素的质量为11.2克。则x:y= (填最小整数比)。
16.为测定某氯化镁和氯化钠样品(杂质不含镁元素,不溶于水,也不参加反应)中氯化镁的纯度,实验过程及数据记录如下:
(1)实验中发生反应的化学方程式为 ;
(2)列出求解 B→C 样品中参加反应的物质质量(x)的比例式为 ;
(3)配制实验中所用的氢氧化钠溶液,需要氢氧化钠固体的质量为 ,水的体积为 ;
(4)该样品中氯化镁的纯度为 ;
(5)F 所得溶液中溶质的质量分数为 ;
(6) ,经过此流程最多可得到金属镁的质量为 kg。
17.某化学兴趣小组的同学在实验室发现一瓶含有MgCl2和HCl的混合溶液,为确定混合溶液中氯化镁的含量,取4份混合溶液各100g,每份混合溶液中加入一定质量的2%NaOH溶液,得到实验数据如下表所示:
实验编号 ② ③ ③ ④
NaOH溶液质量/g 10.0 20.0 30.0 40.0
Mg(OH)2质量/g 0.116 0.261 0.290 N
(1)实验 (填实验编号)中氯化镁完全反应。N的质量为 g。
(2)计算100g混合溶液中MgCl2这种溶质的质量分数?(写出计算过程)
(3)分析实验数据,在“下图”中,画出往100克混合溶液中逐渐加入2%NaOH溶液质量0~30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值。
18.碳酸氢钠是面点膨松剂的主要成分之一。
小芳同学研究反应2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑中NaHCO3与CO2之间量的关系。
(1)理论计算:1.26gNaHCO3粉末与足量稀硫酸反应,计算生成CO2的质量 (写出计算过程)。
(2)实验分析:小芳用如图装置进行实验,向盛有足量稀硫酸的锥形瓶中加入1.26g NaHCO3粉末,完全反应至不再产生气泡。称取反应前后质量如下表,发现反应前后质量变化值 (填“大于”、“小于”或“等于”)生成CO2质量的理论值,原因可能是 。
反应前 反应后
NaHCO3/g 锥形瓶+稀硫酸/g 锥形瓶+反应后溶液/g
1.26 24.59 25.36
19.将20.0g NaOH、Ca(OH)2、NaCl组成的固体混合物溶于水配成溶液,向混合液中缓慢通入CO2气体(气体的溶解忽略不计),生成沉淀的质量与通入CO2气体的质量关系如图所示,请根据题意回答问题:
已知:Na2CO3+CO2+H2O═2NaHCO3
NaHCO3+NaOH═Na2CO3+H2O
(1)经分析,A点溶液中所含溶质为 (填化学式)。
(2)在B点时,溶液里碳元素均存在于NaHCO3中,若B点后继续通入足量的CO2气体,请将图象补充完整。
(3)该混合物中NaCl的质量分数为多少?(写出计算过程,计算结果精确至0.1%)
20.为了验证氯化钙是不是食盐潮解的原因之一,小张同学做了两个对比实验,分别取10g的氯化钠和10g的氯化钠与氯化钙的混合物,同时放在空气中。一段时间后,氯化钠与氯化钙的混合物潮解了,而纯的氯化钠基本无现象。于是得到了氯化钙是食盐潮解的原因之一、并邀请班上小王同学对10g混合物中氯化钙的含量进行测定,小王同学将小张实验后的那份氯化钠和氯化钙的混合物放在烧杯中,加入一定量的水使固体完全溶解得到溶液的质量为50g,再将30g碳酸钠溶液分三次加入烧杯中,其实验流程及数据如下图所示,请解答下列问题:
(1)小张的实验说明氯化钙具有 性。
(2)上述图示中的X=
(3)10g氯化钠与氯化钙的混合物中氯化钙的质量为多少?(写出计算过程)
21.实验室用二氧化锰与氯酸钾混合加热制取氧气时,有时会闻到刺激性气味,这是因为实验过程中有少量的氯酸钾与二氧化锰反应生成了高锰酸钾、氯气和氧气。
(1)写出上述反应的化学方程式:
(2)若在上述反应中有3mol电子转移,则生成了 mol氯气。
(3)若所得气体在同温同压下对氢气的相对密度是16.0875.则在混合物中,按上述反应的氯酸钾的质量占反应掉的氯酸钾的总质量的 .
22.在我国青海湖地区有一种说法:冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中捞得的Na2CO3会含有少量的NaCl.
某研究性学习小组称取含NaCl的Na2CO3固体25.0g,将其配制成溶液,再向其中逐滴加入足量的7.3%的稀盐酸,使气体完全放出,共收集到8.8g CO2气体.
(1)计算原固体中Na2CO3的质量分数和消耗盐酸的总质量.
(2)下表为研究性学习小组向上述所配制的混合液中分三次逐滴加盐酸后,所记录的部分数据.
经查阅资料知:Na2CO3+HCl=NaCl+NaHCO3 (1)NaHCO3+HCl=NaCl+H2O+CO2↑(2)
已知:反应(1)完全后,反应(2)才开始.
①请完成表格中未填的部分.
实验次序 每次产生的CO2的质量(g)
第一次先逐滴加盐酸100g
第二次再逐滴加盐酸100g 8.8
第三次再逐滴加盐酸100g 0
②根据表中数据在坐标系中画出CO2质量(纵坐标)与所加入盐酸质量(横坐标)的关系图.
答案解析部分
1.【答案】(1)三;100
(2)解:碳酸钙中钙、碳、氧元素的质量比为40:12:(16×3)=10:3:12
(3)解:碳酸钙中钙元素的质量分数是 。
【解析】【解答】(1)碳酸钙是由碳、氢、氧三种元素组成的,其相对分子质量为40+12+16×3=100。
【分析】(1)根据化学式确定物质的组成元素及相对分子质量为分子中各原子的相对原子质量之和分析;
(2)根据元素质量比为相对原子质量×原子个数之比分析;
(3)根据元素质量分数=相对原子质量×原子个数/相对分子质量分析。
2.【答案】(1)4.8
(2)解:设参加反应的氯酸钾的质量为x,
2KClO3 2KCl + 3O2↑
245 96
x 4.8g
x=12.25g
MnO2的质量为15g-12.25g=2.75g。
答:混合物中二氧化锰的质量是2.75g。
【解析】【解答】(1)根据质量守恒定律,固体减少的质量就是生成的氧气的质量,所以制得氧气为:15g-10.2g=4.8g。
【分析】(1)根据质量守恒定律,固体减少的质量就是生成的氧气的质量。
(2)先设未知数,正确写出氯酸钾分解的化学方程式;再找准有关物质,已知量是氧气的质量,未知量是参加反应氯酸钾的质量;列比例式计算。
3.【答案】解:设参加反应的MgSO4质量为x。
x=12g
该MgSO4溶液中溶质的质量分数为: ×100%=12%
答:该MgSO4溶液中溶质的质量分数为12%。
【解析】【分析】化学方程式的计算,关键是根据化学反应方程式找出相关物质的质量关系,利用反应中物质的质量比不变进行列比例式计算,易错点是由质量比算数不正确,所以这一步要仔细检查。
4.【答案】(1)51.6g
(2)80%
【解析】【解答】(1)正常成年人每分钟需要空气的质量=;
(2)用该瓶去收集纯净的氧气所得到的瓶内氧气的体积分数为
【分析】(1)根据氧气的体积算出空气的体积,空气的体积乘以密度就是空气的质量;
(2)集气瓶中150mL,为收集到的氧气的体积,剩余的50mL为空气,空气中氧气的体积为50mL×1/5,为10mL,所以氧气的总体积为160mL,算除瓶中氧气的体积分数为80%。
5.【答案】(1)80%
(2)解:设反应后生成氯化钙的质量为x,生成二氧化碳的质量为y= x=11.1g= y=4.4g反应后溶液的质量=10g+105.4g 4.4g=111g所得溶液中溶质的质量分数=×100%=10% 答:所得溶液中溶质的质量分数为10%。
【解析】【解答】(1)解:贝壳中碳酸钙的质量=12.5g 2.5g=10g
贝壳中碳酸钙的质量分数=×100%=80%
答:贝壳中碳酸钙的质量分数为80%。
【分析】(1)根据图像得出碳素钙的质量,进而计算样品中碳酸钙的质量分数进行分析
(2)根据碳酸钙的质量结合反应的方程式进行分析
6.【答案】(1)让盐酸和镁充分接触,加快反应速率
(2)204.6g
(3)96%
【解析】【解答】(1)搅拌的目的是让盐酸和镁充分接触,加快反应速率;故填:让盐酸和镁充分接触,加快反应速率;(2)由于所加盐酸为同一盐酸,且根据第一次150g稀盐酸完全反应生成氢气为:150g+5g-154.7g=0.3g,所以继续加入50g稀盐酸恰好完全反应,则生成的氢气的质量为0.1g,C中固液混合物的质量是154.7g+50g-0.1g= 204.6g,故填:204.6g;(3)解:设镁样品中镁的质量分数为x,分析实验过程知道共生成氢气0.4g
x=96%
答:样品中镁的质量分数为96%。
【分析】(1)根据反应时搅拌是为了使药品充分接触加快反应分析;
(2)根据有气体生成的反应反应后剩余物质质量为反应前总质量-生成气体质量分析;
(3)根据生成氢气的质量代入方程式中计算镁的质量,从而计算镁的质量分数分析。
7.【答案】(1)解:一个尿素分子是由一个碳原子、一个氧原子、两个氮原子和四个氢原子构成的,故一个尿素分子中共有8个原子。
(2)解:需要尿素的质量为 。
答:含氮元素56kg的尿素的质量为 120kg。
【解析】【解答】(1)(2)根据化合物的质量=该化合物中某元素的质量÷该元素的质量分数,见答案。
【分析】(1)根据化学式的意义分析
(2)根据物质质量等于元素质量除以元素的质量分数分析
8.【答案】(1)0.32
(2)1.56g
【解析】【解答】(1)由图中信息可知,刚好完全反应生成氧气的质量为0.32g;
(2)设该样品中过氧化钠的质量为x,
2Na2O2 +2CO2 = 2Na2CO3 +O2
156 32
x 0.32g
x=1.56g
答:该样品中过氧化钠的质量为1.56g。
【分析】(1)根据图象分析生成氧气的质量;
(2)根据氧气的质量可计算出过氧化钠的质量。
9.【答案】解:设理论上每年可减排二氧化碳的质量为,则:
答:理论上每年可减排二氧化碳的质量是2062.5t。
【解析】【分析】根据化学方程式的计算方法进行分析
10.【答案】(1)12:1
(2)16.9g“小狗烯”中含碳元素的质量为
含有15.6g碳元素,需要二氧化碳的质量为
答:16.9g“小狗烯”与57.2g二氧化碳中含碳元素质量相等。
【解析】【解答】(1)碳、氢元素质量比为(12×26):(1×26)=12:1。
【分析】(1)相对分子质量等于元素的相对原子质量与原子个数的乘积之和。
(2)物质中元素的质量=物质的质量×化学式中该元素的质量分数。
11.【答案】(1)反应的接触面积越大,反应速率越快
(2)3.52
(3)解:设10g贝壳中碳酸钙的质量为x
解得:x=8g
贝壳中碳酸钙的质量分数为:=80%
答:贝壳中碳酸钙的质量分数为80%。
【解析】【解答】(1)等纯度、等质量的贝壳块和贝壳粉末,分别加入足量等浓度的稀盐酸,其他条件一样,只有贝壳的形状不同,从而产生气体体积曲线不同,但是最后生成的气体体积相等,说明只改变了反应的速率,不改变生成气体的质量,故可得出反应的接触面积越大,反应速率越快的结论;
(2)由表中数据可知,t3时刻起,总质量不再减少,由于盐酸是足量的,说明了碳酸钙已完全发生了反应,由质量守恒定律可知,生成的二氧化碳的质量为:240.00g-236.48g=3.52g;
【分析】(1)根据物质接触面积影响反应速率分析;
(2)根据反应后减少质量为生成二氧化碳质量分析;
(3)根据生成二氧化碳质量及方程式中物质间质量关系计算碳酸钙质量分析。
12.【答案】(1)3种
(2)7:12
(3)35%
【解析】【解答】(1)硝酸铵由氮、氢、氧三种元素组成;
(2)NH4NO3中氮元素和氧元素的质量比为氮原子的相对原子质量×氮原子的数目:氧原子的相对原子质量×氧原子的数目=(14×2):(16×3)=7:12
(3)NH4NO3中氮元素的质量分数为:
【分析】(1)化学式中有几种元素符号,物质就含有几种元素。
(2)在化学式中,元素的质量比等于元素的相对原子质量与原子个数的乘积之比。
(3)在化合物中,元素的质量分数=。
13.【答案】(1)136.8
(2)解:生成氧气的质量为:.
设参过氧化氢的质量为.
答:136.0g该医用双氧水中过氧化氢的质量是6.8g。
【解析】【解答】(1)由表格中数据可知,从第4分钟到第6分钟,物质质量没有减少,说明至第4分钟时过氧化氢已经完全反应,反应已经结束,所以第5分钟时,物质质量与第4分钟的相等,故m的值为136.8。
(2)过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气,产生的氧气逸出,所以物质减少的质量即为生成氧气的质量,所以产生氧气的质量为:,过氧化氢的质量可根据反应的化学方程式由氧气的质量求得。
【分析】(1)根据表格中数据可知,从第4分钟到第6分钟,物质质量没有减少,说明至第4分钟时过氧化氢已经完全反应分析。
(2)根据质量守恒定律,物质减少的质量即为生成氧气的质量。
先设未知数,正确写出过氧化氢分解的化学方程式;再找准有关物质,已知量是氧气的质量,未知量是需要过氧化氢的质量;列比例式计算。
14.【答案】(1)3.3
(2)3##三
(3):第1次盐酸反应完全,产生二氧化碳的质量:150g+36.5g-185.4g=1.1g;
设该盐酸的溶质质量分数为x。
答:该盐酸的溶质质量分数为5%
(4)
15.【答案】(1)②
(2)343
(3)2:1
【解析】【解答】(1)根据质量守恒定律,恰好完全反应生成氢气质量=100g×9.8%××100%=0.2g,
反应的化学方程式及其质量关系:
Fe +H2SO4═FeSO4+ H2↑
56 2
5.6g 0.2g
Zn +H2SO4═ZnSO4+ H2↑
65 2
5.6g 0.17g
Mg +H2SO4═MgSO4+ H2↑
24 2
5.6g 0.47g
铁样品中含有杂质生产氢气没有减少,故一定含镁,铜和锌至少含有一种.
① 由分析可知,可能含有铜,故可能有固体剩余,故错误;
② 由分析可知生成氢气0.2g,故x=0.2,正确。
③ 由分析可知,一定含镁,故错误;
④ M点硫酸过量,铁和硫酸生成硫酸 亚铁,镁和硫酸生成硫酸镁,可能含有锌,锌和硫酸生成硫酸锌,故含有三种或四种溶质,故错误;
故答案为:②。
(2)设可炼得铁的质量为x。
Fe2O3 +3CO3CO2+ 2Fe
160 112
800t×60% x
x=336t
理论上可炼出含铁98%的生铁的质量==343t
(3)15.2克的某铁的氧化物中铁的质量为11.2克,
则氧元素的质量=15.2g-11.2g=4g,
则a:b=:=4:5。
则x+2y=4,x+3y=5,
则x=2,y=1,x:y=2:1。
【分析】(1)根据排在氢前面的金属可以置换出酸的氢元素,依据图象中的数据和氢元素守恒即可计算出生成氢气的质量,然后结合金属与硫酸反应的化学方程式分析。
(2)先设未知数,正确写出化学方程式;再找准有关物质,已知量是氧化铁的质量,未知量是生成铁的质量;列比例式计算。
(3)根据15.2克的某铁的氧化物中铁的质量为11.2克,则氧元素的质量为15.2g-11.2g=4g分析。
16.【答案】(1)
(2)
(3)24g;216mL
(4)75%
(5)12.5%
(6)14.4kg
【解析】【解答】(1)实验中是氯化镁和氢氧化钠反应生成氯化钠和氢氧化镁沉淀,反应的化学方程式为 ;
(2)B→C参加反应氢氧化钠的质量=160g 10%,设参加反应氯化镁的质量为x,
;
(3)由题意可知,实验中所用的氢氧化钠溶液质量为160g+80g=240g,需要氢氧化钠固体的质量=240g 10%=24g,水的质量=240g-24g=216g,故水的体积为216mL;
(4)E中只含有一种溶质,即氯化钠,说明240g氢氧化钠溶液已完全反应,参加氢氧化钠的质量=240g 10%=24g,设参加反应氯化镁的质量为a,生成氯化钠的质量为b,生成氢氧化镁的质量为c,由题意得:
a=28.5g,
b=35.1g,
c=17.4g,
根据题意可知,氯化镁和氯化钠样品的质量=138g-100g=38g,该样品中氯化镁的纯度为 ;
(5)根据题意可知,氯化镁和氯化钠样品中未反应杂质的质量=22g-17.4g=4.6g,氯化镁和氯化钠样品中氯化钠的质量=38g-28.5g-4.6g=4.9g,所以F 所得溶液中溶质的质量分数为 ;
(6)根据质量守恒定律可知,经过此流程最多可得到金属镁的质量为: 。
【分析】(1)根据氯化镁和氢氧化钠反应生成氯化钠和氢氧化镁沉淀分析;
(2)根据方程式中氢氧化钠和氯化镁的质量关系列比例式分析;
(3)根据溶质质量=溶液质量溶质质量分数分析;
(4)根据方程式计算出氯化镁的质量,再计算氯化镁的纯度分析;
(5)根据反应后所得溶液为氯化钠溶液,由方程式计算出生成氯化钠,再由溶质质量为反应前氯化钠与生成氯化钠质量和,从而计算氯化钠溶液的溶质质量分数分析;
(6)根据根据反应前后镁元素的质量不变分析。
17.【答案】(1)③;0.290
(2)解:设100g混合溶液中MgCl2这种的质量为x,需要NaOH的质量为y,
x=0.475g,
y=0.4g
(3)解:则100g混合溶液中MgCl2这种溶质的质量分数 ×100%=0.475%;
【解析】【解答】(1)分析①②两组实验可知每10.0g2%的NaOH溶液与氯化镁完全反应可生成氢氧化镁沉淀的质量0.261g-0.116g=0.145g,再分析②③两组实验数据知,加入30.0g的NaOH溶液前20.0g与氯化镁反应生成氢氧化镁沉淀的质量0.261g,后10.0g与氯化镁反应生成0.290g-0.261g=0.029g<0.145g,说明氯化镁已完全反应,氢氧化钠溶液已过量,所以实验③中氯化镁已完全反应,N的质量为0.290g;
(3)分析①数据可知加入10.0g2%氢氧化钠溶液中与氯化镁反应的2%氢氧化钠溶液质量为
=8.0g,则与HCl反应的2%氢氧化钠溶液质量10.0g-8.0g=2.0g,生成0.290g氢氧化镁沉淀需要2%NaOH溶液的质量 =20.0g,如图: 。
【分析】(1)根据表中各组实验生成氢氧化镁的质量结合相等量物质完全反应生成物质量相等分析;
(2)根据生成氢氧化镁质量代入方程式中,利用方程式中物质间质量比计算氯化镁的质量,从而计算氯化镁质量分数分析;
(3)根据与盐酸反应的氢氧化钠质量和与氯化镁反应的氢氧化钠溶液质量及生成氢氧化镁质量描点绘制图像分析。
18.【答案】(1)0.66g
(2)小于;有部分生成的CO2溶解在反应后的溶液中
【解析】【解答】(1)设生成CO2的质量为x。
答:生成CO2的质量为0.66g。
(2)根据表内数据,反应前的总质量为1.26g+24.59g=25.85g,反应后锥形瓶与固液的总质量为25.36g,质量减少为25.85g-25.36g=0.49g,小于理论生成的质量0.66g;再根据CO2可溶于水的性质,可猜测原因是少量CO2溶于水造成;故答案为:0.66g;小于;有部分生成的CO2溶解在反应后的溶液中。
【分析】(1)先设未知数,正确写出碳酸氢钠与硫酸反应的化学方程式;再找准有关物质,已知量是碳酸氢钠的质量,未知量是生成二氧化碳的质量;列比例式计算。
(2)二氧化碳与水反应,会生成碳酸。
19.【答案】(1)NaOH、NaCl
(2)
(3)解:设氢氧化钙的质量为y
解得:y=7.4g由图示可知,与氢氧化钠反应转化为碳酸氢钠的二氧化碳的质量为:10.56g﹣4.4g=6.16g。
设氢氧化钠的质量为z,
解得:z=5.6g该混合物中NaCl的质量分数为: =35%。
答:该混合物中NaCl的质量分数为35%。
【解析】【解答】(1)向NaOH、Ca(OH)2、NaCl的混合溶液缓慢通入CO2气体,A点时二氧化碳与氢氧化钙恰好反应,溶液中所含溶质为:NaOH、NaCl;(2)设与碳酸钙反应的二氧化碳的质量为x
解得:x=4.4g所以消耗二氧化碳的总质量为10.56g+4.4g=14.96g。所以若B点后继续通入足量的CO2气体,将图象补充完整如下: 。
【分析】(1)根据二氧化碳与氢氧化钙的反应分析A点溶液中所含溶质;(2)根据碳酸钙与二氧化碳的反应画出B点后继续通入足量的CO2气体与沉淀的关系;(3)根据碳酸钙沉淀的质量可计算出氢氧化钙的质量,根据与氢氧化钠反应二氧化碳的质量计算出氢氧化钠的质量可计算出氢氧化钠的质量,即可计算出混合物中NaCl的质量及质量分数。
20.【答案】(1)吸水
(2)68
(3)设混合物中氯化钙的质量为x,则
解得x=2.22g
答:10g氯化钠与氯化钙的混合物中氯化钙的质量为2.22g。
21.【答案】(1)2MnO2 +2KClO3=2KMnO4+Cl2↑+O2↑
(2)0.3
(3)1.36%
【解析】【解答(1)根据信息写出生成物并配平得2MnO2 +2KClO3=2KMnO4+Cl2↑+O2↑;
(2)该反应中转移电子为10e-,所以当转移3mol电子时,生成Cl2为0.3mol;
(3)由题意知混合气体的平均相对分子质量为32.175,设氧气的体积分数为x,氯气的体积分数为1-x。则有32x+71(1-x)=32.175,解得x=0.955;
所以氧气的体积分数为99.55%,氯气的体积分数为0.45%。
由高锰酸钾与二氧化锰反应得到的氧气的体积分数与氯气相等,为0.45%。所以由氯酸钾直接分解得到氧气的体积分数为99.1%。
设最后得到的气体体积为1L,氧气密度为ρg/L,则有:
2KClO3 2KCl+ 3O2↑
245 96
m1 0.991pg
2MnO2 +2KCO3 =2KMnO4 +Cl2↑ +O2↑
245 32
m2 0.0045pg
则题目所求质量比为×100% =1.36%。
【分析】(1)氯酸钾与二氧化锰反应生成了高锰酸钾、氯气和氧气;
(2)根据2MnO2 +2KClO3=2KMnO4+Cl2↑+O2↑计算;
(3)根据2KClO32KCl+3O2↑和2MnO2 +2KClO3=2KMnO4+Cl2↑+O2↑计算。
22.【答案】(1)解:设原固体中Na2CO3的质量为x,消耗稀盐酸的质量为y
Na2CO3 +2HCl =2NaCl +CO2↑ +H2O
106 73 44
x y×7.3% 8.8g
x=21.2g y=200g
原固体中Na2CO3的质量分数100%=84.8%
答:原固体中Na2CO3的质量分数为84.8%,消耗盐酸的总质量为200g.
(2)0;
1.某保健食品主要成分为碳酸钙,请完成下列问题:
(1)碳酸钙的化学式为CaCO3,它是由 种元素组成的,其相对分子质量为 。
(2)计算碳酸钙中钙、碳、氧元素的质量比。(写出计算过程,下同)
(3)碳酸钙中钙元素的质量分数是多少?
2.将干燥、纯净的氯酸钾和二氧化锰的混合物15g装入大试管中,加热制取氧气。待完全反应后,将试管冷却、称量,得到10.2g固体物质。
(1)制得氧气 g.
(2)混合物中二氧化锰是多少g?(写出具体的计算步骤)
3.为测定某MgSO4溶液中溶质的质量分数,某化学兴趣小组同学取MgSO4溶液100g,向其中加入一定溶质质量分数的NaOH溶液80g,二者恰好完全反应生成沉淀5.8g。计算该MgSO4溶液中溶质的质量分数。
4.晓燕同学查阅资料获悉,正常成年人每分钟大约需要吸入氧气。已知在标准状况下氧气密度约为,空气密度氧气的体积含量按计算
请问:
(1)在标准状况下,正常成年人每分钟需要空气的质量为多少克?请写出计算过程
(2)容积为的集气瓶内有的水,用该瓶去收集纯净的氧气所得到的瓶内氧气的体积分数为 用百分数表示。
5.为测定某种贝壳中碳酸钙的含量,取12.5g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示。(已知杂质不参与反应也不溶于水)。
请计算:
(1)这种贝壳中碳酸钙的质量分数 。
(2)12.5g贝壳与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数 (写出计算过程)。
6.为了测定金属镁样品中镁的质量分数(杂质不含镁元素,不溶于水,也不与其它物质发生反应),用一稀盐酸进行了如下实验;
请回答下列问题:
(1)搅拌的目的是 ;
(2)C中固液混合物的质量是 ;
(3)计算镁样品中镁的质量分数 。
7.尿素(CO(NH2)2)是氮肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。计算:
(1)一个尿素分子中共含有几个原子?
(2)计算含氮元素56kg的尿素的质量。(写出计算过程)
8.过氧化钠(Na2O2)能与二氧化碳反应产生氧气,因此可用于呼吸面具或潜水艇中作为氧气的来源。现有2g过氧化钠样品(杂质不参加反应),与一定量的二氧化碳完全反应,生成气体质量与时间的关系如图所示,发生反应的化学方程式为2Na2O3+2CO2═2Na2CO3+O2。请计算:
(1)生成氧气的质量是 g。
(2)样品中过氧化钠的质量。
9.“液态阳光”技术可助力中国完成碳达峰、碳中和目标。2020年1月,“液态阳光”示范项目投料试车,该项目若满负荷运行,每年可生产甲醇1500t,计算理论上每年可减排二氧化碳的质量是多少?主要反应为:。
10.化学家将如图所示,分子结构简式像小狗的某物质,取名为“小狗烯”。其化学式为C26H26请计算:
(1)“小狗烯”中碳、氢元素质量比为 (填最简整数比)。
(2)16.9g“小狗烯”与多少克二氧化碳中含碳元素质量相等?
11.学习小组对贝壳(主要成分为CaCO3)与稀盐酸的反应进行了研究。
(1)Ⅰ、研究贝壳的状态对反应速率的影响
取等纯度、等质量的块状和粉末状贝壳,分别加入足量等浓度的稀盐酸,实验过程中生成气体的体积随时间变化的情况如图所示(贝壳中的杂质不与稀盐酸反应)。
结合实验分析图中曲线,可得出结论: 。
(2)Ⅱ、测定贝壳中碳酸钙的质量分数
小组取10g贝壳,按照如图所示过程进行实验。实验过程中测得不同时刻装置和药品总质量随时间变化的数据见下表。请计算:
时刻 t0 t1 t2 t3
装置和药品总质量/g 240.00 237.00 236.48 236.48
实验中共产生二氧化碳 g。
(3)该贝壳中碳酸钙的质量分数(写出计算过程)。
12.硝酸铵(NH4NO3)是一种重要的化肥,试着计算:
(1)该物质由几种元素组成 。
(2)NH4NO3中氮元素和氧元素的质量比 ;
(3)NH4NO3中氮元素的质量分数 。
13.医学上常用双氧水(过氧化氢和水的混合物)来清洗伤口和局部抗菌。某同学取136.0g医用双氧水放入烧杯中,然后加入4.0g二氧化锰,放在电子秤上,每隔一分钟观察一次并记录,烧杯中的剩余物质质量如下表所示,直到实验结束。
称量时间/min 0 1 2 3 4 5 6
物质质量/g 140.0 138.5 137.5 137.0 136.8 m 136.8
请回答下列问题:
(1)从表格中可知,m的数值是 。
(2)求136.0g该医用双氧水中过氧化氢的质量是多少?(写出计算过程)。
14.为测定所用盐酸的溶质质量分数,某实验小组取50g碳酸钙粉末于锥形瓶(瓶身100g)中,现将146g稀盐酸分4次逐渐加入装有碳酸钙粉末的锥形瓶,充分反应后,稀盐酸、锥形瓶与药品的总质量如图所示:
(1)最终生成气体的质量为 g。
(2)加入第 次稀盐酸时恰好完全反应。
(3)请求出该盐酸的溶质质量分数。
(4)请画出产生气体的质量与加入盐酸的质量的变化曲线图 。
15.现有某铁样品5.6g,含有的杂质为镁、锌、铜中的两种或三种。向其中逐渐加入溶质质量分数为9.8%的稀硫酸,产生氢气质量与加入稀硫酸质量的关系如图所示。
(1)则下列结论正确的是 (填序号)。
①恰好完全反应时,一定没有固体剩余
②x的值为0.2
③铁样品中可能含有镁
④M点对应的溶液中含有2种或3种溶质
(2)用含Fe2O360%的赤铁矿石800t,理论上可炼出含铁98%的生铁 吨。
(3)已知某铁的氧化物可表示为FeaOb=xFeO yFe2O3。经测:15.2克的某铁的氧化物中铁元素的质量为11.2克。则x:y= (填最小整数比)。
16.为测定某氯化镁和氯化钠样品(杂质不含镁元素,不溶于水,也不参加反应)中氯化镁的纯度,实验过程及数据记录如下:
(1)实验中发生反应的化学方程式为 ;
(2)列出求解 B→C 样品中参加反应的物质质量(x)的比例式为 ;
(3)配制实验中所用的氢氧化钠溶液,需要氢氧化钠固体的质量为 ,水的体积为 ;
(4)该样品中氯化镁的纯度为 ;
(5)F 所得溶液中溶质的质量分数为 ;
(6) ,经过此流程最多可得到金属镁的质量为 kg。
17.某化学兴趣小组的同学在实验室发现一瓶含有MgCl2和HCl的混合溶液,为确定混合溶液中氯化镁的含量,取4份混合溶液各100g,每份混合溶液中加入一定质量的2%NaOH溶液,得到实验数据如下表所示:
实验编号 ② ③ ③ ④
NaOH溶液质量/g 10.0 20.0 30.0 40.0
Mg(OH)2质量/g 0.116 0.261 0.290 N
(1)实验 (填实验编号)中氯化镁完全反应。N的质量为 g。
(2)计算100g混合溶液中MgCl2这种溶质的质量分数?(写出计算过程)
(3)分析实验数据,在“下图”中,画出往100克混合溶液中逐渐加入2%NaOH溶液质量0~30.0g过程中,产生Mg(OH)2沉淀质量对应的变化图,并标注必要的数值。
18.碳酸氢钠是面点膨松剂的主要成分之一。
小芳同学研究反应2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑中NaHCO3与CO2之间量的关系。
(1)理论计算:1.26gNaHCO3粉末与足量稀硫酸反应,计算生成CO2的质量 (写出计算过程)。
(2)实验分析:小芳用如图装置进行实验,向盛有足量稀硫酸的锥形瓶中加入1.26g NaHCO3粉末,完全反应至不再产生气泡。称取反应前后质量如下表,发现反应前后质量变化值 (填“大于”、“小于”或“等于”)生成CO2质量的理论值,原因可能是 。
反应前 反应后
NaHCO3/g 锥形瓶+稀硫酸/g 锥形瓶+反应后溶液/g
1.26 24.59 25.36
19.将20.0g NaOH、Ca(OH)2、NaCl组成的固体混合物溶于水配成溶液,向混合液中缓慢通入CO2气体(气体的溶解忽略不计),生成沉淀的质量与通入CO2气体的质量关系如图所示,请根据题意回答问题:
已知:Na2CO3+CO2+H2O═2NaHCO3
NaHCO3+NaOH═Na2CO3+H2O
(1)经分析,A点溶液中所含溶质为 (填化学式)。
(2)在B点时,溶液里碳元素均存在于NaHCO3中,若B点后继续通入足量的CO2气体,请将图象补充完整。
(3)该混合物中NaCl的质量分数为多少?(写出计算过程,计算结果精确至0.1%)
20.为了验证氯化钙是不是食盐潮解的原因之一,小张同学做了两个对比实验,分别取10g的氯化钠和10g的氯化钠与氯化钙的混合物,同时放在空气中。一段时间后,氯化钠与氯化钙的混合物潮解了,而纯的氯化钠基本无现象。于是得到了氯化钙是食盐潮解的原因之一、并邀请班上小王同学对10g混合物中氯化钙的含量进行测定,小王同学将小张实验后的那份氯化钠和氯化钙的混合物放在烧杯中,加入一定量的水使固体完全溶解得到溶液的质量为50g,再将30g碳酸钠溶液分三次加入烧杯中,其实验流程及数据如下图所示,请解答下列问题:
(1)小张的实验说明氯化钙具有 性。
(2)上述图示中的X=
(3)10g氯化钠与氯化钙的混合物中氯化钙的质量为多少?(写出计算过程)
21.实验室用二氧化锰与氯酸钾混合加热制取氧气时,有时会闻到刺激性气味,这是因为实验过程中有少量的氯酸钾与二氧化锰反应生成了高锰酸钾、氯气和氧气。
(1)写出上述反应的化学方程式:
(2)若在上述反应中有3mol电子转移,则生成了 mol氯气。
(3)若所得气体在同温同压下对氢气的相对密度是16.0875.则在混合物中,按上述反应的氯酸钾的质量占反应掉的氯酸钾的总质量的 .
22.在我国青海湖地区有一种说法:冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中捞得的Na2CO3会含有少量的NaCl.
某研究性学习小组称取含NaCl的Na2CO3固体25.0g,将其配制成溶液,再向其中逐滴加入足量的7.3%的稀盐酸,使气体完全放出,共收集到8.8g CO2气体.
(1)计算原固体中Na2CO3的质量分数和消耗盐酸的总质量.
(2)下表为研究性学习小组向上述所配制的混合液中分三次逐滴加盐酸后,所记录的部分数据.
经查阅资料知:Na2CO3+HCl=NaCl+NaHCO3 (1)NaHCO3+HCl=NaCl+H2O+CO2↑(2)
已知:反应(1)完全后,反应(2)才开始.
①请完成表格中未填的部分.
实验次序 每次产生的CO2的质量(g)
第一次先逐滴加盐酸100g
第二次再逐滴加盐酸100g 8.8
第三次再逐滴加盐酸100g 0
②根据表中数据在坐标系中画出CO2质量(纵坐标)与所加入盐酸质量(横坐标)的关系图.
答案解析部分
1.【答案】(1)三;100
(2)解:碳酸钙中钙、碳、氧元素的质量比为40:12:(16×3)=10:3:12
(3)解:碳酸钙中钙元素的质量分数是 。
【解析】【解答】(1)碳酸钙是由碳、氢、氧三种元素组成的,其相对分子质量为40+12+16×3=100。
【分析】(1)根据化学式确定物质的组成元素及相对分子质量为分子中各原子的相对原子质量之和分析;
(2)根据元素质量比为相对原子质量×原子个数之比分析;
(3)根据元素质量分数=相对原子质量×原子个数/相对分子质量分析。
2.【答案】(1)4.8
(2)解:设参加反应的氯酸钾的质量为x,
2KClO3 2KCl + 3O2↑
245 96
x 4.8g
x=12.25g
MnO2的质量为15g-12.25g=2.75g。
答:混合物中二氧化锰的质量是2.75g。
【解析】【解答】(1)根据质量守恒定律,固体减少的质量就是生成的氧气的质量,所以制得氧气为:15g-10.2g=4.8g。
【分析】(1)根据质量守恒定律,固体减少的质量就是生成的氧气的质量。
(2)先设未知数,正确写出氯酸钾分解的化学方程式;再找准有关物质,已知量是氧气的质量,未知量是参加反应氯酸钾的质量;列比例式计算。
3.【答案】解:设参加反应的MgSO4质量为x。
x=12g
该MgSO4溶液中溶质的质量分数为: ×100%=12%
答:该MgSO4溶液中溶质的质量分数为12%。
【解析】【分析】化学方程式的计算,关键是根据化学反应方程式找出相关物质的质量关系,利用反应中物质的质量比不变进行列比例式计算,易错点是由质量比算数不正确,所以这一步要仔细检查。
4.【答案】(1)51.6g
(2)80%
【解析】【解答】(1)正常成年人每分钟需要空气的质量=;
(2)用该瓶去收集纯净的氧气所得到的瓶内氧气的体积分数为
【分析】(1)根据氧气的体积算出空气的体积,空气的体积乘以密度就是空气的质量;
(2)集气瓶中150mL,为收集到的氧气的体积,剩余的50mL为空气,空气中氧气的体积为50mL×1/5,为10mL,所以氧气的总体积为160mL,算除瓶中氧气的体积分数为80%。
5.【答案】(1)80%
(2)解:设反应后生成氯化钙的质量为x,生成二氧化碳的质量为y= x=11.1g= y=4.4g反应后溶液的质量=10g+105.4g 4.4g=111g所得溶液中溶质的质量分数=×100%=10% 答:所得溶液中溶质的质量分数为10%。
【解析】【解答】(1)解:贝壳中碳酸钙的质量=12.5g 2.5g=10g
贝壳中碳酸钙的质量分数=×100%=80%
答:贝壳中碳酸钙的质量分数为80%。
【分析】(1)根据图像得出碳素钙的质量,进而计算样品中碳酸钙的质量分数进行分析
(2)根据碳酸钙的质量结合反应的方程式进行分析
6.【答案】(1)让盐酸和镁充分接触,加快反应速率
(2)204.6g
(3)96%
【解析】【解答】(1)搅拌的目的是让盐酸和镁充分接触,加快反应速率;故填:让盐酸和镁充分接触,加快反应速率;(2)由于所加盐酸为同一盐酸,且根据第一次150g稀盐酸完全反应生成氢气为:150g+5g-154.7g=0.3g,所以继续加入50g稀盐酸恰好完全反应,则生成的氢气的质量为0.1g,C中固液混合物的质量是154.7g+50g-0.1g= 204.6g,故填:204.6g;(3)解:设镁样品中镁的质量分数为x,分析实验过程知道共生成氢气0.4g
x=96%
答:样品中镁的质量分数为96%。
【分析】(1)根据反应时搅拌是为了使药品充分接触加快反应分析;
(2)根据有气体生成的反应反应后剩余物质质量为反应前总质量-生成气体质量分析;
(3)根据生成氢气的质量代入方程式中计算镁的质量,从而计算镁的质量分数分析。
7.【答案】(1)解:一个尿素分子是由一个碳原子、一个氧原子、两个氮原子和四个氢原子构成的,故一个尿素分子中共有8个原子。
(2)解:需要尿素的质量为 。
答:含氮元素56kg的尿素的质量为 120kg。
【解析】【解答】(1)(2)根据化合物的质量=该化合物中某元素的质量÷该元素的质量分数,见答案。
【分析】(1)根据化学式的意义分析
(2)根据物质质量等于元素质量除以元素的质量分数分析
8.【答案】(1)0.32
(2)1.56g
【解析】【解答】(1)由图中信息可知,刚好完全反应生成氧气的质量为0.32g;
(2)设该样品中过氧化钠的质量为x,
2Na2O2 +2CO2 = 2Na2CO3 +O2
156 32
x 0.32g
x=1.56g
答:该样品中过氧化钠的质量为1.56g。
【分析】(1)根据图象分析生成氧气的质量;
(2)根据氧气的质量可计算出过氧化钠的质量。
9.【答案】解:设理论上每年可减排二氧化碳的质量为,则:
答:理论上每年可减排二氧化碳的质量是2062.5t。
【解析】【分析】根据化学方程式的计算方法进行分析
10.【答案】(1)12:1
(2)16.9g“小狗烯”中含碳元素的质量为
含有15.6g碳元素,需要二氧化碳的质量为
答:16.9g“小狗烯”与57.2g二氧化碳中含碳元素质量相等。
【解析】【解答】(1)碳、氢元素质量比为(12×26):(1×26)=12:1。
【分析】(1)相对分子质量等于元素的相对原子质量与原子个数的乘积之和。
(2)物质中元素的质量=物质的质量×化学式中该元素的质量分数。
11.【答案】(1)反应的接触面积越大,反应速率越快
(2)3.52
(3)解:设10g贝壳中碳酸钙的质量为x
解得:x=8g
贝壳中碳酸钙的质量分数为:=80%
答:贝壳中碳酸钙的质量分数为80%。
【解析】【解答】(1)等纯度、等质量的贝壳块和贝壳粉末,分别加入足量等浓度的稀盐酸,其他条件一样,只有贝壳的形状不同,从而产生气体体积曲线不同,但是最后生成的气体体积相等,说明只改变了反应的速率,不改变生成气体的质量,故可得出反应的接触面积越大,反应速率越快的结论;
(2)由表中数据可知,t3时刻起,总质量不再减少,由于盐酸是足量的,说明了碳酸钙已完全发生了反应,由质量守恒定律可知,生成的二氧化碳的质量为:240.00g-236.48g=3.52g;
【分析】(1)根据物质接触面积影响反应速率分析;
(2)根据反应后减少质量为生成二氧化碳质量分析;
(3)根据生成二氧化碳质量及方程式中物质间质量关系计算碳酸钙质量分析。
12.【答案】(1)3种
(2)7:12
(3)35%
【解析】【解答】(1)硝酸铵由氮、氢、氧三种元素组成;
(2)NH4NO3中氮元素和氧元素的质量比为氮原子的相对原子质量×氮原子的数目:氧原子的相对原子质量×氧原子的数目=(14×2):(16×3)=7:12
(3)NH4NO3中氮元素的质量分数为:
【分析】(1)化学式中有几种元素符号,物质就含有几种元素。
(2)在化学式中,元素的质量比等于元素的相对原子质量与原子个数的乘积之比。
(3)在化合物中,元素的质量分数=。
13.【答案】(1)136.8
(2)解:生成氧气的质量为:.
设参过氧化氢的质量为.
答:136.0g该医用双氧水中过氧化氢的质量是6.8g。
【解析】【解答】(1)由表格中数据可知,从第4分钟到第6分钟,物质质量没有减少,说明至第4分钟时过氧化氢已经完全反应,反应已经结束,所以第5分钟时,物质质量与第4分钟的相等,故m的值为136.8。
(2)过氧化氢在二氧化锰作催化剂的条件下反应生成水和氧气,产生的氧气逸出,所以物质减少的质量即为生成氧气的质量,所以产生氧气的质量为:,过氧化氢的质量可根据反应的化学方程式由氧气的质量求得。
【分析】(1)根据表格中数据可知,从第4分钟到第6分钟,物质质量没有减少,说明至第4分钟时过氧化氢已经完全反应分析。
(2)根据质量守恒定律,物质减少的质量即为生成氧气的质量。
先设未知数,正确写出过氧化氢分解的化学方程式;再找准有关物质,已知量是氧气的质量,未知量是需要过氧化氢的质量;列比例式计算。
14.【答案】(1)3.3
(2)3##三
(3):第1次盐酸反应完全,产生二氧化碳的质量:150g+36.5g-185.4g=1.1g;
设该盐酸的溶质质量分数为x。
答:该盐酸的溶质质量分数为5%
(4)
15.【答案】(1)②
(2)343
(3)2:1
【解析】【解答】(1)根据质量守恒定律,恰好完全反应生成氢气质量=100g×9.8%××100%=0.2g,
反应的化学方程式及其质量关系:
Fe +H2SO4═FeSO4+ H2↑
56 2
5.6g 0.2g
Zn +H2SO4═ZnSO4+ H2↑
65 2
5.6g 0.17g
Mg +H2SO4═MgSO4+ H2↑
24 2
5.6g 0.47g
铁样品中含有杂质生产氢气没有减少,故一定含镁,铜和锌至少含有一种.
① 由分析可知,可能含有铜,故可能有固体剩余,故错误;
② 由分析可知生成氢气0.2g,故x=0.2,正确。
③ 由分析可知,一定含镁,故错误;
④ M点硫酸过量,铁和硫酸生成硫酸 亚铁,镁和硫酸生成硫酸镁,可能含有锌,锌和硫酸生成硫酸锌,故含有三种或四种溶质,故错误;
故答案为:②。
(2)设可炼得铁的质量为x。
Fe2O3 +3CO3CO2+ 2Fe
160 112
800t×60% x
x=336t
理论上可炼出含铁98%的生铁的质量==343t
(3)15.2克的某铁的氧化物中铁的质量为11.2克,
则氧元素的质量=15.2g-11.2g=4g,
则a:b=:=4:5。
则x+2y=4,x+3y=5,
则x=2,y=1,x:y=2:1。
【分析】(1)根据排在氢前面的金属可以置换出酸的氢元素,依据图象中的数据和氢元素守恒即可计算出生成氢气的质量,然后结合金属与硫酸反应的化学方程式分析。
(2)先设未知数,正确写出化学方程式;再找准有关物质,已知量是氧化铁的质量,未知量是生成铁的质量;列比例式计算。
(3)根据15.2克的某铁的氧化物中铁的质量为11.2克,则氧元素的质量为15.2g-11.2g=4g分析。
16.【答案】(1)
(2)
(3)24g;216mL
(4)75%
(5)12.5%
(6)14.4kg
【解析】【解答】(1)实验中是氯化镁和氢氧化钠反应生成氯化钠和氢氧化镁沉淀,反应的化学方程式为 ;
(2)B→C参加反应氢氧化钠的质量=160g 10%,设参加反应氯化镁的质量为x,
;
(3)由题意可知,实验中所用的氢氧化钠溶液质量为160g+80g=240g,需要氢氧化钠固体的质量=240g 10%=24g,水的质量=240g-24g=216g,故水的体积为216mL;
(4)E中只含有一种溶质,即氯化钠,说明240g氢氧化钠溶液已完全反应,参加氢氧化钠的质量=240g 10%=24g,设参加反应氯化镁的质量为a,生成氯化钠的质量为b,生成氢氧化镁的质量为c,由题意得:
a=28.5g,
b=35.1g,
c=17.4g,
根据题意可知,氯化镁和氯化钠样品的质量=138g-100g=38g,该样品中氯化镁的纯度为 ;
(5)根据题意可知,氯化镁和氯化钠样品中未反应杂质的质量=22g-17.4g=4.6g,氯化镁和氯化钠样品中氯化钠的质量=38g-28.5g-4.6g=4.9g,所以F 所得溶液中溶质的质量分数为 ;
(6)根据质量守恒定律可知,经过此流程最多可得到金属镁的质量为: 。
【分析】(1)根据氯化镁和氢氧化钠反应生成氯化钠和氢氧化镁沉淀分析;
(2)根据方程式中氢氧化钠和氯化镁的质量关系列比例式分析;
(3)根据溶质质量=溶液质量溶质质量分数分析;
(4)根据方程式计算出氯化镁的质量,再计算氯化镁的纯度分析;
(5)根据反应后所得溶液为氯化钠溶液,由方程式计算出生成氯化钠,再由溶质质量为反应前氯化钠与生成氯化钠质量和,从而计算氯化钠溶液的溶质质量分数分析;
(6)根据根据反应前后镁元素的质量不变分析。
17.【答案】(1)③;0.290
(2)解:设100g混合溶液中MgCl2这种的质量为x,需要NaOH的质量为y,
x=0.475g,
y=0.4g
(3)解:则100g混合溶液中MgCl2这种溶质的质量分数 ×100%=0.475%;
【解析】【解答】(1)分析①②两组实验可知每10.0g2%的NaOH溶液与氯化镁完全反应可生成氢氧化镁沉淀的质量0.261g-0.116g=0.145g,再分析②③两组实验数据知,加入30.0g的NaOH溶液前20.0g与氯化镁反应生成氢氧化镁沉淀的质量0.261g,后10.0g与氯化镁反应生成0.290g-0.261g=0.029g<0.145g,说明氯化镁已完全反应,氢氧化钠溶液已过量,所以实验③中氯化镁已完全反应,N的质量为0.290g;
(3)分析①数据可知加入10.0g2%氢氧化钠溶液中与氯化镁反应的2%氢氧化钠溶液质量为
=8.0g,则与HCl反应的2%氢氧化钠溶液质量10.0g-8.0g=2.0g,生成0.290g氢氧化镁沉淀需要2%NaOH溶液的质量 =20.0g,如图: 。
【分析】(1)根据表中各组实验生成氢氧化镁的质量结合相等量物质完全反应生成物质量相等分析;
(2)根据生成氢氧化镁质量代入方程式中,利用方程式中物质间质量比计算氯化镁的质量,从而计算氯化镁质量分数分析;
(3)根据与盐酸反应的氢氧化钠质量和与氯化镁反应的氢氧化钠溶液质量及生成氢氧化镁质量描点绘制图像分析。
18.【答案】(1)0.66g
(2)小于;有部分生成的CO2溶解在反应后的溶液中
【解析】【解答】(1)设生成CO2的质量为x。
答:生成CO2的质量为0.66g。
(2)根据表内数据,反应前的总质量为1.26g+24.59g=25.85g,反应后锥形瓶与固液的总质量为25.36g,质量减少为25.85g-25.36g=0.49g,小于理论生成的质量0.66g;再根据CO2可溶于水的性质,可猜测原因是少量CO2溶于水造成;故答案为:0.66g;小于;有部分生成的CO2溶解在反应后的溶液中。
【分析】(1)先设未知数,正确写出碳酸氢钠与硫酸反应的化学方程式;再找准有关物质,已知量是碳酸氢钠的质量,未知量是生成二氧化碳的质量;列比例式计算。
(2)二氧化碳与水反应,会生成碳酸。
19.【答案】(1)NaOH、NaCl
(2)
(3)解:设氢氧化钙的质量为y
解得:y=7.4g由图示可知,与氢氧化钠反应转化为碳酸氢钠的二氧化碳的质量为:10.56g﹣4.4g=6.16g。
设氢氧化钠的质量为z,
解得:z=5.6g该混合物中NaCl的质量分数为: =35%。
答:该混合物中NaCl的质量分数为35%。
【解析】【解答】(1)向NaOH、Ca(OH)2、NaCl的混合溶液缓慢通入CO2气体,A点时二氧化碳与氢氧化钙恰好反应,溶液中所含溶质为:NaOH、NaCl;(2)设与碳酸钙反应的二氧化碳的质量为x
解得:x=4.4g所以消耗二氧化碳的总质量为10.56g+4.4g=14.96g。所以若B点后继续通入足量的CO2气体,将图象补充完整如下: 。
【分析】(1)根据二氧化碳与氢氧化钙的反应分析A点溶液中所含溶质;(2)根据碳酸钙与二氧化碳的反应画出B点后继续通入足量的CO2气体与沉淀的关系;(3)根据碳酸钙沉淀的质量可计算出氢氧化钙的质量,根据与氢氧化钠反应二氧化碳的质量计算出氢氧化钠的质量可计算出氢氧化钠的质量,即可计算出混合物中NaCl的质量及质量分数。
20.【答案】(1)吸水
(2)68
(3)设混合物中氯化钙的质量为x,则
解得x=2.22g
答:10g氯化钠与氯化钙的混合物中氯化钙的质量为2.22g。
21.【答案】(1)2MnO2 +2KClO3=2KMnO4+Cl2↑+O2↑
(2)0.3
(3)1.36%
【解析】【解答(1)根据信息写出生成物并配平得2MnO2 +2KClO3=2KMnO4+Cl2↑+O2↑;
(2)该反应中转移电子为10e-,所以当转移3mol电子时,生成Cl2为0.3mol;
(3)由题意知混合气体的平均相对分子质量为32.175,设氧气的体积分数为x,氯气的体积分数为1-x。则有32x+71(1-x)=32.175,解得x=0.955;
所以氧气的体积分数为99.55%,氯气的体积分数为0.45%。
由高锰酸钾与二氧化锰反应得到的氧气的体积分数与氯气相等,为0.45%。所以由氯酸钾直接分解得到氧气的体积分数为99.1%。
设最后得到的气体体积为1L,氧气密度为ρg/L,则有:
2KClO3 2KCl+ 3O2↑
245 96
m1 0.991pg
2MnO2 +2KCO3 =2KMnO4 +Cl2↑ +O2↑
245 32
m2 0.0045pg
则题目所求质量比为×100% =1.36%。
【分析】(1)氯酸钾与二氧化锰反应生成了高锰酸钾、氯气和氧气;
(2)根据2MnO2 +2KClO3=2KMnO4+Cl2↑+O2↑计算;
(3)根据2KClO32KCl+3O2↑和2MnO2 +2KClO3=2KMnO4+Cl2↑+O2↑计算。
22.【答案】(1)解:设原固体中Na2CO3的质量为x,消耗稀盐酸的质量为y
Na2CO3 +2HCl =2NaCl +CO2↑ +H2O
106 73 44
x y×7.3% 8.8g
x=21.2g y=200g
原固体中Na2CO3的质量分数100%=84.8%
答:原固体中Na2CO3的质量分数为84.8%,消耗盐酸的总质量为200g.
(2)0;
同课章节目录
