1.1 物质的分类及转化 课件 (共20张PPT) 人教版(2019)必修第一册
文档属性
| 名称 | 1.1 物质的分类及转化 课件 (共20张PPT) 人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 342.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-14 23:31:10 | ||
图片预览







文档简介
(共20张PPT)
第一章 物质及其变化
物质的分类及转化
第一章 物质及其变化
课时1 物质的分类
1.从不同角度利用树状分类法将化学物质进行分类,能准确判断酸性氧化物和碱性氧化物。
2.通过对分散系的分类研究,认识胶体是一种新的分散系。能举例说明三种分散系的典型特征,并能设计实验鉴别胶体。
目标一:从不同角度利用树状分类法化学物质进行分类,能准确判断酸性氧化物和碱性氧化物。
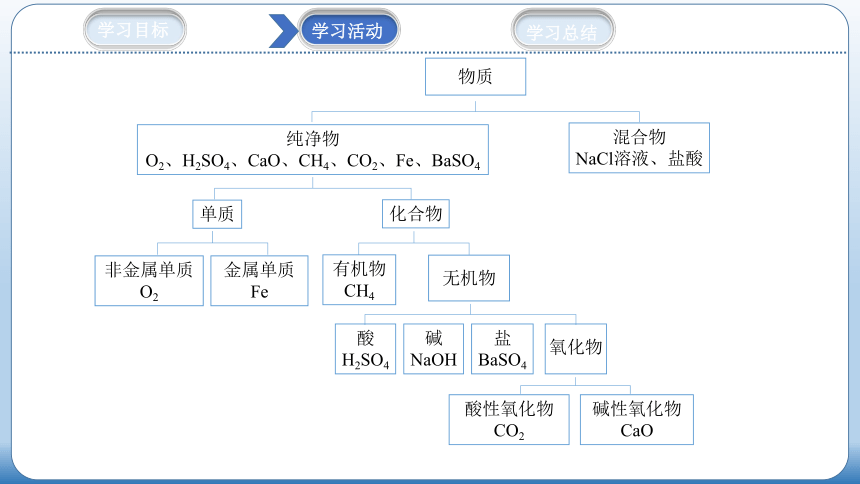
任务1:请阅读教材P6~7,将下列物质:O2、NaCl溶液、H2SO4、CaO、CO2、Fe、盐酸、BaSO4、CH4,进行分类,你将用什么样的分类形式,分类依据有哪些?
树状分类
物质
酸性氧化物
CO2
纯净物
O2、H2SO4、CaO、CH4、CO2、Fe、BaSO4
混合物
NaCl溶液、盐酸
单质
化合物
非金属单质
O2
金属单质
Fe
有机物
CH4
无机物
氧化物
酸
H2SO4
碱性氧化物
CaO
盐
BaSO4
碱
NaOH
任务2:(1)每一种元素都可以形成单质,由氧元素形成的O2和O3是什么关系?
(2)氧化物能否再分?如何分类呢?CO2是什么氧化物?如何判断?
氧化物分类
氧化物
组成元素
性质
非金属氧化物CO、CO2、SO3、SO2等
金属氧化物CaO、Fe2O3、CuO等
酸性氧化物CO2、SO2等
碱性氧化物CaO、CuO、Fe2O3等
同素异形体。
由同种元素构成的不同种单质互为同素异形体。还有如:金刚石与石墨。
CO2是非金属氧化物,是一种酸性氧化物。
酸性氧化物:与碱反应只生成盐和水的氧化物。如CO2、SO2等。
CO2+Ca(OH)2=CaCO3+H2O
碱性氧化物:与酸反应只生成盐和水的氧化物。如CaO、CuO等。
CaO+2HCl=CaCl2+H2O
目标二:认识胶体是一种新的分散系,探究胶体的性质,能设计实验鉴别胶体
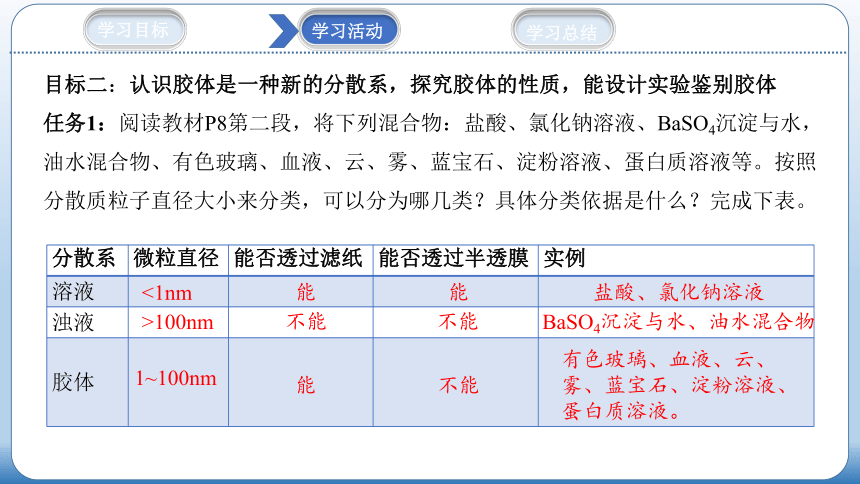
任务1:阅读教材P8第二段,将下列混合物:盐酸、氯化钠溶液、BaSO4沉淀与水,油水混合物、有色玻璃、血液、云、雾、蓝宝石、淀粉溶液、蛋白质溶液等。按照分散质粒子直径大小来分类,可以分为哪几类?具体分类依据是什么?完成下表。
分散系 微粒直径 能否透过滤纸 能否透过半透膜 实例
溶液
浊液
胶体
<1nm
能
能
盐酸、氯化钠溶液
>100nm
1~100nm
不能
不能
BaSO4沉淀与水、油水混合物
能
不能
有色玻璃、血液、云、雾、蓝宝石、淀粉溶液、蛋白质溶液。
任务2:阅读教材P8-9,完成下列问题。
实验探究胶体的性质
实验内容 操作与现象
氢氧化铁胶体的制备 ①将烧杯中的蒸馏水加热至 。
②向沸水中逐滴加入5~6滴 。
③继续煮沸至液体呈 色,停止加热。
激光笔照射 用红色激光笔照射烧杯中的液体,在与光束垂直的方向进行观察,现象是 。
沸腾
饱和FeCl3溶液
红褐
有一条光亮的通路
(1)制备氢氧化铁胶体时为什么不用NaOH与FeCl3溶液反应?
(2)可以用过滤的方法除去氢氧化铁胶体中的泥沙吗?
(3)Fe(OH)3胶体与硫酸铜溶液有何不同?如何鉴别胶体和溶液?
NaOH与FeCl3反应产生Fe(OH)3沉淀。
可以,胶体中的分散质能透过滤纸的孔隙,而泥沙不能透过。
Fe(OH)3胶体微粒直径介于1~100nm之间,硫酸铜溶液微粒直径小于1n m 。用一束光照射,在Fe(OH)3胶体中会产生一条光亮的通路。这条光亮“通路”是由胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,这种现象叫做丁达尔效应。常用于区分胶体和溶液。
物质分类
混合物
纯净物
浊液
胶体
非金属单质
金属单质
溶液
单质
化合物
氧化物
酸
碱
盐
丁达尔效应
酸性氧化物
碱性氧化物
第一章 物质及其变化
课时2 物质的转化
1.从物质类别角度,找出金属、氧化物、酸、碱、盐等各类物质的通性,理清物质之间的转化规律。
2.能用分类观及物质转化关系,学会设计多种方案制备常见物质。
目标一:从物质类别角度,找出金属、氧化物、酸、碱、盐等各类物质的通性,理清物质之间的转化关系。
任务1:回顾初中学习酸、碱、盐的主要化学性质,完成下表。
(1)回忆盐酸、硫酸能发生的反应,归纳酸的主要化学性质。
酸的主要化学性质 反应实例(写出化学方程式)
酸与活泼金属反应
Zn+H2SO4===ZnSO4+H2↑
酸与碱性氧化物反应
Na2O+H2SO4===Na2SO4+H2O
酸与碱反应
2KOH+H2SO4===K2SO4+2H2O
酸与某些盐反应
H2SO4+BaCl2===BaSO4↓+2HCl
(2)回忆氢氧化钠能发生的反应,归纳碱的主要化学性质。
碱主要化学性质 反应实例(写出化学方程式)
(3)回忆碳酸钠能发生的反应,归纳盐的通性。
盐主要化学性质 反应实例(写出化学方程式)
与酸性氧化物反应
2NaOH+CO2===Na2CO3+H2O
与酸反应
2NaOH+H2SO4===Na2SO4+2H2O
与某些盐反应
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
与某些金属发生反应
Zn+CuSO4===ZnSO4+Cu
与某些酸发生反应
Na2CO3+2HCl===2NaCl+H2O+CO2↑
与某些碱发生反应
Na2CO3+Ba(OH)2===BaCO3↓+2NaOH
与某些盐发生反应
Na2CO3+BaCl2===BaCO3↓+2NaCl
任务2:写出物质转化的化学方程式并判断化学反应类型。
(1)单质→氧化物→酸→盐(以碳元素为例)
化学方程式 反应类型
点燃
C+O2===CO2
化合反应
CO2+H2O===H2CO3
化合反应
Ca(OH)2+H2CO3===CaCO3↓+2H2O
复分解反应
(2)单质→氧化物→碱→盐(以钙元素为例)
化学方程式 反应类型
2Ca+O2===2CaO
化合反应
CaO+H2O===Ca(OH)2
化合反应
Ca(OH)2+2HCl===CaCl2+2H2O
复分解反应
知识小结
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
O2
O2
H2O
H2O
酸或酸性氧化物
碱或碱性氧化物
单质--氧化物--酸(碱)--盐之间的转化规律
目标二:能用分类观及物质转化规关系解决实际问题。
任务:单质、氧化物、酸、碱、盐之间的转化关系:
通过物质的转化关系制备具体物质。写出相关反应方程式。
(1)用硫磺制备亚硫酸钠(Na2SO3)。
(2)以镁为原料,用三种不同方法制备MgCl2。
(3)用Fe、CuO、H2SO4为原料,用两种方法制备铜。
(1)单质→氧化物→盐:S→SO2→Na2SO3
S+O2=====SO2
SO2+2NaOH=Na2SO3+H2O
(2)①Mg+Cl2=====MgCl2
②Mg+2HCl=MgCl2+H2
③Mg+O2=====2MgO MgO+2HCl=MgCl2+H2O
(3)①Fe+H2SO4=FeSO4+H2 CuO+H2=====Cu+H2O
②CuO+H2SO4=CuSO4+H2O Fe+CuSO4=FeSO4+Cu
点燃
点燃
点燃
高温
物质的转化
酸、碱、盐的性质
酸的性质
碱的性质
盐的性质
金属、非金属、氧化物、酸、碱、盐的转化
化学反应基本类型
第一章 物质及其变化
物质的分类及转化
第一章 物质及其变化
课时1 物质的分类
1.从不同角度利用树状分类法将化学物质进行分类,能准确判断酸性氧化物和碱性氧化物。
2.通过对分散系的分类研究,认识胶体是一种新的分散系。能举例说明三种分散系的典型特征,并能设计实验鉴别胶体。
目标一:从不同角度利用树状分类法化学物质进行分类,能准确判断酸性氧化物和碱性氧化物。
任务1:请阅读教材P6~7,将下列物质:O2、NaCl溶液、H2SO4、CaO、CO2、Fe、盐酸、BaSO4、CH4,进行分类,你将用什么样的分类形式,分类依据有哪些?
树状分类
物质
酸性氧化物
CO2
纯净物
O2、H2SO4、CaO、CH4、CO2、Fe、BaSO4
混合物
NaCl溶液、盐酸
单质
化合物
非金属单质
O2
金属单质
Fe
有机物
CH4
无机物
氧化物
酸
H2SO4
碱性氧化物
CaO
盐
BaSO4
碱
NaOH
任务2:(1)每一种元素都可以形成单质,由氧元素形成的O2和O3是什么关系?
(2)氧化物能否再分?如何分类呢?CO2是什么氧化物?如何判断?
氧化物分类
氧化物
组成元素
性质
非金属氧化物CO、CO2、SO3、SO2等
金属氧化物CaO、Fe2O3、CuO等
酸性氧化物CO2、SO2等
碱性氧化物CaO、CuO、Fe2O3等
同素异形体。
由同种元素构成的不同种单质互为同素异形体。还有如:金刚石与石墨。
CO2是非金属氧化物,是一种酸性氧化物。
酸性氧化物:与碱反应只生成盐和水的氧化物。如CO2、SO2等。
CO2+Ca(OH)2=CaCO3+H2O
碱性氧化物:与酸反应只生成盐和水的氧化物。如CaO、CuO等。
CaO+2HCl=CaCl2+H2O
目标二:认识胶体是一种新的分散系,探究胶体的性质,能设计实验鉴别胶体
任务1:阅读教材P8第二段,将下列混合物:盐酸、氯化钠溶液、BaSO4沉淀与水,油水混合物、有色玻璃、血液、云、雾、蓝宝石、淀粉溶液、蛋白质溶液等。按照分散质粒子直径大小来分类,可以分为哪几类?具体分类依据是什么?完成下表。
分散系 微粒直径 能否透过滤纸 能否透过半透膜 实例
溶液
浊液
胶体
<1nm
能
能
盐酸、氯化钠溶液
>100nm
1~100nm
不能
不能
BaSO4沉淀与水、油水混合物
能
不能
有色玻璃、血液、云、雾、蓝宝石、淀粉溶液、蛋白质溶液。
任务2:阅读教材P8-9,完成下列问题。
实验探究胶体的性质
实验内容 操作与现象
氢氧化铁胶体的制备 ①将烧杯中的蒸馏水加热至 。
②向沸水中逐滴加入5~6滴 。
③继续煮沸至液体呈 色,停止加热。
激光笔照射 用红色激光笔照射烧杯中的液体,在与光束垂直的方向进行观察,现象是 。
沸腾
饱和FeCl3溶液
红褐
有一条光亮的通路
(1)制备氢氧化铁胶体时为什么不用NaOH与FeCl3溶液反应?
(2)可以用过滤的方法除去氢氧化铁胶体中的泥沙吗?
(3)Fe(OH)3胶体与硫酸铜溶液有何不同?如何鉴别胶体和溶液?
NaOH与FeCl3反应产生Fe(OH)3沉淀。
可以,胶体中的分散质能透过滤纸的孔隙,而泥沙不能透过。
Fe(OH)3胶体微粒直径介于1~100nm之间,硫酸铜溶液微粒直径小于1n m 。用一束光照射,在Fe(OH)3胶体中会产生一条光亮的通路。这条光亮“通路”是由胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的,这种现象叫做丁达尔效应。常用于区分胶体和溶液。
物质分类
混合物
纯净物
浊液
胶体
非金属单质
金属单质
溶液
单质
化合物
氧化物
酸
碱
盐
丁达尔效应
酸性氧化物
碱性氧化物
第一章 物质及其变化
课时2 物质的转化
1.从物质类别角度,找出金属、氧化物、酸、碱、盐等各类物质的通性,理清物质之间的转化规律。
2.能用分类观及物质转化关系,学会设计多种方案制备常见物质。
目标一:从物质类别角度,找出金属、氧化物、酸、碱、盐等各类物质的通性,理清物质之间的转化关系。
任务1:回顾初中学习酸、碱、盐的主要化学性质,完成下表。
(1)回忆盐酸、硫酸能发生的反应,归纳酸的主要化学性质。
酸的主要化学性质 反应实例(写出化学方程式)
酸与活泼金属反应
Zn+H2SO4===ZnSO4+H2↑
酸与碱性氧化物反应
Na2O+H2SO4===Na2SO4+H2O
酸与碱反应
2KOH+H2SO4===K2SO4+2H2O
酸与某些盐反应
H2SO4+BaCl2===BaSO4↓+2HCl
(2)回忆氢氧化钠能发生的反应,归纳碱的主要化学性质。
碱主要化学性质 反应实例(写出化学方程式)
(3)回忆碳酸钠能发生的反应,归纳盐的通性。
盐主要化学性质 反应实例(写出化学方程式)
与酸性氧化物反应
2NaOH+CO2===Na2CO3+H2O
与酸反应
2NaOH+H2SO4===Na2SO4+2H2O
与某些盐反应
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
与某些金属发生反应
Zn+CuSO4===ZnSO4+Cu
与某些酸发生反应
Na2CO3+2HCl===2NaCl+H2O+CO2↑
与某些碱发生反应
Na2CO3+Ba(OH)2===BaCO3↓+2NaOH
与某些盐发生反应
Na2CO3+BaCl2===BaCO3↓+2NaCl
任务2:写出物质转化的化学方程式并判断化学反应类型。
(1)单质→氧化物→酸→盐(以碳元素为例)
化学方程式 反应类型
点燃
C+O2===CO2
化合反应
CO2+H2O===H2CO3
化合反应
Ca(OH)2+H2CO3===CaCO3↓+2H2O
复分解反应
(2)单质→氧化物→碱→盐(以钙元素为例)
化学方程式 反应类型
2Ca+O2===2CaO
化合反应
CaO+H2O===Ca(OH)2
化合反应
Ca(OH)2+2HCl===CaCl2+2H2O
复分解反应
知识小结
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
O2
O2
H2O
H2O
酸或酸性氧化物
碱或碱性氧化物
单质--氧化物--酸(碱)--盐之间的转化规律
目标二:能用分类观及物质转化规关系解决实际问题。
任务:单质、氧化物、酸、碱、盐之间的转化关系:
通过物质的转化关系制备具体物质。写出相关反应方程式。
(1)用硫磺制备亚硫酸钠(Na2SO3)。
(2)以镁为原料,用三种不同方法制备MgCl2。
(3)用Fe、CuO、H2SO4为原料,用两种方法制备铜。
(1)单质→氧化物→盐:S→SO2→Na2SO3
S+O2=====SO2
SO2+2NaOH=Na2SO3+H2O
(2)①Mg+Cl2=====MgCl2
②Mg+2HCl=MgCl2+H2
③Mg+O2=====2MgO MgO+2HCl=MgCl2+H2O
(3)①Fe+H2SO4=FeSO4+H2 CuO+H2=====Cu+H2O
②CuO+H2SO4=CuSO4+H2O Fe+CuSO4=FeSO4+Cu
点燃
点燃
点燃
高温
物质的转化
酸、碱、盐的性质
酸的性质
碱的性质
盐的性质
金属、非金属、氧化物、酸、碱、盐的转化
化学反应基本类型
