2.3.1化学反应的方向课件(共46张PPT)人教版(2019)选择性必修1
文档属性
| 名称 | 2.3.1化学反应的方向课件(共46张PPT)人教版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 12.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-15 00:35:21 | ||
图片预览










文档简介
(共46张PPT)
1.N2(g)+3H2(g) 2NH3(g) △H=-92.4KJ/mol,但是1molN2和3molH2在一定条件下混合,反应后放出热量却少于92.4KJ。说明了化学反应有什么特点?
化学反应的进行有一定的限度
2.碳和氧气燃烧可以得到二氧化碳,而二氧化碳却很难分解成碳和氧,为什么?又说明了化学反应有怎样的特点?
化学反应的发生有一定的方向性
化学反应原理
化学反应的快慢
——化学反应速率
化学反应的限度
——化学平衡
化学反应的方向
——
可逆反应进行的方向:
1、化学反应速率角度
v正 > v逆
向正反应方向进行
v正 < v逆
向逆反应方向进行
v正 = v逆
平衡状态
2、化学平衡角度
Q向正反应方向进行
Q>K
向逆反应方向进行
Q=K
平衡状态
化学反应进行的方向
如果一个化学反应已经发生,方向也就确定了。
如果还没发生,就需要依据科学理论,
对它是否能够发生,以及在什么条件下发生做出判断。
第二章 化学反应速率与化学平衡
第三节 化学反应的方向
自发过程与非自发过程
过程1:水的流动
飞流直下:不借助外力
抽水上山:借助水泵,
持续消耗电能
高处
低处
自发
非自发
自发过程与非自发过程
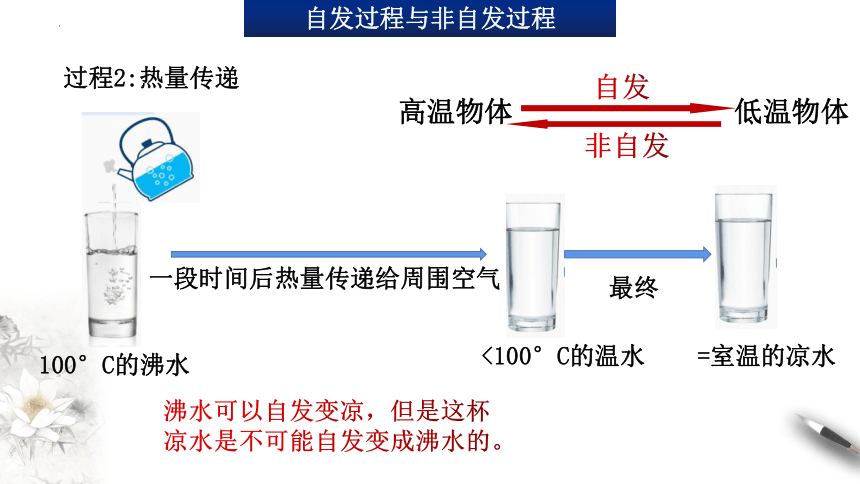
过程2:热量传递
100°C的沸水
一段时间后热量传递给周围空气
<100°C的温水
最终
=室温的凉水
高温物体
低温物体
自发
非自发
沸水可以自发变凉,但是这杯凉水是不可能自发变成沸水的。
自发过程与非自发过程
过程3:氢气燃烧
氢气的燃烧
水的电解
2H2+O2=2H2O
自发
非自发
①在一定条件下,如果一个过程是自发的,那么它的逆过程通常是非自发的
自发过程与非自发过程
水从高处到低处可以用来发电
氢气燃烧可以设计成原电池
处于高水位的水有向低处流动的趋势,但是现在被大坝拦截,此过程并没有实际发生,但是有发生的趋势。
②自发过程可以对外界做功
③“自发”只是有发生的趋势,并不代表实际发生,更不能确定发生的速率。“非自发”也不代表不能发生。
自发过程与非自发过程
过程4:钢铁生锈
自发
非自发
钢铁生锈也是自发反应,但是速率很慢。
过程5:冬天水结冰自发
过程6:春天冰融水自发
④“自发”是一定条件下的自发,条件变了,可能由原来的“自发”变成“非自发”
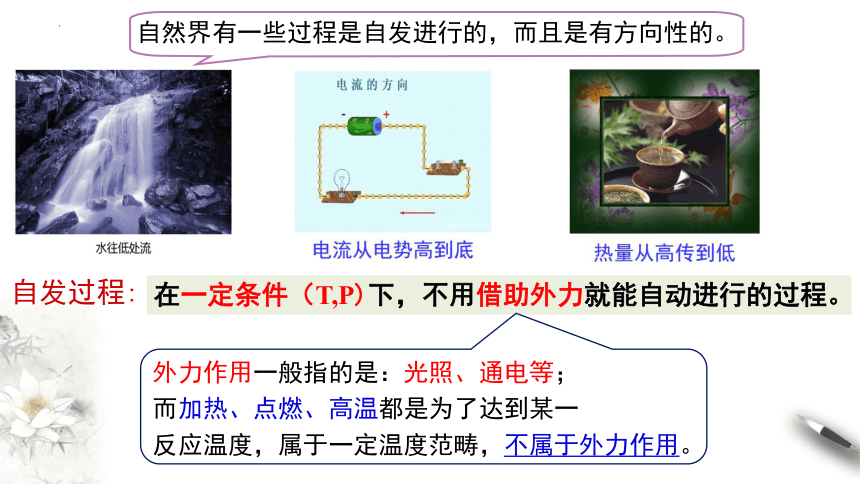
自然界有一些过程是自发进行的,而且是有方向性的。
自发过程:
在一定条件(T,P)下,不用借助外力就能自动进行的过程。
外力作用一般指的是:光照、通电等;
而加热、点燃、高温都是为了达到某一
反应温度,属于一定温度范畴,不属于外力作用。
在一定条件(T,P)下,需要持续借助外力才能进行的过程。
自然界有一些过程是自发进行的,而且是有方向性的。
非自发过程:
与自然界中的许多变化一样,
有些化学反应也是自发进行的,而且有方向性
在一定条件(T、P)下,不需要外力作用(光能,电能)就能自动进行的化学反应。
1、自发反应:
2、非自发反应:
在一定条件(T、P)下,需要持续借助外力作用(光能,电能)才能进行的化学反应。
如何判断一个过程,一个反应能否自发进行?
一、自发反应与非自发反应
下列反应在一定条件下都能自发进行,你知道这些反应能自发进行的原因吗?
①Na(s)+H2O(l)===NaOH(aq)+1/2H2(g)
②铁生锈:2Fe(s)+3/2O2(g)=== Fe2O3(s)
③Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)
④Mg(s)+H2SO4(aq)===MgSO4(aq)+H2(g)
---大多数自发反应为放热反应。
H= -184kJ/mol
H= -824kJ/mol
H= -217kJ/mol
H= -851.5kJ/mol
反应物的总能量高
生成物的总能量低
放热反应
H < 0
体系的能量降低
思考与
讨论:
在19世纪,一些化学家认为,决定反应能否自发进行的因素是反应热,放热反应可以自发进行,而吸热反应不能自发进行。吸热反应都不能自发进行吗?
2NH4Cl(s)+Ba(OH)2·8 H2O(s)===NH3(g)+BaCl2(s)+10H2O(l) H ﹥0
NaHCO3(s)+HCl(aq)===NaCl(aq)+CO2(g)+ H2O(l) H=+31.4kJ/mol
这些反应是吸热反应,但在常温下能自发进行。
【结论】焓减有利于反应自发进行,
但不是唯一的因素。
二、化学反应进行方向的焓判据
体系趋向于从能量高的状态转变为能量低的状态,因此反应放热有利于反应自发进行。
很多自发的化学反应都是焓减的过程,即ΔH<0
放热
反应物
生成物
焓
反应过程
△H<0
1、对于C(s)+ O2(g)=CO2 (g) H =-393.5kJ/mol ,
有同学认为这个过程不能自发,因为需要点燃,你怎么看?
思考与讨论
外力作用一般指的是:光照、通电等;
而加热、点燃、高温都是为了达到某一反应温度,
属于一定温度范畴,不属于外力作用。
在一定条件(T、P)下,不需要外力作用(光能,电能)就能自动进行的化学反应。
自发反应:
因为燃烧反应存在“障碍”——活化能,“点燃”的目的是克服反应的活化能,“启动”反应,使之发生。因为反应放出的热量|△H|>Ea。使得放出的热量足以克服后续反应的活化能,因此在反应引发后,不用持续加热,也能自发进行下去。
思考与讨论
2、为什么有些放热反应需要持续加热呢?
例如:H2(g) + CuO(s) = Cu(s) + H2O(1) H=-128.5KJ/mol
因为此反应所需活化能很大,而反应放出的热量太少,即|△H|反应物
Ea
△H
生成物
反应进程
能量
Ea很小,常温即能自发。
反应物
Ea
△H
生成物
反应进程
能量
Ea稍大,但Ea< | △H | ,给予外界条件一经引发后即能自发。
反应物
Ea
△H
生成物
反应进程
能量
0
Ea稍大,且Ea> | △H | ,需持续给予外界条件才能自发。
小结:自然之法如此神奇,正是很多燃烧反应会遇到“活化能”的壁垒。才使得富含有机物的生命体在富含氧气的大气中没有“自燃”。
思考与讨论
不需要外界的任何作用,气体通过分子的扩散,自发地混合均匀。
这些过程
共同特点:
混乱度小(有序)
自发的
混乱度大(无序)
阅读课本P41-42了解描述体系混乱(或无序)程度的物理量熵
体系除了具有从高能状态自发地转变为低能状态的倾向,还有从有序自发地转变为无序的倾向。
德国科学家克劳修斯(R. Clausius)最早提出了另一个推动体系变化的因素,并称之为
“熵”(符号S)的概念,用熵表示体系混乱。
熵(S):
描述体系混乱(或无序)程度的物理量。单位:J·mol-1·K-1
熵变(△S):
△S = S(生成物)-— S(反应物)
△S>0,熵增反应
△S<0,熵减反应
标准状况下:1 mol 不同物质的熵 S (J· mol-1·K-1)
CH4 O2 CO2
186.15 205.03 214
H2O(l) HNO3(l) Br2(l)
69.9 156 152
NaCl Fe 金刚石
72.1 27.3 2.4
思考:同一物质不同状态下熵值相等吗?
同一物质:S(g)>S(l)>S(s)。
体系混乱度越大,熵值越大;
体系混乱度越小,熵值越小。
熵的大小规律
(1) 与物质的存在状态有关:
(2)与物质的量有关:物质的量越大,分子数越多,熵值越大。
(3)不同物质熵值间的关系:
对于等物质的量同一种物质,
S(g)>S(l)>S(s),即气态>液态>固态。
物质的组成越复杂,其熵值越大,
一般组成物质的原子种类相同时,一个分子中的原子数目越多,其混乱度越大,熵值也越大。
课堂练习、试根据熵的定义判断下列过程中体系的熵变大于零还是小于零
(1)水蒸气冷凝成水
(2)硫酸铜溶于水
(3)CaCO3(s)=CaO(s)+CO2(g)
(4) 2N2O5(g)=4NO2(g)+O2(g)
(5)2H2(g)+ O2(g) =2H2O (l)
△S<0
△S>0
△S>0
△S>0
△S<0
化学反应中,固态物质或液态物质生成气态物质,体系的混乱度增大;从较少的气态物质生成较多的气态物质,体系的混乱度也增大
通常情况下,气体分子数增大的化学反应为熵增的反应。
(6)水煤气转化:CO(g)+H2O(g) === CO2(g)+H2(g)
反应前后气体分子的物质的量没有变化,熵变很小。
思考与讨论:是熵增过程容易自发,还是熵减过程容易自发?
越是有序的状态,越是难以维持
结论:密闭条件下,体系有从有序自发的转变为无序的倾向。
即△S>0有利于反应自发进行,也叫熵增原理,这就是熵判据
三、化学反应进行方向的熵判据
熵变:变化前后体系或反应前后物质的熵的变化。用符号 S表示。
S=S(生成物)-S(反应物)
S>0 熵增
S<0 熵减
熵判据:体系趋向于从有序转变为无序,因此熵增反应(△s>0 )有利于反应自发进行。
导致熵增(△S>0)的一些因素
1、同一物质状态改变:
2、固体的溶解过程、墨水扩散过程和气体扩散过程。
3、反应过程中气体物质的量增多的反应。
4 、生成气体的反应。
熵增过程
墨水滴入水中
气体的扩散
固体的溶解
思考与讨论
所有的自发反应一定是熵增加的反应吗?
有些熵减的过程也可自发进行,即ΔS<0
【结论】熵增有利于反应自发进行,
但不是唯一的因素。
4Fe(OH)2(s) + O2(g) + H2O (l) = 4Fe(OH)3(s)
熵增原理的条件:
不能只根据熵增或熵减来判断化学反应进行的方向。事实上,只有与环境没有物质交换的孤立体系或与环境既没有物质交换也没有热量交换的绝热体系,自发过程才向着熵增的方向进行。
我们生活中遇到的熵增过程
2H2(g)+O2(g)=2H2O(I)
△H<0依焓判据,放热有利于反应自发
△S<0 依熵判据,熵减小不利于反应自发
结论:自发反应的方向与焓变、熵变有关,
判断反应自发进行的方向,
需综合考虑体系的焓变和熵变。
推论: 熵增有利于反应自发进行,
但只根据熵变判断化学反应的方向是不全面的。
判断下列反应能否自发进行
2KClO3(s)==2KCl(s)+3O2(g)
H = -78.03 kJ·mol-1 S = +494.4 J·mol-1·K-1
CO(g)==C(s,石墨)+1/2O2(g)
H =+110.5 kJ·mol-1 S = -89.36 J·mol-1·K-1
4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
H = -444.3kJ·mol-1 S = -280.1 J·mol-1·K-1
CaCO3(s)= CaO(s)+ CO2(g)
H = + 178.2 kJ·mol-1 S = +169.6 J·mol-1·K-1
√
√
X
X
√
X
X
√
利用熵变和焓变对自发反应方向性的判断不一致时,怎么办?
1876年,吉布斯(美)提出自由能变化ΔG,并认为化学反应总是向着自由能减小(ΔG<0 )的方向进行,直至达到平衡。
美国物理化学家吉布斯
四、复合判据(焓与熵复合判据:ΔG=ΔH-TΔS )
1、自由能变化
符号:ΔG,单位:kJ·mol-1
在恒温、恒容的封闭体系中, G = H – T S
2、反应进行方向的判断方法
①当ΔG<0时,反应能自发进行;
②当ΔG=0时,反应处于平衡状态;
③当ΔG>0时,反应不能自发进行。
( T 为热力学温度,T=t +273,单位开尔文 K )
课堂练习根据 G = H – T S计算能否自发进行
2KClO3(s)==2KCl(s)+3O2(g)
△H (25℃)= -78.03 kJ·mol-1
△S(25℃)= +494.4 J·mol-1·K-1
解:
△G=△H-T△S=-78.03 kJ/mol-298K×0.4944 KJ/(mol·K)
=-78.03 kJ/mol-147.33 KJ/mol
=-225.36 kJ/mol
∵△G<0,∴能自发进行。
CO(g)==C(s,石墨)+1/2O2(g)
△H (298K)= +110.5 kJ·mol-1
△S (298K)= -89.36 J·mol-1·K-1
解:
△G=△H-T△S=+110.5 kJ/mol-298K×(-0.08936) KJ/(mol·K)
=+110.5 kJ/mol+26.63 KJ/mol
=+137.13 kJ/mol
∵△G>0,∴不能自发进行。
课堂作业:判断下列反应能否自发进行
1.4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
△H (25℃)= -444.3kJ·mol-1
△S (25℃)= -280.1 J·mol-1·K-1
2.CaCO3(s) = CaO(s)+CO2(g)
△H (298K)= +178.2 kJ·mol-1
△S (298K)= +169.6 J·mol-1·K-1
四、复合判据(焓与熵复合判据:ΔG=ΔH-TΔS )
① H<0, S>0
G= H-T S<0
② H>0, S<0)
G= H-T S > 0
③ H>0, S>0?
④ H<0, S<0?
G= H-T S
取决于温度
反应能自发进行
反应不能自发进行
高温下能自发
低温下能自发
“自发反应”也是有一定条件的
2、反应进行方向的判断方法
△S
△H
H<0
S>0
能自发
H>0
S>0
高温下自发
H<0
S<0
低温下自发
H<0 ,
S<0
不能自发
反应在该状况下能否自发进行
<0 >0
>0 <0
>0 >0
<0 <0
H
S
G
<0
>0
低温时>0,高温时<0
低温时<0,高温时>0
自发进行
不自发进行
低温不自发,高温自发
低温自发,高温不自发
【学习评价】
1.下列过程是非自发的是∶( )
A.水由高处向低处流 B.天然气的燃烧
C.铁在潮湿空气中生锈 D.室温下水结成冰
2.碳酸铵〔(NH4)2CO3〕在室温下就能自发地分解产生氨气,对其说法中正确的是∶( )
A.其分解是因为生成了易挥发的气体,使体系的熵增大
B.其分解是因为外界给予了能量
C.其分解是吸热反应,据能量判据不能自发分解
D.碳酸盐都不稳定,都能自发分解
D
A
【学习评价】
3.以下自发反应可用焓判据来解释的是( )
A.硝酸铵自发地溶于水
B.2N2O5(g)===4NO2(g)+O2(g);△H=+56.7kJ/mol
C.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g); △H=+74.9 kJ/mol
D.2H2(g)+O2(g)=2H2O(l); △H=-571.6 kJ/mol
D
4.下列反应中,熵减小的是( )
D
A.(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)
B.2N2O5(g)=4NO2(g)+O2(g)
C.MgCO3(s)=MgO(s)+CO2(g)
D.2CO(g)=2C(s)+O2(g)
【学习评价】
5.某化学反应其△H= -122 kJ·mol-1, S=+ 231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行 ( )
A.在任何温度下都能自发进行
B.在任何温度下都不能自发进行
C.仅在高温下自发进行
D.仅在低温下自发进行
A
课堂小结
化学反应进行的方向
影响因素
反应焓变
温度
反应熵变
焓减小有利于反应自发
熵增大有利于反应自发
复合判据
G = H – T S< 0 自发
课堂小结
化学反应进行的方向
焓判据
熵判据
复合判据
能量降低的方向,就是反应容易进行的方向( H<0)
熵增的方向,就是反应容易进行的方向( S>0)
吉布斯自由能减小的方向,
就是反应容易进行的方向( G<0)
自由能判据
△G = △H - T△S
△S
△H
H<0
S>0
所有温度下
反应自发进行
H>0
S>0
高温下
反应自发进行
H<0
S<0
低温下
反应自发进行
H>0
S<0
所有温度下
反应不能自发进行
课堂达标
1、一定条件下发生反应:CO2(g)+3H2 (g) CH3OH(g) +H20(g),如图表示该反应过程中能量(单位为KJ/mol)的变化。关于该反应的下列说法中,正确的是( )
A.ΔH>O,ΔS>0
B.ΔH>O,ΔS<0
C. ΔH<0,ΔS<0
D.ΔH<0,ΔS>0
C
2、已知下列反应都能自发进行,其中不能用“焓判据”解释的是( )
A.2Na(s)+Cl2(g)=2NaCl(s) ΔH<0
B.C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH<0
C. 2NH4Cl(s)+Ba(OH)2·8 H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l) ΔH>0
D.2Mg(s)+O2(g)=2MgO(s) ΔH<0
C
3、关于下列过程熵变的判断不正确的是( )
A.溶解少量食盐于水中,△S>0
B.纯碳和氧气反应生成CO(g),△S>0
C.H2O(g)变成液态水,△S>0
D.CaCO3(s)加热分解为CaO(s)和CO2(g),△S>0
C
4、汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)=N2(g)+2CO2(g)。由此可知,下列说法正确的是( )
A.该反应是熵增大的反应
B.该反应不能自发进行,因此需要合适的催化剂
C.该反应常温下能自发进行,催化剂条件只是增大反应的速率
D.该反应常温下能自发进行,因为正反应是吸热反应
C
5、某化学反应的ΔH=-122 kJ·mol-1,ΔS=+231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行( )
A.在任何温度下都能自发进行
B.在任何温度下都不能自发进行
C.仅在高温下自发进行
D.仅在低温下自发进行
A
1.N2(g)+3H2(g) 2NH3(g) △H=-92.4KJ/mol,但是1molN2和3molH2在一定条件下混合,反应后放出热量却少于92.4KJ。说明了化学反应有什么特点?
化学反应的进行有一定的限度
2.碳和氧气燃烧可以得到二氧化碳,而二氧化碳却很难分解成碳和氧,为什么?又说明了化学反应有怎样的特点?
化学反应的发生有一定的方向性
化学反应原理
化学反应的快慢
——化学反应速率
化学反应的限度
——化学平衡
化学反应的方向
——
可逆反应进行的方向:
1、化学反应速率角度
v正 > v逆
向正反应方向进行
v正 < v逆
向逆反应方向进行
v正 = v逆
平衡状态
2、化学平衡角度
Q
Q>K
向逆反应方向进行
Q=K
平衡状态
化学反应进行的方向
如果一个化学反应已经发生,方向也就确定了。
如果还没发生,就需要依据科学理论,
对它是否能够发生,以及在什么条件下发生做出判断。
第二章 化学反应速率与化学平衡
第三节 化学反应的方向
自发过程与非自发过程
过程1:水的流动
飞流直下:不借助外力
抽水上山:借助水泵,
持续消耗电能
高处
低处
自发
非自发
自发过程与非自发过程
过程2:热量传递
100°C的沸水
一段时间后热量传递给周围空气
<100°C的温水
最终
=室温的凉水
高温物体
低温物体
自发
非自发
沸水可以自发变凉,但是这杯凉水是不可能自发变成沸水的。
自发过程与非自发过程
过程3:氢气燃烧
氢气的燃烧
水的电解
2H2+O2=2H2O
自发
非自发
①在一定条件下,如果一个过程是自发的,那么它的逆过程通常是非自发的
自发过程与非自发过程
水从高处到低处可以用来发电
氢气燃烧可以设计成原电池
处于高水位的水有向低处流动的趋势,但是现在被大坝拦截,此过程并没有实际发生,但是有发生的趋势。
②自发过程可以对外界做功
③“自发”只是有发生的趋势,并不代表实际发生,更不能确定发生的速率。“非自发”也不代表不能发生。
自发过程与非自发过程
过程4:钢铁生锈
自发
非自发
钢铁生锈也是自发反应,但是速率很慢。
过程5:冬天水结冰自发
过程6:春天冰融水自发
④“自发”是一定条件下的自发,条件变了,可能由原来的“自发”变成“非自发”
自然界有一些过程是自发进行的,而且是有方向性的。
自发过程:
在一定条件(T,P)下,不用借助外力就能自动进行的过程。
外力作用一般指的是:光照、通电等;
而加热、点燃、高温都是为了达到某一
反应温度,属于一定温度范畴,不属于外力作用。
在一定条件(T,P)下,需要持续借助外力才能进行的过程。
自然界有一些过程是自发进行的,而且是有方向性的。
非自发过程:
与自然界中的许多变化一样,
有些化学反应也是自发进行的,而且有方向性
在一定条件(T、P)下,不需要外力作用(光能,电能)就能自动进行的化学反应。
1、自发反应:
2、非自发反应:
在一定条件(T、P)下,需要持续借助外力作用(光能,电能)才能进行的化学反应。
如何判断一个过程,一个反应能否自发进行?
一、自发反应与非自发反应
下列反应在一定条件下都能自发进行,你知道这些反应能自发进行的原因吗?
①Na(s)+H2O(l)===NaOH(aq)+1/2H2(g)
②铁生锈:2Fe(s)+3/2O2(g)=== Fe2O3(s)
③Zn(s)+CuSO4(aq)===ZnSO4(aq)+Cu(s)
④Mg(s)+H2SO4(aq)===MgSO4(aq)+H2(g)
---大多数自发反应为放热反应。
H= -184kJ/mol
H= -824kJ/mol
H= -217kJ/mol
H= -851.5kJ/mol
反应物的总能量高
生成物的总能量低
放热反应
H < 0
体系的能量降低
思考与
讨论:
在19世纪,一些化学家认为,决定反应能否自发进行的因素是反应热,放热反应可以自发进行,而吸热反应不能自发进行。吸热反应都不能自发进行吗?
2NH4Cl(s)+Ba(OH)2·8 H2O(s)===NH3(g)+BaCl2(s)+10H2O(l) H ﹥0
NaHCO3(s)+HCl(aq)===NaCl(aq)+CO2(g)+ H2O(l) H=+31.4kJ/mol
这些反应是吸热反应,但在常温下能自发进行。
【结论】焓减有利于反应自发进行,
但不是唯一的因素。
二、化学反应进行方向的焓判据
体系趋向于从能量高的状态转变为能量低的状态,因此反应放热有利于反应自发进行。
很多自发的化学反应都是焓减的过程,即ΔH<0
放热
反应物
生成物
焓
反应过程
△H<0
1、对于C(s)+ O2(g)=CO2 (g) H =-393.5kJ/mol ,
有同学认为这个过程不能自发,因为需要点燃,你怎么看?
思考与讨论
外力作用一般指的是:光照、通电等;
而加热、点燃、高温都是为了达到某一反应温度,
属于一定温度范畴,不属于外力作用。
在一定条件(T、P)下,不需要外力作用(光能,电能)就能自动进行的化学反应。
自发反应:
因为燃烧反应存在“障碍”——活化能,“点燃”的目的是克服反应的活化能,“启动”反应,使之发生。因为反应放出的热量|△H|>Ea。使得放出的热量足以克服后续反应的活化能,因此在反应引发后,不用持续加热,也能自发进行下去。
思考与讨论
2、为什么有些放热反应需要持续加热呢?
例如:H2(g) + CuO(s) = Cu(s) + H2O(1) H=-128.5KJ/mol
因为此反应所需活化能很大,而反应放出的热量太少,即|△H|
Ea
△H
生成物
反应进程
能量
Ea很小,常温即能自发。
反应物
Ea
△H
生成物
反应进程
能量
Ea稍大,但Ea< | △H | ,给予外界条件一经引发后即能自发。
反应物
Ea
△H
生成物
反应进程
能量
0
Ea稍大,且Ea> | △H | ,需持续给予外界条件才能自发。
小结:自然之法如此神奇,正是很多燃烧反应会遇到“活化能”的壁垒。才使得富含有机物的生命体在富含氧气的大气中没有“自燃”。
思考与讨论
不需要外界的任何作用,气体通过分子的扩散,自发地混合均匀。
这些过程
共同特点:
混乱度小(有序)
自发的
混乱度大(无序)
阅读课本P41-42了解描述体系混乱(或无序)程度的物理量熵
体系除了具有从高能状态自发地转变为低能状态的倾向,还有从有序自发地转变为无序的倾向。
德国科学家克劳修斯(R. Clausius)最早提出了另一个推动体系变化的因素,并称之为
“熵”(符号S)的概念,用熵表示体系混乱。
熵(S):
描述体系混乱(或无序)程度的物理量。单位:J·mol-1·K-1
熵变(△S):
△S = S(生成物)-— S(反应物)
△S>0,熵增反应
△S<0,熵减反应
标准状况下:1 mol 不同物质的熵 S (J· mol-1·K-1)
CH4 O2 CO2
186.15 205.03 214
H2O(l) HNO3(l) Br2(l)
69.9 156 152
NaCl Fe 金刚石
72.1 27.3 2.4
思考:同一物质不同状态下熵值相等吗?
同一物质:S(g)>S(l)>S(s)。
体系混乱度越大,熵值越大;
体系混乱度越小,熵值越小。
熵的大小规律
(1) 与物质的存在状态有关:
(2)与物质的量有关:物质的量越大,分子数越多,熵值越大。
(3)不同物质熵值间的关系:
对于等物质的量同一种物质,
S(g)>S(l)>S(s),即气态>液态>固态。
物质的组成越复杂,其熵值越大,
一般组成物质的原子种类相同时,一个分子中的原子数目越多,其混乱度越大,熵值也越大。
课堂练习、试根据熵的定义判断下列过程中体系的熵变大于零还是小于零
(1)水蒸气冷凝成水
(2)硫酸铜溶于水
(3)CaCO3(s)=CaO(s)+CO2(g)
(4) 2N2O5(g)=4NO2(g)+O2(g)
(5)2H2(g)+ O2(g) =2H2O (l)
△S<0
△S>0
△S>0
△S>0
△S<0
化学反应中,固态物质或液态物质生成气态物质,体系的混乱度增大;从较少的气态物质生成较多的气态物质,体系的混乱度也增大
通常情况下,气体分子数增大的化学反应为熵增的反应。
(6)水煤气转化:CO(g)+H2O(g) === CO2(g)+H2(g)
反应前后气体分子的物质的量没有变化,熵变很小。
思考与讨论:是熵增过程容易自发,还是熵减过程容易自发?
越是有序的状态,越是难以维持
结论:密闭条件下,体系有从有序自发的转变为无序的倾向。
即△S>0有利于反应自发进行,也叫熵增原理,这就是熵判据
三、化学反应进行方向的熵判据
熵变:变化前后体系或反应前后物质的熵的变化。用符号 S表示。
S=S(生成物)-S(反应物)
S>0 熵增
S<0 熵减
熵判据:体系趋向于从有序转变为无序,因此熵增反应(△s>0 )有利于反应自发进行。
导致熵增(△S>0)的一些因素
1、同一物质状态改变:
2、固体的溶解过程、墨水扩散过程和气体扩散过程。
3、反应过程中气体物质的量增多的反应。
4 、生成气体的反应。
熵增过程
墨水滴入水中
气体的扩散
固体的溶解
思考与讨论
所有的自发反应一定是熵增加的反应吗?
有些熵减的过程也可自发进行,即ΔS<0
【结论】熵增有利于反应自发进行,
但不是唯一的因素。
4Fe(OH)2(s) + O2(g) + H2O (l) = 4Fe(OH)3(s)
熵增原理的条件:
不能只根据熵增或熵减来判断化学反应进行的方向。事实上,只有与环境没有物质交换的孤立体系或与环境既没有物质交换也没有热量交换的绝热体系,自发过程才向着熵增的方向进行。
我们生活中遇到的熵增过程
2H2(g)+O2(g)=2H2O(I)
△H<0依焓判据,放热有利于反应自发
△S<0 依熵判据,熵减小不利于反应自发
结论:自发反应的方向与焓变、熵变有关,
判断反应自发进行的方向,
需综合考虑体系的焓变和熵变。
推论: 熵增有利于反应自发进行,
但只根据熵变判断化学反应的方向是不全面的。
判断下列反应能否自发进行
2KClO3(s)==2KCl(s)+3O2(g)
H = -78.03 kJ·mol-1 S = +494.4 J·mol-1·K-1
CO(g)==C(s,石墨)+1/2O2(g)
H =+110.5 kJ·mol-1 S = -89.36 J·mol-1·K-1
4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
H = -444.3kJ·mol-1 S = -280.1 J·mol-1·K-1
CaCO3(s)= CaO(s)+ CO2(g)
H = + 178.2 kJ·mol-1 S = +169.6 J·mol-1·K-1
√
√
X
X
√
X
X
√
利用熵变和焓变对自发反应方向性的判断不一致时,怎么办?
1876年,吉布斯(美)提出自由能变化ΔG,并认为化学反应总是向着自由能减小(ΔG<0 )的方向进行,直至达到平衡。
美国物理化学家吉布斯
四、复合判据(焓与熵复合判据:ΔG=ΔH-TΔS )
1、自由能变化
符号:ΔG,单位:kJ·mol-1
在恒温、恒容的封闭体系中, G = H – T S
2、反应进行方向的判断方法
①当ΔG<0时,反应能自发进行;
②当ΔG=0时,反应处于平衡状态;
③当ΔG>0时,反应不能自发进行。
( T 为热力学温度,T=t +273,单位开尔文 K )
课堂练习根据 G = H – T S计算能否自发进行
2KClO3(s)==2KCl(s)+3O2(g)
△H (25℃)= -78.03 kJ·mol-1
△S(25℃)= +494.4 J·mol-1·K-1
解:
△G=△H-T△S=-78.03 kJ/mol-298K×0.4944 KJ/(mol·K)
=-78.03 kJ/mol-147.33 KJ/mol
=-225.36 kJ/mol
∵△G<0,∴能自发进行。
CO(g)==C(s,石墨)+1/2O2(g)
△H (298K)= +110.5 kJ·mol-1
△S (298K)= -89.36 J·mol-1·K-1
解:
△G=△H-T△S=+110.5 kJ/mol-298K×(-0.08936) KJ/(mol·K)
=+110.5 kJ/mol+26.63 KJ/mol
=+137.13 kJ/mol
∵△G>0,∴不能自发进行。
课堂作业:判断下列反应能否自发进行
1.4Fe(OH)2(s)+2H2O(l)+O2(g)==4Fe(OH)3(s)
△H (25℃)= -444.3kJ·mol-1
△S (25℃)= -280.1 J·mol-1·K-1
2.CaCO3(s) = CaO(s)+CO2(g)
△H (298K)= +178.2 kJ·mol-1
△S (298K)= +169.6 J·mol-1·K-1
四、复合判据(焓与熵复合判据:ΔG=ΔH-TΔS )
① H<0, S>0
G= H-T S<0
② H>0, S<0)
G= H-T S > 0
③ H>0, S>0?
④ H<0, S<0?
G= H-T S
取决于温度
反应能自发进行
反应不能自发进行
高温下能自发
低温下能自发
“自发反应”也是有一定条件的
2、反应进行方向的判断方法
△S
△H
H<0
S>0
能自发
H>0
S>0
高温下自发
H<0
S<0
低温下自发
H<0 ,
S<0
不能自发
反应在该状况下能否自发进行
<0 >0
>0 <0
>0 >0
<0 <0
H
S
G
<0
>0
低温时>0,高温时<0
低温时<0,高温时>0
自发进行
不自发进行
低温不自发,高温自发
低温自发,高温不自发
【学习评价】
1.下列过程是非自发的是∶( )
A.水由高处向低处流 B.天然气的燃烧
C.铁在潮湿空气中生锈 D.室温下水结成冰
2.碳酸铵〔(NH4)2CO3〕在室温下就能自发地分解产生氨气,对其说法中正确的是∶( )
A.其分解是因为生成了易挥发的气体,使体系的熵增大
B.其分解是因为外界给予了能量
C.其分解是吸热反应,据能量判据不能自发分解
D.碳酸盐都不稳定,都能自发分解
D
A
【学习评价】
3.以下自发反应可用焓判据来解释的是( )
A.硝酸铵自发地溶于水
B.2N2O5(g)===4NO2(g)+O2(g);△H=+56.7kJ/mol
C.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g); △H=+74.9 kJ/mol
D.2H2(g)+O2(g)=2H2O(l); △H=-571.6 kJ/mol
D
4.下列反应中,熵减小的是( )
D
A.(NH4 )2CO3(s)=NH4HCO3(s)+NH3(g)
B.2N2O5(g)=4NO2(g)+O2(g)
C.MgCO3(s)=MgO(s)+CO2(g)
D.2CO(g)=2C(s)+O2(g)
【学习评价】
5.某化学反应其△H= -122 kJ·mol-1, S=+ 231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行 ( )
A.在任何温度下都能自发进行
B.在任何温度下都不能自发进行
C.仅在高温下自发进行
D.仅在低温下自发进行
A
课堂小结
化学反应进行的方向
影响因素
反应焓变
温度
反应熵变
焓减小有利于反应自发
熵增大有利于反应自发
复合判据
G = H – T S< 0 自发
课堂小结
化学反应进行的方向
焓判据
熵判据
复合判据
能量降低的方向,就是反应容易进行的方向( H<0)
熵增的方向,就是反应容易进行的方向( S>0)
吉布斯自由能减小的方向,
就是反应容易进行的方向( G<0)
自由能判据
△G = △H - T△S
△S
△H
H<0
S>0
所有温度下
反应自发进行
H>0
S>0
高温下
反应自发进行
H<0
S<0
低温下
反应自发进行
H>0
S<0
所有温度下
反应不能自发进行
课堂达标
1、一定条件下发生反应:CO2(g)+3H2 (g) CH3OH(g) +H20(g),如图表示该反应过程中能量(单位为KJ/mol)的变化。关于该反应的下列说法中,正确的是( )
A.ΔH>O,ΔS>0
B.ΔH>O,ΔS<0
C. ΔH<0,ΔS<0
D.ΔH<0,ΔS>0
C
2、已知下列反应都能自发进行,其中不能用“焓判据”解释的是( )
A.2Na(s)+Cl2(g)=2NaCl(s) ΔH<0
B.C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH<0
C. 2NH4Cl(s)+Ba(OH)2·8 H2O(s)=2NH3(g)+BaCl2(s)+10H2O(l) ΔH>0
D.2Mg(s)+O2(g)=2MgO(s) ΔH<0
C
3、关于下列过程熵变的判断不正确的是( )
A.溶解少量食盐于水中,△S>0
B.纯碳和氧气反应生成CO(g),△S>0
C.H2O(g)变成液态水,△S>0
D.CaCO3(s)加热分解为CaO(s)和CO2(g),△S>0
C
4、汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,其反应原理是2NO(g)+2CO(g)=N2(g)+2CO2(g)。由此可知,下列说法正确的是( )
A.该反应是熵增大的反应
B.该反应不能自发进行,因此需要合适的催化剂
C.该反应常温下能自发进行,催化剂条件只是增大反应的速率
D.该反应常温下能自发进行,因为正反应是吸热反应
C
5、某化学反应的ΔH=-122 kJ·mol-1,ΔS=+231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行( )
A.在任何温度下都能自发进行
B.在任何温度下都不能自发进行
C.仅在高温下自发进行
D.仅在低温下自发进行
A
