3.2.1水的电离课件(共25张ppt)化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.2.1水的电离课件(共25张ppt)化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1002.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-15 07:26:45 | ||
图片预览





文档简介
(共25张PPT)
第二节 水的电离和溶液的pH
第1课时 水的电离
引入
在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂水是全部以分子形式存在(如图3-5),还是部分以离子形式存在呢 怎样验证你的猜想?
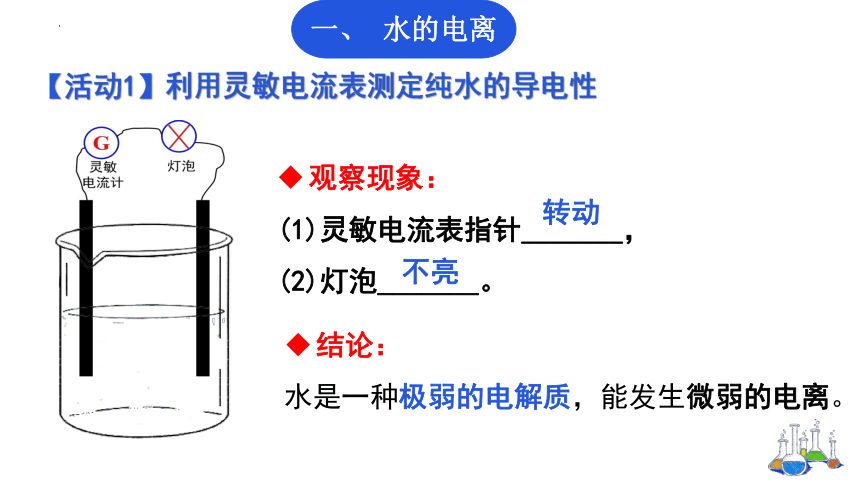
观察现象:
(1)灵敏电流表指针_______,
(2)灯泡_______。
转动
不亮
结论:
水是一种极弱的电解质,能发生微弱的电离。
【活动1】利用灵敏电流表测定纯水的导电性
一、 水的电离
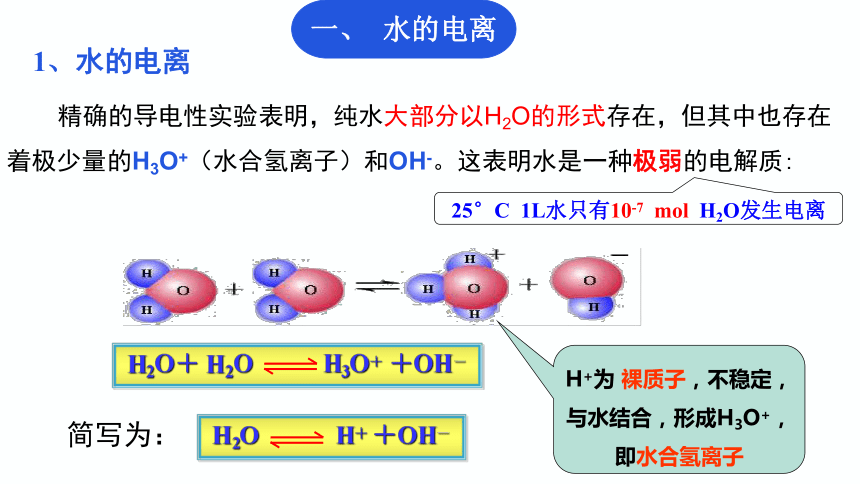
精确的导电性实验表明,纯水大部分以H2O的形式存在,但其中也存在着极少量的H3O+(水合氢离子)和OH-。这表明水是一种极弱的电解质:
1、水的电离
25°C 1L水只有10-7 mol H2O发生电离
H2O+ H2O H3O+ +OH-
简写为:
H2O H+ +OH-
H+为 裸质子,不稳定,与水结合,形成H3O+,即水合氢离子
一、 水的电离
(1)定义:当水的电离达到平衡时,溶液中的c(H+)总和c(OH-) 总乘积是一个常数,叫做水的离子积常数,记作 KW。
(2)表达式:KW = K水电离·c(H2O) = c(H+)总·c(OH-) 总
注意:
因纯水中:水电离出的c(H+)=c(OH-)=10-7mol·L-1。
1. 25 ℃, 纯水中 KW=c(H+)总·c(OH-)总 =10-14,
2. KW不仅适用于纯水,也适用于任何稀的电解质水溶液。
2、水的离子积常数KW
【思考】如何衡量水的电离程度?
K电离=
c(H+) ×c(OH-)
c(H2O)
(4)影响因素:
Kw只受温度影响。温度升高,促进水的电离,水的离子积增大。
注意:
25℃, Kw = 1×10-14; 100℃, Kw = 55×10-14 ≈ 1.0×10-12
T/℃ 0 10 20 25 40 50 100
Kw/ 10-14 0.114 0.292 0.681 1.00 2.92 5.47 55.0
【思考】分析表格中的数据,有何规律,得出什么结论?并解释?
2、水的离子积常数KW
水的电离方程式为:H2O H+ + OH-, H >0 。
条 件 移动方向 c(H+) c(OH-) 电离度α Kw
升 温
加入Na(s)
通入HCl
加 NaOH
加FeCl3(s)
加入NH4Cl(s)
3、水的电离平衡的影响因素
右移 增大 增大 增大 增大
右移 减小 增大 增大 不变
左移 增大 减小 减小 不变
左移 减小 增大 减小 不变
右移 增大 减小 增大 不变
右移 增大 减小 增大 不变
结论:
1. 加热 或 加入活泼金属 或 加入含弱离子的盐能促进水的电离;
2. 加酸 或 加碱 能抑制水的电离。
1.在常温下,某溶液中,由水电离产生的c(H+) =1×10-9 mol/L,
则该溶液的酸碱性如何?
学 与 问
答:该溶液水的电离受到了抑制,可能是酸性也可能是碱性
2.在常温下,某溶液中,由水电离产生的c(0H-) =1×10-3 mol/L,
则该溶液可能是加入了哪些试剂?
答:该溶液水的电离受到了促进,可能是加入了活泼金属,
或加入了含弱离子的盐,消耗了水电离出的 c(H+)或c(0H-)
促进了水的电离。
【练习1】在25 ℃时,水的离子积Kw=1.0×10-14;在35 ℃时,水的离子积Kw=2.1×10-14则下列叙述正确的是( )
A. c(H+)随着温度的升高而降低
B. 35 ℃时,c(H+)>c(OH-)
C. 35 ℃时的水比25 ℃时的水电离程度小
D. 升高温度,水的电离程度增大,纯水仍显中性
解析:由题中条件可以看出,温度升高时,Kw增大。25 ℃时,c(H+)=c(OH-)=1×10-7 mol·L-1;35 ℃时,c(H+)=c(OH-)≈1.45×10-7 mol·L-1。温度升高,c(H+) 和c(OH-) 都增大,且始终相等,水的电离程度也增大,因温度升高平衡向正反应方向移动,故水的电离为吸热过程。
D
跟踪训练
1. 某温度时,水溶液中Kw=4.0×10-14,那么该温度比常温(25 ℃)高还是低?该温度下纯水中c(H+)是多少?
【深度思考】
提示:因此时水的离子积大于常温时水的离子积,故温度高于25 ℃,此时c(H+)=2×10-7mol·L-1。
2.水的离子积常数Kw=c(H+)·c(OH-),溶液中H+和OH-一定是水电离出来的吗?
提示:不一定。c(H+)和c(OH-)均指溶液中H+或OH-的总浓度,如盐酸中的H+包括HCl和H2O电离产生的H+,即c(H+)=c酸(H+)+c水(H+),而OH-全部来自水的电离。
一、 水的电离
【例1】常温下, 0. 1 mol·L-1的盐酸溶液中c(H+)、c(OH-)的来源 具体数值?由水电离产生的c(H+)与c(OH-)是多少?
二、水电离出的c(H+)或者c(OH-)的计算
c(H+)=_______________,来源于_________________
c(OH-)=_______________,来源于_________________
KW=_______________。
由水电离出的c(OH-)水=_______________,
c(H+)水=_______________。
0.1 mol/L
酸的电离和水的电离
1.0×10-13 mol/L
水的电离
1.0×10-14
1.0×10-13 mol/L
1.0×10-13 mol/L
【例2】常温下,浓度为0.01 mol·L-1的NaOH溶液中,c(H+)、c(OH-)的来源 由水电离产生的c水(H+)与c水(OH-)是多少?
【解析】
0.01 mol·L-1NaOH溶液中c(OH-)=0.01 mol·L-1 (NaOH电离产生)。
根据25 ℃时水的离子积Kw=1.0×10-14,
可得c碱(OH-)·c水(H+)=1.0×10-14,
解得c水(H+)=c水(OH-)=1.0×10-12 mol·L-1。
在任何水溶液中,c(H+)、 c(OH-) 可能不同,但是任何水溶液中水电离的c水电离(H+)、 c水电离(OH-) 总是相等。
规律小结
任何水溶液中都存在:Kw=c(H+)总 . c(OH-)总,
Kw只受温度影响,温度升高,Kw增大。
(1)曲线上的任意点(如a,b,c)的Kw都 ,即c(H+)·c(OH-) ,温度 。
(2)曲线外的任意点(如d)与曲线上任意点的Kw ,温度 。
相同
相同
相同
(3)实现曲线上点之间的转化需保持温度不变,改变 ;实现曲线上点与曲线外点之间的转化一定改变 。
不同
不同
酸碱性
温度
三、Kw的应用
1、水的电离平衡曲线的理解与识别
(1)A点水的离子积为________,
E点水的离子积为________。
造成A、E点水的离子积变化的原因是:______。
1×10-14
1×10-12
水的电离要吸热,温度升高,水的电离程度增大,即离子积增大
(2)25℃时,若向溶液中滴加盐酸,
能否使体系处于A点位置 为什么
____________________________________________。
(3)100 ℃时,若盐酸中c(H+)=5×10-4 mol·L-1,则由水电离产生的c(H+)=________。
否,在盐酸中c(H+)≠c(OH-),所以不可能处于A点
2×10-9 mol·L-1
(4)图中五点Kw间的大小关系:
【例题】在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
E>D>A=B=C
三、Kw的应用
1.常温下,下列各溶液中水的电离度最大的是( )
A PH=1的硫酸溶液
B c(H+)=1×10-10 mol/L的纯碱溶液
C 0.01mol/L的烧碱溶液
D c(H+)=1×10-5 mol/L的硫酸铵溶液
B
巩固练习
判断水电离的影响因素:
【酸碱抑制盐热促进】
水电离的计算:
【酸碱取小盐取大】
巩固练习
2.(1)常温下,浓度为1×10-5 mol/L的盐酸溶液中,
由水电离产生的c(H+)是多少?
解:
酸溶液中Kw =
c(H+)酸 · c(OH-) 水
c(OH-)水 =
c(H+)水 =
Kw
c(H+)酸
= 1×10-9 mol/L
=
1×10-14
1×10-5 mol/L
(2)常温下,浓度为1×10-5 mol/L的NaOH溶液中,
由水电离产生的c(OH-)是多少?
解:
碱溶液中Kw =
c (H+)水 · c(OH-)碱
c(OH-)水 =
c(H+)水 =
Kw
c(OH-)碱
=
1×10-14
1×10-5 mol/L
= 1×10-9 mol/L
在常温下,由水电离产生的c(H+) =1×10-9 mol/L
的溶液,则该溶液的酸碱性如何?
答:可能是酸性也可能是碱性
2.常温下,下列三种溶液中,由水电离出的氢离子浓度之比为( )
①1 mol·L-1的盐酸 ②0.1 mol·L-1的盐酸 ③0.01 mol·L-1的NaOH
A.1∶10∶100 B.0∶1∶12
C.14∶13∶12 D.14∶13∶2
解析:
①1 mol·L-1盐酸中c(H+)=1 mol·L-1,由水电离出的c水(H+)=10-14 mol·L-1。
②0.1 mol·L-1盐酸中c(H+)=0.1 mol·L-1,由水电离出的c(H+)水=10-13 mol·L-1,
③0.01 mol·L-1 NaOH溶液中,c(OH-) =0.01 mol·L-1,由水电离出的c(H+)水=10-12 mol·L-1,
则三者由水电离出的氢离子浓度之比为10-14∶10-13∶10-12=1∶10∶100。
答案:A
(1)升高温度,水的电离平衡右移,溶液中的c(H+)和c(OH-)均增大,但Kw不变。( )
(2)25 ℃时,水的离子积Kw=1.0×10-14,35 ℃时水的离子积Kw=2.1×10-14,则35 ℃时纯水中的c(H+)>c(OH-)。( )
(3)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。 ( )
(4)向水中加入酸抑制水的电离,向水中加入碱促进水的电离。( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
√
×
2.在氨水中存在的粒子有 ;
在氯水中存在的粒子有 。
NH3、NH3 H2O、H2O、OH-、NH4+、H+
Cl2、H2O、H+、OH-、ClO-、HClO、Cl-
巩固训练
2、(1)常温下,某溶液中由水电离出来的c(H+)=1.0×10-11 mol·L-1,该溶液可能是________。
①二氧化硫的水溶液 ②氯化钠水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
①④
(2)某温度下,纯水的c(H+)=2×10-7 mol·L-1,则此时纯水的c(OH-)为__________________。若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·
L-1,则溶液中c(OH-)为________________,此时温度______(填“高于”“低于”或“等于”)25 ℃。
2×10-7 mol·L-1
8×10-11 mol·L-1
高于
3、常温下,在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2-
② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
酸性条件不能共存
碱性条件不能共存
能共存
酸、碱性条件都不能共存
能共存
B
4.25 ℃时,水的电离达到平衡:H2O H++OH- ΔH>0。下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)减小
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体钠,平衡逆向移动,c(H+)减小
D.将水加热,KW增大,c(H+)不变
解析:向水中加入稀氨水,OH-浓度增大,水的电离平衡逆向移动,A项错误;硫酸氢钠是强酸酸式盐,向水中加入少量固体硫酸氢钠,其在水溶液中完全电离: c(H+)增大,由于KW只与温度有关,所以KW不变,B项正确;向水中加入少量固体钠,由于金属钠非常活泼,可与水电离出的H+直接发生置换反应,产生H2,故促进了水的电离,使平衡正向移动,C项错误;将水加热,KW增大,c(H+)、c(OH-)同等倍数增大,D项错误。
√
5. 常温下,0.1 mol·L-1的NaOH溶液中由水电离出的OH-的物质的量浓度为( )
A.0.1 mol·L-1 B.1.0×10-13 mol·L-1
C.1.0×10-7 mol·L-1 D.1.0×10-6 mol·L-1
B
碱溶液中Kw =
c(H+)水 · c(OH-)碱
c(OH-)水=
c(H+)水 =
Kw
c(OH-)碱
=
1×10-14
1×10-1 mol/L
= 1×10-13 mol/L
解析:
水电离:
酸碱抑制取小值
第二节 水的电离和溶液的pH
第1课时 水的电离
引入
在水溶液中,酸、碱和盐全部或部分以离子形式存在,那么,其中的溶剂水是全部以分子形式存在(如图3-5),还是部分以离子形式存在呢 怎样验证你的猜想?
观察现象:
(1)灵敏电流表指针_______,
(2)灯泡_______。
转动
不亮
结论:
水是一种极弱的电解质,能发生微弱的电离。
【活动1】利用灵敏电流表测定纯水的导电性
一、 水的电离
精确的导电性实验表明,纯水大部分以H2O的形式存在,但其中也存在着极少量的H3O+(水合氢离子)和OH-。这表明水是一种极弱的电解质:
1、水的电离
25°C 1L水只有10-7 mol H2O发生电离
H2O+ H2O H3O+ +OH-
简写为:
H2O H+ +OH-
H+为 裸质子,不稳定,与水结合,形成H3O+,即水合氢离子
一、 水的电离
(1)定义:当水的电离达到平衡时,溶液中的c(H+)总和c(OH-) 总乘积是一个常数,叫做水的离子积常数,记作 KW。
(2)表达式:KW = K水电离·c(H2O) = c(H+)总·c(OH-) 总
注意:
因纯水中:水电离出的c(H+)=c(OH-)=10-7mol·L-1。
1. 25 ℃, 纯水中 KW=c(H+)总·c(OH-)总 =10-14,
2. KW不仅适用于纯水,也适用于任何稀的电解质水溶液。
2、水的离子积常数KW
【思考】如何衡量水的电离程度?
K电离=
c(H+) ×c(OH-)
c(H2O)
(4)影响因素:
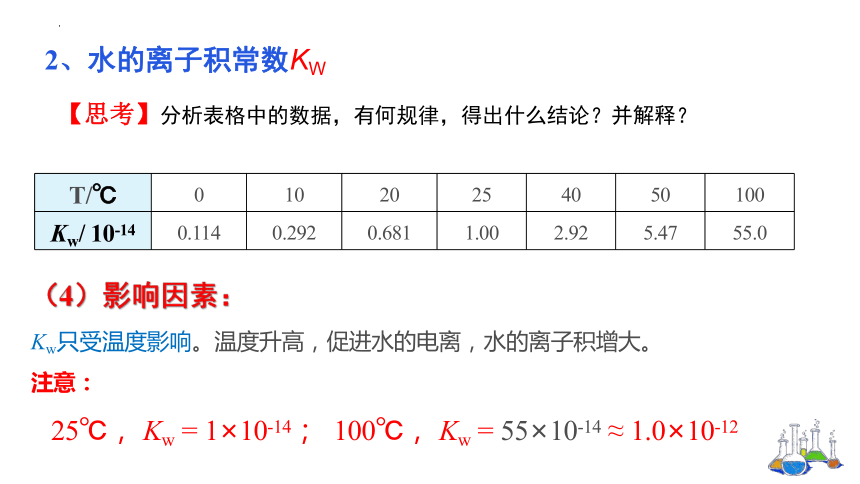
Kw只受温度影响。温度升高,促进水的电离,水的离子积增大。
注意:
25℃, Kw = 1×10-14; 100℃, Kw = 55×10-14 ≈ 1.0×10-12
T/℃ 0 10 20 25 40 50 100
Kw/ 10-14 0.114 0.292 0.681 1.00 2.92 5.47 55.0
【思考】分析表格中的数据,有何规律,得出什么结论?并解释?
2、水的离子积常数KW
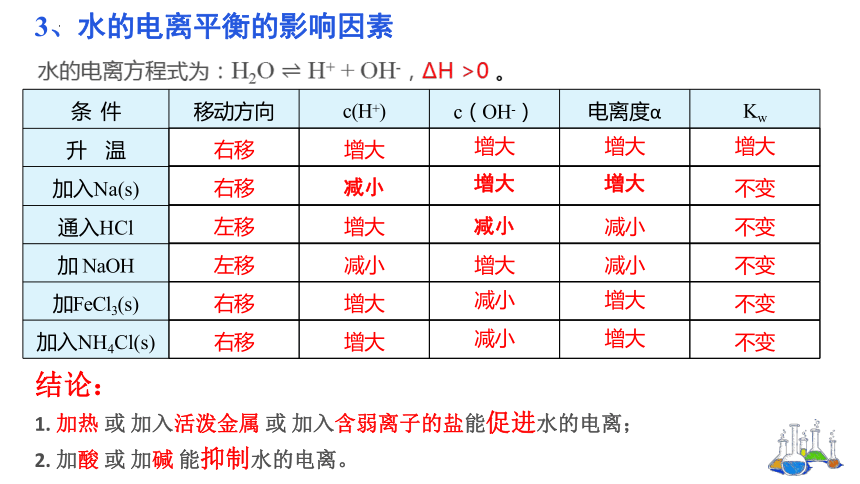
水的电离方程式为:H2O H+ + OH-, H >0 。
条 件 移动方向 c(H+) c(OH-) 电离度α Kw
升 温
加入Na(s)
通入HCl
加 NaOH
加FeCl3(s)
加入NH4Cl(s)
3、水的电离平衡的影响因素
右移 增大 增大 增大 增大
右移 减小 增大 增大 不变
左移 增大 减小 减小 不变
左移 减小 增大 减小 不变
右移 增大 减小 增大 不变
右移 增大 减小 增大 不变
结论:
1. 加热 或 加入活泼金属 或 加入含弱离子的盐能促进水的电离;
2. 加酸 或 加碱 能抑制水的电离。
1.在常温下,某溶液中,由水电离产生的c(H+) =1×10-9 mol/L,
则该溶液的酸碱性如何?
学 与 问
答:该溶液水的电离受到了抑制,可能是酸性也可能是碱性
2.在常温下,某溶液中,由水电离产生的c(0H-) =1×10-3 mol/L,
则该溶液可能是加入了哪些试剂?
答:该溶液水的电离受到了促进,可能是加入了活泼金属,
或加入了含弱离子的盐,消耗了水电离出的 c(H+)或c(0H-)
促进了水的电离。
【练习1】在25 ℃时,水的离子积Kw=1.0×10-14;在35 ℃时,水的离子积Kw=2.1×10-14则下列叙述正确的是( )
A. c(H+)随着温度的升高而降低
B. 35 ℃时,c(H+)>c(OH-)
C. 35 ℃时的水比25 ℃时的水电离程度小
D. 升高温度,水的电离程度增大,纯水仍显中性
解析:由题中条件可以看出,温度升高时,Kw增大。25 ℃时,c(H+)=c(OH-)=1×10-7 mol·L-1;35 ℃时,c(H+)=c(OH-)≈1.45×10-7 mol·L-1。温度升高,c(H+) 和c(OH-) 都增大,且始终相等,水的电离程度也增大,因温度升高平衡向正反应方向移动,故水的电离为吸热过程。
D
跟踪训练
1. 某温度时,水溶液中Kw=4.0×10-14,那么该温度比常温(25 ℃)高还是低?该温度下纯水中c(H+)是多少?
【深度思考】
提示:因此时水的离子积大于常温时水的离子积,故温度高于25 ℃,此时c(H+)=2×10-7mol·L-1。
2.水的离子积常数Kw=c(H+)·c(OH-),溶液中H+和OH-一定是水电离出来的吗?
提示:不一定。c(H+)和c(OH-)均指溶液中H+或OH-的总浓度,如盐酸中的H+包括HCl和H2O电离产生的H+,即c(H+)=c酸(H+)+c水(H+),而OH-全部来自水的电离。
一、 水的电离
【例1】常温下, 0. 1 mol·L-1的盐酸溶液中c(H+)、c(OH-)的来源 具体数值?由水电离产生的c(H+)与c(OH-)是多少?
二、水电离出的c(H+)或者c(OH-)的计算
c(H+)=_______________,来源于_________________
c(OH-)=_______________,来源于_________________
KW=_______________。
由水电离出的c(OH-)水=_______________,
c(H+)水=_______________。
0.1 mol/L
酸的电离和水的电离
1.0×10-13 mol/L
水的电离
1.0×10-14
1.0×10-13 mol/L
1.0×10-13 mol/L
【例2】常温下,浓度为0.01 mol·L-1的NaOH溶液中,c(H+)、c(OH-)的来源 由水电离产生的c水(H+)与c水(OH-)是多少?
【解析】
0.01 mol·L-1NaOH溶液中c(OH-)=0.01 mol·L-1 (NaOH电离产生)。
根据25 ℃时水的离子积Kw=1.0×10-14,
可得c碱(OH-)·c水(H+)=1.0×10-14,
解得c水(H+)=c水(OH-)=1.0×10-12 mol·L-1。
在任何水溶液中,c(H+)、 c(OH-) 可能不同,但是任何水溶液中水电离的c水电离(H+)、 c水电离(OH-) 总是相等。
规律小结
任何水溶液中都存在:Kw=c(H+)总 . c(OH-)总,
Kw只受温度影响,温度升高,Kw增大。
(1)曲线上的任意点(如a,b,c)的Kw都 ,即c(H+)·c(OH-) ,温度 。
(2)曲线外的任意点(如d)与曲线上任意点的Kw ,温度 。
相同
相同
相同
(3)实现曲线上点之间的转化需保持温度不变,改变 ;实现曲线上点与曲线外点之间的转化一定改变 。
不同
不同
酸碱性
温度
三、Kw的应用
1、水的电离平衡曲线的理解与识别
(1)A点水的离子积为________,
E点水的离子积为________。
造成A、E点水的离子积变化的原因是:______。
1×10-14
1×10-12
水的电离要吸热,温度升高,水的电离程度增大,即离子积增大
(2)25℃时,若向溶液中滴加盐酸,
能否使体系处于A点位置 为什么
____________________________________________。
(3)100 ℃时,若盐酸中c(H+)=5×10-4 mol·L-1,则由水电离产生的c(H+)=________。
否,在盐酸中c(H+)≠c(OH-),所以不可能处于A点
2×10-9 mol·L-1
(4)图中五点Kw间的大小关系:
【例题】在水的电离平衡中,c(H+)和c(OH-)的关系如图所示:
E>D>A=B=C
三、Kw的应用
1.常温下,下列各溶液中水的电离度最大的是( )
A PH=1的硫酸溶液
B c(H+)=1×10-10 mol/L的纯碱溶液
C 0.01mol/L的烧碱溶液
D c(H+)=1×10-5 mol/L的硫酸铵溶液
B
巩固练习
判断水电离的影响因素:
【酸碱抑制盐热促进】
水电离的计算:
【酸碱取小盐取大】
巩固练习
2.(1)常温下,浓度为1×10-5 mol/L的盐酸溶液中,
由水电离产生的c(H+)是多少?
解:
酸溶液中Kw =
c(H+)酸 · c(OH-) 水
c(OH-)水 =
c(H+)水 =
Kw
c(H+)酸
= 1×10-9 mol/L
=
1×10-14
1×10-5 mol/L
(2)常温下,浓度为1×10-5 mol/L的NaOH溶液中,
由水电离产生的c(OH-)是多少?
解:
碱溶液中Kw =
c (H+)水 · c(OH-)碱
c(OH-)水 =
c(H+)水 =
Kw
c(OH-)碱
=
1×10-14
1×10-5 mol/L
= 1×10-9 mol/L
在常温下,由水电离产生的c(H+) =1×10-9 mol/L
的溶液,则该溶液的酸碱性如何?
答:可能是酸性也可能是碱性
2.常温下,下列三种溶液中,由水电离出的氢离子浓度之比为( )
①1 mol·L-1的盐酸 ②0.1 mol·L-1的盐酸 ③0.01 mol·L-1的NaOH
A.1∶10∶100 B.0∶1∶12
C.14∶13∶12 D.14∶13∶2
解析:
①1 mol·L-1盐酸中c(H+)=1 mol·L-1,由水电离出的c水(H+)=10-14 mol·L-1。
②0.1 mol·L-1盐酸中c(H+)=0.1 mol·L-1,由水电离出的c(H+)水=10-13 mol·L-1,
③0.01 mol·L-1 NaOH溶液中,c(OH-) =0.01 mol·L-1,由水电离出的c(H+)水=10-12 mol·L-1,
则三者由水电离出的氢离子浓度之比为10-14∶10-13∶10-12=1∶10∶100。
答案:A
(1)升高温度,水的电离平衡右移,溶液中的c(H+)和c(OH-)均增大,但Kw不变。( )
(2)25 ℃时,水的离子积Kw=1.0×10-14,35 ℃时水的离子积Kw=2.1×10-14,则35 ℃时纯水中的c(H+)>c(OH-)。( )
(3)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等。 ( )
(4)向水中加入酸抑制水的电离,向水中加入碱促进水的电离。( )
1.判断正误(正确的打“√”,错误的打“×”)
×
×
√
×
2.在氨水中存在的粒子有 ;
在氯水中存在的粒子有 。
NH3、NH3 H2O、H2O、OH-、NH4+、H+
Cl2、H2O、H+、OH-、ClO-、HClO、Cl-
巩固训练
2、(1)常温下,某溶液中由水电离出来的c(H+)=1.0×10-11 mol·L-1,该溶液可能是________。
①二氧化硫的水溶液 ②氯化钠水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
①④
(2)某温度下,纯水的c(H+)=2×10-7 mol·L-1,则此时纯水的c(OH-)为__________________。若温度不变,滴入稀盐酸使c(H+)=5×10-4 mol·
L-1,则溶液中c(OH-)为________________,此时温度______(填“高于”“低于”或“等于”)25 ℃。
2×10-7 mol·L-1
8×10-11 mol·L-1
高于
3、常温下,在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( )
① K+、Cl-、NO3-、S2-
② K+、Fe2+、I-、SO42-
③ Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤ K+、Ba2+、Cl-、NO3-
A.①③ B.③⑤ C.③④ D.②⑤
酸性条件不能共存
碱性条件不能共存
能共存
酸、碱性条件都不能共存
能共存
B
4.25 ℃时,水的电离达到平衡:H2O H++OH- ΔH>0。下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)减小
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体钠,平衡逆向移动,c(H+)减小
D.将水加热,KW增大,c(H+)不变
解析:向水中加入稀氨水,OH-浓度增大,水的电离平衡逆向移动,A项错误;硫酸氢钠是强酸酸式盐,向水中加入少量固体硫酸氢钠,其在水溶液中完全电离: c(H+)增大,由于KW只与温度有关,所以KW不变,B项正确;向水中加入少量固体钠,由于金属钠非常活泼,可与水电离出的H+直接发生置换反应,产生H2,故促进了水的电离,使平衡正向移动,C项错误;将水加热,KW增大,c(H+)、c(OH-)同等倍数增大,D项错误。
√
5. 常温下,0.1 mol·L-1的NaOH溶液中由水电离出的OH-的物质的量浓度为( )
A.0.1 mol·L-1 B.1.0×10-13 mol·L-1
C.1.0×10-7 mol·L-1 D.1.0×10-6 mol·L-1
B
碱溶液中Kw =
c(H+)水 · c(OH-)碱
c(OH-)水=
c(H+)水 =
Kw
c(OH-)碱
=
1×10-14
1×10-1 mol/L
= 1×10-13 mol/L
解析:
水电离:
酸碱抑制取小值
