必修一化学人教版 1.2 阿伏加德罗定律推导 课件(共41张PPT)
文档属性
| 名称 | 必修一化学人教版 1.2 阿伏加德罗定律推导 课件(共41张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 143.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-10-21 00:00:00 | ||
图片预览











文档简介
课件41张PPT。阿伏加德罗定律化学课堂演示2018/11/28四、阿伏加德罗定律及其推论1.阿伏加德罗定律
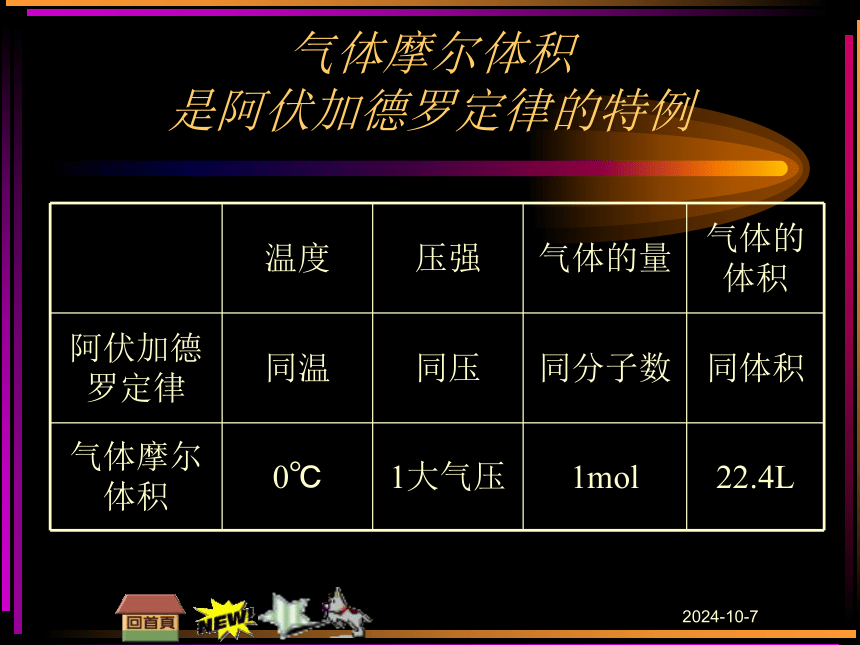
(1)内容:在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子(2)使用范围:气体或有气体参加的反应,不适用于固体或液体.(3)条件:三个“同”(只有在同温、同压、同体积的条件下,才有分子数相等这一结论).(4)特例:标准状况下,1 mol任何气体所占的体积都为22.4 L.2018/11/28
(1)阿伏加德罗定律的适用条件不仅仅是标准状况,也可以是其他温度和压强条件下,只要物质的存在状态一定是气态即可.
(2)阿伏加德罗定律推论不可死记公式,要通过阿伏加德罗定律进行推导,在理解的基础上记忆.2018/11/28气体摩尔体积 是阿伏加德罗定律的特例 2018/11/28介绍:克拉珀龙方程:PV=nRT R=8.314 Pa·m3·mol-1·K-1 若T=273K(0℃) P=1.01×105Pa,n=1mol R=8.314 (即标准状况)则
V=1mol任何气体只有在标准状况下其体积才约是22.4升吗?思考:1mol任何气体只有在标准状况下其体积才约是22.4升吗?2018/11/28例:1mol任何气体在常温下(25℃),1.106×105Pa压强时 2、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
(T、P、V相同) 练习一1)同温同压下,同体积任何气体的质量比等于式量之比2、阿伏加德罗定律的推论: 依据:PV=nRT 或 PV=
2)同温同压下,任何气体密度比(T、P相同) 练习二等于式量之比2、阿伏加德罗定律的推论: 依据:PV=nRT 或 PV=
3)同温同压下,气体体积之比(T、P相同) 练习三等于物质的量之比2、阿伏加德罗定律的推论: 依据:PV=nRT 或 PV=
4)同温同体积下,气体的压强之比等于(T、V相同) 练习四物质的量之比2、阿伏加德罗定律的推论: 依据:PV=nRT 或 PV=
5)同温同压下,相同质量的任何气体的体积与其式量 (T、P、m相同 ) 练习五成反比五、气体物质的式量的常用方法 由气体的体积和质量求式量
由标准状况下密度求式量
?摩尔质量=密度×22.4
根据气体的相对密度求式量(相对密度指两种气体密度的比值,用D表示)
D = d1/d2 = M1/M2
计算混合气体的平均式量( M )2018/11/28计算混合气体的平均式量2018/11/28例题:800mL的某气体,在标准状况下,质量是1克,求这种气体的式量。
某有机物气体在标准状况下密度为1.16克/升,求这种气体的式量。
某有机物气体在同温同压下对氢气的相对密度为2.69,求该气体的式量。 2018/11/28例题在空气中N2、O2、Ar的体积分数分别为78%,21%,约1%,求空气的平均式量
计算在150℃,碳酸铵分解后的混合气体的平均式量。
相同条件下,氮气和氧气以1:3体积比混合,求混合气体的平均式量。
已知氮气和氧气的混合气体其平均式量为31,求氮气和氧气的体积比。 2018/11/28练习一同温同压下,相同体积(或分子数或物质的量)的下列气体中,质量最大的是( ) (A)氦气 (B)氢气 (C)氧气 (D)氮气
某气体的质量是同温同压同体积氢气质量的22倍,则该气体的式量是( ) (A)22 (B)66 (C)88 (D)44 推导一CD2018/11/28练习二同温同压下,体积相同的下列气体,密度与其它三者不同的是( ) (A)N2 (B)C2H4 (C)CO (D)H2S
同温同压下,密度相同的气体组是( ) (A)CO、N2 (B)NO、CH4 (C)C2H4、NO (D)SO2、Cl2 推导二DA2018/11/28练习三 同温同压下,同物质的量的乙炔气体(C2H2)与苯蒸气(C6H6)体积比是( ) (A)3:1 (B)1:1 (C)1:3 (D)2:3 推导三B2018/11/28练习四在某温度下,将0.1摩Cl2和0.4摩H2充入容积为2升的密闭容器中,测得其压强为1大气压,点火充分反应后再恢复到原来温度时,容器内的压强是( ) (A)0.2大气压 (B)0.6大气压 (C)1个大气压 (D)无法确定 推导四C2018/11/28练习四将H2、O2、N2三种气体分别装在三个容积相等的容器中,当温度和密度完全相同时,三种气体压强(P)的大小关系正确的是( ) (A)P(H2)=P(O2)=P(N2) (B)P(H2)>P(N2)>P(O2) (C)P(H2)>P(O2) >P(N2) (D)P(N2)>P(O2) >P(H2) 推导四B2018/11/28练习四在某温度时,一定量的元素A的气态氢化物(AH3),在一定体积的密闭容器中完全分解成两种气态单质,此时压强增加75%,则A的单质的一个分子中 有 个A原子。
推导四42018/11/28练习五现有两种气体,它们的分子量分别为MA:MB (1)当两种气体质量相同时,标准状况下A与B的体积比为 ,密度比为 ,所含分子数比为 。 (2)当两种气体(同温同压)的体积相同时,A和B的质量比为 。 推导五MB:MAMA:MBMB:MAMA:MB2018/11/28练习五同温同压下,等质量的二氧化硫和二氧化碳相比较,下列叙述中,正确的是 ( )
(A)密度比为16:11 (B)密度比为11:16 (C)体积比为1:1 (D)体积比为11:16 推导五A、D2018/11/28练习五同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的: (1)分子数之比为 ; (2)原子数之比为 ; (3)质量之比为 (4)物质的量之比为 。 (5)密度之比为 (6)摩尔质量之比为 。 推导五1:23:411:141:211:711:72018/11/28练习五 在一定温度和压强下,10体积气体A2跟30体积B2化合生成20体积某气体C,则C的化学式为( ) (A)AB (B)A2B (C)AB3 (D)AB2
关于同温同压下等体积的CO2和CO的叙述:①质量相等②密度相等③所含分子数相等④所含碳原子数相等,其中正确的是( ) (A)①②③④ (B)②③④ (C)③④ (D)③
推导五CC2018/11/282018/11/28 例题2 在两个密闭容器中,分别充有质量相同的 甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量小
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小B2018/11/28考查点一 气体摩尔体积的判断和计算——————
[例1] 下列叙述正确的是 ( )
A.1 mol任何气体的体积都为22.4 L
B.1 mol任何物质在标准状况下所占的体积都为22.4 L
C.标准状况下,1 mol水所占的体积是22.4 L
D.标准状况下,22.4 L任何气体的物质的量都是1 mol2018/11/28[解析] 按气体摩尔体积的“四要素”即状态(气体)、状况(温度、压强)、定量(1 mol)、数值(体积)进行分析.A项中没有指明该物质所处的状况;B项中没有指明该物质所处的状态;C项中的水在标准状况下不是气体;D项是对气体摩尔体积概念的应用.[答案] D2018/11/28在273 K和101 kPa的条件下,将2.00 g氦气,1.40 g 氮
气和1.60 g氧气混合,该混合气体的体积是 ( )
A.6.72 L B.7.84 L
C.10.08 L D.13.44 L答案:D
考查点二 阿伏加德罗定律及推论的应用—————
2018/11/28[例2](2010·河北省冀州期末)下列两种气体的分子数一定相等的是 ( )
A.质量相等、密度不等的N2和CO
B.等体积、等密度的CO和NO
C.等温、等体积的O2和N2
D.等压、等体积的N2和CO22018/11/28[答案] A[解析] 由阿伏加德罗定律可知“三同定一同”B、C、D三项中只能推出两同故错误.而A中,由于二者摩尔质量相等,质量相等,则n(N2)=n(CO).2018/11/28(2010·四川雅安市高一检测)同温同压下,相同体积的H2
和CO2气体,具有相同的 ( )
A.分子数 B.原子数
C.质量 D.摩尔质量2018/11/28解析:同温同压下,相同体积的气体,具有相同的分子数,故A正确;每个H2分子中有2个原子,CO2分子中有3个原子,原子数目不相等,故B不正确;H2和CO2摩尔质量分别为2 g/mol,44 g/mol,其对应质量也不同,故C、D不正确.答案:A
(1)内容:在相同的温度和压强下,相同体积的任何气体都含有相同数目的粒子(2)使用范围:气体或有气体参加的反应,不适用于固体或液体.(3)条件:三个“同”(只有在同温、同压、同体积的条件下,才有分子数相等这一结论).(4)特例:标准状况下,1 mol任何气体所占的体积都为22.4 L.2018/11/28
(1)阿伏加德罗定律的适用条件不仅仅是标准状况,也可以是其他温度和压强条件下,只要物质的存在状态一定是气态即可.
(2)阿伏加德罗定律推论不可死记公式,要通过阿伏加德罗定律进行推导,在理解的基础上记忆.2018/11/28气体摩尔体积 是阿伏加德罗定律的特例 2018/11/28介绍:克拉珀龙方程:PV=nRT R=8.314 Pa·m3·mol-1·K-1 若T=273K(0℃) P=1.01×105Pa,n=1mol R=8.314 (即标准状况)则
V=1mol任何气体只有在标准状况下其体积才约是22.4升吗?思考:1mol任何气体只有在标准状况下其体积才约是22.4升吗?2018/11/28例:1mol任何气体在常温下(25℃),1.106×105Pa压强时 2、阿伏加德罗定律的推论 依据:PV=nRT 或 PV=
(T、P、V相同) 练习一1)同温同压下,同体积任何气体的质量比等于式量之比2、阿伏加德罗定律的推论: 依据:PV=nRT 或 PV=
2)同温同压下,任何气体密度比(T、P相同) 练习二等于式量之比2、阿伏加德罗定律的推论: 依据:PV=nRT 或 PV=
3)同温同压下,气体体积之比(T、P相同) 练习三等于物质的量之比2、阿伏加德罗定律的推论: 依据:PV=nRT 或 PV=
4)同温同体积下,气体的压强之比等于(T、V相同) 练习四物质的量之比2、阿伏加德罗定律的推论: 依据:PV=nRT 或 PV=
5)同温同压下,相同质量的任何气体的体积与其式量 (T、P、m相同 ) 练习五成反比五、气体物质的式量的常用方法 由气体的体积和质量求式量
由标准状况下密度求式量
?摩尔质量=密度×22.4
根据气体的相对密度求式量(相对密度指两种气体密度的比值,用D表示)
D = d1/d2 = M1/M2
计算混合气体的平均式量( M )2018/11/28计算混合气体的平均式量2018/11/28例题:800mL的某气体,在标准状况下,质量是1克,求这种气体的式量。
某有机物气体在标准状况下密度为1.16克/升,求这种气体的式量。
某有机物气体在同温同压下对氢气的相对密度为2.69,求该气体的式量。 2018/11/28例题在空气中N2、O2、Ar的体积分数分别为78%,21%,约1%,求空气的平均式量
计算在150℃,碳酸铵分解后的混合气体的平均式量。
相同条件下,氮气和氧气以1:3体积比混合,求混合气体的平均式量。
已知氮气和氧气的混合气体其平均式量为31,求氮气和氧气的体积比。 2018/11/28练习一同温同压下,相同体积(或分子数或物质的量)的下列气体中,质量最大的是( ) (A)氦气 (B)氢气 (C)氧气 (D)氮气
某气体的质量是同温同压同体积氢气质量的22倍,则该气体的式量是( ) (A)22 (B)66 (C)88 (D)44 推导一CD2018/11/28练习二同温同压下,体积相同的下列气体,密度与其它三者不同的是( ) (A)N2 (B)C2H4 (C)CO (D)H2S
同温同压下,密度相同的气体组是( ) (A)CO、N2 (B)NO、CH4 (C)C2H4、NO (D)SO2、Cl2 推导二DA2018/11/28练习三 同温同压下,同物质的量的乙炔气体(C2H2)与苯蒸气(C6H6)体积比是( ) (A)3:1 (B)1:1 (C)1:3 (D)2:3 推导三B2018/11/28练习四在某温度下,将0.1摩Cl2和0.4摩H2充入容积为2升的密闭容器中,测得其压强为1大气压,点火充分反应后再恢复到原来温度时,容器内的压强是( ) (A)0.2大气压 (B)0.6大气压 (C)1个大气压 (D)无法确定 推导四C2018/11/28练习四将H2、O2、N2三种气体分别装在三个容积相等的容器中,当温度和密度完全相同时,三种气体压强(P)的大小关系正确的是( ) (A)P(H2)=P(O2)=P(N2) (B)P(H2)>P(N2)>P(O2) (C)P(H2)>P(O2) >P(N2) (D)P(N2)>P(O2) >P(H2) 推导四B2018/11/28练习四在某温度时,一定量的元素A的气态氢化物(AH3),在一定体积的密闭容器中完全分解成两种气态单质,此时压强增加75%,则A的单质的一个分子中 有 个A原子。
推导四42018/11/28练习五现有两种气体,它们的分子量分别为MA:MB (1)当两种气体质量相同时,标准状况下A与B的体积比为 ,密度比为 ,所含分子数比为 。 (2)当两种气体(同温同压)的体积相同时,A和B的质量比为 。 推导五MB:MAMA:MBMB:MAMA:MB2018/11/28练习五同温同压下,等质量的二氧化硫和二氧化碳相比较,下列叙述中,正确的是 ( )
(A)密度比为16:11 (B)密度比为11:16 (C)体积比为1:1 (D)体积比为11:16 推导五A、D2018/11/28练习五同温同压下,将1体积的CO2和2体积的CO进行比较,则CO2与CO的: (1)分子数之比为 ; (2)原子数之比为 ; (3)质量之比为 (4)物质的量之比为 。 (5)密度之比为 (6)摩尔质量之比为 。 推导五1:23:411:141:211:711:72018/11/28练习五 在一定温度和压强下,10体积气体A2跟30体积B2化合生成20体积某气体C,则C的化学式为( ) (A)AB (B)A2B (C)AB3 (D)AB2
关于同温同压下等体积的CO2和CO的叙述:①质量相等②密度相等③所含分子数相等④所含碳原子数相等,其中正确的是( ) (A)①②③④ (B)②③④ (C)③④ (D)③
推导五CC2018/11/282018/11/28 例题2 在两个密闭容器中,分别充有质量相同的 甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量小
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小B2018/11/28考查点一 气体摩尔体积的判断和计算——————
[例1] 下列叙述正确的是 ( )
A.1 mol任何气体的体积都为22.4 L
B.1 mol任何物质在标准状况下所占的体积都为22.4 L
C.标准状况下,1 mol水所占的体积是22.4 L
D.标准状况下,22.4 L任何气体的物质的量都是1 mol2018/11/28[解析] 按气体摩尔体积的“四要素”即状态(气体)、状况(温度、压强)、定量(1 mol)、数值(体积)进行分析.A项中没有指明该物质所处的状况;B项中没有指明该物质所处的状态;C项中的水在标准状况下不是气体;D项是对气体摩尔体积概念的应用.[答案] D2018/11/28在273 K和101 kPa的条件下,将2.00 g氦气,1.40 g 氮
气和1.60 g氧气混合,该混合气体的体积是 ( )
A.6.72 L B.7.84 L
C.10.08 L D.13.44 L答案:D
考查点二 阿伏加德罗定律及推论的应用—————
2018/11/28[例2](2010·河北省冀州期末)下列两种气体的分子数一定相等的是 ( )
A.质量相等、密度不等的N2和CO
B.等体积、等密度的CO和NO
C.等温、等体积的O2和N2
D.等压、等体积的N2和CO22018/11/28[答案] A[解析] 由阿伏加德罗定律可知“三同定一同”B、C、D三项中只能推出两同故错误.而A中,由于二者摩尔质量相等,质量相等,则n(N2)=n(CO).2018/11/28(2010·四川雅安市高一检测)同温同压下,相同体积的H2
和CO2气体,具有相同的 ( )
A.分子数 B.原子数
C.质量 D.摩尔质量2018/11/28解析:同温同压下,相同体积的气体,具有相同的分子数,故A正确;每个H2分子中有2个原子,CO2分子中有3个原子,原子数目不相等,故B不正确;H2和CO2摩尔质量分别为2 g/mol,44 g/mol,其对应质量也不同,故C、D不正确.答案:A
