高中化学同步练习:选择性必修三1.2研究有机化合物的一般方法(能力提升)
文档属性
| 名称 | 高中化学同步练习:选择性必修三1.2研究有机化合物的一般方法(能力提升) |
|
|
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-16 00:00:00 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
高中化学同步练习:选择性必修三1.2研究有机化合物的一般方法(能力提升)
一、选择题
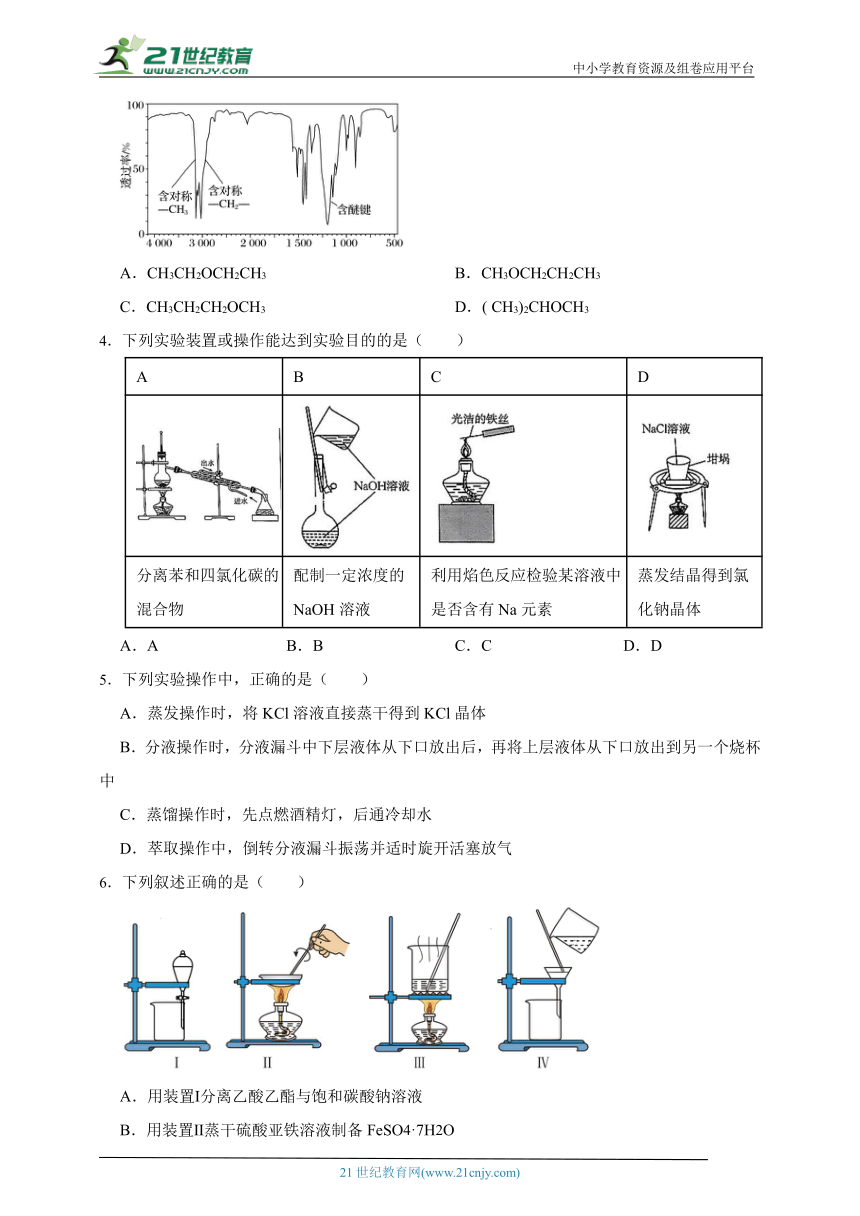
1.将6.8gX完全燃烧生成和8.96L(标准状况)。X的质谱图、核磁共振氢谱图与红外光谱图如图所示。下列关于的叙述错误的是( )
A.的化学式为
B.分子中有四种化学环境不同的氢原子
C.的官能团一定为醚键和羰基
D.可能是
2.研究有机物的一般步骤:分离提纯→确定最简式→确定分子式→确定结构式。以下研究有机物的方法错误的是( )
A.蒸馏——分离提纯液态有机混合物
B.燃烧法——研究确定有机物成分的有效方法
C.核磁共振氢谱——通常用于分析有机物的相对分子质量
D.红外光谱——确定有机物分子中的官能团或化学键
3.某有机物A的分子式为C4H10O,红外光谱图如图所示,则A的结构简式为 ( )
A.CH3CH2OCH2CH3 B.CH3OCH2CH2CH3
C.CH3CH2CH2OCH3 D.( CH3)2CHOCH3
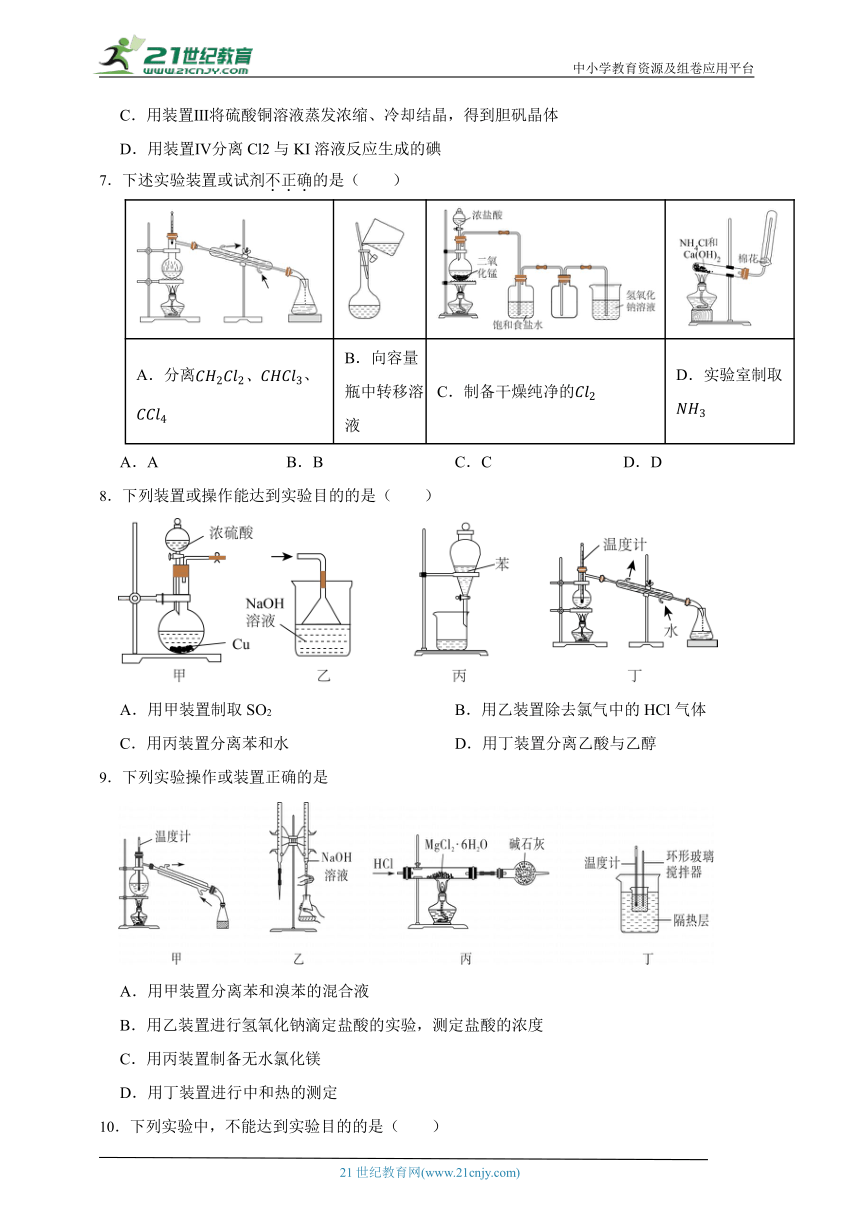
4.下列实验装置或操作能达到实验目的的是( )
A B C D
分离苯和四氯化碳的混合物 配制一定浓度的NaOH溶液 利用焰色反应检验某溶液中是否含有Na元素 蒸发结晶得到氯化钠晶体
A.A B.B C.C D.D
5.下列实验操作中,正确的是( )
A.蒸发操作时,将KCl溶液直接蒸干得到KCl晶体
B.分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从下口放出到另一个烧杯中
C.蒸馏操作时,先点燃酒精灯,后通冷却水
D.萃取操作中,倒转分液漏斗振荡并适时旋开活塞放气
6.下列叙述正确的是( )
A.用装置Ⅰ分离乙酸乙酯与饱和碳酸钠溶液
B.用装置Ⅱ蒸干硫酸亚铁溶液制备FeSO4·7H2O
C.用装置Ⅲ将硫酸铜溶液蒸发浓缩、冷却结晶,得到胆矾晶体
D.用装置Ⅳ分离Cl2与KI溶液反应生成的碘
7.下述实验装置或试剂不正确的是( )
A.分离、 B.向容量瓶中转移溶液 C.制备干燥纯净的 D.实验室制取
A.A B.B C.C D.D
8.下列装置或操作能达到实验目的的是( )
A.用甲装置制取SO2 B.用乙装置除去氯气中的HCl气体
C.用丙装置分离苯和水 D.用丁装置分离乙酸与乙醇
9.下列实验操作或装置正确的是
A.用甲装置分离苯和溴苯的混合液
B.用乙装置进行氢氧化钠滴定盐酸的实验,测定盐酸的浓度
C.用丙装置制备无水氯化镁
D.用丁装置进行中和热的测定
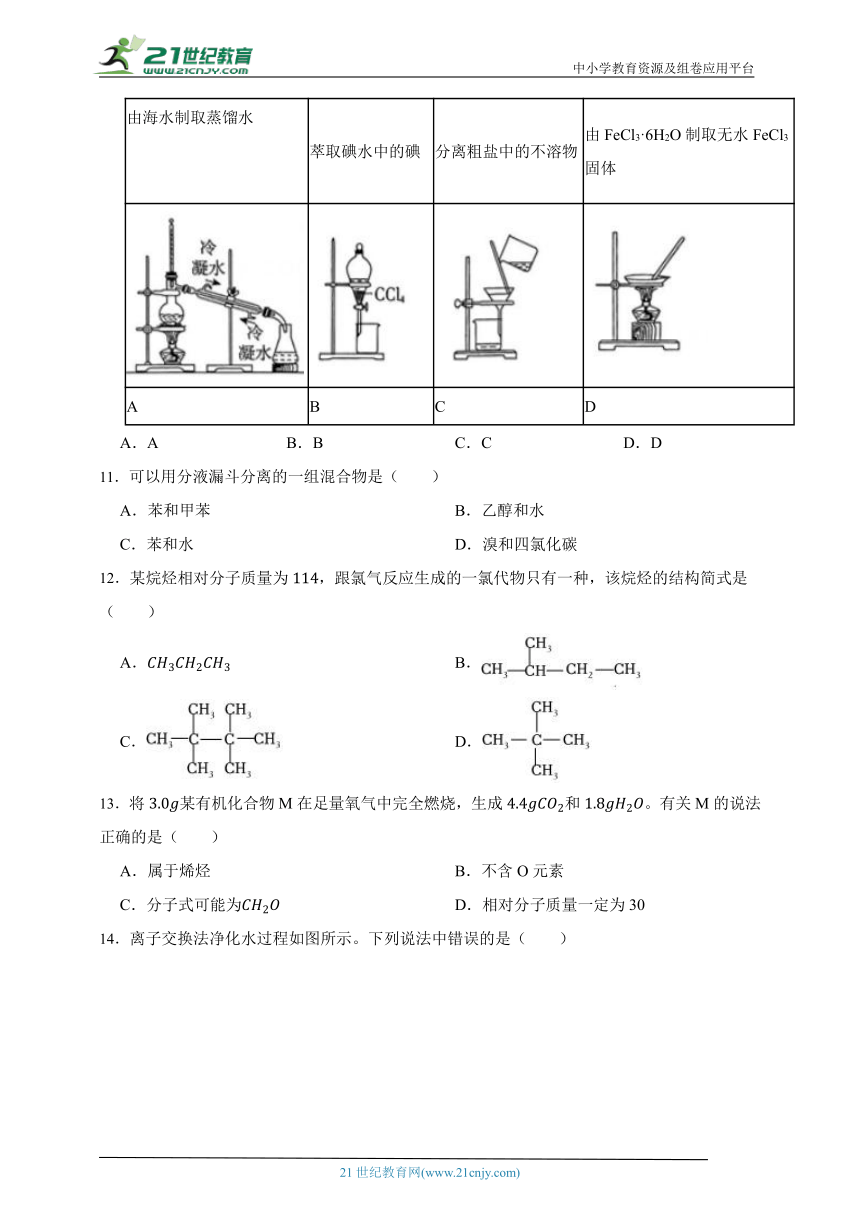
10.下列实验中,不能达到实验目的的是( )
由海水制取蒸馏水
萃取碘水中的碘 分离粗盐中的不溶物 由FeCl3·6H2O制取无水FeCl3固体
A B C D
A.A B.B C.C D.D
11.可以用分液漏斗分离的一组混合物是( )
A.苯和甲苯 B.乙醇和水
C.苯和水 D.溴和四氯化碳
12.某烷烃相对分子质量为,跟氯气反应生成的一氯代物只有一种,该烷烃的结构简式是( )
A. B.
C. D.
13.将某有机化合物M在足量氧气中完全燃烧,生成和。有关M的说法正确的是( )
A.属于烯烃 B.不含O元素
C.分子式可能为 D.相对分子质量一定为30
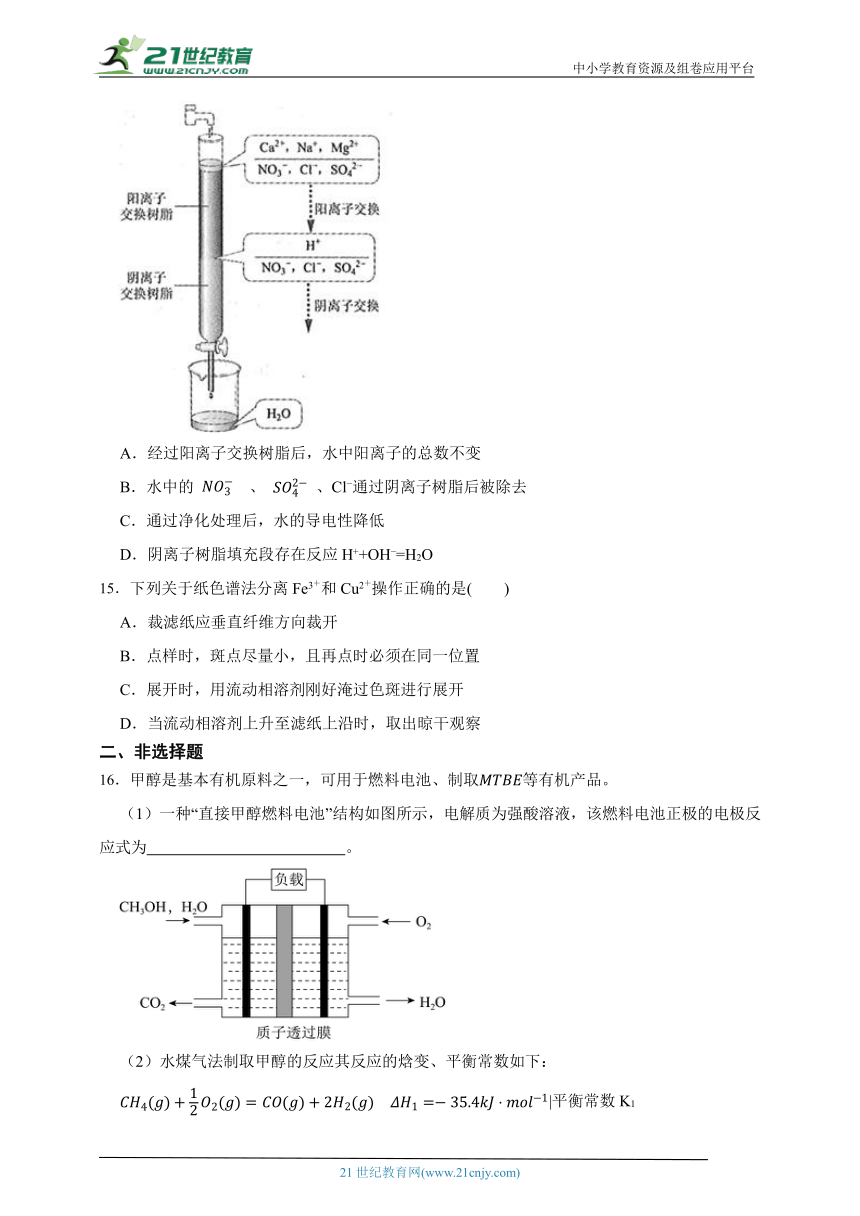
14.离子交换法净化水过程如图所示。下列说法中错误的是( )
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的 、 、Cl 通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH =H2O
15.下列关于纸色谱法分离Fe3+和Cu2+操作正确的是( )
A.裁滤纸应垂直纤维方向裁开
B.点样时,斑点尽量小,且再点时必须在同一位置
C.展开时,用流动相溶剂刚好淹过色斑进行展开
D.当流动相溶剂上升至滤纸上沿时,取出晾干观察
二、非选择题
16.甲醇是基本有机原料之一,可用于燃料电池、制取等有机产品。
(1)一种“直接甲醇燃料电池”结构如图所示,电解质为强酸溶液,该燃料电池正极的电极反应式为 。
(2)水煤气法制取甲醇的反应其反应的焓变、平衡常数如下:
|平衡常数K1
CO(g)+2H2(g)CH3OH(g) ΔH2=-90.1kJ/mol 平衡常数K2
2CH4(g)+O2(g) CH3OH(g) ΔH3平衡常数K3
则相同温度下K3= (用含K1代数式表示)。
(3)二氧化碳加氢也可合成甲醇[CO2(g) + 3H2(g) CH3OH(g) + H2O(g)],在10.0L的密闭容器中投入和,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强变化如图所示。
①图中二氧化碳合成甲醇正反应为 反应(选填:“放热”或“吸热”)。
②图中压强p1 P2 (选填:“>”或“<”)。
③在图中“M”点,平衡常数K= (填数值,保留2位小数)。
(4)甲醇与醇ROH在浓硫酸及加热条件下可制备汽油抗爆震剂MTBE,反应原理为:CH3OH+ROHCH3OR+H2O
已知MTBE的分子式为,其核磁共振氢谱如图所示。
①ROH的结构简式为 。
②写出制备MTBE的化学方程式: 。
17.氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备和,探究其氧化还原性质。
已知:①是一种无色、密度比水大、不溶于水的液体。
②的水溶液呈棕黄色,的溶液呈紫色。
回答下列问题:
(1)a的作用是除去杂质 (写化学式)。
(2)c中采用冰水浴冷却的目的是避免生成副产物 (写化学式),写出c中反应的化学方程式 。
(3)d的作用是进行尾气处理,可选用试剂____(填标号)。
A. B. C. D.
(4)反应结束后,取出b中试管,经蒸发浓缩, , ,少量(冷)水洗涤,干燥,得到晶体。
(5)取少量和溶液分别置于1号和2号试管中,滴加中性溶液。1号试管溶液变为 色,加入振荡,静置后层显紫色。2号试管溶液颜色不变。可知该条件下的氧化能力 (填“大于”或“小于”)。
18.某同学探究 1﹣溴丁烷消去反应的实验装置如图所示,先在圆底烧瓶中加入 2.0gNaOH 和 15mL 无水乙醇,搅拌,再加入 5mL1﹣溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯)产生的气体通过盛有水的试管后,再通入盛有酸性 KMnO4溶液的试管中。试回答下列问题:
(1)写出圆底烧瓶中反应的化学方程式: 。
(2)实验时加入碎瓷片的目的是 。
(3)装置Ⅱ的作用是 。
(4)装置Ⅲ中可观察到的现象是 。如果没有装置Ⅱ,则装置Ⅲ中的药品应换成 。
(5)向圆底烧瓶中反应后的溶液加入金属钠,产生气泡。该同学分析同时发生取代反应,请判断此分析正确与否?并说明理由: 。
(6)已知:溴乙烷的沸点:38.4℃,1﹣溴丁烷的沸点:101.6℃。该同学用溴乙烷代替 1﹣溴丁烷进行实验时,发现酸性 KMnO4溶液不褪色。则实验失败的原因可能是 。
19.某实验小组为探究Cl-、I-、SO32-的还原性强弱,甲同学设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量新制氯水溶液,溶液立刻变蓝;
实验②:向实验①的溶液中加入亚硫酸钠溶液,发现溶液蓝色褪去。
(1)根据上述实验现象,可以判断Cl-、I-、SO32-还原性由强到弱的顺序为 。
乙同学参考教科书知识,提出另一种实验方法,在碘化钾溶液中加入新制氯水后,将碘化钾溶液加入新制氯水后,将溶液转移入分液漏斗,并加入萃取剂,主要操作步骤如图:
1. 加入萃取剂后振荡 2. 静置分层 3. 分离
(2)根据图中现象,该同学所采用的萃取剂可能是( )
A.酒精 B.苯 C.CCl4 D.汽油
(3)甲、乙、丙三步实验操作中,不正确的是 (填“1”、“2”或“3”),理由是 。
(4)在乙图的分液漏斗中,下层液体呈 色。
20.某小组设计实验探究铜被碘氧化的产物及铜元素的价态。
已知:①易溶于溶液,发生反应(红棕色);
②铜元素被氧化可能存在的形式有(蓝色)、(无色);
③(无色),易被空气氧化。
请回答:
(1)步骤Ⅰ中加入萃取分液的目的是 .
(2)用离子方程式表示步骤Ⅱ中发生的反应 .
(3)已知为白色不溶于水的固体,向中加入浓溶液,现象为 .
(4)向深蓝色溶液中滴加浓盐酸,溶液呈黄绿色,写出该转化能进行的可能原因 .
(已知:稳定性远大于(黄色),稳定指的是不易发生解离反应)
(5)层呈 色。如何设计实验将层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液, 。请补充完实验操作中涉及的离子方程式:, .
21.某课外活动小组利用如图所示装置探究甲烷和氯气的反应:
(1)实验中可观察到的现象有 ____ 填字母。
A.试管内液面上升,最终充满试管
B.试管内气体颜色逐渐变深
C.试管内壁出现油状液滴
D.试管内有少量白雾生成
(2)用饱和食盐水而不用水的原因是 。
(3)请写出生成一氯甲烷的化学反应方程式: 。
(4)某链状烷烃的相对分了质量为,该烷烃的分子式为 ,该烷烃存在同分异构体现象,用结构简式写出该有机物的所有结构 。
22.烷烃广泛存在于自然界中,例如苹果表面的蜡状物质、蚂蚁分泌的信息素、石蜡和凡士林等物质中都含有烷烃。
(1)写出下列各烷烃的分子式。
烷烃在同温同压下蒸气的密度是的倍: 。
烷烃的分子中含有个氢原子: 。
(2)把下列物质的沸点按由高到低的顺序排列 。填入编号
,,三甲基戊烷
(3)①用系统命名法命名下面的烃: ;
的一氯代物有 种。
答案解析部分
1.【答案】C
【知识点】利用质谱、红外光谱、核磁共振等确定有机物的结构;有机物中的官能团;有机分子式的推断与计算
【解析】【解答】A、由分析可知,X的分子式为C8H8O2,A不符合题意。
B、由核磁共振氢谱图可知,X分子中含有四种吸收峰,因此X分子中含有四种化学环境不同的氢原子,B不符合题意。
C、有机物X的不饱和度为,所以分子结构中含有苯环和一个碳氧双键。由核磁共振氢谱可知,分子结构中含有4种不同化学环境的氢原子,且个数比为3:2:2:1,因此满足条件的X的结构简式以为,所以其所含的官能团为酯基,C符合题意。
D、由C选项的分析可知,有机物X的结构简式为,D不符合题意。
故答案为:C
【分析】由质谱图可知,有机物X的相对分子质量为136,因此6.8gX的物质的量为0.05mol,反应生成n(H2O)=0.2mol、n(CO2)=0.4mol。所以有机物X中所含m(C)=0.4mol×12g·mol-1=4.8g;m(H)=0.2mol×2×1g·mol-1=0.4g。因此有机物X中含有氧元素,其质量m(O)=6.8g-4.8g-0.4g=1.6g。所以可得0.05mol有机物X中n(C)=0.4mol、n(H)=0.4mol、n(O)=0.1mol,所以有机物X的分子式为C8H8O2。
2.【答案】C
【知识点】利用质谱、红外光谱、核磁共振等确定有机物的结构;蒸馏与分馏
【解析】【解答】A、蒸馏,用于分离提出互溶但沸点不同的液态有机物,A不符合题意。
B、燃烧法,用于测定有机物中元素质量比,从而确定有机物的实验式,B不符合题意。
C、核磁共振氢谱,用于测定有机物中氢原子的种类,从而确定有机物的结构简式,相对分子质量是通过质谱仪测定,C符合题意。
D、红外光谱,是用于确定有机物分子中的官能团或化学键,D不符合题意。
故答案为:C
【分析】根据有机物的研究步骤、方法进行分析即可。
3.【答案】A
【知识点】利用质谱、红外光谱、核磁共振等确定有机物的结构
【解析】【解答】A的分子式为C4H10O,分析红外光谱图可知,分子中含有对称的-CH3,对称的-CH2-和醚键,其结构简式为CH3CH2OCH2CH3;
故答案选A。
【分析】A的分子式为C4H10O,分析红外光谱图可知,分子中含有对称的-CH3,对称的-CH2-和醚键。
4.【答案】C
【知识点】焰色反应;蒸发和结晶、重结晶;分液和萃取;配制一定物质的量浓度的溶液
【解析】【解答】A.分离苯和四氯化碳利用蒸馏应该将温度计放在支管口时,故A不符合题意;
B.配制溶液应该在烧杯中进行溶解冷却,故B不符合题意;
C.利用焰色试验可检验钠元素,故C符合题意;
D.蒸发结晶时利用蒸发皿,故D不符合题意;
故答案为:C
【分析】A.温度计放在支管口处
B.配制氢氧化钠溶液时应该在烧杯中溶解和冷却
C.焰色试验时利用铁丝蘸取待测液进行检验钠元素
D.蒸发时利用蒸发皿
5.【答案】D
【知识点】蒸发和结晶、重结晶;蒸馏与分馏;分液和萃取
【解析】【解答】A. 蒸发操作时,将KCl溶液蒸发快蒸干时停止加热,用预余热蒸干得到晶体,故A不符合题意;
B. 分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从上口放出到另一个烧杯中,故B不符合题意;
C. 蒸馏操作时,先通冷却水 ,后点燃酒精灯,故C不符合题意;
D. 萃取操作中,倒转分液漏斗振荡并适时旋开活塞放气 ,防止压强过大,故D符合题意;
故答案为:D
【分析】A.蒸发操作时,可将溶液蒸发到快蒸干时停止加热利用余热蒸干
B.分液时分液漏斗上层液体从上端倒出,下层从下面流出
C.蒸馏时先通冷水再点燃酒精灯
D.萃取时需要不断放气防止压强过大
6.【答案】A
【知识点】蒸发和结晶、重结晶;蒸馏与分馏;分液和萃取
【解析】【解答】A.乙酸乙酯是有机物,碳酸钠溶液是无机物,可进行分液,故A符合题意;
B.亚铁离子具有还原性,在空气中加热易被氧化,故B不符合题意;
C.蒸发结晶一般用的是坩埚不是用烧杯,故C不符合题意;
D.碘单质可溶于水,因此加入有机物萃取,故D不符合题意;
故答案为:A
【分析】A.分离乙酸乙酯是利用碳酸钠溶液;
B.亚铁离子具有还原性易被氧化;
C.蒸发结晶一般用的是坩埚;
D.碘单质溶于水,过滤不能分离一般用萃取。
7.【答案】C
【知识点】氯气的实验室制法;氨的实验室制法;蒸馏与分馏;配制一定物质的量浓度的溶液
【解析】【解答】A. 、三种有机物的熔沸点不同,可以用蒸馏的方法进行分离有机物,故A不符合题意;
B.利用玻璃棒进行引流将液体倒入容量瓶中,故B不符合题意;
C.制备干燥的氯气需要用饱和食盐水除去氯化氢,用浓硫酸除去水蒸气,故C符合题意;
D.实验室制取氨气利用熟石灰和铵盐进行加热得到,故D不符合题意;
故答案为:C
【分析】A.利用熔沸点不同可将有机物进行分离
B.利用玻璃棒进行引流进行液体转移
C.制备干燥的氯气需要用饱和食盐水除去氯化氢和浓硫酸除水
D.利用熟石灰和铵盐可制取氨气
8.【答案】C
【知识点】氯气的实验室制法;二氧化硫的性质;蒸馏与分馏;分液和萃取
【解析】【解答】A、Cu与浓硫酸反应制取SO2的化学方程式为:Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑,该反应需要加热,A不符合题意。
B、Cl2、HCl都能与NaOH反应,因此不能用NaOH溶液除去Cl2中混有的HCl,应用饱和食盐水除去Cl2中混有的HCl,B不符合题意。
C、苯和水不互溶,可用分液操作进行分离,C符合题意。
D、蒸馏装置中,温度计测量的是蒸汽的温度,因此温度计的水银球应位于蒸馏烧瓶的支管口处,不能伸入溶液内,D不符合题意。
故答案为:C
【分析】A、Cu与浓硫酸的反应需要加热。
B、Cl2、HCl都能与NaOH溶液反应。
C、苯和水不互溶,可用分液进行分离。
D、蒸馏时温度计应位于蒸馏烧瓶支管口处,不能伸入溶液中。
9.【答案】C
【知识点】蒸馏与分馏;中和滴定;中和热的测定
【解析】【解答】A.图中温度计的水银球未在支管口处,A不符合题意;
B.用氢氧化钠滴定盐酸,氢氧化钠标准溶液应该放在碱式滴定管中,图中为酸式滴定管,B不符合题意;
C.HCl可抑制氯化镁的水解,故可在HCl气流中加热氯化镁晶体制备无水氯化镁,C符合题意;
D.测定中和热时,大小两个烧杯口应该平齐并用盖板盖严以减少热量的损失,D不符合题意;
故答案为:C。
【分析】A.蒸馏时温度计测定馏分的温度,温度计的水银球应在蒸馏烧瓶的支管口处;
B.NaOH溶液应盛放在碱式滴定管中;
D.测定中和热时,大小烧杯的烧杯口应该平齐。
10.【答案】D
【知识点】海水资源及其综合利用;蒸发和结晶、重结晶;分液和萃取
【解析】【解答】A.利用海水进行蒸馏得到蒸馏水,故A不符合题意;
B.碘在四氯化碳的溶解度大于水,故B不符合题意;
C.过滤可以实现固液分离,故C不符合题意;
D.此方法得到的是氢氧化铁固体,故D符合题意;
故答案为:D
【分析】A.利用蒸馏可以得到蒸馏水;
B.利用溶解度不同可以提纯碘;
C.利用过滤可以实现固体液体分离;
D.考虑铁离子水解此法不能得到氯化铁晶体。
11.【答案】C
【知识点】分液和萃取
【解析】【解答】A、苯和甲苯互溶,不能用分液漏斗分离,故A不符合题意;
B、乙醇和水互溶,不能用分液漏斗分离,故B不符合题意;
C、苯和水互不相溶,能用分液漏斗分离,故C符合题意;
D、溴和四氯化碳互溶,不能用分液漏斗分离,故D不符合题意;
故答案为:C。
【分析】用分液漏斗可分离互不相溶的液体混合物。
12.【答案】C
【知识点】同分异构现象和同分异构体;有机分子式的推断与计算;烷烃
【解析】【解答】烷烃相对分子质量114,其分子式应为C8H18; 跟氯气反应生成的一氯代物只有一种 ,说明只有一种氢原子,根据对称原则, 烷烃的结构简式是;故答案为:C.
【分析】 跟氯气反应生成的一氯代物只有一种 ,可以通过等效氢来确定有机物一氯代物种类,结合有机物分子式,据此解答即可。
13.【答案】C
【知识点】有机分子式的推断与计算
【解析】【解答】A.由分析可知,该有机化合物一定含有氧元素,而烯烃只含碳、氢元素,所以不属于烯烃,A不符合题意;
B.由分析可知,该有机化合物一定含有氧元素,B不符合题意;
C.由分析可知,该有机化合物的最简式为CH2O,其分子式可能是CH2O,C符合题意;
D.由分析可知,该有机化合物的最简式为CH2O,其分子式不一定是CH2O,所以其相对分子质量不一定为30,D不符合题意;
故答案为:C。
【分析】根据题干信息可知,n(C)=n(CO2)==0.1mol,n(H)=2n(H2O)=2×=2mol,n(O)==0.1mol,则该有机物中含有C、H、O三种元素,且C、H、O原子个数比为0.1:0.2:0.1=1:2:1,则其最简式为CH2O。
14.【答案】A
【知识点】水的净化;色谱法
【解析】【解答】离子交换树脂净化水的原理是:当含有Na+、Ca2+、Mg2+等阳离子及SO42-、Cl-、NO3-等阴离子的原水通过阳离子交换树脂时,水中的阳离子为树脂所吸附,而树脂上可交换的阳离子H+则被交换到水中,并和水中的阴离子组成相应的无机酸;当含有无机酸的水再通过阴离子交换树脂时,水中的阴离子也为树脂所吸附,树脂上可交换的阴离子OH-也被交换到水中,同时与水中的H+离子结合成水,则
A、根据电荷守恒可知经过阳离子交换树脂后,水中阳离子总数增加,A符合题意;
B、根据以上分析可知水中的SO42-、Cl-、NO3-等阴离子通过阴离子交换树脂被除去,B不符合题意;
C、通过净化处理后,溶液中离子的浓度降低,导电性降低,C不符合题意;
D、根据以上分析可知阴离子交换树脂填充段存在反应H++OH-=H2O,D不符合题意;
故答案为:A。
【分析】A.经过过阳离子交换树脂后,溶液中阳离子所带总电荷不变,但是水中部分阳离子由带2个单位正电荷变为带1个单位正电荷;
B.阴离子交换树脂吸收溶液中阴离子;
C.溶液导电性与离子浓度成正比;
D.经过阳离子交换膜后得到氢离子,经过阴离子交换膜后生成水。
15.【答案】D
【知识点】色谱法
【解析】【解答】裁纸时注意使滤纸纤维为竖直走向,流动相溶剂的液面低于色斑,当流动相溶剂上升至滤纸条的上端(距滤纸上沿约1cm处)时,取出滤纸,用铅笔在流动相溶剂前沿处画一条线,再晾干。
【分析】本题考查纸上层析法的操作,熟练掌握纸上层析法的原理和操作是解题的关键 。
16.【答案】(1)O2 + 4e- +4H+ = 2H2O
(2)
(3)放热;>;1.04
(4);
【知识点】反应热和焓变;电极反应和电池反应方程式;化学平衡常数;化学平衡转化过程中的变化曲线;利用质谱、红外光谱、核磁共振等确定有机物的结构
【解析】【解答】 (1)燃料电池中, O2 作正极,燃料作负极, CH3OH 转化为CO2,在正极氧气得电子生成水,电极方程式为:O2 + 4e- +4H+ = 2H2O;
(2) K1= 【c(CO) ×c2(H2)】【c(CH4)×c1/2(O2)】,K2=c(CH3OH)【 c(CO)×c2(H2)】 ,K3=c2(CH3OH)【c2(CH4) ×c(O2)】;K3= ;
(3)①随着温度的升高,n(CH3OH)减小,升温使平衡逆向移动,正反应为放热反应;
②在图2中作一垂线,温度相同时,P1对应的n(CH3OH)大,反应为体积减小的反应,n(CH3OH)多,P1大于P2;
③M点,n(CH3OH)=0.25mol,根据三段式知:
K=【(0.25/10)×(0.25/10)】【(0.75/10)×(2/10)3】=1.04;
(4)醇与醇分子间可以脱水成醚, CH3OH与ROH生成 C5H12O,R中含有4个碳原子,C5H12O的结构简式为CH3OC4H9,只有2种峰, ROH的结构简式为 , 制备MTBE的化学方程式: ;
【分析】 (1)燃料电池中, O2 作正极,燃料作负极, CH3OH 转化为CO2,在正极氧气得电子生成水,电极方程式为:O2 + 4e- +4H+ = 2H2O;
(2)平衡常数的计算;
(3)①升温使平衡逆向移动,正反应为放热反应;
②根据三段式求平衡常数K;
(4)醇与醇分子间可以脱水成醚, CH3OH与ROH生成 C5H12O,R中含有4个碳原子,C5H12O的结构简式为CH3OC4H9,只有2种峰, ROH的结构简式为 。
17.【答案】(1)
(2);
(3)B;D
(4)冷却结晶;过滤
(5))棕黄;大于
【知识点】氧化还原反应;氧化性、还原性强弱的比较;氯气的实验室制法;蒸发和结晶、重结晶
【解析】【解答】(1)中装的是饱和食盐水,作用是除去杂质氯化氢气体,故为: ;
(2)当温度较高时,氯气会被氧化为氯酸钠,c中采用冰水浴冷却的目的是避免生成副产物氯酸钠,c中是氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为 ;
(3)氯气有毒,d的作用是吸收多余的Cl2,防止污染空气,氯化钠、硫酸均不能与氯气反应,盐硫酸钠、氢氧化钙均能与氯气反应,故答案为:BD。
(4)取出b中试管,经冷却结晶后,要得到KClO3晶体还需要过滤,少量(冷)水洗涤,干燥等操作
故为冷却结晶,过滤;
(5) 取少量和溶液分别置于1号和2号试管中,滴加中性碘化钾溶液。1号试管碘离子被氧化生成碘单质,溶液变为棕黄色,加入 振荡,静置后 层显紫色。2号试管溶液颜色不变;根据上述实验现象可以判断该条件下氧化能力KClO3小于NaClO;故答案为:棕黄色;大于
【分析】本实验的目的是制备KClO3和NaClO,并探究其氧化还原性质,首先利用浓盐酸和二氧化锰共热制取氯气,装置a中用饱和食盐水除去氯气中混有的HCl气体,然后与KOH溶液在热水浴条件下反应制备氯酸钾,剩余的氯气在冰水浴中与NaOH溶液反应制备次氯酸钠,氯气有毒,可以在装置d中盛放NaOH溶液吸收过量的氯气。
18.【答案】(1)CH3CH2CH2CH2Br+NaOHCH2=CHCH2CH3+NaBr+H2O
(2)防止暴沸
(3)可吸收会发出来的乙醇,防止对装置Ⅲ的干扰
(4)紫红色褪去;溴水
(5)不正确,开始加入的物质有乙醇 ,无法判断是否发生取代生成醇
(6)溴乙烷沸点低,加热时没有充分反应就挥发出去
【知识点】乙醇的化学性质;蒸馏与分馏;加成反应
【解析】【解答】(1)圆底烧瓶发生的是卤代烃的消去反应: CH3CH2CH2CH2Br+NaOHCH2=CHCH2CH3+NaBr+H2O ;
(2)液体共热容易出现暴沸的现象,因此加入碎瓷片是为了防暴沸;
(3)装置II中的试剂是水,结合反应的特点可知,其目的是将第一步中挥发出来的乙醇蒸气吸收,防止为后续分析烯烃的实验造成干扰;
(4)因为第一步中有1,3丁二烯的产生,可以与酸性高锰酸钾发生氧化还原反应,所以可以观察到紫红色的溶液褪色;
(5)因为乙醇也可以与钠反应,所以不能证明是产物中的有机物与钠反应,不能证明卤代烃发生取代反应生成了醇;
(6) 实验失败的原因可能是 : 溴乙烷沸点低,加热时没有充分反应就挥发出去 。
【分析】(1)圆底烧瓶发生的是卤代烃的消去反应,消去的是卤素原子以及相邻碳上的氢原子 ;
(2)加入碎瓷片是为了防暴沸;
(3)水的作用是将第一步中挥发出来的乙醇蒸气吸收,防止为后续分析烯烃的实验造成干扰;
(4)烯烃可以与酸性高锰酸钾发生氧化还原反应,紫红色的溶液褪色;
(5)乙醇可以与钠反应;
(6) 实验失败的原因可能是 : 溴乙烷沸点低,加热时没有充分反应就挥发出去 。
19.【答案】(1)SO32->I->Cl-
(2)C
(3)3;上层液体应该在下层液体放出后,再从上口倒出
(4)紫红
【知识点】氧化还原反应;分液和萃取
【解析】【解答】(1)I-可以还原Cl2,亚硫酸钠可以还原碘单质,从而证明三者的还原性顺序为: SO32->I->Cl- ;
(2)根据实验现象,下层是紫色,证明萃取剂的密度大于水,C选项符合题意;
故答案为:C;
(3)3是错误的操作;正确操作是: 上层液体应该在下层液体放出后,再从上口倒出 ;
(4)碘的CCl4溶液显紫红色,在下层。
【分析】(1)在氧化还原反应中,还原剂的还原性强于还原产物;
(2)萃取剂可以溶解更多的溶质,且萃取剂与原溶剂不发生反应也不互溶;
(3)应该先从下口放出下层溶液;然后再从上口倒出上层液体;
(4)CCl4的密度大于水,在下层,且碘单质溶于CCl4显紫红色。
20.【答案】(1)除去,防止干扰后续实验
(2)
(3)白色固体逐渐溶解,溶液为无色
(4)氢离子与氨分子结合成稳定的铵根离子,促使解离平衡正向移动
(5)紫红色;充分振荡静置分液,取上层溶液于烧杯中,滴加足量浓盐酸,充分反应后过滤、洗涤、干燥可得单质碘;
【知识点】配合物的成键情况;化学平衡的影响因素;分液和萃取;离子方程式的书写
【解析】【解答】(1)多余的碘单质,用四氯化碳将碘单质除去,防止后期实验被干扰;
(2)根据无色溶液为 ,加入浓氨水后得到深蓝色的溶液主要是因为 (无色),易被空气氧化,最终得到,方程式为: ;
(3) 为白色不溶于水的固体,向中加入浓溶液 ,得到 (无色),因此现象为:白色固体逐渐溶解,溶液为无色 ;
(4) (蓝色)加入盐酸后变为黄绿色得到的是(黄色) ,主要是 氢离子与氨分子结合成稳定的铵根离子,促使解离平衡正向移动 ;
(5)碘单质溶解在四氯化碳中呈紫红色,加入浓氢氧化钠溶液后,振荡静置,取上层溶液加入浓盐酸过滤洗涤干燥得到单质碘;发生的反应为: , ;
【分析】(1)四氯化碳是用来萃取碘单质;
(2)根据颜色变化找出产物利用物质的性质写出方程式;
(3)考查的是形成无色的 ;
(4)根据氢离子结合氨气分子导致平衡移动;
(5)结合碘单质溶于四氯化碳的颜色为紫红色,加入氢氧化钠溶液后振荡区上层清液加入浓盐酸即可过滤洗涤干燥,结合收集到的产物即可写出方程式。
21.【答案】(1)C;D
(2)降低在水中的溶解度,抑制和水的反应
(3)
(4);、、
【知识点】同分异构现象和同分异构体;甲烷的化学性质;甲烷的取代反应;取代反应;有机分子式的推断与计算
【解析】【解答】(1)A.甲烷与氯气光照产物有:一氯甲烷(气体),所以不可能全部充满,A项错误;
B.甲烷与氯气反应,氯气颜色逐渐变浅,B项错误;
C.二氯甲烷、三氯甲烷、四氯甲烷均为油状液体,密度大于水,试管内壁出现油状液滴,C项正确;
D.该反应有氯化氢生成,所以试管内部有白雾生成,D项正确;
故答案为:CD。
(2)氯气在饱和食盐水中溶解度非常小,而在水中溶解度比较大,所以选择用饱和食盐水;
(3)该反应为取代反应,生成一氯甲烷同时还有氯化氢生成,反应为:
(4)根据烷烃的通式为CnH2n+2,则12n+2n+2=72,解得n=5,该烷烃的分子式为C5H12
该有机物为戊烷,有3种同分异构体,分别为: 、、
【分析】(1)结合甲烷与氯气反应的产物进行分析,要注意一氯甲烷为气体,其他有机产物都是油状液体;
(2)通常用饱和食盐水进行降低氯气的溶解度,而氯气在水中溶解度比较大;
(3)该反应为取代反应,注意反应条件和取代产物还有氯化氢;
(4)根据烷烃通式即可算出有机物分子式,进而写出该有机物的同分异构体。
22.【答案】(1);
(2)③④①②
(3),,三甲基乙基辛烷;
【知识点】有机化合物的命名;同分异构现象和同分异构体;有机分子式的推断与计算;烷烃
【解析】【解答】(1)①根据阿伏加德罗推理可知,密度之比等于摩尔质量之比,所以烷烃A在同温同压下蒸气的密度是H2的43倍,则A的相对分子量为2×43=86,烷烃的组成为CnH2n+2,14n+2=86,n=6,即该烷烃的分子式为C6H14,故答案为:C6H14;②根据烷烃的通式CnH2n+2,烷烃B的分子中含有200个氢原子,即2n+2=200,解得n=99,所以B的分子式为C99H200;
(2)对应烷烃来说,碳原子数目越多,沸点越高,碳原子数目相同时,支链越多,沸点越多,据此可以判断 沸点按由高到低的顺序排列 为: ③④①② ;
(3)①根据结构可知,最长碳链有7个碳,为辛烷,从左边对主链碳进行编号,确定支链位置,所以命名为: ,,三甲基乙基辛烷 ;②根据结构可知,该有机物含有10种不同氢原子,所以一氯代物有10种。
【分析】(1) 同温同压下蒸气的密度是的倍 即可算出摩尔质量为氢气的43倍,再根据烷烃有机物通式进行计算即可;
(2)对应烷烃来说,碳原子数目越多,沸点越高,碳原子数目相同时,支链越多,沸点越多。
(3)对于烷烃命名步骤:1.选最长碳链为主链;2.编序号,定支链,3.命名;一般在判断一氯代物种类,即判断氢原子种类即可。
试题分析部分
1、试卷总体分布分析
总分:77分
分值分布 客观题(占比) 30.0(39.0%)
主观题(占比) 47.0(61.0%)
题量分布 客观题(占比) 15(68.2%)
主观题(占比) 7(31.8%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
选择题 15(68.2%) 30.0(39.0%)
非选择题 7(31.8%) 47.0(61.0%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (100.0%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 甲烷的化学性质 6.0(7.8%) 21
2 有机化合物的命名 5.0(6.5%) 22
3 氧化性、还原性强弱的比较 9.0(11.7%) 17
4 有机物中的官能团 2.0(2.6%) 1
5 离子方程式的书写 7.0(9.1%) 20
6 色谱法 4.0(5.2%) 14,15
7 化学平衡转化过程中的变化曲线 7.0(9.1%) 16
8 乙醇的化学性质 7.0(9.1%) 18
9 焰色反应 2.0(2.6%) 4
10 水的净化 2.0(2.6%) 14
11 配合物的成键情况 7.0(9.1%) 20
12 氧化还原反应 15.0(19.5%) 17,19
13 分液和萃取 25.0(32.5%) 4,5,6,8,10,11,19,20
14 利用质谱、红外光谱、核磁共振等确定有机物的结构 13.0(16.9%) 1,2,3,16
15 蒸馏与分馏 19.0(24.7%) 2,5,6,7,8,9,18
16 氯气的实验室制法 13.0(16.9%) 7,8,17
17 同分异构现象和同分异构体 13.0(16.9%) 12,21,22
18 加成反应 7.0(9.1%) 18
19 有机分子式的推断与计算 17.0(22.1%) 1,12,13,21,22
20 配制一定物质的量浓度的溶液 4.0(5.2%) 4,7
21 烷烃 7.0(9.1%) 12,22
22 海水资源及其综合利用 2.0(2.6%) 10
23 甲烷的取代反应 6.0(7.8%) 21
24 电极反应和电池反应方程式 7.0(9.1%) 16
25 化学平衡常数 7.0(9.1%) 16
26 中和热的测定 2.0(2.6%) 9
27 中和滴定 2.0(2.6%) 9
28 蒸发和结晶、重结晶 17.0(22.1%) 4,5,6,10,17
29 二氧化硫的性质 2.0(2.6%) 8
30 化学平衡的影响因素 7.0(9.1%) 20
31 取代反应 6.0(7.8%) 21
32 氨的实验室制法 2.0(2.6%) 7
33 反应热和焓变 7.0(9.1%) 16
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
高中化学同步练习:选择性必修三1.2研究有机化合物的一般方法(能力提升)
一、选择题
1.将6.8gX完全燃烧生成和8.96L(标准状况)。X的质谱图、核磁共振氢谱图与红外光谱图如图所示。下列关于的叙述错误的是( )
A.的化学式为
B.分子中有四种化学环境不同的氢原子
C.的官能团一定为醚键和羰基
D.可能是
2.研究有机物的一般步骤:分离提纯→确定最简式→确定分子式→确定结构式。以下研究有机物的方法错误的是( )
A.蒸馏——分离提纯液态有机混合物
B.燃烧法——研究确定有机物成分的有效方法
C.核磁共振氢谱——通常用于分析有机物的相对分子质量
D.红外光谱——确定有机物分子中的官能团或化学键
3.某有机物A的分子式为C4H10O,红外光谱图如图所示,则A的结构简式为 ( )
A.CH3CH2OCH2CH3 B.CH3OCH2CH2CH3
C.CH3CH2CH2OCH3 D.( CH3)2CHOCH3
4.下列实验装置或操作能达到实验目的的是( )
A B C D
分离苯和四氯化碳的混合物 配制一定浓度的NaOH溶液 利用焰色反应检验某溶液中是否含有Na元素 蒸发结晶得到氯化钠晶体
A.A B.B C.C D.D
5.下列实验操作中,正确的是( )
A.蒸发操作时,将KCl溶液直接蒸干得到KCl晶体
B.分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从下口放出到另一个烧杯中
C.蒸馏操作时,先点燃酒精灯,后通冷却水
D.萃取操作中,倒转分液漏斗振荡并适时旋开活塞放气
6.下列叙述正确的是( )
A.用装置Ⅰ分离乙酸乙酯与饱和碳酸钠溶液
B.用装置Ⅱ蒸干硫酸亚铁溶液制备FeSO4·7H2O
C.用装置Ⅲ将硫酸铜溶液蒸发浓缩、冷却结晶,得到胆矾晶体
D.用装置Ⅳ分离Cl2与KI溶液反应生成的碘
7.下述实验装置或试剂不正确的是( )
A.分离、 B.向容量瓶中转移溶液 C.制备干燥纯净的 D.实验室制取
A.A B.B C.C D.D
8.下列装置或操作能达到实验目的的是( )
A.用甲装置制取SO2 B.用乙装置除去氯气中的HCl气体
C.用丙装置分离苯和水 D.用丁装置分离乙酸与乙醇
9.下列实验操作或装置正确的是
A.用甲装置分离苯和溴苯的混合液
B.用乙装置进行氢氧化钠滴定盐酸的实验,测定盐酸的浓度
C.用丙装置制备无水氯化镁
D.用丁装置进行中和热的测定
10.下列实验中,不能达到实验目的的是( )
由海水制取蒸馏水
萃取碘水中的碘 分离粗盐中的不溶物 由FeCl3·6H2O制取无水FeCl3固体
A B C D
A.A B.B C.C D.D
11.可以用分液漏斗分离的一组混合物是( )
A.苯和甲苯 B.乙醇和水
C.苯和水 D.溴和四氯化碳
12.某烷烃相对分子质量为,跟氯气反应生成的一氯代物只有一种,该烷烃的结构简式是( )
A. B.
C. D.
13.将某有机化合物M在足量氧气中完全燃烧,生成和。有关M的说法正确的是( )
A.属于烯烃 B.不含O元素
C.分子式可能为 D.相对分子质量一定为30
14.离子交换法净化水过程如图所示。下列说法中错误的是( )
A.经过阳离子交换树脂后,水中阳离子的总数不变
B.水中的 、 、Cl 通过阴离子树脂后被除去
C.通过净化处理后,水的导电性降低
D.阴离子树脂填充段存在反应H++OH =H2O
15.下列关于纸色谱法分离Fe3+和Cu2+操作正确的是( )
A.裁滤纸应垂直纤维方向裁开
B.点样时,斑点尽量小,且再点时必须在同一位置
C.展开时,用流动相溶剂刚好淹过色斑进行展开
D.当流动相溶剂上升至滤纸上沿时,取出晾干观察
二、非选择题
16.甲醇是基本有机原料之一,可用于燃料电池、制取等有机产品。
(1)一种“直接甲醇燃料电池”结构如图所示,电解质为强酸溶液,该燃料电池正极的电极反应式为 。
(2)水煤气法制取甲醇的反应其反应的焓变、平衡常数如下:
|平衡常数K1
CO(g)+2H2(g)CH3OH(g) ΔH2=-90.1kJ/mol 平衡常数K2
2CH4(g)+O2(g) CH3OH(g) ΔH3平衡常数K3
则相同温度下K3= (用含K1代数式表示)。
(3)二氧化碳加氢也可合成甲醇[CO2(g) + 3H2(g) CH3OH(g) + H2O(g)],在10.0L的密闭容器中投入和,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强变化如图所示。
①图中二氧化碳合成甲醇正反应为 反应(选填:“放热”或“吸热”)。
②图中压强p1 P2 (选填:“>”或“<”)。
③在图中“M”点,平衡常数K= (填数值,保留2位小数)。
(4)甲醇与醇ROH在浓硫酸及加热条件下可制备汽油抗爆震剂MTBE,反应原理为:CH3OH+ROHCH3OR+H2O
已知MTBE的分子式为,其核磁共振氢谱如图所示。
①ROH的结构简式为 。
②写出制备MTBE的化学方程式: 。
17.氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备和,探究其氧化还原性质。
已知:①是一种无色、密度比水大、不溶于水的液体。
②的水溶液呈棕黄色,的溶液呈紫色。
回答下列问题:
(1)a的作用是除去杂质 (写化学式)。
(2)c中采用冰水浴冷却的目的是避免生成副产物 (写化学式),写出c中反应的化学方程式 。
(3)d的作用是进行尾气处理,可选用试剂____(填标号)。
A. B. C. D.
(4)反应结束后,取出b中试管,经蒸发浓缩, , ,少量(冷)水洗涤,干燥,得到晶体。
(5)取少量和溶液分别置于1号和2号试管中,滴加中性溶液。1号试管溶液变为 色,加入振荡,静置后层显紫色。2号试管溶液颜色不变。可知该条件下的氧化能力 (填“大于”或“小于”)。
18.某同学探究 1﹣溴丁烷消去反应的实验装置如图所示,先在圆底烧瓶中加入 2.0gNaOH 和 15mL 无水乙醇,搅拌,再加入 5mL1﹣溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯)产生的气体通过盛有水的试管后,再通入盛有酸性 KMnO4溶液的试管中。试回答下列问题:
(1)写出圆底烧瓶中反应的化学方程式: 。
(2)实验时加入碎瓷片的目的是 。
(3)装置Ⅱ的作用是 。
(4)装置Ⅲ中可观察到的现象是 。如果没有装置Ⅱ,则装置Ⅲ中的药品应换成 。
(5)向圆底烧瓶中反应后的溶液加入金属钠,产生气泡。该同学分析同时发生取代反应,请判断此分析正确与否?并说明理由: 。
(6)已知:溴乙烷的沸点:38.4℃,1﹣溴丁烷的沸点:101.6℃。该同学用溴乙烷代替 1﹣溴丁烷进行实验时,发现酸性 KMnO4溶液不褪色。则实验失败的原因可能是 。
19.某实验小组为探究Cl-、I-、SO32-的还原性强弱,甲同学设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量新制氯水溶液,溶液立刻变蓝;
实验②:向实验①的溶液中加入亚硫酸钠溶液,发现溶液蓝色褪去。
(1)根据上述实验现象,可以判断Cl-、I-、SO32-还原性由强到弱的顺序为 。
乙同学参考教科书知识,提出另一种实验方法,在碘化钾溶液中加入新制氯水后,将碘化钾溶液加入新制氯水后,将溶液转移入分液漏斗,并加入萃取剂,主要操作步骤如图:
1. 加入萃取剂后振荡 2. 静置分层 3. 分离
(2)根据图中现象,该同学所采用的萃取剂可能是( )
A.酒精 B.苯 C.CCl4 D.汽油
(3)甲、乙、丙三步实验操作中,不正确的是 (填“1”、“2”或“3”),理由是 。
(4)在乙图的分液漏斗中,下层液体呈 色。
20.某小组设计实验探究铜被碘氧化的产物及铜元素的价态。
已知:①易溶于溶液,发生反应(红棕色);
②铜元素被氧化可能存在的形式有(蓝色)、(无色);
③(无色),易被空气氧化。
请回答:
(1)步骤Ⅰ中加入萃取分液的目的是 .
(2)用离子方程式表示步骤Ⅱ中发生的反应 .
(3)已知为白色不溶于水的固体,向中加入浓溶液,现象为 .
(4)向深蓝色溶液中滴加浓盐酸,溶液呈黄绿色,写出该转化能进行的可能原因 .
(已知:稳定性远大于(黄色),稳定指的是不易发生解离反应)
(5)层呈 色。如何设计实验将层中的碘元素分离得到碘单质,请补充完具体实验操作步骤:将层溶液转移入分液漏斗中,加入足量浓氢氧化钠溶液, 。请补充完实验操作中涉及的离子方程式:, .
21.某课外活动小组利用如图所示装置探究甲烷和氯气的反应:
(1)实验中可观察到的现象有 ____ 填字母。
A.试管内液面上升,最终充满试管
B.试管内气体颜色逐渐变深
C.试管内壁出现油状液滴
D.试管内有少量白雾生成
(2)用饱和食盐水而不用水的原因是 。
(3)请写出生成一氯甲烷的化学反应方程式: 。
(4)某链状烷烃的相对分了质量为,该烷烃的分子式为 ,该烷烃存在同分异构体现象,用结构简式写出该有机物的所有结构 。
22.烷烃广泛存在于自然界中,例如苹果表面的蜡状物质、蚂蚁分泌的信息素、石蜡和凡士林等物质中都含有烷烃。
(1)写出下列各烷烃的分子式。
烷烃在同温同压下蒸气的密度是的倍: 。
烷烃的分子中含有个氢原子: 。
(2)把下列物质的沸点按由高到低的顺序排列 。填入编号
,,三甲基戊烷
(3)①用系统命名法命名下面的烃: ;
的一氯代物有 种。
答案解析部分
1.【答案】C
【知识点】利用质谱、红外光谱、核磁共振等确定有机物的结构;有机物中的官能团;有机分子式的推断与计算
【解析】【解答】A、由分析可知,X的分子式为C8H8O2,A不符合题意。
B、由核磁共振氢谱图可知,X分子中含有四种吸收峰,因此X分子中含有四种化学环境不同的氢原子,B不符合题意。
C、有机物X的不饱和度为,所以分子结构中含有苯环和一个碳氧双键。由核磁共振氢谱可知,分子结构中含有4种不同化学环境的氢原子,且个数比为3:2:2:1,因此满足条件的X的结构简式以为,所以其所含的官能团为酯基,C符合题意。
D、由C选项的分析可知,有机物X的结构简式为,D不符合题意。
故答案为:C
【分析】由质谱图可知,有机物X的相对分子质量为136,因此6.8gX的物质的量为0.05mol,反应生成n(H2O)=0.2mol、n(CO2)=0.4mol。所以有机物X中所含m(C)=0.4mol×12g·mol-1=4.8g;m(H)=0.2mol×2×1g·mol-1=0.4g。因此有机物X中含有氧元素,其质量m(O)=6.8g-4.8g-0.4g=1.6g。所以可得0.05mol有机物X中n(C)=0.4mol、n(H)=0.4mol、n(O)=0.1mol,所以有机物X的分子式为C8H8O2。
2.【答案】C
【知识点】利用质谱、红外光谱、核磁共振等确定有机物的结构;蒸馏与分馏
【解析】【解答】A、蒸馏,用于分离提出互溶但沸点不同的液态有机物,A不符合题意。
B、燃烧法,用于测定有机物中元素质量比,从而确定有机物的实验式,B不符合题意。
C、核磁共振氢谱,用于测定有机物中氢原子的种类,从而确定有机物的结构简式,相对分子质量是通过质谱仪测定,C符合题意。
D、红外光谱,是用于确定有机物分子中的官能团或化学键,D不符合题意。
故答案为:C
【分析】根据有机物的研究步骤、方法进行分析即可。
3.【答案】A
【知识点】利用质谱、红外光谱、核磁共振等确定有机物的结构
【解析】【解答】A的分子式为C4H10O,分析红外光谱图可知,分子中含有对称的-CH3,对称的-CH2-和醚键,其结构简式为CH3CH2OCH2CH3;
故答案选A。
【分析】A的分子式为C4H10O,分析红外光谱图可知,分子中含有对称的-CH3,对称的-CH2-和醚键。
4.【答案】C
【知识点】焰色反应;蒸发和结晶、重结晶;分液和萃取;配制一定物质的量浓度的溶液
【解析】【解答】A.分离苯和四氯化碳利用蒸馏应该将温度计放在支管口时,故A不符合题意;
B.配制溶液应该在烧杯中进行溶解冷却,故B不符合题意;
C.利用焰色试验可检验钠元素,故C符合题意;
D.蒸发结晶时利用蒸发皿,故D不符合题意;
故答案为:C
【分析】A.温度计放在支管口处
B.配制氢氧化钠溶液时应该在烧杯中溶解和冷却
C.焰色试验时利用铁丝蘸取待测液进行检验钠元素
D.蒸发时利用蒸发皿
5.【答案】D
【知识点】蒸发和结晶、重结晶;蒸馏与分馏;分液和萃取
【解析】【解答】A. 蒸发操作时,将KCl溶液蒸发快蒸干时停止加热,用预余热蒸干得到晶体,故A不符合题意;
B. 分液操作时,分液漏斗中下层液体从下口放出后,再将上层液体从上口放出到另一个烧杯中,故B不符合题意;
C. 蒸馏操作时,先通冷却水 ,后点燃酒精灯,故C不符合题意;
D. 萃取操作中,倒转分液漏斗振荡并适时旋开活塞放气 ,防止压强过大,故D符合题意;
故答案为:D
【分析】A.蒸发操作时,可将溶液蒸发到快蒸干时停止加热利用余热蒸干
B.分液时分液漏斗上层液体从上端倒出,下层从下面流出
C.蒸馏时先通冷水再点燃酒精灯
D.萃取时需要不断放气防止压强过大
6.【答案】A
【知识点】蒸发和结晶、重结晶;蒸馏与分馏;分液和萃取
【解析】【解答】A.乙酸乙酯是有机物,碳酸钠溶液是无机物,可进行分液,故A符合题意;
B.亚铁离子具有还原性,在空气中加热易被氧化,故B不符合题意;
C.蒸发结晶一般用的是坩埚不是用烧杯,故C不符合题意;
D.碘单质可溶于水,因此加入有机物萃取,故D不符合题意;
故答案为:A
【分析】A.分离乙酸乙酯是利用碳酸钠溶液;
B.亚铁离子具有还原性易被氧化;
C.蒸发结晶一般用的是坩埚;
D.碘单质溶于水,过滤不能分离一般用萃取。
7.【答案】C
【知识点】氯气的实验室制法;氨的实验室制法;蒸馏与分馏;配制一定物质的量浓度的溶液
【解析】【解答】A. 、三种有机物的熔沸点不同,可以用蒸馏的方法进行分离有机物,故A不符合题意;
B.利用玻璃棒进行引流将液体倒入容量瓶中,故B不符合题意;
C.制备干燥的氯气需要用饱和食盐水除去氯化氢,用浓硫酸除去水蒸气,故C符合题意;
D.实验室制取氨气利用熟石灰和铵盐进行加热得到,故D不符合题意;
故答案为:C
【分析】A.利用熔沸点不同可将有机物进行分离
B.利用玻璃棒进行引流进行液体转移
C.制备干燥的氯气需要用饱和食盐水除去氯化氢和浓硫酸除水
D.利用熟石灰和铵盐可制取氨气
8.【答案】C
【知识点】氯气的实验室制法;二氧化硫的性质;蒸馏与分馏;分液和萃取
【解析】【解答】A、Cu与浓硫酸反应制取SO2的化学方程式为:Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑,该反应需要加热,A不符合题意。
B、Cl2、HCl都能与NaOH反应,因此不能用NaOH溶液除去Cl2中混有的HCl,应用饱和食盐水除去Cl2中混有的HCl,B不符合题意。
C、苯和水不互溶,可用分液操作进行分离,C符合题意。
D、蒸馏装置中,温度计测量的是蒸汽的温度,因此温度计的水银球应位于蒸馏烧瓶的支管口处,不能伸入溶液内,D不符合题意。
故答案为:C
【分析】A、Cu与浓硫酸的反应需要加热。
B、Cl2、HCl都能与NaOH溶液反应。
C、苯和水不互溶,可用分液进行分离。
D、蒸馏时温度计应位于蒸馏烧瓶支管口处,不能伸入溶液中。
9.【答案】C
【知识点】蒸馏与分馏;中和滴定;中和热的测定
【解析】【解答】A.图中温度计的水银球未在支管口处,A不符合题意;
B.用氢氧化钠滴定盐酸,氢氧化钠标准溶液应该放在碱式滴定管中,图中为酸式滴定管,B不符合题意;
C.HCl可抑制氯化镁的水解,故可在HCl气流中加热氯化镁晶体制备无水氯化镁,C符合题意;
D.测定中和热时,大小两个烧杯口应该平齐并用盖板盖严以减少热量的损失,D不符合题意;
故答案为:C。
【分析】A.蒸馏时温度计测定馏分的温度,温度计的水银球应在蒸馏烧瓶的支管口处;
B.NaOH溶液应盛放在碱式滴定管中;
D.测定中和热时,大小烧杯的烧杯口应该平齐。
10.【答案】D
【知识点】海水资源及其综合利用;蒸发和结晶、重结晶;分液和萃取
【解析】【解答】A.利用海水进行蒸馏得到蒸馏水,故A不符合题意;
B.碘在四氯化碳的溶解度大于水,故B不符合题意;
C.过滤可以实现固液分离,故C不符合题意;
D.此方法得到的是氢氧化铁固体,故D符合题意;
故答案为:D
【分析】A.利用蒸馏可以得到蒸馏水;
B.利用溶解度不同可以提纯碘;
C.利用过滤可以实现固体液体分离;
D.考虑铁离子水解此法不能得到氯化铁晶体。
11.【答案】C
【知识点】分液和萃取
【解析】【解答】A、苯和甲苯互溶,不能用分液漏斗分离,故A不符合题意;
B、乙醇和水互溶,不能用分液漏斗分离,故B不符合题意;
C、苯和水互不相溶,能用分液漏斗分离,故C符合题意;
D、溴和四氯化碳互溶,不能用分液漏斗分离,故D不符合题意;
故答案为:C。
【分析】用分液漏斗可分离互不相溶的液体混合物。
12.【答案】C
【知识点】同分异构现象和同分异构体;有机分子式的推断与计算;烷烃
【解析】【解答】烷烃相对分子质量114,其分子式应为C8H18; 跟氯气反应生成的一氯代物只有一种 ,说明只有一种氢原子,根据对称原则, 烷烃的结构简式是;故答案为:C.
【分析】 跟氯气反应生成的一氯代物只有一种 ,可以通过等效氢来确定有机物一氯代物种类,结合有机物分子式,据此解答即可。
13.【答案】C
【知识点】有机分子式的推断与计算
【解析】【解答】A.由分析可知,该有机化合物一定含有氧元素,而烯烃只含碳、氢元素,所以不属于烯烃,A不符合题意;
B.由分析可知,该有机化合物一定含有氧元素,B不符合题意;
C.由分析可知,该有机化合物的最简式为CH2O,其分子式可能是CH2O,C符合题意;
D.由分析可知,该有机化合物的最简式为CH2O,其分子式不一定是CH2O,所以其相对分子质量不一定为30,D不符合题意;
故答案为:C。
【分析】根据题干信息可知,n(C)=n(CO2)==0.1mol,n(H)=2n(H2O)=2×=2mol,n(O)==0.1mol,则该有机物中含有C、H、O三种元素,且C、H、O原子个数比为0.1:0.2:0.1=1:2:1,则其最简式为CH2O。
14.【答案】A
【知识点】水的净化;色谱法
【解析】【解答】离子交换树脂净化水的原理是:当含有Na+、Ca2+、Mg2+等阳离子及SO42-、Cl-、NO3-等阴离子的原水通过阳离子交换树脂时,水中的阳离子为树脂所吸附,而树脂上可交换的阳离子H+则被交换到水中,并和水中的阴离子组成相应的无机酸;当含有无机酸的水再通过阴离子交换树脂时,水中的阴离子也为树脂所吸附,树脂上可交换的阴离子OH-也被交换到水中,同时与水中的H+离子结合成水,则
A、根据电荷守恒可知经过阳离子交换树脂后,水中阳离子总数增加,A符合题意;
B、根据以上分析可知水中的SO42-、Cl-、NO3-等阴离子通过阴离子交换树脂被除去,B不符合题意;
C、通过净化处理后,溶液中离子的浓度降低,导电性降低,C不符合题意;
D、根据以上分析可知阴离子交换树脂填充段存在反应H++OH-=H2O,D不符合题意;
故答案为:A。
【分析】A.经过过阳离子交换树脂后,溶液中阳离子所带总电荷不变,但是水中部分阳离子由带2个单位正电荷变为带1个单位正电荷;
B.阴离子交换树脂吸收溶液中阴离子;
C.溶液导电性与离子浓度成正比;
D.经过阳离子交换膜后得到氢离子,经过阴离子交换膜后生成水。
15.【答案】D
【知识点】色谱法
【解析】【解答】裁纸时注意使滤纸纤维为竖直走向,流动相溶剂的液面低于色斑,当流动相溶剂上升至滤纸条的上端(距滤纸上沿约1cm处)时,取出滤纸,用铅笔在流动相溶剂前沿处画一条线,再晾干。
【分析】本题考查纸上层析法的操作,熟练掌握纸上层析法的原理和操作是解题的关键 。
16.【答案】(1)O2 + 4e- +4H+ = 2H2O
(2)
(3)放热;>;1.04
(4);
【知识点】反应热和焓变;电极反应和电池反应方程式;化学平衡常数;化学平衡转化过程中的变化曲线;利用质谱、红外光谱、核磁共振等确定有机物的结构
【解析】【解答】 (1)燃料电池中, O2 作正极,燃料作负极, CH3OH 转化为CO2,在正极氧气得电子生成水,电极方程式为:O2 + 4e- +4H+ = 2H2O;
(2) K1= 【c(CO) ×c2(H2)】【c(CH4)×c1/2(O2)】,K2=c(CH3OH)【 c(CO)×c2(H2)】 ,K3=c2(CH3OH)【c2(CH4) ×c(O2)】;K3= ;
(3)①随着温度的升高,n(CH3OH)减小,升温使平衡逆向移动,正反应为放热反应;
②在图2中作一垂线,温度相同时,P1对应的n(CH3OH)大,反应为体积减小的反应,n(CH3OH)多,P1大于P2;
③M点,n(CH3OH)=0.25mol,根据三段式知:
K=【(0.25/10)×(0.25/10)】【(0.75/10)×(2/10)3】=1.04;
(4)醇与醇分子间可以脱水成醚, CH3OH与ROH生成 C5H12O,R中含有4个碳原子,C5H12O的结构简式为CH3OC4H9,只有2种峰, ROH的结构简式为 , 制备MTBE的化学方程式: ;
【分析】 (1)燃料电池中, O2 作正极,燃料作负极, CH3OH 转化为CO2,在正极氧气得电子生成水,电极方程式为:O2 + 4e- +4H+ = 2H2O;
(2)平衡常数的计算;
(3)①升温使平衡逆向移动,正反应为放热反应;
②根据三段式求平衡常数K;
(4)醇与醇分子间可以脱水成醚, CH3OH与ROH生成 C5H12O,R中含有4个碳原子,C5H12O的结构简式为CH3OC4H9,只有2种峰, ROH的结构简式为 。
17.【答案】(1)
(2);
(3)B;D
(4)冷却结晶;过滤
(5))棕黄;大于
【知识点】氧化还原反应;氧化性、还原性强弱的比较;氯气的实验室制法;蒸发和结晶、重结晶
【解析】【解答】(1)中装的是饱和食盐水,作用是除去杂质氯化氢气体,故为: ;
(2)当温度较高时,氯气会被氧化为氯酸钠,c中采用冰水浴冷却的目的是避免生成副产物氯酸钠,c中是氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为 ;
(3)氯气有毒,d的作用是吸收多余的Cl2,防止污染空气,氯化钠、硫酸均不能与氯气反应,盐硫酸钠、氢氧化钙均能与氯气反应,故答案为:BD。
(4)取出b中试管,经冷却结晶后,要得到KClO3晶体还需要过滤,少量(冷)水洗涤,干燥等操作
故为冷却结晶,过滤;
(5) 取少量和溶液分别置于1号和2号试管中,滴加中性碘化钾溶液。1号试管碘离子被氧化生成碘单质,溶液变为棕黄色,加入 振荡,静置后 层显紫色。2号试管溶液颜色不变;根据上述实验现象可以判断该条件下氧化能力KClO3小于NaClO;故答案为:棕黄色;大于
【分析】本实验的目的是制备KClO3和NaClO,并探究其氧化还原性质,首先利用浓盐酸和二氧化锰共热制取氯气,装置a中用饱和食盐水除去氯气中混有的HCl气体,然后与KOH溶液在热水浴条件下反应制备氯酸钾,剩余的氯气在冰水浴中与NaOH溶液反应制备次氯酸钠,氯气有毒,可以在装置d中盛放NaOH溶液吸收过量的氯气。
18.【答案】(1)CH3CH2CH2CH2Br+NaOHCH2=CHCH2CH3+NaBr+H2O
(2)防止暴沸
(3)可吸收会发出来的乙醇,防止对装置Ⅲ的干扰
(4)紫红色褪去;溴水
(5)不正确,开始加入的物质有乙醇 ,无法判断是否发生取代生成醇
(6)溴乙烷沸点低,加热时没有充分反应就挥发出去
【知识点】乙醇的化学性质;蒸馏与分馏;加成反应
【解析】【解答】(1)圆底烧瓶发生的是卤代烃的消去反应: CH3CH2CH2CH2Br+NaOHCH2=CHCH2CH3+NaBr+H2O ;
(2)液体共热容易出现暴沸的现象,因此加入碎瓷片是为了防暴沸;
(3)装置II中的试剂是水,结合反应的特点可知,其目的是将第一步中挥发出来的乙醇蒸气吸收,防止为后续分析烯烃的实验造成干扰;
(4)因为第一步中有1,3丁二烯的产生,可以与酸性高锰酸钾发生氧化还原反应,所以可以观察到紫红色的溶液褪色;
(5)因为乙醇也可以与钠反应,所以不能证明是产物中的有机物与钠反应,不能证明卤代烃发生取代反应生成了醇;
(6) 实验失败的原因可能是 : 溴乙烷沸点低,加热时没有充分反应就挥发出去 。
【分析】(1)圆底烧瓶发生的是卤代烃的消去反应,消去的是卤素原子以及相邻碳上的氢原子 ;
(2)加入碎瓷片是为了防暴沸;
(3)水的作用是将第一步中挥发出来的乙醇蒸气吸收,防止为后续分析烯烃的实验造成干扰;
(4)烯烃可以与酸性高锰酸钾发生氧化还原反应,紫红色的溶液褪色;
(5)乙醇可以与钠反应;
(6) 实验失败的原因可能是 : 溴乙烷沸点低,加热时没有充分反应就挥发出去 。
19.【答案】(1)SO32->I->Cl-
(2)C
(3)3;上层液体应该在下层液体放出后,再从上口倒出
(4)紫红
【知识点】氧化还原反应;分液和萃取
【解析】【解答】(1)I-可以还原Cl2,亚硫酸钠可以还原碘单质,从而证明三者的还原性顺序为: SO32->I->Cl- ;
(2)根据实验现象,下层是紫色,证明萃取剂的密度大于水,C选项符合题意;
故答案为:C;
(3)3是错误的操作;正确操作是: 上层液体应该在下层液体放出后,再从上口倒出 ;
(4)碘的CCl4溶液显紫红色,在下层。
【分析】(1)在氧化还原反应中,还原剂的还原性强于还原产物;
(2)萃取剂可以溶解更多的溶质,且萃取剂与原溶剂不发生反应也不互溶;
(3)应该先从下口放出下层溶液;然后再从上口倒出上层液体;
(4)CCl4的密度大于水,在下层,且碘单质溶于CCl4显紫红色。
20.【答案】(1)除去,防止干扰后续实验
(2)
(3)白色固体逐渐溶解,溶液为无色
(4)氢离子与氨分子结合成稳定的铵根离子,促使解离平衡正向移动
(5)紫红色;充分振荡静置分液,取上层溶液于烧杯中,滴加足量浓盐酸,充分反应后过滤、洗涤、干燥可得单质碘;
【知识点】配合物的成键情况;化学平衡的影响因素;分液和萃取;离子方程式的书写
【解析】【解答】(1)多余的碘单质,用四氯化碳将碘单质除去,防止后期实验被干扰;
(2)根据无色溶液为 ,加入浓氨水后得到深蓝色的溶液主要是因为 (无色),易被空气氧化,最终得到,方程式为: ;
(3) 为白色不溶于水的固体,向中加入浓溶液 ,得到 (无色),因此现象为:白色固体逐渐溶解,溶液为无色 ;
(4) (蓝色)加入盐酸后变为黄绿色得到的是(黄色) ,主要是 氢离子与氨分子结合成稳定的铵根离子,促使解离平衡正向移动 ;
(5)碘单质溶解在四氯化碳中呈紫红色,加入浓氢氧化钠溶液后,振荡静置,取上层溶液加入浓盐酸过滤洗涤干燥得到单质碘;发生的反应为: , ;
【分析】(1)四氯化碳是用来萃取碘单质;
(2)根据颜色变化找出产物利用物质的性质写出方程式;
(3)考查的是形成无色的 ;
(4)根据氢离子结合氨气分子导致平衡移动;
(5)结合碘单质溶于四氯化碳的颜色为紫红色,加入氢氧化钠溶液后振荡区上层清液加入浓盐酸即可过滤洗涤干燥,结合收集到的产物即可写出方程式。
21.【答案】(1)C;D
(2)降低在水中的溶解度,抑制和水的反应
(3)
(4);、、
【知识点】同分异构现象和同分异构体;甲烷的化学性质;甲烷的取代反应;取代反应;有机分子式的推断与计算
【解析】【解答】(1)A.甲烷与氯气光照产物有:一氯甲烷(气体),所以不可能全部充满,A项错误;
B.甲烷与氯气反应,氯气颜色逐渐变浅,B项错误;
C.二氯甲烷、三氯甲烷、四氯甲烷均为油状液体,密度大于水,试管内壁出现油状液滴,C项正确;
D.该反应有氯化氢生成,所以试管内部有白雾生成,D项正确;
故答案为:CD。
(2)氯气在饱和食盐水中溶解度非常小,而在水中溶解度比较大,所以选择用饱和食盐水;
(3)该反应为取代反应,生成一氯甲烷同时还有氯化氢生成,反应为:
(4)根据烷烃的通式为CnH2n+2,则12n+2n+2=72,解得n=5,该烷烃的分子式为C5H12
该有机物为戊烷,有3种同分异构体,分别为: 、、
【分析】(1)结合甲烷与氯气反应的产物进行分析,要注意一氯甲烷为气体,其他有机产物都是油状液体;
(2)通常用饱和食盐水进行降低氯气的溶解度,而氯气在水中溶解度比较大;
(3)该反应为取代反应,注意反应条件和取代产物还有氯化氢;
(4)根据烷烃通式即可算出有机物分子式,进而写出该有机物的同分异构体。
22.【答案】(1);
(2)③④①②
(3),,三甲基乙基辛烷;
【知识点】有机化合物的命名;同分异构现象和同分异构体;有机分子式的推断与计算;烷烃
【解析】【解答】(1)①根据阿伏加德罗推理可知,密度之比等于摩尔质量之比,所以烷烃A在同温同压下蒸气的密度是H2的43倍,则A的相对分子量为2×43=86,烷烃的组成为CnH2n+2,14n+2=86,n=6,即该烷烃的分子式为C6H14,故答案为:C6H14;②根据烷烃的通式CnH2n+2,烷烃B的分子中含有200个氢原子,即2n+2=200,解得n=99,所以B的分子式为C99H200;
(2)对应烷烃来说,碳原子数目越多,沸点越高,碳原子数目相同时,支链越多,沸点越多,据此可以判断 沸点按由高到低的顺序排列 为: ③④①② ;
(3)①根据结构可知,最长碳链有7个碳,为辛烷,从左边对主链碳进行编号,确定支链位置,所以命名为: ,,三甲基乙基辛烷 ;②根据结构可知,该有机物含有10种不同氢原子,所以一氯代物有10种。
【分析】(1) 同温同压下蒸气的密度是的倍 即可算出摩尔质量为氢气的43倍,再根据烷烃有机物通式进行计算即可;
(2)对应烷烃来说,碳原子数目越多,沸点越高,碳原子数目相同时,支链越多,沸点越多。
(3)对于烷烃命名步骤:1.选最长碳链为主链;2.编序号,定支链,3.命名;一般在判断一氯代物种类,即判断氢原子种类即可。
试题分析部分
1、试卷总体分布分析
总分:77分
分值分布 客观题(占比) 30.0(39.0%)
主观题(占比) 47.0(61.0%)
题量分布 客观题(占比) 15(68.2%)
主观题(占比) 7(31.8%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
选择题 15(68.2%) 30.0(39.0%)
非选择题 7(31.8%) 47.0(61.0%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (100.0%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 甲烷的化学性质 6.0(7.8%) 21
2 有机化合物的命名 5.0(6.5%) 22
3 氧化性、还原性强弱的比较 9.0(11.7%) 17
4 有机物中的官能团 2.0(2.6%) 1
5 离子方程式的书写 7.0(9.1%) 20
6 色谱法 4.0(5.2%) 14,15
7 化学平衡转化过程中的变化曲线 7.0(9.1%) 16
8 乙醇的化学性质 7.0(9.1%) 18
9 焰色反应 2.0(2.6%) 4
10 水的净化 2.0(2.6%) 14
11 配合物的成键情况 7.0(9.1%) 20
12 氧化还原反应 15.0(19.5%) 17,19
13 分液和萃取 25.0(32.5%) 4,5,6,8,10,11,19,20
14 利用质谱、红外光谱、核磁共振等确定有机物的结构 13.0(16.9%) 1,2,3,16
15 蒸馏与分馏 19.0(24.7%) 2,5,6,7,8,9,18
16 氯气的实验室制法 13.0(16.9%) 7,8,17
17 同分异构现象和同分异构体 13.0(16.9%) 12,21,22
18 加成反应 7.0(9.1%) 18
19 有机分子式的推断与计算 17.0(22.1%) 1,12,13,21,22
20 配制一定物质的量浓度的溶液 4.0(5.2%) 4,7
21 烷烃 7.0(9.1%) 12,22
22 海水资源及其综合利用 2.0(2.6%) 10
23 甲烷的取代反应 6.0(7.8%) 21
24 电极反应和电池反应方程式 7.0(9.1%) 16
25 化学平衡常数 7.0(9.1%) 16
26 中和热的测定 2.0(2.6%) 9
27 中和滴定 2.0(2.6%) 9
28 蒸发和结晶、重结晶 17.0(22.1%) 4,5,6,10,17
29 二氧化硫的性质 2.0(2.6%) 8
30 化学平衡的影响因素 7.0(9.1%) 20
31 取代反应 6.0(7.8%) 21
32 氨的实验室制法 2.0(2.6%) 7
33 反应热和焓变 7.0(9.1%) 16
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
