2019-2023年化学高考真题分类练--专题七 元素及其化合物的综合应用(含解析)
文档属性
| 名称 | 2019-2023年化学高考真题分类练--专题七 元素及其化合物的综合应用(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-17 15:37:02 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2019-2023年化学高考真题分类
专题七 元素及其化合物的综合应用
题组一
一、选择题
1. [2023辽宁,3分]下列有关物质的工业制备反应错误的是( )
A. 合成氨: B. 制
C. 制粗硅: D. 冶炼镁:
2. [2022河北,3分]下列说法错误的是( )
A. 与浓 糊状混合物可用于刻蚀玻璃
B. 是强碱,因此钠盐的水溶液不会呈酸性
C. 溶洞的形成主要源于溶解 的水对岩石的溶蚀作用
D. 与 的反应中, 既是还原产物又是催化剂
3. [2022河北,3分] 溶液可作为替代氟利昂的绿色制冷剂。合成 工艺流程如下:
下列说法错误的是( )
A. 还原工序逸出的 用 溶液吸收,吸收液直接返回还原工序
B. 除杂工序中产生的滤渣可用煤油进行组分分离
C. 中和工序中的化学反应为
D. 参与反应的 为
4. [2022辽宁,3分]镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入 ,振荡,静置,液体分层。下列说法正确的是( )
A. 褪色原因为 被 还原 B. 液体分层后,上层呈紫红色
C. 镀锌铁钉比镀锡铁钉更易生锈 D. 溶液恢复棕色的原因为 被氧化
5. [2021浙江1月选考,2分]下列“类比”合理的是( )
A. 与 反应生成 和 ,则 与 反应生成 和
B. 溶液与 反应生成 和 ,则 溶液与 反应生成 和
C. 与盐酸反应生成 和 ,则 与盐酸反应生成 和
D. 溶液与少量 溶液反应生成 和 ,则氨水与少量 溶液反应生成 和
6. [2021广东,2分]化学创造美好生活。下列生产活动中,没有运用相应化学原理的是( )
选项 生产活动 化学原理
A 用聚乙烯塑料制作食品保鲜膜 聚乙烯燃烧生成 和
B 利用海水制取溴和镁单质 可被氧化、 可被还原
C 利用氢氟酸刻蚀石英制作艺术品 氢氟酸可与 反应
D 公园的钢铁护栏涂刷多彩防锈漆 钢铁与潮湿空气隔绝可防止腐蚀
7. [2019浙江4月选考,2分]针对下列实验现象表述不正确的是( )
A. 用同一针筒先后抽取 氯气、 水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入 浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
二、非选择题
8. [2023全国乙卷,15分] 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿 ,含有少量 、 、 、 等元素 制备 的流程如下:
已知: , , 。
回答下列问题:
(1) 硫酸溶矿主要反应的化学方程式为 。为提高溶矿速率,可采取的措施是 (举1例)。
(2) 加入少量 的作用是 。不宜使用 替代 ,原因是 。
(3) 溶矿反应完成后,反应器中溶液 ,此时 ;用石灰乳调节至 ,除去的金属离子是 。
(4) 加入少量 溶液除去 ,生成的沉淀有 。
(5) 在电解槽中,发生电解反应的离子方程式为 。随着电解反应进行,为保持电解液成分稳定,应不断 。电解废液可在反应器中循环利用。
(6) 煅烧窑中,生成 反应的化学方程式是 。
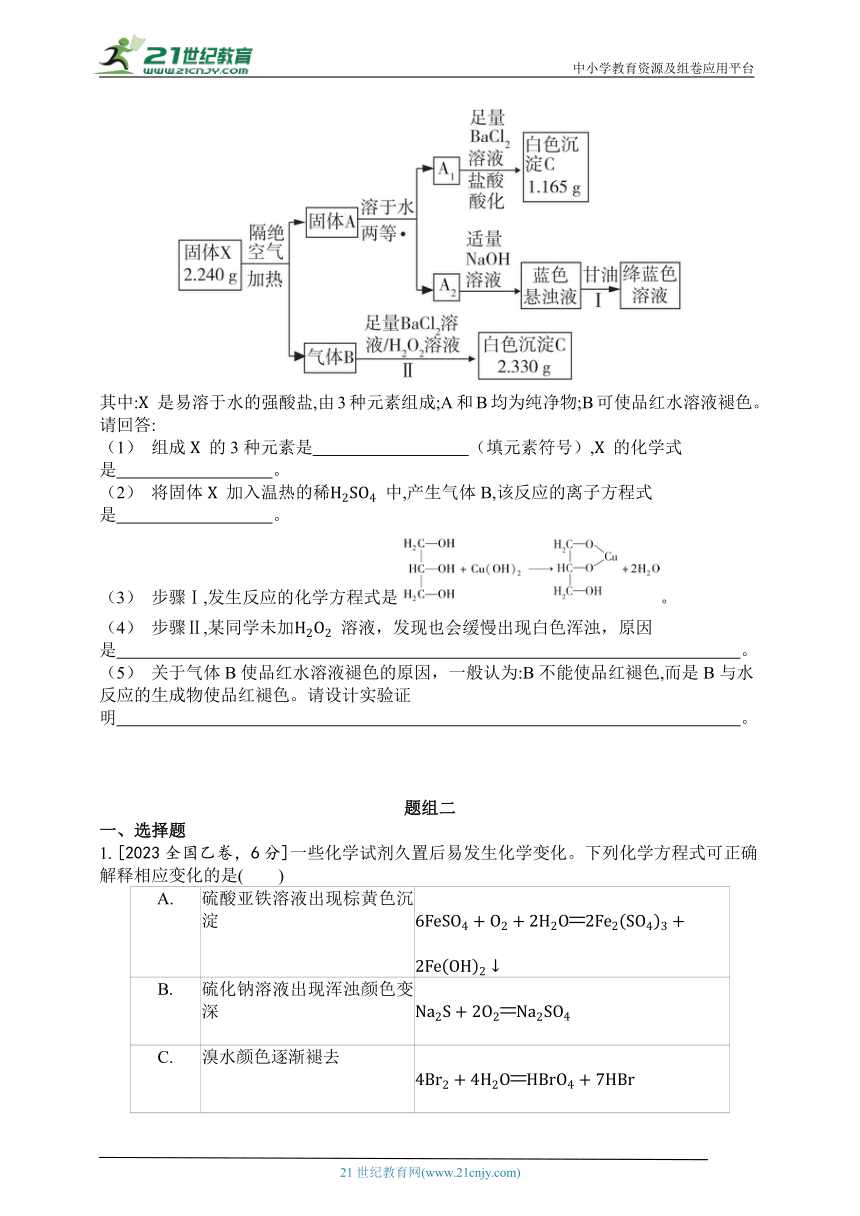
9. [2021浙江1月选考,10分]某兴趣小组对化合物 开展探究实验。
其中: 是易溶于水的强酸盐,由3种元素组成;A和B均为纯净物;B可使品红水溶液褪色。
请回答:
(1) 组成 的3种元素是 (填元素符号), 的化学式是 。
(2) 将固体 加入温热的稀 中,产生气体B,该反应的离子方程式是 。
(3) 步骤Ⅰ,发生反应的化学方程式是。
(4) 步骤Ⅱ,某同学未加 溶液,发现也会缓慢出现白色浑浊,原因是 。
(5) 关于气体B使品红水溶液褪色的原因,一般认为:B不能使品红褪色,而是B与水反应的生成物使品红褪色。请设计实验证明 。
题组二
一、选择题
1. [2023全国乙卷,6分]一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是( )
A. 硫酸亚铁溶液出现棕黄色沉淀
B. 硫化钠溶液出现浑浊颜色变深
C. 溴水颜色逐渐褪去
D. 胆矾表面出现白色粉末
2. [2023湖南,3分]取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为 ),反应现象没有明显差别的是( )
选项 试剂① 试剂②
A 氨水 溶液
B 溶液 溶液
C 溶液 酸性 溶液
D 溶液 溶液
3. [2020江苏,2分]下列关于 、 、 、 元素及其化合物的说法正确的是( )
A. 的碱性比 的强
B. 得到电子的能力比 的弱
C. 原子半径
D. 原子的最外层电子数
4. [2020江苏,2分]下列选项所示的物质间转化均能实现的是( )
A. 漂白粉
B.
C.
D.
二、非选择题
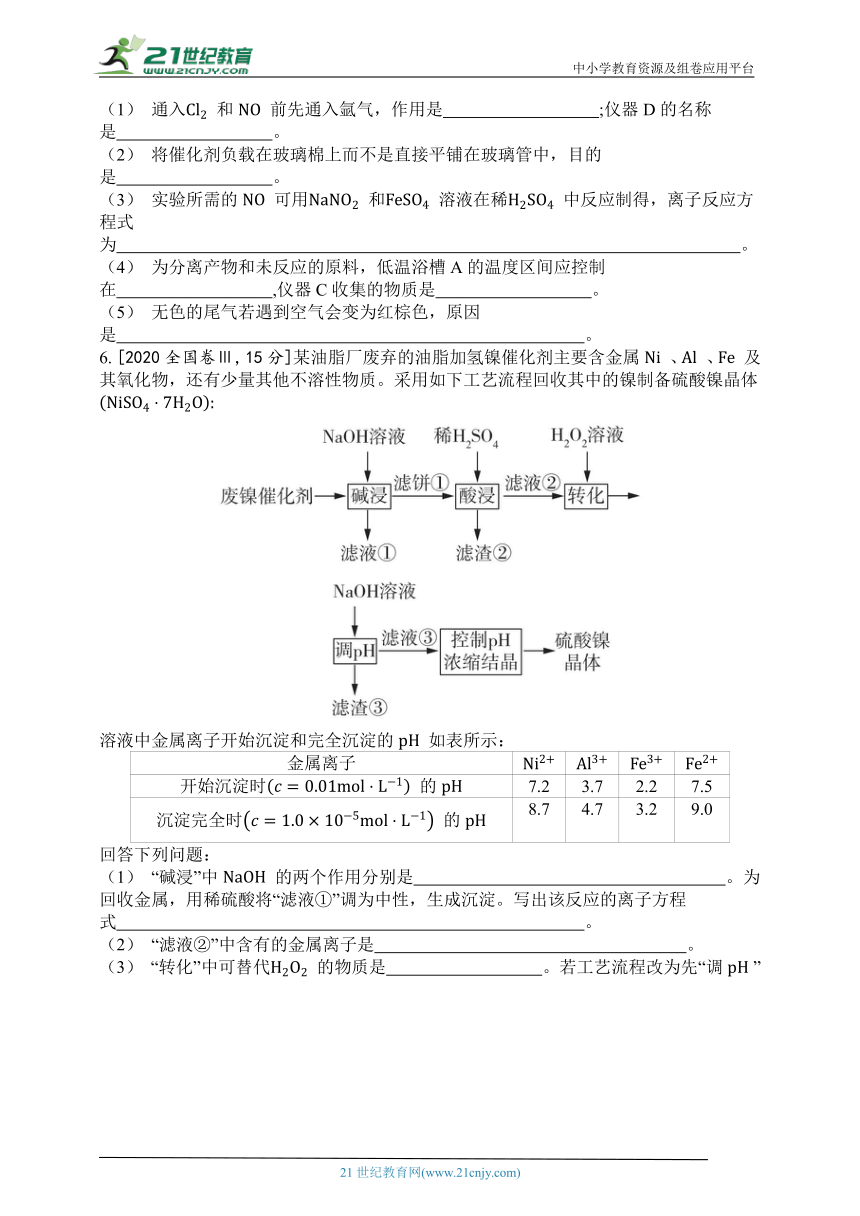
5. [2021海南,12分]亚硝酰氯 可作为有机合成试剂。
已知:
② 沸点: 为 , 为 , 为 。
易水解,能与 反应。
某研究小组用 和 在如图所示装置中制备 ,并分离回收未反应的原料。
回答问题:
(1) 通入 和 前先通入氩气,作用是 ;仪器D的名称是 。
(2) 将催化剂负载在玻璃棉上而不是直接平铺在玻璃管中,目的是 。
(3) 实验所需的 可用 和 溶液在稀 中反应制得,离子反应方程式为 。
(4) 为分离产物和未反应的原料,低温浴槽A的温度区间应控制在 ,仪器C收集的物质是 。
(5) 无色的尾气若遇到空气会变为红棕色,原因是 。
6. [2020全国卷Ⅲ,15分]某油脂厂废弃的油脂加氢镍催化剂主要含金属 、 、 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
溶液中金属离子开始沉淀和完全沉淀的 如表所示:
金属离子
开始沉淀时 的 7.2 3.7 2.2 7.5
沉淀完全时 的 8.7 4.7 3.2 9.0
回答下列问题:
(1) “碱浸”中 的两个作用分别是 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式 。
(2) “滤液②”中含有的金属离子是 。
(3) “转化”中可替代 的物质是 。若工艺流程改为先“调 ”后“转化”,即,“滤液③”中可能含有的杂质离子为 。
(4) 利用上述表格数据,计算 的 (列出计算式)。如果“转化”后的溶液中 浓度为 ,则“调 ”应控制的 范围是 。
(5) 硫酸镍在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式 。
(6) 将分离出硫酸镍晶体后的母液收集、循环使用,其意义是 。
7. [2020全国卷Ⅰ,14分]钒具有广泛用途。黏土钒矿中,钒以 、 、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、 。采用以下工艺流程可由黏土钒矿制备 。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
金属离子
开始沉淀 1.9 7.0 3.0 8.1
完全沉淀 3.2 9.0 4.7 10.1
回答下列问题:
(1) “酸浸氧化”需要加热,其原因是 。
(2) “酸浸氧化”中, 和 被氧化成 ,同时还有 离子被氧化。写出 转化为 反应的离子方程式 。
(3) “中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子 、 、 、 ,以及部分的 。
(4) “沉淀转溶”中, 转化为钒酸盐溶解。滤渣③的主要成分是 。
(5) “调 ”中有沉淀生成,生成沉淀反应的化学方程式是 。
(6) “沉钒”中析出 晶体时,需要加入过量 ,其原因是 。
题组三
一、选择题
1. [2021河北,3分] 是一种具有珍珠光泽的材料,利用金属 制备 的工艺流程如图:
下列说法错误的是( )
A. 酸浸工序中分次加入稀 可降低反应剧烈程度
B. 转化工序中加入稀 可抑制生成
C. 水解工序中加入少量 可提高 水解程度
D. 水解工序中加入少量 有利于 的生成
二、非选择题
2. [2022全国甲卷,14分]硫酸锌 是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备,菱锌矿的主要成分为 ,杂质为 以及 、 、 、 等的化合物。其制备流程如下:
本题中所涉及离子的氢氧化物溶度积常数如下表:
离子
回答下列问题:
(1) 菱锌矿焙烧生成氧化锌的化学方程式为 。
(2) 为了提高锌的浸取效果,可采取的措施有 、 。
(3) 加入物质 调溶液 ,最适宜使用的 是 (填标号)。
A.
B.
C.
滤渣①的主要成分是 、 、 。
(4) 向 的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为 。
(5) 滤液②中加入锌粉的目的是 。
(6) 滤渣④与浓 反应可以释放 并循环利用,同时得到的副产物是 、 。
3. [2022广东,14分]稀土 包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸 熔点为 ;月桂酸和 均难溶于水。该工艺条件下,稀土离子保持 价不变; 的 ; 开始溶解时的 为8.8;有关金属离子沉淀的相关 见下表。
离子
开始沉淀时的 8.8 1.5 3.6
沉淀完全时的 / 3.2 4.7 /
(1) “氧化调 ”中,化合价有变化的金属离子是 。
(2) “过滤1”前,用 溶液调 至 的范围内,该过程中 发生反应的离子方程式为 。
(3) “过滤2”后,滤饼中检测不到 元素,滤液2中 浓度为 。为尽可能多地提取 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中 低于 (保留两位有效数字)。
(4)① “加热搅拌”有利于加快 溶出、提高产率,其原因是 。
② “操作 ”的过程为:先 ,再固液分离。
(5) 该工艺中,可再生循环利用的物质有 (写化学式)。
(6) 稀土元素钇 可用于制备高活性的合金类催化剂 。
① 还原 和 熔融盐制备 时,生成 转移 电子。
② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为 。
4. [2021广东,13分]对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝 、钼 、镍 等元素的氧化物,一种回收利用工艺的部分流程如下:
已知: 时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。
(1) “焙烧”中,有 生成,其中 元素的化合价为 。
(2) “沉铝”中,生成的沉淀 为 。
(3) “沉钼”中, 为7.0。
① 生成 的离子方程式为 。
② 若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中 (列出算式)时,应停止加入 溶液。
(4)① 滤液Ⅲ中,主要存在的钠盐有 和 , 为 。
② 往滤液Ⅲ中添加适量 固体后,通入足量 (填化学式)气体,再通入足量 ,可析出 。
(5) 高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
① 该氧化物为 。
② 已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为 价,则该反应的氧化剂与还原剂物质的量之比为 。
题组四
1. [2023新课标卷,14分]铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物。从铬钒渣中分离提取铬和钒的一种流程如下图所示。
已知:最高价铬酸根在酸性介质中以 存在,在碱性介质中以 存在。
回答下列问题:
煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要
为 (填化学式)。
(2) 水浸渣中主要有 和 。
(3) “沉淀”步骤调 到弱碱性,主要除去的杂质是 。
(4) “除硅磷”步骤中,使硅、磷分别以 和 的形式沉淀。该步需要控制溶液的 以达到最好的除杂效果。若 时,会导致 ;
时,会导致 。
(5) “分离钒”步骤中,将溶液 调到1.8左右得到 沉淀。 在 时,溶解为 或 ;在碱性条件下,溶解为 或 。上述性质说明 具有 (填标号)。
A. 酸性 B. 碱性 C. 两性
(6) “还原”步骤中加入焦亚硫酸钠 溶液,反应的离子方程式为 。
2. [2022全国乙卷,14分]废旧铅蓄电池的铅膏中主要含有 、 、 和 ,还有少量 、 、 的盐或氧化物等,为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的 如下表:
金属氢氧化物
开始沉淀的 2.3 6.8 3.5 7.2
完全沉淀的 3.2 8.3 4.6 9.1
回答下列问题:
(1) 在“脱硫”中 转化反应的离子方程式为 ,用沉淀溶解平衡原理解释选择 的原因 。
(2) 在“脱硫”中,加入 不能使铅膏中 完全转化,原因是 。
(3) 在“酸浸”中,除加入醋酸 ,还要加入 。
(i) 能被 氧化的离子是 ;
(ii) 促进了金属 在醋酸中转化为 ,其化学方程式为 ;
(iii) 也能使 转化为 , 的作用是 。
(4) “酸浸”后溶液的 约为 ,滤渣的主要成分是 。
(5) “沉铅”的滤液中,金属离子有 。
3. [2021湖北,14分]废旧太阳能电池 具有较高的回收利用价值,其主要组成为 。某探究小组回收处理流程如下:
回答下列问题:
(1) 硒 与硫为同族元素, 的最外层电子数为 ;镓 和铟 位于元素周期表第三主族, 中 的化合价为 。
(2) “酸浸氧化”发生的主要氧化还原反应的化学方程式为 。
(3) 时,已知: , , , ,“浸出液”中 。当金属阳离子浓度小于 时沉淀完全, 恰好完全沉淀时溶液的 约为 (保留一位小数);若继续加入 氨水至过量,观察到的实验现象是先有蓝色沉淀,然后 ;为探究 在氨水中能否溶解,计算反应 的平衡常数 。
(已知: )
(4) “滤渣”与 混合前需要洗涤、干燥,检验滤渣中 是否洗净的试剂是 ;“回流过滤”中 的作用是将氢氧化物转化为氯化物和 。
(5) “高温气相沉积”过程中发生的化学反应方程式为 。
4. [2020山东,12分]用软锰矿(主要成分为 ,含少量 、 )和 制备高纯 的工艺流程如下:
已知: 是一种两性氧化物; 时相关物质的 见下表。
物质
回答下列问题:
(1) 软锰矿预先粉碎的目的是 , 与 溶液反应转化为 的化学方程式为 。
(2) 保持 投料量不变,随 与 投料比增大, 的量达到最大值后无明显变化,而 的量达到最大值后会减小,减小的原因是 。
(3) 滤液Ⅰ可循环使用,应当将其导入到 操作中(填操作单元的名称)。
(4) 净化时需先加入的试剂 为 (填化学式),再使用氨水调溶液的 ,则 的理论最小值为 (当溶液中某离子浓度 时,可认为该离子沉淀完全)。
(5) 碳化过程中发生反应的离子方程式为 。
专题七 元素及其化合物的综合应用
题组一
一、选择题
1. [2023辽宁,3分]下列有关物质的工业制备反应错误的是( D )
A. 合成氨: B. 制
C. 制粗硅: D. 冶炼镁:
[解析]化学工业的制备反应合成氨工业为氮气和氢气在高温高压、催化剂条件下反应生成氨气, 项正确;工业制备 为氢气和氯气在点燃时反应生成 , 项正确;工业制备粗硅为石英和焦炭在高温条件下反应生成单质硅和 , 项正确;工业冶炼镁为电解熔融氯化镁生成镁和氯气, 项错误。
2. [2022河北,3分]下列说法错误的是( B )
A. 与浓 糊状混合物可用于刻蚀玻璃
B. 是强碱,因此钠盐的水溶液不会呈酸性
C. 溶洞的形成主要源于溶解 的水对岩石的溶蚀作用
D. 与 的反应中, 既是还原产物又是催化剂
[解析] , 水溶液可以刻蚀玻璃, 项正确; 溶液呈酸性, 项错误; , 可溶于水, 项正确; , 化合价降低, 是还原产物,且生成的 可以催化 和 的反应, 项正确。
3. [2022河北,3分] 溶液可作为替代氟利昂的绿色制冷剂。合成 工艺流程如下:
下列说法错误的是( A )
A. 还原工序逸出的 用 溶液吸收,吸收液直接返回还原工序
B. 除杂工序中产生的滤渣可用煤油进行组分分离
C. 中和工序中的化学反应为
D. 参与反应的 为
[解析]
逸出的 用 溶液吸收后生成 、 和水,若直接返回还原工序,会引入杂质离子 ,导致产品不纯, 项错误;滤渣中含 和 ,单质 可溶于煤油,而 不溶于煤油,故 项正确;中和工序中 与 反应生成 、 和 , 项正确;根据 、 知,参与反应的 , 项正确。
4. [2022辽宁,3分]镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入 ,振荡,静置,液体分层。下列说法正确的是( D )
A. 褪色原因为 被 还原 B. 液体分层后,上层呈紫红色
C. 镀锌铁钉比镀锡铁钉更易生锈 D. 溶液恢复棕色的原因为 被氧化
[解析]锌的金属活动性强于铁,镀锌铁钉放入棕色的碘水中, 被锌还原成 ,溶液褪色, 项错误;加入漂白粉,溶液恢复棕色,说明溶液中的 又被氧化成 , 易溶于 , 不溶于水且密度比水大,故加入 , 的 溶液在下层,下层呈紫红色, 项错误, 项正确;镀锌铁钉形成原电池时,由于锌比铁活泼,锌作负极被腐蚀,铁作正极被保护,镀锡铁钉形成原电池时,由于铁比锡活泼,铁作负极被腐蚀,故镀锡铁钉比镀锌铁钉更易生锈, 项错误。
5. [2021浙江1月选考,2分]下列“类比”合理的是( C )
A. 与 反应生成 和 ,则 与 反应生成 和
B. 溶液与 反应生成 和 ,则 溶液与 反应生成 和
C. 与盐酸反应生成 和 ,则 与盐酸反应生成 和
D. 溶液与少量 溶液反应生成 和 ,则氨水与少量 溶液反应生成 和
[解析]铁与水蒸气反应生成 和 , 不正确; 具有强氧化性,会将 氧化, 不正确;氮化钠与氮化镁水解生成相应的碱和氨气,再与盐酸反应生成盐, 正确; 与 反应先生成 , 不稳定,生成 ,氨水与少量硝酸银溶液反应先生成 ,而 能溶于过量的氨水中,生成 , 不正确。
6. [2021广东,2分]化学创造美好生活。下列生产活动中,没有运用相应化学原理的是( )
选项 生产活动 化学原理
A 用聚乙烯塑料制作食品保鲜膜 聚乙烯燃烧生成 和
B 利用海水制取溴和镁单质 可被氧化、 可被还原
C 利用氢氟酸刻蚀石英制作艺术品 氢氟酸可与 反应
D 公园的钢铁护栏涂刷多彩防锈漆 钢铁与潮湿空气隔绝可防止腐蚀
[解析]聚乙烯塑料可用作食品保鲜膜,与其燃烧产物无关,应和聚乙烯的无毒无污染等性能有关, 项错误;海水提溴和制镁时, 发生了氧化反应,而 发生了还原反应, 项正确;氢氟酸刻蚀石英制作艺术品,利用了氢氟酸与 的反应, 项正确;钢铁护栏涂刷多彩防锈漆,能避免钢铁护栏与潮湿空气直接接触,可防止钢铁护栏被腐蚀, 项正确。
7. [2019浙江4月选考,2分]针对下列实验现象表述不正确的是( A )
A. 用同一针筒先后抽取 氯气、 水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入 浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
[解析]常温常压下,1体积水约溶解2体积的氯气,故 水只能溶解大约 的氯气, 项错误;浓硫酸具有吸水性,将 转化为 ,固体由蓝色变为白色, 项正确;双氧水将含 价硫元素的微粒氧化为 , 与 反应生成 沉淀, 项正确;镁在二氧化碳中燃烧生成 和 , 项正确。
二、非选择题
8. [2023全国乙卷,15分] 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿 ,含有少量 、 、 、 等元素 制备 的流程如下:
已知: , , 。
回答下列问题:
(1) 硫酸溶矿主要反应的化学方程式为 。为提高溶矿速率,可采取的措施是粉碎矿石(或适当增大硫酸浓度、搅拌、适当升高反应液的温度等)(举1例)。
[解析]
硫酸溶矿时发生的主要反应是 溶于硫酸的反应,化学方程式为 。可根据影响反应速率的因素分析可采取的措施。
(2) 加入少量 的作用是将 氧化为 。不宜使用 替代 ,原因是 和生成的 会催化 分解。
[解析]加入少量 的作用是将 氧化为 ,便于除铁。若使用 替代 ,则 和生成的 会催化 分解,原料利用率低。
(3) 溶矿反应完成后,反应器中溶液 ,此时 ;用石灰乳调节至 ,除去的金属离子是 。
[解析]溶液 ,即 时,由 ,可得 。同理, , 时, , 被除去, , 未被除去。
(4) 加入少量 溶液除去 ,生成的沉淀有 和 。
[解析]酸溶时得到相应金属的硫酸盐,故加入少量 溶液除 时会生成 和 沉淀。
(5) 在电解槽中,发生电解反应的离子方程式为 。随着电解反应进行,为保持电解液成分稳定,应不断加 。电解废液可在反应器中循环利用。
[解析]电解槽中反应生成 ,则阳极反应为 ,阴极反应为 ,总反应为 ,该反应中消耗水,生成 、 ,为保持电解液成分稳定,应不断补充 。
(6) 煅烧窑中,生成 反应的化学方程式是 。
[解析]根据得失电子守恒和质量守恒可写出煅烧窑中生成 反应的化学方程式是 。
9. [2021浙江1月选考,10分]某兴趣小组对化合物 开展探究实验。
其中: 是易溶于水的强酸盐,由3种元素组成;A和B均为纯净物;B可使品红水溶液褪色。
请回答:
(1) 组成 的3种元素是 、 、 (填元素符号), 的化学式是 。
[解析]由原子守恒知 由 、 、 三种元素组成。 中 , , , ,故 的化学式为 。
(2) 将固体 加入温热的稀 中,产生气体B,该反应的离子方程式是 。
[解析] 易溶于水,与稀硫酸反应的产物之一是 ,易推出另一种产物含 ,反应的离子方程式为 。
(3) 步骤Ⅰ,发生反应的化学方程式是。
[解析] 与甘油发生反应生成 与。
(4) 步骤Ⅱ,某同学未加 溶液,发现也会缓慢出现白色浑浊,原因是 与水反应生成 ; 能被氧气氧化为 ,与 反应生成 。
[解析] 在水中可被溶解在水中的 氧化为 , 与 作用生成 。
(5) 关于气体B使品红水溶液褪色的原因,一般认为:B不能使品红褪色,而是B与水反应的生成物使品红褪色。请设计实验证明配制品红无水乙醇溶液(其他非水溶剂亦可),通入 ,不褪色;品红水溶液中加入亚硫酸钠(亚硫酸氢钠)固体,褪色更快。
[解析]由 的形成过程知其是 , 中 ;由题意可推出气体 是 ,同理可求出 。能与甘油作用形成绛蓝色溶液的蓝色悬浊液是 悬浊液, 中含有 ,由此可推出固体 为 。
溶于水后溶液中的含 微粒还有 、 、 。证明 不能使品红褪色的方法为:配制品红的无水乙醇溶液(或其他非水溶剂溶液),再向溶液中通入 ,品红不褪色。证明使品红溶液褪色的物质是 与水反应的产物的方法为:向品红水溶液中加入 ,品红水溶液褪色更快。
题组二
一、选择题
1. [2023全国乙卷,6分]一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是( )
A. 硫酸亚铁溶液出现棕黄色沉淀
B. 硫化钠溶液出现浑浊颜色变深
C. 溴水颜色逐渐褪去
D. 胆矾表面出现白色粉末
[解析] 溶液中出现的棕黄色沉淀应为 ,而不是 ,发生的反应为 , 错误; 溶液出现浑浊颜色变深,说明生成了 , , 错误;溴水中存在平衡 , 见光易分解,促使该平衡正向移动,从而使溴水褪色, 错误;胆矾在空气中久置易失去结晶水而逐渐变成白色 粉末, 正确。
2. [2023湖南,3分]取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为 ),反应现象没有明显差别的是( )
选项 试剂① 试剂②
A 氨水 溶液
B 溶液 溶液
C 溶液 酸性 溶液
D 溶液 溶液
[解析]
选项 ①加入②中现象 ②加入①中现象
先产生白色沉淀,后白色沉淀溶解 先无明显现象,后产生白色沉淀
先产生白色沉淀,后白色沉淀溶解 先无明显现象,后产生白色沉淀
溶液紫色逐渐褪去,有气泡产生 紫色溶液迅速褪色,有气泡产生
溶液变为红色 溶液变为红色
3. [2020江苏,2分]下列关于 、 、 、 元素及其化合物的说法正确的是( A )
A. 的碱性比 的强
B. 得到电子的能力比 的弱
C. 原子半径
D. 原子的最外层电子数
[解析]元素的金属性越强,其最高价氧化物对应的水化物的碱性越强, 项正确; 的非金属性强于 ,则 得到电子的能力比 的强, 项错误;同周期元素从左到右原子半径逐渐减小,则原子半径大小顺序为 , 项错误; 、 、 、 原子的最外层电子数分别为1、2、7、7, 项错误。
4. [2020江苏,2分]下列选项所示的物质间转化均能实现的是( C )
A. 漂白粉
B.
C.
D.
[解析] 与石灰乳反应可制得漂白粉, 项错误; , , 项错误;由于氧化性 ,则 , , 项正确;电解 溶液不能得到单质镁,要得到单质 ,需电解熔融态的 , 项错误。
二、非选择题
5. [2021海南,12分]亚硝酰氯 可作为有机合成试剂。
已知:
② 沸点: 为 , 为 , 为 。
易水解,能与 反应。
某研究小组用 和 在如图所示装置中制备 ,并分离回收未反应的原料。
回答问题:
(1) 通入 和 前先通入氩气,作用是排除装置中的空气;仪器D的名称是球形干燥管。
[解析]由已知③可知, 、 都能与 反应,为防止 、 与 反应,实验前应排净装置中的空气。
(2) 将催化剂负载在玻璃棉上而不是直接平铺在玻璃管中,目的是增大与气体的接触面积,增强催化效果。
[解析]将催化剂负载在玻璃棉上可增大其与气体的接触面积,增强催化效果。
(3) 实验所需的 可用 和 溶液在稀 中反应制得,离子反应方程式为 。
[解析] 转化为 , 元素的化合价降低,得到电子,则 失电子,化合价升高,生成 ,根据化合价升降法配平得 。
(4) 为分离产物和未反应的原料,低温浴槽A的温度区间应控制在 ,仪器C收集的物质是 。
[解析]由已知②知,低温浴槽 的温度区间应控制在 ,从而使未反应的 、 挥发出去, 的沸点为 ,实验中低温浴槽 的温度不易低至 ,所以仪器 收集的是 。
(5) 无色的尾气若遇到空气会变为红棕色,原因是 与空气中的氧气反应生成红棕色的 。
[解析]无色尾气为 , 与空气中的氧气反应生成红棕色的 气体。
6. [2020全国卷Ⅲ,15分]某油脂厂废弃的油脂加氢镍催化剂主要含金属 、 、 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
溶液中金属离子开始沉淀和完全沉淀的 如表所示:
金属离子
开始沉淀时 的 7.2 3.7 2.2 7.5
沉淀完全时 的 8.7 4.7 3.2 9.0
回答下列问题:
(1) “碱浸”中 的两个作用分别是除去油脂、溶解铝及其氧化物。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式 。
[解析]由题给条件可知,该废镍催化剂表面覆有油脂,且其中含有 、 、 及其氧化物等,“碱浸”时,油脂在氢氧化钠溶液中水解而被除去,铝及其氧化物也会与氢氧化钠溶液反应而被除去,“碱浸”中 的两个作用分别是除去油脂、溶解铝及其氧化物。“滤液①”中铝元素以 的形式存在,加入稀硫酸生成沉淀的离子方程式为 。
(2) “滤液②”中含有的金属离子是 、 、 。
[解析]因 、 及其氧化物不与 溶液反应, 、 及其氧化物存在于“滤饼①”中,向“滤饼①”中加入稀硫酸, 、 及其氧化物与稀硫酸反应,故得到的“滤液②”中含有的金属离子为 、 、 。
(3) “转化”中可替代 的物质是 或空气。若工艺流程改为先“调 ”后“转化”,即,“滤液③”中可能含有的杂质离子为 。
[解析]“转化”过程是将二价铁离子全部转化为三价铁离子,选用的氧化剂是 溶液,选用过氧化氢溶液氧化的好处是不引入其他杂质,因此替代过氧化氢溶液的物质也不能引入其他杂质,可用 或空气替代 溶液;由题表中金属离子开始沉淀和沉淀完全的 可知, 开始沉淀时, 已经沉淀一部分。若先调节 ,调节至 ,只能将 除去, 在“转化”时会生成 ,则滤液③中可能含有 。
(4) 利用上述表格数据,计算 的 [或 ](列出计算式)。如果“转化”后的溶液中 浓度为 ,则“调 ”应控制的 范围是 。
[解析] , , , ,或利用 沉淀完全时计算得 。 ,若不生成 ,则 , , ,同时应调节 以除去 ,故 应控制的范围是 。
(5) 硫酸镍在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式 。
[解析]由题意可知,反应物为硫酸镍、次氯酸钠和强碱,生成物有 ,硫酸镍中镍元素为 价, 中镍元素为 价,镍元素的化合价升高被氧化,则次氯酸钠中氯元素被还原得到氯化钠,该反应的离子方程式为 。
(6) 将分离出硫酸镍晶体后的母液收集、循环使用,其意义是提高镍回收率。
[解析]母液中还含有少量的硫酸镍,将母液收集、循环使用可提高镍回收率。
【流程梳理】
7. [2020全国卷Ⅰ,14分]钒具有广泛用途。黏土钒矿中,钒以 、 、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、 。采用以下工艺流程可由黏土钒矿制备 。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
金属离子
开始沉淀 1.9 7.0 3.0 8.1
完全沉淀 3.2 9.0 4.7 10.1
回答下列问题:
(1) “酸浸氧化”需要加热,其原因是加快酸浸和氧化反应速率(促进氧化完全)。
[解析]“酸浸氧化”中温度较低时,酸浸和氧化反应速率较慢。为了加快酸浸和氧化反应速率,需要加热。
(2) “酸浸氧化”中, 和 被氧化成 ,同时还有 离子被氧化。写出 转化为 反应的离子方程式 。
[解析]从原料看,“酸浸氧化”中四氧化三铁溶于稀硫酸,发生反应 ,加入的二氧化锰除氧化 和 外,还氧化 。 转化为 反应的离子方程式为 。
(3) “中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子 、 、 、 ,以及部分的 和 。
[解析]根据表格中数据知, 在 时,铁离子接近沉淀完全,少量铁离子随滤液②除去, 部分沉淀,大量铝离子随滤液②除去, 、 、 、 随滤液②除去。
(4) “沉淀转溶”中, 转化为钒酸盐溶解。滤渣③的主要成分是 。
[解析]在 的强碱性溶液中, 转化为钒酸盐溶解, 转化为 溶解, 不溶,故滤渣③的主要成分是 。
(5) “调 ”中有沉淀生成,生成沉淀反应的化学方程式是 。
[解析] 时铝元素沉淀,故“调 ”时生成氢氧化铝沉淀,反应的化学方程式为 。
(6) “沉钒”中析出 晶体时,需要加入过量 ,其原因是利用同离子效应,促进 尽可能析出完全。
[解析]“沉钒”时要使 尽可能析出完全,利用同离子效应,加入过量 可达到此目的。
【流程梳理】
题组三
一、选择题
1. [2021河北,3分] 是一种具有珍珠光泽的材料,利用金属 制备 的工艺流程如图:
下列说法错误的是( D )
A. 酸浸工序中分次加入稀 可降低反应剧烈程度
B. 转化工序中加入稀 可抑制生成
C. 水解工序中加入少量 可提高 水解程度
D. 水解工序中加入少量 有利于 的生成
[解析]酸浸时分次加入稀硝酸,相当于降低了硝酸浓度,减小了反应的速率,降低反应剧烈程度, 项正确;转化工序中, 水解生成 和 ,加入盐酸,可抑制 的水解,从而抑制生成 , 项正确;水解工序中加入的醋酸钠电离生成的 可与 水解生成的 结合,生成弱电解质 ,促进 的水解, 项正确;硝酸铵水解使溶液显酸性,由上述分析可知,酸会抑制 水解, 项错误。
二、非选择题
2. [2022全国甲卷,14分]硫酸锌 是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备,菱锌矿的主要成分为 ,杂质为 以及 、 、 、 等的化合物。其制备流程如下:
本题中所涉及离子的氢氧化物溶度积常数如下表:
离子
回答下列问题:
(1) 菱锌矿焙烧生成氧化锌的化学方程式为 。
(2) 为了提高锌的浸取效果,可采取的措施有将菱锌矿焙烧产品粉碎、适当增大硫酸浓度(或升高浸取时的反应温度等,合理即可)。
(3) 加入物质 调溶液 ,最适宜使用的 是 (填标号)。
A.
B.
C.
滤渣①的主要成分是 、 、 。
[解析]加入物质 调溶液 ,为了不引入新的阳离子,故 宜选用 ; 时, ,根据表中各离子的氢氧化物的 可知,只有 能完全沉淀。
(4) 向 的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为 。
[解析] 被适量 溶液氧化为 ,同时生成 , 沉淀和 进入滤渣②中。
(5) 滤液②中加入锌粉的目的是除去 。
(6) 滤渣④与浓 反应可以释放 并循环利用,同时得到的副产物是 、 。
[解析]
3. [2022广东,14分]稀土 包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸 熔点为 ;月桂酸和 均难溶于水。该工艺条件下,稀土离子保持 价不变; 的 ; 开始溶解时的 为8.8;有关金属离子沉淀的相关 见下表。
离子
开始沉淀时的 8.8 1.5 3.6
沉淀完全时的 / 3.2 4.7 /
(1) “氧化调 ”中,化合价有变化的金属离子是 。
[解析]由题意知,“氧化调 ”中只有铁是变价金属,铝和稀土金属元素均为 价, 被氧化为 。
(2) “过滤1”前,用 溶液调 至 的范围内,该过程中 发生反应的离子方程式为 。
[解析]“过滤1”所得“滤渣”为 和 ,应调节的 范围为 , 小于6.2是防止 开始沉淀。该过程中 与 反应生成 沉淀。
(3) “过滤2”后,滤饼中检测不到 元素,滤液2中 浓度为 。为尽可能多地提取 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中 低于 (保留两位有效数字)。
[答案]
[解析]“滤液2”中 浓度为 ,其物质的量浓度为 , , , ,若 大于 ,则形成的“滤饼”中会混入 。
(4)① “加热搅拌”有利于加快 溶出、提高产率,其原因是加热搅拌可加快反应速率。
[解析]“滤饼”的主要成分为 ,为难溶物,搅拌可以增加其与盐酸的接触面积,加热也可以加快固体的溶解,进而加快反应速率。
② “操作 ”的过程为:先冷却结晶,再固液分离。
[解析]加热搅拌的温度为 ,而月桂酸的熔点为 ,所以“操作 ”(过滤)前,先要冷却结晶,使月桂酸变成固体。
(5) 该工艺中,可再生循环利用的物质有 (写化学式)。
[解析]“滤液2”中含有 ,可以用作“浸取”时加入的“酸化 溶液”。
(6) 稀土元素钇 可用于制备高活性的合金类催化剂 。
① 还原 和 熔融盐制备 时,生成 转移15 电子。
[解析] 中 为 价, 中 为 价, 为合金, 和 均可以看成0价,若生成 ,转移电子的物质的量为 。
② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为 。
[解析]在氢氧燃料电池的碱性介质中, 得电子与水反应生成 。
4. [2021广东,13分]对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝 、钼 、镍 等元素的氧化物,一种回收利用工艺的部分流程如下:
已知: 时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。
(1) “焙烧”中,有 生成,其中 元素的化合价为 。
[解析] 中 为 价, 为 价,根据化合物中正负化合价代数和为0,可知 的化合价为 。
(2) “沉铝”中,生成的沉淀 为 。
[解析]经“ 焙烧”“水浸过滤”后, 转化为 进入到滤液Ⅰ中,向滤液Ⅰ中通入过量 ,发生反应 ,故生成的沉淀 为 。
(3) “沉钼”中, 为7.0。
① 生成 的离子方程式为 。
[解析]“沉钼”中, 为 ,溶液中 元素以 的形态存在,故生成 的离子方程式为 。
② 若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中 (列出算式)时,应停止加入 溶液。
[解析]根据 ,可得 ,当 , 中混入 沉淀时, ,则 。
(4)① 滤液Ⅲ中,主要存在的钠盐有 和 , 为 。
[解析]根据“沉铝”时发生反应 ,可知滤液Ⅲ中主要存在的钠盐有 和 。
② 往滤液Ⅲ中添加适量 固体后,通入足量 (填化学式)气体,再通入足量 ,可析出 。
[解析]往滤液Ⅲ(含 、 )中添加适量 固体后,通入足量 ,再通入足量 ,发生反应 ,故可以析出 。
(5) 高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
① 该氧化物为 。
[解析]题图中所示致密保护膜(氧化物)可以阻止 刻蚀液与下层 反应,可推知该保护膜为 。
② 已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为 价,则该反应的氧化剂与还原剂物质的量之比为 。
[解析] 与 的反应中, 的化合价由 变为 , 参与反应失去 电子,而 参与反应得到 电子,根据得失电子守恒,可知该反应中氧化剂 与还原剂 的物质的量之比为 。
题组四
1. [2023新课标卷,14分]铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物。从铬钒渣中分离提取铬和钒的一种流程如下图所示。
已知:最高价铬酸根在酸性介质中以 存在,在碱性介质中以 存在。
回答下列问题:
(1) 煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为 (填化学式)。
[解析]根据已知条件可知,最高价铬酸根在碱性介质中以 存在,故煅烧后含铬化合物主要为 。
(2) 水浸渣中主要有 和 。
[解析]煅烧时通入空气,含铁化合物转化为 ,且 不溶于水,故水浸渣中还含有 。
(3) “沉淀”步骤调 到弱碱性,主要除去的杂质是 。
[解析]“沉淀”步骤加入稀 调 到弱碱性是为了让 转化为 沉淀而除去。
(4) “除硅磷”步骤中,使硅、磷分别以 和 的形式沉淀。该步需要控制溶液的 以达到最好的除杂效果。若 时,会导致溶液中 降低,不利于生成 沉淀;
时,会导致 形成 沉淀。
[解析]体系中存在平衡 ,当 时, , 降低,平衡正移,不利于生成 沉淀;而 时 会形成 沉淀,原料利用率低。
(5) “分离钒”步骤中,将溶液 调到1.8左右得到 沉淀。 在 时,溶解为 或 ;在碱性条件下,溶解为 或 。上述性质说明 具有C(填标号)。
A. 酸性 B. 碱性 C. 两性
[解析]根据题干描述, 既可与酸反应生成盐和水,又可与碱反应生成盐和水,故 具有两性。
(6) “还原”步骤中加入焦亚硫酸钠 溶液,反应的离子方程式为 。
[解析]分离钒后溶液呈酸性, 元素以 存在,还原过程中 被 还原为 , 转化为 ,因此反应的离子方程式为 ,之后调 , 转化为 。
2. [2022全国乙卷,14分]废旧铅蓄电池的铅膏中主要含有 、 、 和 ,还有少量 、 、 的盐或氧化物等,为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的 如下表:
金属氢氧化物
开始沉淀的 2.3 6.8 3.5 7.2
完全沉淀的 3.2 8.3 4.6 9.1
回答下列问题:
(1) 在“脱硫”中 转化反应的离子方程式为 ,用沉淀溶解平衡原理解释选择 的原因该反应的 ,反应正向进行的程度很大,可以进行到底。
[解析] 的 远小于 的 ,易发生生成 的沉淀转化,且进行较为彻底。
(2) 在“脱硫”中,加入 不能使铅膏中 完全转化,原因是反应 的 ,反应正向进行的程度很小。
[解析] 的 大于 的 ,生成 的沉淀转化的反应进行的程度很小。
(3) 在“酸浸”中,除加入醋酸 ,还要加入 。
(i) 能被 氧化的离子是 ;
[解析]具有还原性,能被 氧化;
(ii) 促进了金属 在醋酸中转化为 ,其化学方程式为 ;
[解析] 能氧化 ,使其转化成 , 再与 结合生成 ,依据氧化还原反应的规律,即可写出反应的化学方程式;
(iii) 也能使 转化为 , 的作用是作还原剂。
[解析] 通过与 、 反应转化为 ,发生氧化还原反应, 化合价降低, 作还原剂。
(4) “酸浸”后溶液的 约为 ,滤渣的主要成分是 、 。
[解析]根据题给信息,当 时, 、 完全转化为 、 。
(5) “沉铅”的滤液中,金属离子有 、 。
[解析]加入 溶液,发生沉铅的反应为 ,故滤液中含有的金属阳离子有 以及未沉淀的 。
3. [2021湖北,14分]废旧太阳能电池 具有较高的回收利用价值,其主要组成为 。某探究小组回收处理流程如下:
回答下列问题:
(1) 硒 与硫为同族元素, 的最外层电子数为6;镓 和铟 位于元素周期表第三主族, 中 的化合价为 。
[解析] 与硫同为 族元素,最外层有6个电子。 为 族元素,化合价为 , 和 同为Ⅲ 族元素,化合价均为 ,根据化合物中各元素正负化合价代数和为0,设 中 的化合价为 ,则 ,解得 。
(2) “酸浸氧化”发生的主要氧化还原反应的化学方程式为 。
[解析] 中 和 元素均处于最高价态,高温焙烧时 元素转化为 ,则酸浸氧化时 氧化 价的 ,高温焙烧时 元素转化为 ,故酸浸氧化时发生的主要氧化还原反应为 。
(3) 时,已知: , , , ,“浸出液”中 。当金属阳离子浓度小于 时沉淀完全, 恰好完全沉淀时溶液的 约为 (保留一位小数);若继续加入 氨水至过量,观察到的实验现象是先有蓝色沉淀,然后蓝色沉淀溶解,溶液变成深蓝色;为探究 在氨水中能否溶解,计算反应 的平衡常数 。
(已知: )
[解析]根据 知,当 恰好完全沉淀时, , , 。若继续加入 氨水至过量,先有蓝色 沉淀生成,然后蓝色沉淀溶解,得到深蓝色溶液。将 、 、 三个反应相加可以得到 ,则平衡常数 。
(4) “滤渣”与 混合前需要洗涤、干燥,检验滤渣中 是否洗净的试剂是 溶液、 溶液;“回流过滤”中 的作用是将氢氧化物转化为氯化物和作溶剂。
[解析]加氨水调 的目的是沉淀溶液中的 、 ,得到的滤液Ⅰ主要含硫酸铵、 ,检验滤渣中 是否洗净,可以加入盐酸酸化的 溶液。 、 可分别写为 、 的形式, 能和 反应生成 和 , 、 和 反应均生成氯化物和 ,因此 的作用是将氢氧化物转化为氯化物和作溶剂。
(5) “高温气相沉积”过程中发生的化学反应方程式为 。
[解析]高温气相沉积时 和 反应生成 ,同时得到 ,化学方程式为 。
4. [2020山东,12分]用软锰矿(主要成分为 ,含少量 、 )和 制备高纯 的工艺流程如下:
已知: 是一种两性氧化物; 时相关物质的 见下表。
物质
回答下列问题:
(1) 软锰矿预先粉碎的目的是增大接触面积,充分反应,提高反应速率, 与 溶液反应转化为 的化学方程式为 。
[解析]对软锰矿进行粉碎,其表面积增大,在后续加入硫化钡溶液时,固体与溶液接触面积大,充分反应,能提高反应速率。分析该制备工艺流程图可知,“反应”操作中硫化钡中的硫元素转化为硫单质,硫化钡中的钡元素转化为氢氧化钡,故软锰矿中的二氧化锰在“反应”操作中被硫化钡中的 还原,锰元素由 价转化为 价,故 与 溶液反应转化为 的化学方程式是 。
(2) 保持 投料量不变,随 与 投料比增大, 的量达到最大值后无明显变化,而 的量达到最大值后会减小,减小的原因是过量的 消耗了产生的 。
[解析]加入的 的量增大,而 的量减少,是因为 为两性氧化物,能与强碱 反应,从而导致 的量减少。
(3) 滤液Ⅰ可循环使用,应当将其导入到蒸发操作中(填操作单元的名称)。
[解析]滤液Ⅰ中仍含少量的 ,为提高其产率,可将滤液Ⅰ导入前边的“蒸发”操作中。
(4) 净化时需先加入的试剂 为 (填化学式),再使用氨水调溶液的 ,则 的理论最小值为 (当溶液中某离子浓度 时,可认为该离子沉淀完全)。
[解析]由软锰矿中的杂质成分有 可知,“酸解”后溶液中含有 ,结合表中四种氢氧化物的溶度积数据知,为减少 的损失,需将 转化为 ,然后再调节溶液 ,使杂质 转化为 ,故“净化”操作中需加入氧化剂,结合后续操作中的物质转化可知,“净化”操作中加入的试剂 为过氧化氢 溶液。对比表中的溶度积数据可知,相较于 , 的溶度积较大,若要除去 、 两种杂质,以前者的溶度积进行计算,推知调节溶液的 大小,由已知信息可知,沉淀完全的最大金属离子浓度为 ,此时 ,则 , ,此时 。
(5) 碳化过程中发生反应的离子方程式为 。
[解析]由工艺流程图中的“碳化”操作可知,该操作中加入的物质是碳酸氢铵、氨水,而“压滤”操作后的滤液中含 ,由目标产物可知,该反应的生成物中有碳酸锰,故“碳化”过程中发生反应的离子方程式是 。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2019-2023年化学高考真题分类
专题七 元素及其化合物的综合应用
题组一
一、选择题
1. [2023辽宁,3分]下列有关物质的工业制备反应错误的是( )
A. 合成氨: B. 制
C. 制粗硅: D. 冶炼镁:
2. [2022河北,3分]下列说法错误的是( )
A. 与浓 糊状混合物可用于刻蚀玻璃
B. 是强碱,因此钠盐的水溶液不会呈酸性
C. 溶洞的形成主要源于溶解 的水对岩石的溶蚀作用
D. 与 的反应中, 既是还原产物又是催化剂
3. [2022河北,3分] 溶液可作为替代氟利昂的绿色制冷剂。合成 工艺流程如下:
下列说法错误的是( )
A. 还原工序逸出的 用 溶液吸收,吸收液直接返回还原工序
B. 除杂工序中产生的滤渣可用煤油进行组分分离
C. 中和工序中的化学反应为
D. 参与反应的 为
4. [2022辽宁,3分]镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入 ,振荡,静置,液体分层。下列说法正确的是( )
A. 褪色原因为 被 还原 B. 液体分层后,上层呈紫红色
C. 镀锌铁钉比镀锡铁钉更易生锈 D. 溶液恢复棕色的原因为 被氧化
5. [2021浙江1月选考,2分]下列“类比”合理的是( )
A. 与 反应生成 和 ,则 与 反应生成 和
B. 溶液与 反应生成 和 ,则 溶液与 反应生成 和
C. 与盐酸反应生成 和 ,则 与盐酸反应生成 和
D. 溶液与少量 溶液反应生成 和 ,则氨水与少量 溶液反应生成 和
6. [2021广东,2分]化学创造美好生活。下列生产活动中,没有运用相应化学原理的是( )
选项 生产活动 化学原理
A 用聚乙烯塑料制作食品保鲜膜 聚乙烯燃烧生成 和
B 利用海水制取溴和镁单质 可被氧化、 可被还原
C 利用氢氟酸刻蚀石英制作艺术品 氢氟酸可与 反应
D 公园的钢铁护栏涂刷多彩防锈漆 钢铁与潮湿空气隔绝可防止腐蚀
7. [2019浙江4月选考,2分]针对下列实验现象表述不正确的是( )
A. 用同一针筒先后抽取 氯气、 水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入 浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
二、非选择题
8. [2023全国乙卷,15分] 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿 ,含有少量 、 、 、 等元素 制备 的流程如下:
已知: , , 。
回答下列问题:
(1) 硫酸溶矿主要反应的化学方程式为 。为提高溶矿速率,可采取的措施是 (举1例)。
(2) 加入少量 的作用是 。不宜使用 替代 ,原因是 。
(3) 溶矿反应完成后,反应器中溶液 ,此时 ;用石灰乳调节至 ,除去的金属离子是 。
(4) 加入少量 溶液除去 ,生成的沉淀有 。
(5) 在电解槽中,发生电解反应的离子方程式为 。随着电解反应进行,为保持电解液成分稳定,应不断 。电解废液可在反应器中循环利用。
(6) 煅烧窑中,生成 反应的化学方程式是 。
9. [2021浙江1月选考,10分]某兴趣小组对化合物 开展探究实验。
其中: 是易溶于水的强酸盐,由3种元素组成;A和B均为纯净物;B可使品红水溶液褪色。
请回答:
(1) 组成 的3种元素是 (填元素符号), 的化学式是 。
(2) 将固体 加入温热的稀 中,产生气体B,该反应的离子方程式是 。
(3) 步骤Ⅰ,发生反应的化学方程式是。
(4) 步骤Ⅱ,某同学未加 溶液,发现也会缓慢出现白色浑浊,原因是 。
(5) 关于气体B使品红水溶液褪色的原因,一般认为:B不能使品红褪色,而是B与水反应的生成物使品红褪色。请设计实验证明 。
题组二
一、选择题
1. [2023全国乙卷,6分]一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是( )
A. 硫酸亚铁溶液出现棕黄色沉淀
B. 硫化钠溶液出现浑浊颜色变深
C. 溴水颜色逐渐褪去
D. 胆矾表面出现白色粉末
2. [2023湖南,3分]取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为 ),反应现象没有明显差别的是( )
选项 试剂① 试剂②
A 氨水 溶液
B 溶液 溶液
C 溶液 酸性 溶液
D 溶液 溶液
3. [2020江苏,2分]下列关于 、 、 、 元素及其化合物的说法正确的是( )
A. 的碱性比 的强
B. 得到电子的能力比 的弱
C. 原子半径
D. 原子的最外层电子数
4. [2020江苏,2分]下列选项所示的物质间转化均能实现的是( )
A. 漂白粉
B.
C.
D.
二、非选择题
5. [2021海南,12分]亚硝酰氯 可作为有机合成试剂。
已知:
② 沸点: 为 , 为 , 为 。
易水解,能与 反应。
某研究小组用 和 在如图所示装置中制备 ,并分离回收未反应的原料。
回答问题:
(1) 通入 和 前先通入氩气,作用是 ;仪器D的名称是 。
(2) 将催化剂负载在玻璃棉上而不是直接平铺在玻璃管中,目的是 。
(3) 实验所需的 可用 和 溶液在稀 中反应制得,离子反应方程式为 。
(4) 为分离产物和未反应的原料,低温浴槽A的温度区间应控制在 ,仪器C收集的物质是 。
(5) 无色的尾气若遇到空气会变为红棕色,原因是 。
6. [2020全国卷Ⅲ,15分]某油脂厂废弃的油脂加氢镍催化剂主要含金属 、 、 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
溶液中金属离子开始沉淀和完全沉淀的 如表所示:
金属离子
开始沉淀时 的 7.2 3.7 2.2 7.5
沉淀完全时 的 8.7 4.7 3.2 9.0
回答下列问题:
(1) “碱浸”中 的两个作用分别是 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式 。
(2) “滤液②”中含有的金属离子是 。
(3) “转化”中可替代 的物质是 。若工艺流程改为先“调 ”后“转化”,即,“滤液③”中可能含有的杂质离子为 。
(4) 利用上述表格数据,计算 的 (列出计算式)。如果“转化”后的溶液中 浓度为 ,则“调 ”应控制的 范围是 。
(5) 硫酸镍在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式 。
(6) 将分离出硫酸镍晶体后的母液收集、循环使用,其意义是 。
7. [2020全国卷Ⅰ,14分]钒具有广泛用途。黏土钒矿中,钒以 、 、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、 。采用以下工艺流程可由黏土钒矿制备 。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
金属离子
开始沉淀 1.9 7.0 3.0 8.1
完全沉淀 3.2 9.0 4.7 10.1
回答下列问题:
(1) “酸浸氧化”需要加热,其原因是 。
(2) “酸浸氧化”中, 和 被氧化成 ,同时还有 离子被氧化。写出 转化为 反应的离子方程式 。
(3) “中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子 、 、 、 ,以及部分的 。
(4) “沉淀转溶”中, 转化为钒酸盐溶解。滤渣③的主要成分是 。
(5) “调 ”中有沉淀生成,生成沉淀反应的化学方程式是 。
(6) “沉钒”中析出 晶体时,需要加入过量 ,其原因是 。
题组三
一、选择题
1. [2021河北,3分] 是一种具有珍珠光泽的材料,利用金属 制备 的工艺流程如图:
下列说法错误的是( )
A. 酸浸工序中分次加入稀 可降低反应剧烈程度
B. 转化工序中加入稀 可抑制生成
C. 水解工序中加入少量 可提高 水解程度
D. 水解工序中加入少量 有利于 的生成
二、非选择题
2. [2022全国甲卷,14分]硫酸锌 是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备,菱锌矿的主要成分为 ,杂质为 以及 、 、 、 等的化合物。其制备流程如下:
本题中所涉及离子的氢氧化物溶度积常数如下表:
离子
回答下列问题:
(1) 菱锌矿焙烧生成氧化锌的化学方程式为 。
(2) 为了提高锌的浸取效果,可采取的措施有 、 。
(3) 加入物质 调溶液 ,最适宜使用的 是 (填标号)。
A.
B.
C.
滤渣①的主要成分是 、 、 。
(4) 向 的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为 。
(5) 滤液②中加入锌粉的目的是 。
(6) 滤渣④与浓 反应可以释放 并循环利用,同时得到的副产物是 、 。
3. [2022广东,14分]稀土 包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸 熔点为 ;月桂酸和 均难溶于水。该工艺条件下,稀土离子保持 价不变; 的 ; 开始溶解时的 为8.8;有关金属离子沉淀的相关 见下表。
离子
开始沉淀时的 8.8 1.5 3.6
沉淀完全时的 / 3.2 4.7 /
(1) “氧化调 ”中,化合价有变化的金属离子是 。
(2) “过滤1”前,用 溶液调 至 的范围内,该过程中 发生反应的离子方程式为 。
(3) “过滤2”后,滤饼中检测不到 元素,滤液2中 浓度为 。为尽可能多地提取 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中 低于 (保留两位有效数字)。
(4)① “加热搅拌”有利于加快 溶出、提高产率,其原因是 。
② “操作 ”的过程为:先 ,再固液分离。
(5) 该工艺中,可再生循环利用的物质有 (写化学式)。
(6) 稀土元素钇 可用于制备高活性的合金类催化剂 。
① 还原 和 熔融盐制备 时,生成 转移 电子。
② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为 。
4. [2021广东,13分]对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝 、钼 、镍 等元素的氧化物,一种回收利用工艺的部分流程如下:
已知: 时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。
(1) “焙烧”中,有 生成,其中 元素的化合价为 。
(2) “沉铝”中,生成的沉淀 为 。
(3) “沉钼”中, 为7.0。
① 生成 的离子方程式为 。
② 若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中 (列出算式)时,应停止加入 溶液。
(4)① 滤液Ⅲ中,主要存在的钠盐有 和 , 为 。
② 往滤液Ⅲ中添加适量 固体后,通入足量 (填化学式)气体,再通入足量 ,可析出 。
(5) 高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
① 该氧化物为 。
② 已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为 价,则该反应的氧化剂与还原剂物质的量之比为 。
题组四
1. [2023新课标卷,14分]铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物。从铬钒渣中分离提取铬和钒的一种流程如下图所示。
已知:最高价铬酸根在酸性介质中以 存在,在碱性介质中以 存在。
回答下列问题:
煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要
为 (填化学式)。
(2) 水浸渣中主要有 和 。
(3) “沉淀”步骤调 到弱碱性,主要除去的杂质是 。
(4) “除硅磷”步骤中,使硅、磷分别以 和 的形式沉淀。该步需要控制溶液的 以达到最好的除杂效果。若 时,会导致 ;
时,会导致 。
(5) “分离钒”步骤中,将溶液 调到1.8左右得到 沉淀。 在 时,溶解为 或 ;在碱性条件下,溶解为 或 。上述性质说明 具有 (填标号)。
A. 酸性 B. 碱性 C. 两性
(6) “还原”步骤中加入焦亚硫酸钠 溶液,反应的离子方程式为 。
2. [2022全国乙卷,14分]废旧铅蓄电池的铅膏中主要含有 、 、 和 ,还有少量 、 、 的盐或氧化物等,为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的 如下表:
金属氢氧化物
开始沉淀的 2.3 6.8 3.5 7.2
完全沉淀的 3.2 8.3 4.6 9.1
回答下列问题:
(1) 在“脱硫”中 转化反应的离子方程式为 ,用沉淀溶解平衡原理解释选择 的原因 。
(2) 在“脱硫”中,加入 不能使铅膏中 完全转化,原因是 。
(3) 在“酸浸”中,除加入醋酸 ,还要加入 。
(i) 能被 氧化的离子是 ;
(ii) 促进了金属 在醋酸中转化为 ,其化学方程式为 ;
(iii) 也能使 转化为 , 的作用是 。
(4) “酸浸”后溶液的 约为 ,滤渣的主要成分是 。
(5) “沉铅”的滤液中,金属离子有 。
3. [2021湖北,14分]废旧太阳能电池 具有较高的回收利用价值,其主要组成为 。某探究小组回收处理流程如下:
回答下列问题:
(1) 硒 与硫为同族元素, 的最外层电子数为 ;镓 和铟 位于元素周期表第三主族, 中 的化合价为 。
(2) “酸浸氧化”发生的主要氧化还原反应的化学方程式为 。
(3) 时,已知: , , , ,“浸出液”中 。当金属阳离子浓度小于 时沉淀完全, 恰好完全沉淀时溶液的 约为 (保留一位小数);若继续加入 氨水至过量,观察到的实验现象是先有蓝色沉淀,然后 ;为探究 在氨水中能否溶解,计算反应 的平衡常数 。
(已知: )
(4) “滤渣”与 混合前需要洗涤、干燥,检验滤渣中 是否洗净的试剂是 ;“回流过滤”中 的作用是将氢氧化物转化为氯化物和 。
(5) “高温气相沉积”过程中发生的化学反应方程式为 。
4. [2020山东,12分]用软锰矿(主要成分为 ,含少量 、 )和 制备高纯 的工艺流程如下:
已知: 是一种两性氧化物; 时相关物质的 见下表。
物质
回答下列问题:
(1) 软锰矿预先粉碎的目的是 , 与 溶液反应转化为 的化学方程式为 。
(2) 保持 投料量不变,随 与 投料比增大, 的量达到最大值后无明显变化,而 的量达到最大值后会减小,减小的原因是 。
(3) 滤液Ⅰ可循环使用,应当将其导入到 操作中(填操作单元的名称)。
(4) 净化时需先加入的试剂 为 (填化学式),再使用氨水调溶液的 ,则 的理论最小值为 (当溶液中某离子浓度 时,可认为该离子沉淀完全)。
(5) 碳化过程中发生反应的离子方程式为 。
专题七 元素及其化合物的综合应用
题组一
一、选择题
1. [2023辽宁,3分]下列有关物质的工业制备反应错误的是( D )
A. 合成氨: B. 制
C. 制粗硅: D. 冶炼镁:
[解析]化学工业的制备反应合成氨工业为氮气和氢气在高温高压、催化剂条件下反应生成氨气, 项正确;工业制备 为氢气和氯气在点燃时反应生成 , 项正确;工业制备粗硅为石英和焦炭在高温条件下反应生成单质硅和 , 项正确;工业冶炼镁为电解熔融氯化镁生成镁和氯气, 项错误。
2. [2022河北,3分]下列说法错误的是( B )
A. 与浓 糊状混合物可用于刻蚀玻璃
B. 是强碱,因此钠盐的水溶液不会呈酸性
C. 溶洞的形成主要源于溶解 的水对岩石的溶蚀作用
D. 与 的反应中, 既是还原产物又是催化剂
[解析] , 水溶液可以刻蚀玻璃, 项正确; 溶液呈酸性, 项错误; , 可溶于水, 项正确; , 化合价降低, 是还原产物,且生成的 可以催化 和 的反应, 项正确。
3. [2022河北,3分] 溶液可作为替代氟利昂的绿色制冷剂。合成 工艺流程如下:
下列说法错误的是( A )
A. 还原工序逸出的 用 溶液吸收,吸收液直接返回还原工序
B. 除杂工序中产生的滤渣可用煤油进行组分分离
C. 中和工序中的化学反应为
D. 参与反应的 为
[解析]
逸出的 用 溶液吸收后生成 、 和水,若直接返回还原工序,会引入杂质离子 ,导致产品不纯, 项错误;滤渣中含 和 ,单质 可溶于煤油,而 不溶于煤油,故 项正确;中和工序中 与 反应生成 、 和 , 项正确;根据 、 知,参与反应的 , 项正确。
4. [2022辽宁,3分]镀锌铁钉放入棕色的碘水中,溶液褪色;取出铁钉后加入少量漂白粉,溶液恢复棕色;加入 ,振荡,静置,液体分层。下列说法正确的是( D )
A. 褪色原因为 被 还原 B. 液体分层后,上层呈紫红色
C. 镀锌铁钉比镀锡铁钉更易生锈 D. 溶液恢复棕色的原因为 被氧化
[解析]锌的金属活动性强于铁,镀锌铁钉放入棕色的碘水中, 被锌还原成 ,溶液褪色, 项错误;加入漂白粉,溶液恢复棕色,说明溶液中的 又被氧化成 , 易溶于 , 不溶于水且密度比水大,故加入 , 的 溶液在下层,下层呈紫红色, 项错误, 项正确;镀锌铁钉形成原电池时,由于锌比铁活泼,锌作负极被腐蚀,铁作正极被保护,镀锡铁钉形成原电池时,由于铁比锡活泼,铁作负极被腐蚀,故镀锡铁钉比镀锌铁钉更易生锈, 项错误。
5. [2021浙江1月选考,2分]下列“类比”合理的是( C )
A. 与 反应生成 和 ,则 与 反应生成 和
B. 溶液与 反应生成 和 ,则 溶液与 反应生成 和
C. 与盐酸反应生成 和 ,则 与盐酸反应生成 和
D. 溶液与少量 溶液反应生成 和 ,则氨水与少量 溶液反应生成 和
[解析]铁与水蒸气反应生成 和 , 不正确; 具有强氧化性,会将 氧化, 不正确;氮化钠与氮化镁水解生成相应的碱和氨气,再与盐酸反应生成盐, 正确; 与 反应先生成 , 不稳定,生成 ,氨水与少量硝酸银溶液反应先生成 ,而 能溶于过量的氨水中,生成 , 不正确。
6. [2021广东,2分]化学创造美好生活。下列生产活动中,没有运用相应化学原理的是( )
选项 生产活动 化学原理
A 用聚乙烯塑料制作食品保鲜膜 聚乙烯燃烧生成 和
B 利用海水制取溴和镁单质 可被氧化、 可被还原
C 利用氢氟酸刻蚀石英制作艺术品 氢氟酸可与 反应
D 公园的钢铁护栏涂刷多彩防锈漆 钢铁与潮湿空气隔绝可防止腐蚀
[解析]聚乙烯塑料可用作食品保鲜膜,与其燃烧产物无关,应和聚乙烯的无毒无污染等性能有关, 项错误;海水提溴和制镁时, 发生了氧化反应,而 发生了还原反应, 项正确;氢氟酸刻蚀石英制作艺术品,利用了氢氟酸与 的反应, 项正确;钢铁护栏涂刷多彩防锈漆,能避免钢铁护栏与潮湿空气直接接触,可防止钢铁护栏被腐蚀, 项正确。
7. [2019浙江4月选考,2分]针对下列实验现象表述不正确的是( A )
A. 用同一针筒先后抽取 氯气、 水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入 浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
[解析]常温常压下,1体积水约溶解2体积的氯气,故 水只能溶解大约 的氯气, 项错误;浓硫酸具有吸水性,将 转化为 ,固体由蓝色变为白色, 项正确;双氧水将含 价硫元素的微粒氧化为 , 与 反应生成 沉淀, 项正确;镁在二氧化碳中燃烧生成 和 , 项正确。
二、非选择题
8. [2023全国乙卷,15分] 作为一种新型锂电池正极材料受到广泛关注。由菱锰矿 ,含有少量 、 、 、 等元素 制备 的流程如下:
已知: , , 。
回答下列问题:
(1) 硫酸溶矿主要反应的化学方程式为 。为提高溶矿速率,可采取的措施是粉碎矿石(或适当增大硫酸浓度、搅拌、适当升高反应液的温度等)(举1例)。
[解析]
硫酸溶矿时发生的主要反应是 溶于硫酸的反应,化学方程式为 。可根据影响反应速率的因素分析可采取的措施。
(2) 加入少量 的作用是将 氧化为 。不宜使用 替代 ,原因是 和生成的 会催化 分解。
[解析]加入少量 的作用是将 氧化为 ,便于除铁。若使用 替代 ,则 和生成的 会催化 分解,原料利用率低。
(3) 溶矿反应完成后,反应器中溶液 ,此时 ;用石灰乳调节至 ,除去的金属离子是 。
[解析]溶液 ,即 时,由 ,可得 。同理, , 时, , 被除去, , 未被除去。
(4) 加入少量 溶液除去 ,生成的沉淀有 和 。
[解析]酸溶时得到相应金属的硫酸盐,故加入少量 溶液除 时会生成 和 沉淀。
(5) 在电解槽中,发生电解反应的离子方程式为 。随着电解反应进行,为保持电解液成分稳定,应不断加 。电解废液可在反应器中循环利用。
[解析]电解槽中反应生成 ,则阳极反应为 ,阴极反应为 ,总反应为 ,该反应中消耗水,生成 、 ,为保持电解液成分稳定,应不断补充 。
(6) 煅烧窑中,生成 反应的化学方程式是 。
[解析]根据得失电子守恒和质量守恒可写出煅烧窑中生成 反应的化学方程式是 。
9. [2021浙江1月选考,10分]某兴趣小组对化合物 开展探究实验。
其中: 是易溶于水的强酸盐,由3种元素组成;A和B均为纯净物;B可使品红水溶液褪色。
请回答:
(1) 组成 的3种元素是 、 、 (填元素符号), 的化学式是 。
[解析]由原子守恒知 由 、 、 三种元素组成。 中 , , , ,故 的化学式为 。
(2) 将固体 加入温热的稀 中,产生气体B,该反应的离子方程式是 。
[解析] 易溶于水,与稀硫酸反应的产物之一是 ,易推出另一种产物含 ,反应的离子方程式为 。
(3) 步骤Ⅰ,发生反应的化学方程式是。
[解析] 与甘油发生反应生成 与。
(4) 步骤Ⅱ,某同学未加 溶液,发现也会缓慢出现白色浑浊,原因是 与水反应生成 ; 能被氧气氧化为 ,与 反应生成 。
[解析] 在水中可被溶解在水中的 氧化为 , 与 作用生成 。
(5) 关于气体B使品红水溶液褪色的原因,一般认为:B不能使品红褪色,而是B与水反应的生成物使品红褪色。请设计实验证明配制品红无水乙醇溶液(其他非水溶剂亦可),通入 ,不褪色;品红水溶液中加入亚硫酸钠(亚硫酸氢钠)固体,褪色更快。
[解析]由 的形成过程知其是 , 中 ;由题意可推出气体 是 ,同理可求出 。能与甘油作用形成绛蓝色溶液的蓝色悬浊液是 悬浊液, 中含有 ,由此可推出固体 为 。
溶于水后溶液中的含 微粒还有 、 、 。证明 不能使品红褪色的方法为:配制品红的无水乙醇溶液(或其他非水溶剂溶液),再向溶液中通入 ,品红不褪色。证明使品红溶液褪色的物质是 与水反应的产物的方法为:向品红水溶液中加入 ,品红水溶液褪色更快。
题组二
一、选择题
1. [2023全国乙卷,6分]一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是( )
A. 硫酸亚铁溶液出现棕黄色沉淀
B. 硫化钠溶液出现浑浊颜色变深
C. 溴水颜色逐渐褪去
D. 胆矾表面出现白色粉末
[解析] 溶液中出现的棕黄色沉淀应为 ,而不是 ,发生的反应为 , 错误; 溶液出现浑浊颜色变深,说明生成了 , , 错误;溴水中存在平衡 , 见光易分解,促使该平衡正向移动,从而使溴水褪色, 错误;胆矾在空气中久置易失去结晶水而逐渐变成白色 粉末, 正确。
2. [2023湖南,3分]取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为 ),反应现象没有明显差别的是( )
选项 试剂① 试剂②
A 氨水 溶液
B 溶液 溶液
C 溶液 酸性 溶液
D 溶液 溶液
[解析]
选项 ①加入②中现象 ②加入①中现象
先产生白色沉淀,后白色沉淀溶解 先无明显现象,后产生白色沉淀
先产生白色沉淀,后白色沉淀溶解 先无明显现象,后产生白色沉淀
溶液紫色逐渐褪去,有气泡产生 紫色溶液迅速褪色,有气泡产生
溶液变为红色 溶液变为红色
3. [2020江苏,2分]下列关于 、 、 、 元素及其化合物的说法正确的是( A )
A. 的碱性比 的强
B. 得到电子的能力比 的弱
C. 原子半径
D. 原子的最外层电子数
[解析]元素的金属性越强,其最高价氧化物对应的水化物的碱性越强, 项正确; 的非金属性强于 ,则 得到电子的能力比 的强, 项错误;同周期元素从左到右原子半径逐渐减小,则原子半径大小顺序为 , 项错误; 、 、 、 原子的最外层电子数分别为1、2、7、7, 项错误。
4. [2020江苏,2分]下列选项所示的物质间转化均能实现的是( C )
A. 漂白粉
B.
C.
D.
[解析] 与石灰乳反应可制得漂白粉, 项错误; , , 项错误;由于氧化性 ,则 , , 项正确;电解 溶液不能得到单质镁,要得到单质 ,需电解熔融态的 , 项错误。
二、非选择题
5. [2021海南,12分]亚硝酰氯 可作为有机合成试剂。
已知:
② 沸点: 为 , 为 , 为 。
易水解,能与 反应。
某研究小组用 和 在如图所示装置中制备 ,并分离回收未反应的原料。
回答问题:
(1) 通入 和 前先通入氩气,作用是排除装置中的空气;仪器D的名称是球形干燥管。
[解析]由已知③可知, 、 都能与 反应,为防止 、 与 反应,实验前应排净装置中的空气。
(2) 将催化剂负载在玻璃棉上而不是直接平铺在玻璃管中,目的是增大与气体的接触面积,增强催化效果。
[解析]将催化剂负载在玻璃棉上可增大其与气体的接触面积,增强催化效果。
(3) 实验所需的 可用 和 溶液在稀 中反应制得,离子反应方程式为 。
[解析] 转化为 , 元素的化合价降低,得到电子,则 失电子,化合价升高,生成 ,根据化合价升降法配平得 。
(4) 为分离产物和未反应的原料,低温浴槽A的温度区间应控制在 ,仪器C收集的物质是 。
[解析]由已知②知,低温浴槽 的温度区间应控制在 ,从而使未反应的 、 挥发出去, 的沸点为 ,实验中低温浴槽 的温度不易低至 ,所以仪器 收集的是 。
(5) 无色的尾气若遇到空气会变为红棕色,原因是 与空气中的氧气反应生成红棕色的 。
[解析]无色尾气为 , 与空气中的氧气反应生成红棕色的 气体。
6. [2020全国卷Ⅲ,15分]某油脂厂废弃的油脂加氢镍催化剂主要含金属 、 、 及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体
溶液中金属离子开始沉淀和完全沉淀的 如表所示:
金属离子
开始沉淀时 的 7.2 3.7 2.2 7.5
沉淀完全时 的 8.7 4.7 3.2 9.0
回答下列问题:
(1) “碱浸”中 的两个作用分别是除去油脂、溶解铝及其氧化物。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式 。
[解析]由题给条件可知,该废镍催化剂表面覆有油脂,且其中含有 、 、 及其氧化物等,“碱浸”时,油脂在氢氧化钠溶液中水解而被除去,铝及其氧化物也会与氢氧化钠溶液反应而被除去,“碱浸”中 的两个作用分别是除去油脂、溶解铝及其氧化物。“滤液①”中铝元素以 的形式存在,加入稀硫酸生成沉淀的离子方程式为 。
(2) “滤液②”中含有的金属离子是 、 、 。
[解析]因 、 及其氧化物不与 溶液反应, 、 及其氧化物存在于“滤饼①”中,向“滤饼①”中加入稀硫酸, 、 及其氧化物与稀硫酸反应,故得到的“滤液②”中含有的金属离子为 、 、 。
(3) “转化”中可替代 的物质是 或空气。若工艺流程改为先“调 ”后“转化”,即,“滤液③”中可能含有的杂质离子为 。
[解析]“转化”过程是将二价铁离子全部转化为三价铁离子,选用的氧化剂是 溶液,选用过氧化氢溶液氧化的好处是不引入其他杂质,因此替代过氧化氢溶液的物质也不能引入其他杂质,可用 或空气替代 溶液;由题表中金属离子开始沉淀和沉淀完全的 可知, 开始沉淀时, 已经沉淀一部分。若先调节 ,调节至 ,只能将 除去, 在“转化”时会生成 ,则滤液③中可能含有 。
(4) 利用上述表格数据,计算 的 [或 ](列出计算式)。如果“转化”后的溶液中 浓度为 ,则“调 ”应控制的 范围是 。
[解析] , , , ,或利用 沉淀完全时计算得 。 ,若不生成 ,则 , , ,同时应调节 以除去 ,故 应控制的范围是 。
(5) 硫酸镍在强碱溶液中用 氧化,可沉淀出能用作镍镉电池正极材料的 。写出该反应的离子方程式 。
[解析]由题意可知,反应物为硫酸镍、次氯酸钠和强碱,生成物有 ,硫酸镍中镍元素为 价, 中镍元素为 价,镍元素的化合价升高被氧化,则次氯酸钠中氯元素被还原得到氯化钠,该反应的离子方程式为 。
(6) 将分离出硫酸镍晶体后的母液收集、循环使用,其意义是提高镍回收率。
[解析]母液中还含有少量的硫酸镍,将母液收集、循环使用可提高镍回收率。
【流程梳理】
7. [2020全国卷Ⅰ,14分]钒具有广泛用途。黏土钒矿中,钒以 、 、 价的化合物存在,还包括钾、镁的铝硅酸盐,以及 、 。采用以下工艺流程可由黏土钒矿制备 。
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的 如下表所示:
金属离子
开始沉淀 1.9 7.0 3.0 8.1
完全沉淀 3.2 9.0 4.7 10.1
回答下列问题:
(1) “酸浸氧化”需要加热,其原因是加快酸浸和氧化反应速率(促进氧化完全)。
[解析]“酸浸氧化”中温度较低时,酸浸和氧化反应速率较慢。为了加快酸浸和氧化反应速率,需要加热。
(2) “酸浸氧化”中, 和 被氧化成 ,同时还有 离子被氧化。写出 转化为 反应的离子方程式 。
[解析]从原料看,“酸浸氧化”中四氧化三铁溶于稀硫酸,发生反应 ,加入的二氧化锰除氧化 和 外,还氧化 。 转化为 反应的离子方程式为 。
(3) “中和沉淀”中,钒水解并沉淀为 ,随滤液②可除去金属离子 、 、 、 ,以及部分的 和 。
[解析]根据表格中数据知, 在 时,铁离子接近沉淀完全,少量铁离子随滤液②除去, 部分沉淀,大量铝离子随滤液②除去, 、 、 、 随滤液②除去。
(4) “沉淀转溶”中, 转化为钒酸盐溶解。滤渣③的主要成分是 。
[解析]在 的强碱性溶液中, 转化为钒酸盐溶解, 转化为 溶解, 不溶,故滤渣③的主要成分是 。
(5) “调 ”中有沉淀生成,生成沉淀反应的化学方程式是 。
[解析] 时铝元素沉淀,故“调 ”时生成氢氧化铝沉淀,反应的化学方程式为 。
(6) “沉钒”中析出 晶体时,需要加入过量 ,其原因是利用同离子效应,促进 尽可能析出完全。
[解析]“沉钒”时要使 尽可能析出完全,利用同离子效应,加入过量 可达到此目的。
【流程梳理】
题组三
一、选择题
1. [2021河北,3分] 是一种具有珍珠光泽的材料,利用金属 制备 的工艺流程如图:
下列说法错误的是( D )
A. 酸浸工序中分次加入稀 可降低反应剧烈程度
B. 转化工序中加入稀 可抑制生成
C. 水解工序中加入少量 可提高 水解程度
D. 水解工序中加入少量 有利于 的生成
[解析]酸浸时分次加入稀硝酸,相当于降低了硝酸浓度,减小了反应的速率,降低反应剧烈程度, 项正确;转化工序中, 水解生成 和 ,加入盐酸,可抑制 的水解,从而抑制生成 , 项正确;水解工序中加入的醋酸钠电离生成的 可与 水解生成的 结合,生成弱电解质 ,促进 的水解, 项正确;硝酸铵水解使溶液显酸性,由上述分析可知,酸会抑制 水解, 项错误。
二、非选择题
2. [2022全国甲卷,14分]硫酸锌 是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备,菱锌矿的主要成分为 ,杂质为 以及 、 、 、 等的化合物。其制备流程如下:
本题中所涉及离子的氢氧化物溶度积常数如下表:
离子
回答下列问题:
(1) 菱锌矿焙烧生成氧化锌的化学方程式为 。
(2) 为了提高锌的浸取效果,可采取的措施有将菱锌矿焙烧产品粉碎、适当增大硫酸浓度(或升高浸取时的反应温度等,合理即可)。
(3) 加入物质 调溶液 ,最适宜使用的 是 (填标号)。
A.
B.
C.
滤渣①的主要成分是 、 、 。
[解析]加入物质 调溶液 ,为了不引入新的阳离子,故 宜选用 ; 时, ,根据表中各离子的氢氧化物的 可知,只有 能完全沉淀。
(4) 向 的滤液①中分批加入适量 溶液充分反应后过滤,滤渣②中有 ,该步反应的离子方程式为 。
[解析] 被适量 溶液氧化为 ,同时生成 , 沉淀和 进入滤渣②中。
(5) 滤液②中加入锌粉的目的是除去 。
(6) 滤渣④与浓 反应可以释放 并循环利用,同时得到的副产物是 、 。
[解析]
3. [2022广东,14分]稀土 包括镧、钇等元素,是高科技发展的关键支撑。我国南方特有的稀土矿可用离子交换法处理,一种从该类矿(含铁、铝等元素)中提取稀土的工艺如下:
已知:月桂酸 熔点为 ;月桂酸和 均难溶于水。该工艺条件下,稀土离子保持 价不变; 的 ; 开始溶解时的 为8.8;有关金属离子沉淀的相关 见下表。
离子
开始沉淀时的 8.8 1.5 3.6
沉淀完全时的 / 3.2 4.7 /
(1) “氧化调 ”中,化合价有变化的金属离子是 。
[解析]由题意知,“氧化调 ”中只有铁是变价金属,铝和稀土金属元素均为 价, 被氧化为 。
(2) “过滤1”前,用 溶液调 至 的范围内,该过程中 发生反应的离子方程式为 。
[解析]“过滤1”所得“滤渣”为 和 ,应调节的 范围为 , 小于6.2是防止 开始沉淀。该过程中 与 反应生成 沉淀。
(3) “过滤2”后,滤饼中检测不到 元素,滤液2中 浓度为 。为尽可能多地提取 ,可提高月桂酸钠的加入量,但应确保“过滤2”前的溶液中 低于 (保留两位有效数字)。
[答案]
[解析]“滤液2”中 浓度为 ,其物质的量浓度为 , , , ,若 大于 ,则形成的“滤饼”中会混入 。
(4)① “加热搅拌”有利于加快 溶出、提高产率,其原因是加热搅拌可加快反应速率。
[解析]“滤饼”的主要成分为 ,为难溶物,搅拌可以增加其与盐酸的接触面积,加热也可以加快固体的溶解,进而加快反应速率。
② “操作 ”的过程为:先冷却结晶,再固液分离。
[解析]加热搅拌的温度为 ,而月桂酸的熔点为 ,所以“操作 ”(过滤)前,先要冷却结晶,使月桂酸变成固体。
(5) 该工艺中,可再生循环利用的物质有 (写化学式)。
[解析]“滤液2”中含有 ,可以用作“浸取”时加入的“酸化 溶液”。
(6) 稀土元素钇 可用于制备高活性的合金类催化剂 。
① 还原 和 熔融盐制备 时,生成 转移15 电子。
[解析] 中 为 价, 中 为 价, 为合金, 和 均可以看成0价,若生成 ,转移电子的物质的量为 。
② 用作氢氧燃料电池电极材料时,能在碱性溶液中高效催化 的还原,发生的电极反应为 。
[解析]在氢氧燃料电池的碱性介质中, 得电子与水反应生成 。
4. [2021广东,13分]对废催化剂进行回收可有效利用金属资源。某废催化剂主要含铝 、钼 、镍 等元素的氧化物,一种回收利用工艺的部分流程如下:
已知: 时, 的 , ; ; ;该工艺中, 时,溶液中 元素以 的形态存在。
(1) “焙烧”中,有 生成,其中 元素的化合价为 。
[解析] 中 为 价, 为 价,根据化合物中正负化合价代数和为0,可知 的化合价为 。
(2) “沉铝”中,生成的沉淀 为 。
[解析]经“ 焙烧”“水浸过滤”后, 转化为 进入到滤液Ⅰ中,向滤液Ⅰ中通入过量 ,发生反应 ,故生成的沉淀 为 。
(3) “沉钼”中, 为7.0。
① 生成 的离子方程式为 。
[解析]“沉钼”中, 为 ,溶液中 元素以 的形态存在,故生成 的离子方程式为 。
② 若条件控制不当, 也会沉淀。为避免 中混入 沉淀,溶液中 (列出算式)时,应停止加入 溶液。
[解析]根据 ,可得 ,当 , 中混入 沉淀时, ,则 。
(4)① 滤液Ⅲ中,主要存在的钠盐有 和 , 为 。
[解析]根据“沉铝”时发生反应 ,可知滤液Ⅲ中主要存在的钠盐有 和 。
② 往滤液Ⅲ中添加适量 固体后,通入足量 (填化学式)气体,再通入足量 ,可析出 。
[解析]往滤液Ⅲ(含 、 )中添加适量 固体后,通入足量 ,再通入足量 ,发生反应 ,故可以析出 。
(5) 高纯 (砷化铝)可用于芯片制造。芯片制造中的一种刻蚀过程如图所示,图中所示致密保护膜为一种氧化物,可阻止 刻蚀液与下层 (砷化镓)反应。
① 该氧化物为 。
[解析]题图中所示致密保护膜(氧化物)可以阻止 刻蚀液与下层 反应,可推知该保护膜为 。
② 已知: 和 同族, 和 同族。在 与上层 的反应中, 元素的化合价变为 价,则该反应的氧化剂与还原剂物质的量之比为 。
[解析] 与 的反应中, 的化合价由 变为 , 参与反应失去 电子,而 参与反应得到 电子,根据得失电子守恒,可知该反应中氧化剂 与还原剂 的物质的量之比为 。
题组四
1. [2023新课标卷,14分]铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物。从铬钒渣中分离提取铬和钒的一种流程如下图所示。
已知:最高价铬酸根在酸性介质中以 存在,在碱性介质中以 存在。
回答下列问题:
(1) 煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为 (填化学式)。
[解析]根据已知条件可知,最高价铬酸根在碱性介质中以 存在,故煅烧后含铬化合物主要为 。
(2) 水浸渣中主要有 和 。
[解析]煅烧时通入空气,含铁化合物转化为 ,且 不溶于水,故水浸渣中还含有 。
(3) “沉淀”步骤调 到弱碱性,主要除去的杂质是 。
[解析]“沉淀”步骤加入稀 调 到弱碱性是为了让 转化为 沉淀而除去。
(4) “除硅磷”步骤中,使硅、磷分别以 和 的形式沉淀。该步需要控制溶液的 以达到最好的除杂效果。若 时,会导致溶液中 降低,不利于生成 沉淀;
时,会导致 形成 沉淀。
[解析]体系中存在平衡 ,当 时, , 降低,平衡正移,不利于生成 沉淀;而 时 会形成 沉淀,原料利用率低。
(5) “分离钒”步骤中,将溶液 调到1.8左右得到 沉淀。 在 时,溶解为 或 ;在碱性条件下,溶解为 或 。上述性质说明 具有C(填标号)。
A. 酸性 B. 碱性 C. 两性
[解析]根据题干描述, 既可与酸反应生成盐和水,又可与碱反应生成盐和水,故 具有两性。
(6) “还原”步骤中加入焦亚硫酸钠 溶液,反应的离子方程式为 。
[解析]分离钒后溶液呈酸性, 元素以 存在,还原过程中 被 还原为 , 转化为 ,因此反应的离子方程式为 ,之后调 , 转化为 。
2. [2022全国乙卷,14分]废旧铅蓄电池的铅膏中主要含有 、 、 和 ,还有少量 、 、 的盐或氧化物等,为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的 如下表:
金属氢氧化物
开始沉淀的 2.3 6.8 3.5 7.2
完全沉淀的 3.2 8.3 4.6 9.1
回答下列问题:
(1) 在“脱硫”中 转化反应的离子方程式为 ,用沉淀溶解平衡原理解释选择 的原因该反应的 ,反应正向进行的程度很大,可以进行到底。
[解析] 的 远小于 的 ,易发生生成 的沉淀转化,且进行较为彻底。
(2) 在“脱硫”中,加入 不能使铅膏中 完全转化,原因是反应 的 ,反应正向进行的程度很小。
[解析] 的 大于 的 ,生成 的沉淀转化的反应进行的程度很小。
(3) 在“酸浸”中,除加入醋酸 ,还要加入 。
(i) 能被 氧化的离子是 ;
[解析]具有还原性,能被 氧化;
(ii) 促进了金属 在醋酸中转化为 ,其化学方程式为 ;
[解析] 能氧化 ,使其转化成 , 再与 结合生成 ,依据氧化还原反应的规律,即可写出反应的化学方程式;
(iii) 也能使 转化为 , 的作用是作还原剂。
[解析] 通过与 、 反应转化为 ,发生氧化还原反应, 化合价降低, 作还原剂。
(4) “酸浸”后溶液的 约为 ,滤渣的主要成分是 、 。
[解析]根据题给信息,当 时, 、 完全转化为 、 。
(5) “沉铅”的滤液中,金属离子有 、 。
[解析]加入 溶液,发生沉铅的反应为 ,故滤液中含有的金属阳离子有 以及未沉淀的 。
3. [2021湖北,14分]废旧太阳能电池 具有较高的回收利用价值,其主要组成为 。某探究小组回收处理流程如下:
回答下列问题:
(1) 硒 与硫为同族元素, 的最外层电子数为6;镓 和铟 位于元素周期表第三主族, 中 的化合价为 。
[解析] 与硫同为 族元素,最外层有6个电子。 为 族元素,化合价为 , 和 同为Ⅲ 族元素,化合价均为 ,根据化合物中各元素正负化合价代数和为0,设 中 的化合价为 ,则 ,解得 。
(2) “酸浸氧化”发生的主要氧化还原反应的化学方程式为 。
[解析] 中 和 元素均处于最高价态,高温焙烧时 元素转化为 ,则酸浸氧化时 氧化 价的 ,高温焙烧时 元素转化为 ,故酸浸氧化时发生的主要氧化还原反应为 。
(3) 时,已知: , , , ,“浸出液”中 。当金属阳离子浓度小于 时沉淀完全, 恰好完全沉淀时溶液的 约为 (保留一位小数);若继续加入 氨水至过量,观察到的实验现象是先有蓝色沉淀,然后蓝色沉淀溶解,溶液变成深蓝色;为探究 在氨水中能否溶解,计算反应 的平衡常数 。
(已知: )
[解析]根据 知,当 恰好完全沉淀时, , , 。若继续加入 氨水至过量,先有蓝色 沉淀生成,然后蓝色沉淀溶解,得到深蓝色溶液。将 、 、 三个反应相加可以得到 ,则平衡常数 。
(4) “滤渣”与 混合前需要洗涤、干燥,检验滤渣中 是否洗净的试剂是 溶液、 溶液;“回流过滤”中 的作用是将氢氧化物转化为氯化物和作溶剂。
[解析]加氨水调 的目的是沉淀溶液中的 、 ,得到的滤液Ⅰ主要含硫酸铵、 ,检验滤渣中 是否洗净,可以加入盐酸酸化的 溶液。 、 可分别写为 、 的形式, 能和 反应生成 和 , 、 和 反应均生成氯化物和 ,因此 的作用是将氢氧化物转化为氯化物和作溶剂。
(5) “高温气相沉积”过程中发生的化学反应方程式为 。
[解析]高温气相沉积时 和 反应生成 ,同时得到 ,化学方程式为 。
4. [2020山东,12分]用软锰矿(主要成分为 ,含少量 、 )和 制备高纯 的工艺流程如下:
已知: 是一种两性氧化物; 时相关物质的 见下表。
物质
回答下列问题:
(1) 软锰矿预先粉碎的目的是增大接触面积,充分反应,提高反应速率, 与 溶液反应转化为 的化学方程式为 。
[解析]对软锰矿进行粉碎,其表面积增大,在后续加入硫化钡溶液时,固体与溶液接触面积大,充分反应,能提高反应速率。分析该制备工艺流程图可知,“反应”操作中硫化钡中的硫元素转化为硫单质,硫化钡中的钡元素转化为氢氧化钡,故软锰矿中的二氧化锰在“反应”操作中被硫化钡中的 还原,锰元素由 价转化为 价,故 与 溶液反应转化为 的化学方程式是 。
(2) 保持 投料量不变,随 与 投料比增大, 的量达到最大值后无明显变化,而 的量达到最大值后会减小,减小的原因是过量的 消耗了产生的 。
[解析]加入的 的量增大,而 的量减少,是因为 为两性氧化物,能与强碱 反应,从而导致 的量减少。
(3) 滤液Ⅰ可循环使用,应当将其导入到蒸发操作中(填操作单元的名称)。
[解析]滤液Ⅰ中仍含少量的 ,为提高其产率,可将滤液Ⅰ导入前边的“蒸发”操作中。
(4) 净化时需先加入的试剂 为 (填化学式),再使用氨水调溶液的 ,则 的理论最小值为 (当溶液中某离子浓度 时,可认为该离子沉淀完全)。
[解析]由软锰矿中的杂质成分有 可知,“酸解”后溶液中含有 ,结合表中四种氢氧化物的溶度积数据知,为减少 的损失,需将 转化为 ,然后再调节溶液 ,使杂质 转化为 ,故“净化”操作中需加入氧化剂,结合后续操作中的物质转化可知,“净化”操作中加入的试剂 为过氧化氢 溶液。对比表中的溶度积数据可知,相较于 , 的溶度积较大,若要除去 、 两种杂质,以前者的溶度积进行计算,推知调节溶液的 大小,由已知信息可知,沉淀完全的最大金属离子浓度为 ,此时 ,则 , ,此时 。
(5) 碳化过程中发生反应的离子方程式为 。
[解析]由工艺流程图中的“碳化”操作可知,该操作中加入的物质是碳酸氢铵、氨水,而“压滤”操作后的滤液中含 ,由目标产物可知,该反应的生成物中有碳酸锰,故“碳化”过程中发生反应的离子方程式是 。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
