2019-2023年化学高考真题分类练--专题十三 化学反应原理的综合应用(含解析)
文档属性
| 名称 | 2019-2023年化学高考真题分类练--专题十三 化学反应原理的综合应用(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 816.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-17 00:00:00 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2019-2023年化学高考真题分类
专题十三 化学反应原理的综合应用
题组一
1. [2021海南,10分]碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知 , 时:
葡萄糖 完全燃烧生成 和 ,放出 热量。
回答问题:
(1) 时, 与 经光合作用生成葡萄糖 和 的热化学方程式为 。
(2) , 时,气态分子断开 化学键的焓变称为键焓。已知 、 键的键焓分别为 、 , 分子中碳氧键的键焓为 。
(3) 溶于水的 只有部分转化为 ,大部分以水合 的形式存在,水合 可用 表示。已知 时, 的平衡常数 ,正反应的速率可表示为 ,逆反应的速率可表示为 ,则 (用含 的代数式表示)。
(4) 时,潮湿的石膏雕像表面会发生反应: ,其平衡常数 。[已知 ,
(5) 溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因 。
2. [2021全国乙卷,15分]一氯化碘 是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1) 历史上海藻提碘中得到一种红棕色液体,由于性质相似, 误认为是 ,从而错过了一种新元素的发现。该元素是 。
(2) 氯铂酸钡 固体加热时部分分解为 、 和 , 时平衡常数 。在一硬质玻璃烧瓶中加入过量 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在 ,碘蒸气初始压强为 。 平衡时,测得烧瓶中压强为 ,则 ,反应 的平衡常数
(列出计算式即可)。
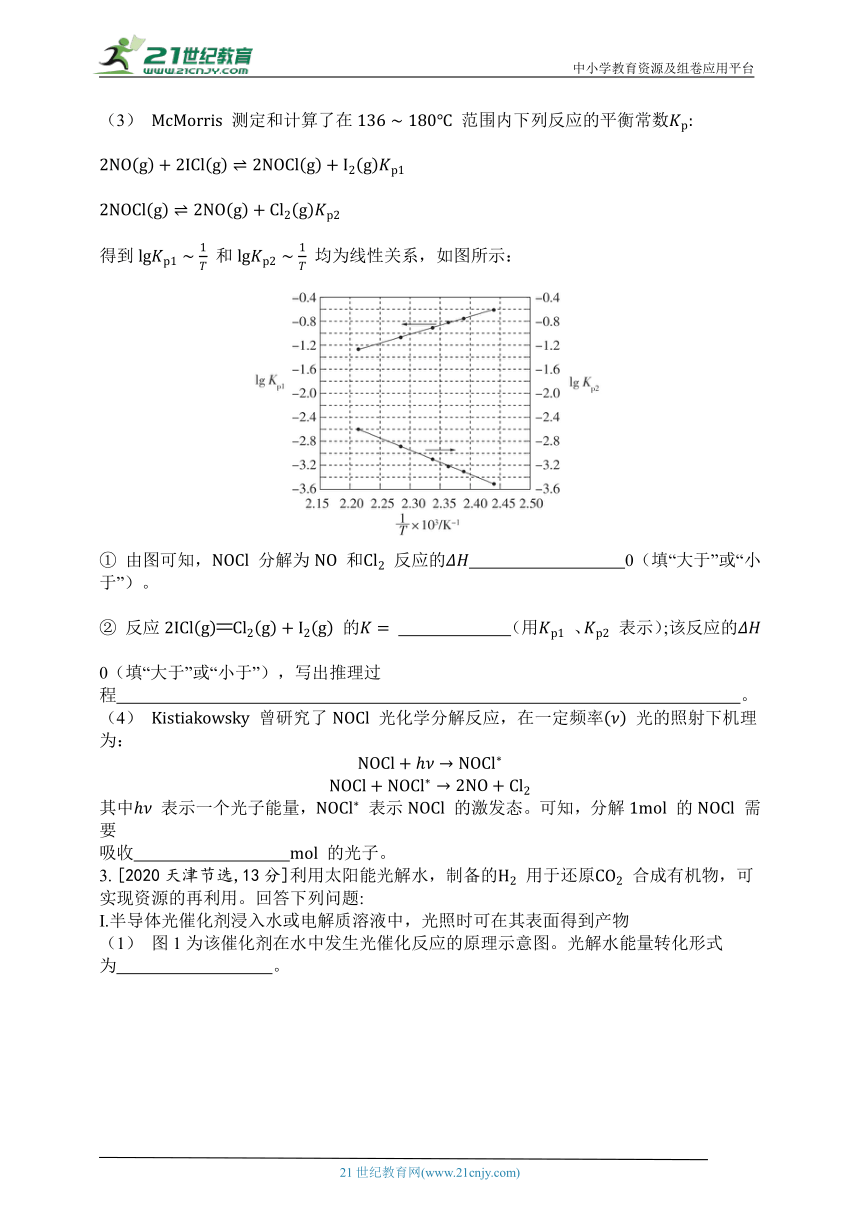
(3) 测定和计算了在 范围内下列反应的平衡常数
得到 和 均为线性关系,如图所示:
① 由图可知, 分解为 和 反应的 0(填“大于”或“小于”)。
② 反应 的 (用 、 表示);该反应的 0(填“大于”或“小于”),写出推理过程 。
(4) 曾研究了 光化学分解反应,在一定频率 光的照射下机理为:
其中 表示一个光子能量, 表示 的激发态。可知,分解 的 需要
吸收 的光子。
3. [2020天津节选,13分]利用太阳能光解水,制备的 用于还原 合成有机物,可实现资源的再利用。回答下列问题:
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
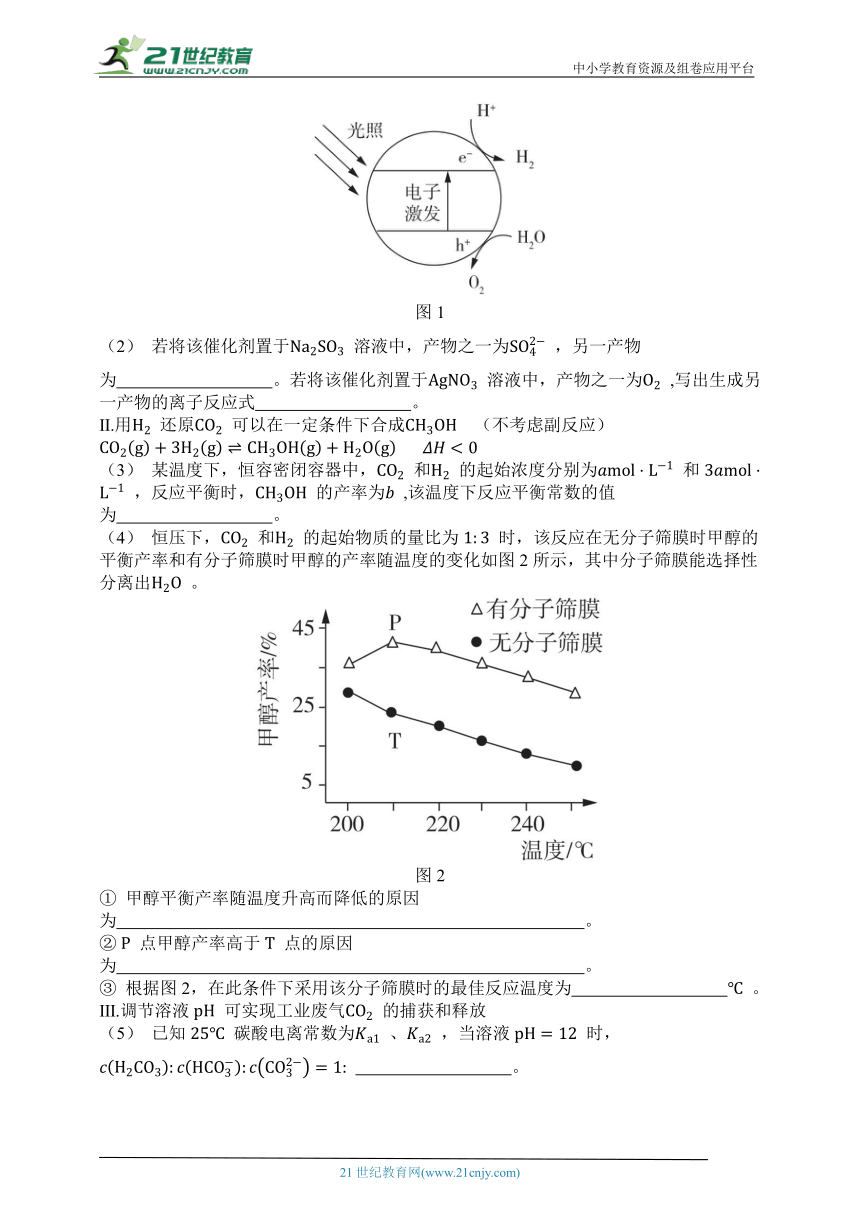
(1) 图1为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为 。
图1
(2) 若将该催化剂置于 溶液中,产物之一为 ,另一产物为 。若将该催化剂置于 溶液中,产物之一为 ,写出生成另一产物的离子反应式 。
Ⅱ.用 还原 可以在一定条件下合成 (不考虑副反应)
(3) 某温度下,恒容密闭容器中, 和 的起始浓度分别为 和 ,反应平衡时, 的产率为 ,该温度下反应平衡常数的值为 。
(4) 恒压下, 和 的起始物质的量比为 时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图2所示,其中分子筛膜能选择性分离出 。
图2
① 甲醇平衡产率随温度升高而降低的原因为 。
② 点甲醇产率高于 点的原因为 。
③ 根据图2,在此条件下采用该分子筛膜时的最佳反应温度为 。
Ⅲ.调节溶液 可实现工业废气 的捕获和释放
(5) 已知 碳酸电离常数为 、 ,当溶液 时, 。
题组二
1. [2022广东,14分]铬及其化合物在催化、金属防腐等方面具有重要应用。
(1) 催化剂 可由 加热分解制备,反应同时生成无污染气体。
① 完成化学方程式: 。
② 催化丙烷脱氢过程中,部分反应历程如图1, 过程的焓变为 (列式表示)。
图1
③ 可用于 的催化氧化。设计从 出发经过3步反应制备 的路
线 (用“ ”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
① 下列有关 溶液的说法正确的有 。
A. 加入少量硫酸,溶液的 不变
B. 加入少量水稀释,溶液中离子总数增加
C. 加入少量 溶液,反应 的平衡逆向移动
D. 加入少量 固体,平衡时 与 的比值保持不变
② 时, 溶液中 随 的变化关系如图2。当 时,设 、 与 的平衡浓度分别为 、 、 ,则 、 、 之间的关系式为 ;计算溶液中 的平衡浓度(写出计算过程,结果保留两位有效数字)。
图2
③ 在稀溶液中,一种物质对光的吸收程度( )与其所吸收光的波长 有关;在一定波长范围内,最大 对应的波长 取决于物质的结构特征;浓度越高, 越大。混合溶液在某一波长的 是各组分吸收程度之和。为研究 对反应 和 平衡的影响,配制浓度相同、 不同的 稀溶液,测得其 随 的变化曲线如图3。波长 、 和 中,与 的 最接近的是 ;溶液 从 变到 的过程中, 的值 (填“增大”“减小”或“不变”)。
图3
2. [2020江苏,14分] 循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1) 催化加氢。在密闭容器中,向含有催化剂的 溶液( 与 溶液反应制得)中通入 生成 ,其离子方程式为 ;其他条件不变, 转化为 的转化率随温度的变化如图1所示。反应温度在 范围内, 催化加氢的转化率迅速上升,其主要原因是 。
(2) 燃料电池。研究 燃料电池性能的装置如图2所示,两电极区间用允许 、 通过的半透膜隔开。
① 电池负极电极反应式为 ;放电过程中需补充的物质A为 (填化学式)。
② 图2所示的 燃料电池放电的本质是通过 与 的反应,将化学能转化为电能,其反应的离子方程式为 。
图2
(3) 催化释氢。在催化剂作用下, 分解生成 和 可能的反应机理如图3所示。
图3
① 催化释氢反应除生成 外,还生成 (填化学式)。
② 研究发现:其他条件不变时,以 溶液代替 催化释氢的效果更佳,其具体优点是 。
题组三
1. [2021湖南,14分]氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ.氨热分解法制氢气
相关化学键的键能数据
化学键
键能 946 436.0 390.8
在一定温度下,利用催化剂将 分解为 和 。回答下列问题:
(1) 反应 ;
(2) 已知该反应的 ,在下列哪些温度下反应能自发进行 (填标号);
A. B. C. D.
(3) 某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将 通入 的密闭容器中进行反应(此时容器内总压为 ),各物质的分压随时间的变化曲线如图所示。
① 若保持容器体积不变, 时反应达到平衡,用 的浓度变化表示 时间内的反应速率 (用含 的代数式表示);
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是 (用图中 、 、 、 表示),理由是 ;
③ 在该温度下,反应的标准平衡常数 (已知:分压 总压×该组分物质的量分数,对于反应 ,其中 , 、 、 、 为各组分的平衡分压)。
方法Ⅱ.氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。
(4) 电解过程中 的移动方向为 (填“从左往右”或“从右往左”);
(5) 阳极的电极反应式为 。
2. [2021浙江1月选考,10分]“氯碱工业”以电解饱和食盐水为基础制取氯气等产品,氯气是实验室和工业上的常用气体。
请回答:
(1) 电解饱和食盐水制取氯气的化学方程式是 。
(2) 下列说法不正确的是 。
A. 可采用碱石灰干燥氯气
B. 可通过排饱和食盐水法收集氯气
C. 常温下,可通过加压使氯气液化而储存于钢瓶中
D. 工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸
(3) 在一定温度下,氯气溶于水的过程及其平衡常数为:
其中 为 的平衡压强, 为 在水溶液中的平衡浓度。
① 的焓变 0。(填“ ”“ ”或“ ”)
② 平衡常数 的表达式为 。
③ 氯气在水中的溶解度(以物质的量浓度表示)为 ,则 。(用平衡压强 和上述平衡常数表示,忽略 的电离)
(4) 工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为 )为原料生产 ,相应的化学方程式为:
Ⅰ
Ⅱ
结合数据说明氯化过程中加碳的理由 。
(5) 在一定温度下,以 为催化剂,氯苯和 在 中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为 ,反应 测得氯苯 转化为邻二氯苯, 转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是 。
A. 适当提高反应温度 B. 改变催化剂
C. 适当降低反应温度 D. 改变反应物浓度
3. [2020全国卷Ⅱ,14分]天然气的主要成分为 ,一般还含有 等烃类,是重要的燃料和化工原料。
(1) 乙烷在一定条件可发生如下反应: ,相关物质的燃烧热数据如表所示:
物质
燃烧热
① 。
② 提高该反应平衡转化率的方法有 。
③ 容器中通入等物质的量的乙烷和氢气,在等压下 发生上述反应,乙烷的平衡转化率为 。反应的平衡常数 (用平衡分压代替平衡浓度计算,分压 总压×物质的量分数)。
(2) 高温下,甲烷生成乙烷的反应如下: 。反应在初期阶段的速率方程为 ,其中 为反应速率常数。
① 设反应开始时的反应速率为 ,甲烷的转化率为 时的反应速率为 ,则 。
② 对于处于初期阶段的该反应,下列说法正确的是 。
A. 增加甲烷浓度, 增大 B. 增加 浓度, 增大
C. 乙烷的生成速率逐渐增大 D. 降低反应温度, 减小
(3) 和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
① 阴极上的反应式为 。
② 若生成的乙烯和乙烷的体积比为 ,则消耗的 和 体积比为 。
专题十三 化学反应原理的综合应用
题组一
1. [2021海南,10分]碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知 , 时:
葡萄糖 完全燃烧生成 和 ,放出 热量。
回答问题:
(1) 时, 与 经光合作用生成葡萄糖 和 的热化学方程式为 。
[解析]由已知①可得 ,则 与 经光合作用生成葡萄糖和氧气的热化学方程式为 。
(2) , 时,气态分子断开 化学键的焓变称为键焓。已知 、 键的键焓分别为 、 , 分子中碳氧键的键焓为 。
[解析]设 中碳氧键的键焓为 ,根据键焓定义,由已知②可得 ,解得 。
(3) 溶于水的 只有部分转化为 ,大部分以水合 的形式存在,水合 可用 表示。已知 时, 的平衡常数 ,正反应的速率可表示为 ,逆反应的速率可表示为 ,则 (用含 的代数式表示)。
[解析]反应达平衡时, ,又反应达平衡时,正、逆反应速率相等,即 ,故 。
(4) 时,潮湿的石膏雕像表面会发生反应: ,其平衡常数 。[已知 ,
[解析]已知 , ,则该反应的 。
(5) 溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因钟乳石的主要成分是 ,游客呼出的 气体可与 发生反应 ,且 使 平衡正向移动, 与 结合又使平衡 正向移动,从而使钟乳石遭到破坏。
2. [2021全国乙卷,15分]一氯化碘 是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1) 历史上海藻提碘中得到一种红棕色液体,由于性质相似, 误认为是 ,从而错过了一种新元素的发现。该元素是溴(或 )。
[解析]根据题给信息“得到一种红棕色液体”,且含有一种新元素,结合卤素的性质,可知所得液体中含有的新元素应为溴(或 )。
(2) 氯铂酸钡 固体加热时部分分解为 、 和 , 时平衡常数 。在一硬质玻璃烧瓶中加入过量 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在 ,碘蒸气初始压强为 。 平衡时,测得烧瓶中压强为 ,则 ,反应 的平衡常数 (列出计算式即可)。
[解析]结合 可得 时 ,则平衡时 。相同温度、相同容积下,气体物质的量之比等于压强之比,设平衡时 减小的压强为 ,根据三段式法得
根据平衡时总压强为 得 ,解得 ,则平衡时 。结合上述分析可知反应 的平衡常数 。
(3) 测定和计算了在 范围内下列反应的平衡常数
得到 和 均为线性关系,如图所示:
① 由图可知, 分解为 和 反应的 大于0(填“大于”或“小于”)。
[解析]结合图像 可知,随着横坐标逐渐增大,即温度逐渐降低, 逐渐减小,即平衡逆向移动,说明该反应的正反应为吸热反应,即 大于0。
② 反应 的 (用 、 表示);该反应的 大于0(填“大于”或“小于”),写出推理过程设 ,即 ,由图可知: ,则 , (2分)。
[解析]结合题中信息可知 、 ,故反应 的平衡常数 。设 ,即 ,据题图可知 ,则 ,即 ,故 ,由此可判断出 为吸热反应,即 大于0。
(4) 曾研究了 光化学分解反应,在一定频率 光的照射下机理为:
其中 表示一个光子能量, 表示 的激发态。可知,分解 的 需要吸收 的光子。
[解析]结合在光的照射下 分解的反应机理可得,总反应为 ,可知分解 时需吸收 光子。
3. [2020天津节选,13分]利用太阳能光解水,制备的 用于还原 合成有机物,可实现资源的再利用。回答下列问题:
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
(1) 图1为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为光能转化为化学能。
图1
[解析]在光照下,水转化为 、 ,故能量转化形式为光能转化为化学能。
(2) 若将该催化剂置于 溶液中,产物之一为 ,另一产物为 。若将该催化剂置于 溶液中,产物之一为 ,写出生成另一产物的离子反应式 。
[解析] 转化为 的过程中,硫元素化合价升高,根据氧化还原反应中化合价有升必有降的规律及反应体系中只有 、 、 、 四种元素,可知另一产物为 。在催化剂存在的条件下, 溶液通过反应生成 ,氧元素的化合价升高,故有单质银生成,相应的离子反应式为 。
Ⅱ.用 还原 可以在一定条件下合成 (不考虑副反应)
(3) 某温度下,恒容密闭容器中, 和 的起始浓度分别为 和 ,反应平衡时, 的产率为 ,该温度下反应平衡常数的值为 。
[解析]列三段式如下:
。
(4) 恒压下, 和 的起始物质的量比为 时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图2所示,其中分子筛膜能选择性分离出 。
图2
① 甲醇平衡产率随温度升高而降低的原因为该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小)。
[解析]该反应是放热反应,温度升高有利于平衡逆向移动,甲醇的平衡产率随温度升高而降低。
② 点甲醇产率高于 点的原因为分子筛膜从反应体系中不断分离出 ,有利于反应正向进行,甲醇产率升高。
[解析] 点对应反应有分子筛膜,分子筛膜能选择性分离出水,有利于反应正向进行,故 点甲醇产率高于 点甲醇产率。
③ 根据图2,在此条件下采用该分子筛膜时的最佳反应温度为210 。
[解析]由图2知,当温度为 时,甲醇的产率最高,因此最佳反应温度为 。
Ⅲ.调节溶液 可实现工业废气 的捕获和释放
(5) 已知 碳酸电离常数为 、 ,当溶液 时, ∶ 。
[解析] , , 时, ,则 , ,进而可得 ,故有 。
题组二
1. [2022广东,14分]铬及其化合物在催化、金属防腐等方面具有重要应用。
(1) 催化剂 可由 加热分解制备,反应同时生成无污染气体。
① 完成化学方程式: 。
[解析]根据化学方程式中反应前后 的化合价降低,且反应生成无污染气体,推出生成的无污染气体为 ,根据 和 得失电子守恒配平反应,确定 、 和 前的化学计量数均为1,再由 、 原子守恒,确定另一产物为 ,且 前的化学计量数为4。
② 催化丙烷脱氢过程中,部分反应历程如图1, 过程的焓变为 (列式表示)。
图1
[解析]从图像看出, 的能量比 的高,则 转化为 的反应为吸热反应,焓变为正值,反应共经历三个过程,均为吸热过程,第一个过程的焓变为 ,第二个过程的焓变为 ,第三个过程的焓变为 ,根据盖斯定律,将三个过程的焓变相加即为 转化为 过程的焓变。
③ 可用于 的催化氧化。设计从 出发经过3步反应制备 的路线 (用“ ”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为 。
[解析]从 出发经过3步反应制备 的路线: 催化氧化生成 , 被氧气氧化生成 , 溶于水生成 。 为无色, 为红棕色。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
① 下列有关 溶液的说法正确的有BD。
A. 加入少量硫酸,溶液的 不变
B. 加入少量水稀释,溶液中离子总数增加
C. 加入少量 溶液,反应 的平衡逆向移动
D. 加入少量 固体,平衡时 与 的比值保持不变
[解析]反应 反应 得 。 项,加入少量硫酸,总反应平衡逆向移动,但根据勒夏特列原理知,平衡移动只能削弱,不能消除,平衡后,溶液中 依然增大,所以溶液的 变小,错误; 项,由总反应知,生成物的离子总数比反应物的多,在加入少量水稀释时,生成物的浓度比反应物的浓度下降得快,所以加入少量水后,平衡正向移动,生成物的离子总数增多,正确; 项,加入少量 溶液,反应 的平衡正向移动,使得 的浓度减小,进而导致反应 的平衡正向移动,错误; 项,反应 的平衡常数可表示为 ,加入少量 固体,不会引起溶液温度的变化,而 仅与温度有关,所以 不变,平衡时 的比值也不变,正确。
② 时, 溶液中 随 的变化关系如图2。当 时,设 、 与 的平衡浓度分别为 、 、 ,则 、 、 之间的关系式为 (2分); 当溶液 时, ,因此可忽略溶液中 ,即 ,反应 的平衡常数 ,联立两个方程式可得 ;计算溶液中 的平衡浓度(写出计算过程,结果保留两位有效数字)。
图2
[解析] 时, 溶液中 原子的总浓度为 ,由 原子守恒知, ,则有 。
③ 在稀溶液中,一种物质对光的吸收程度( )与其所吸收光的波长 有关;在一定波长范围内,最大 对应的波长 取决于物质的结构特征;浓度越高, 越大。混合溶液在某一波长的 是各组分吸收程度之和。为研究 对反应 和 平衡的影响,配制浓度相同、 不同的 稀溶液,测得其 随 的变化曲线如图3。波长 、 和 中,与 的 最接近的是 ;溶液 从 变到 的过程中, 的值增大(填“增大”“减小”或“不变”)。
图3
[解析]根据反应 、 可知,溶液 越大,溶液中 越大,混合溶液在某一波长的 越大,溶液的 越大,溶液中 越大,因此与 的 最接近的是 ; , ,溶液 从 变到 的过程中, 变大, 变小,而 不变,所以 的值增大。
2. [2020江苏,14分] 循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1) 催化加氢。在密闭容器中,向含有催化剂的 溶液( 与 溶液反应制得)中通入 生成 ,其离子方程式为 ;其他条件不变, 转化为 的转化率随温度的变化如图1所示。反应温度在 范围内, 催化加氢的转化率迅速上升,其主要原因是温度升高反应速率增大,温度升高催化剂的活性增强。
[解析] 和 在催化剂的作用下反应生成 ,根据得失电子守恒、原子守恒和电荷守恒可写出反应的离子方程式。温度升高,反应速率增大,同时升高温度催化剂的活性增强, 催化加氢的反应速率增大,相同反应时间内, 催化加氢的转化率迅速上升。
(2) 燃料电池。研究 燃料电池性能的装置如图2所示,两电极区间用允许 、 通过的半透膜隔开。
① 电池负极电极反应式为 (2分);放电过程中需补充的物质A为 (填化学式)。
[解析]负极发生氧化反应,碱性条件下, (其中的碳元素可看作 价)被氧化生成 (其中的碳元素为 价),则负极的电极反应式为 。正极反应中, 被还原为 , 再被 在酸性条件下氧化为 ,因为最终有 生成, 氧化 的过程中要消耗 ,故需要补充的物质 为 。
② 图2所示的 燃料电池放电的本质是通过 与 的反应,将化学能转化为电能,其反应的离子方程式为 或 。
图2
[解析]结合上述分析可知, 与 反应的离子方程式为 或 。
(3) 催化释氢。在催化剂作用下, 分解生成 和 可能的反应机理如图3所示。
图3
① 催化释氢反应除生成 外,还生成(填化学式)。
[解析]根据原子守恒并结合题图3,可知 催化释氢反应除生成 外,还生成 。
② 研究发现:其他条件不变时,以 溶液代替 催化释氢的效果更佳,其具体优点是提高释放氢气的速率,提高释放出氢气的纯度。
[解析]从题图3可以看出, 催化释氢的第一步是转化为 ,故以 溶液代替 催化释氢,可以提高释放氢气的速率,又 催化释氢时,氢元素的来源单一,提高释放出氢气的纯度。
题组三
1. [2021湖南,14分]氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ.氨热分解法制氢气
相关化学键的键能数据
化学键
键能 946 436.0 390.8
在一定温度下,利用催化剂将 分解为 和 。回答下列问题:
(1) 反应 ;
[解析]根据键能与反应热的关系,知 反应物键能之和-生成物键能之和 。
(2) 已知该反应的 ,在下列哪些温度下反应能自发进行 CD(填标号);
A. B. C. D.
[解析]因为反应自发进行,故 , ,即温度高于 ,选 、 。
(3) 某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将 通入 的密闭容器中进行反应(此时容器内总压为 ),各物质的分压随时间的变化曲线如图所示。
① 若保持容器体积不变, 时反应达到平衡,用 的浓度变化表示 时间内的反应速率 (用含 的代数式表示);
[解析]根据 ,由图像可知, 时 , ,设 时气体的总物质的量为 ,则 ,解得 ,则 时 ,故 。
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是 (用图中 、 、 、 表示),理由是 时,快速缩小容器体积为原来的一半,即对反应体系加压,压强增大为原来的2倍, 的分压瞬时增大为原来的2倍,随后反应 平衡逆向移动, 的分压减小,符合该变化趋势的为 线;
[解析] 时,快速缩小容器体积为原来的一半,即将反应体系的压强增大为原来的2倍, 的分压瞬时增大为原来的2倍,随后反应 的平衡逆向移动, 的分压减小,变化趋势的曲线为 线。
③ 在该温度下,反应的标准平衡常数 0.48(已知:分压 总压×该组分物质的量分数,对于反应 ,其中 , 、 、 、 为各组分的平衡分压)。
[解析]根据平衡时总压为 , 、 、 的分压分别是 、 、 ,代入公式得 。
方法Ⅱ.氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。
(4) 电解过程中 的移动方向为从右往左(填“从左往右”或“从右往左”);
[解析]因为左侧电极上 , 失去电子,所以左侧电极为阳极,电解质溶液中的 向阳极移动,移动方向为从右往左。
(5) 阳极的电极反应式为 。
[解析]阳极反应是 ,电解质溶液为 溶液,故阳极的电极反应式为 。
2. [2021浙江1月选考,10分]“氯碱工业”以电解饱和食盐水为基础制取氯气等产品,氯气是实验室和工业上的常用气体。
请回答:
(1) 电解饱和食盐水制取氯气的化学方程式是 。
[解析]电解饱和食盐水得到 、 、 ,由此可写出化学方程式。
(2) 下列说法不正确的是A。
A. 可采用碱石灰干燥氯气
B. 可通过排饱和食盐水法收集氯气
C. 常温下,可通过加压使氯气液化而储存于钢瓶中
D. 工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸
[解析] 可与碱石灰反应, 项错误; 在饱和食盐水中溶解度很小, 项正确;常温下 与铁不反应,可储存于钢瓶中, 项正确。
(3) 在一定温度下,氯气溶于水的过程及其平衡常数为:
其中 为 的平衡压强, 为 在水溶液中的平衡浓度。
① 的焓变 0。(填“ ”“ ”或“ ”)
[解析] 溶于水是熵值减小的过程, 易溶于水, 溶于水具有自发性,熵减不利于过程自发进行,故其溶于水是放热的过程,即 。
② 平衡常数 的表达式为 。
[解析]由平衡常数的定义知, 。
③ 氯气在水中的溶解度(以物质的量浓度表示)为 ,则 。(用平衡压强 和上述平衡常数表示,忽略 的电离)
[解析]设与水反应消耗的 浓度为 ,则反应生成的 , , , , 的溶解度 的平衡浓度 的消耗浓度 。
(4) 工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为 )为原料生产 ,相应的化学方程式为:
Ⅰ
Ⅱ
结合数据说明氯化过程中加碳的理由反应Ⅰ Ⅱ得: , Ⅰ Ⅱ 远大于 Ⅰ,反应Ⅱ使 氯化为 得以实现; Ⅰ Ⅱ ,反应Ⅱ可为反应Ⅰ提供所需的能量。
[解析]加碳可消耗反应Ⅰ中生成的 发生反应Ⅱ,由反应Ⅰ Ⅱ可得到反应 , ,并且反应Ⅱ放热,所以反应Ⅱ的存在使 生成 的反应更易进行。
(5) 在一定温度下,以 为催化剂,氯苯和 在 中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为 ,反应 测得氯苯 转化为邻二氯苯, 转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是AB。
A. 适当提高反应温度 B. 改变催化剂
C. 适当降低反应温度 D. 改变反应物浓度
[解析]从反应 测得氯苯 转化为邻二氯苯, 转化为对二氯苯可知,氯苯生成邻二氯苯的活化能较大,反应速率较慢,受温度的影响较大,因此升高温度可提高产物中邻二氯苯的比例, 项正确、 项错误;催化剂具有选择性,选用有利于生成邻二氯苯的催化剂可提高产物中邻二氯苯的比例, 项正确;改变反应物浓度会影响反应速率,但由“两产物浓度之比与反应时间无关”知改变反应物浓度无法提高产物中邻二氯苯的比例, 项错误。
3. [2020全国卷Ⅱ,14分]天然气的主要成分为 ,一般还含有 等烃类,是重要的燃料和化工原料。
(1) 乙烷在一定条件可发生如下反应: ,相关物质的燃烧热数据如表所示:
物质
燃烧热
① 137 。
[解析]根据题表中数据信息可写出热化学方程式 、 、 ,根据盖斯定律,由 得 。
② 提高该反应平衡转化率的方法有升高温度、减小压强(增大体积)。
[解析]由于该反应为吸热反应、且为气体分子数增大的反应,因此可通过升高温度、减小体系压强等提高该反应的平衡转化率。
③ 容器中通入等物质的量的乙烷和氢气,在等压下 发生上述反应,乙烷的平衡转化率为 。反应的平衡常数 (用平衡分压代替平衡浓度计算,分压 总压×物质的量分数)。
[解析]设起始时 和 的物质的量均为 ,列出三段式:
平衡时 、 和 对应的分压分别为 、 和 ,则该反应的平衡常数 。
(2) 高温下,甲烷生成乙烷的反应如下: 。反应在初期阶段的速率方程为 ,其中 为反应速率常数。
① 设反应开始时的反应速率为 ,甲烷的转化率为 时的反应速率为 ,则 。
[解析]设反应初始时 ,根据初期阶段的速率方程可知 ,题给反应反应前后气体分子数不变,当 的转化率为 时, ,则此时 。
② 对于处于初期阶段的该反应,下列说法正确的是AD。
A. 增加甲烷浓度, 增大 B. 增加 浓度, 增大
C. 乙烷的生成速率逐渐增大 D. 降低反应温度, 减小
[解析]由 可知, 的浓度越大,反应速率 越大, 项正确;增加 浓度, 的浓度减小或不变,则 减小或不变, 项错误;随着反应的进行, 的浓度逐渐减小,则反应速率逐渐减小, 项错误;降低温度,该反应进行非常缓慢甚至停止,即 也随着减小, 项正确。
(3) 和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
① 阴极上的反应式为 。
[解析]结合图示可知 在阴极上发生还原反应生成 ,即阴极上的反应式为 。
② 若生成的乙烯和乙烷的体积比为 ,则消耗的 和 体积比为 。
[解析]设生成 和 的物质的量分别为 和 ,则反应中转移电子的物质的量为 ,根据碳原子守恒,可知反应的 为 ;由 转移 电子,需消耗 ,则反应中消耗 和 的体积比为 。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2019-2023年化学高考真题分类
专题十三 化学反应原理的综合应用
题组一
1. [2021海南,10分]碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知 , 时:
葡萄糖 完全燃烧生成 和 ,放出 热量。
回答问题:
(1) 时, 与 经光合作用生成葡萄糖 和 的热化学方程式为 。
(2) , 时,气态分子断开 化学键的焓变称为键焓。已知 、 键的键焓分别为 、 , 分子中碳氧键的键焓为 。
(3) 溶于水的 只有部分转化为 ,大部分以水合 的形式存在,水合 可用 表示。已知 时, 的平衡常数 ,正反应的速率可表示为 ,逆反应的速率可表示为 ,则 (用含 的代数式表示)。
(4) 时,潮湿的石膏雕像表面会发生反应: ,其平衡常数 。[已知 ,
(5) 溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因 。
2. [2021全国乙卷,15分]一氯化碘 是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1) 历史上海藻提碘中得到一种红棕色液体,由于性质相似, 误认为是 ,从而错过了一种新元素的发现。该元素是 。
(2) 氯铂酸钡 固体加热时部分分解为 、 和 , 时平衡常数 。在一硬质玻璃烧瓶中加入过量 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在 ,碘蒸气初始压强为 。 平衡时,测得烧瓶中压强为 ,则 ,反应 的平衡常数
(列出计算式即可)。
(3) 测定和计算了在 范围内下列反应的平衡常数
得到 和 均为线性关系,如图所示:
① 由图可知, 分解为 和 反应的 0(填“大于”或“小于”)。
② 反应 的 (用 、 表示);该反应的 0(填“大于”或“小于”),写出推理过程 。
(4) 曾研究了 光化学分解反应,在一定频率 光的照射下机理为:
其中 表示一个光子能量, 表示 的激发态。可知,分解 的 需要
吸收 的光子。
3. [2020天津节选,13分]利用太阳能光解水,制备的 用于还原 合成有机物,可实现资源的再利用。回答下列问题:
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
(1) 图1为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为 。
图1
(2) 若将该催化剂置于 溶液中,产物之一为 ,另一产物为 。若将该催化剂置于 溶液中,产物之一为 ,写出生成另一产物的离子反应式 。
Ⅱ.用 还原 可以在一定条件下合成 (不考虑副反应)
(3) 某温度下,恒容密闭容器中, 和 的起始浓度分别为 和 ,反应平衡时, 的产率为 ,该温度下反应平衡常数的值为 。
(4) 恒压下, 和 的起始物质的量比为 时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图2所示,其中分子筛膜能选择性分离出 。
图2
① 甲醇平衡产率随温度升高而降低的原因为 。
② 点甲醇产率高于 点的原因为 。
③ 根据图2,在此条件下采用该分子筛膜时的最佳反应温度为 。
Ⅲ.调节溶液 可实现工业废气 的捕获和释放
(5) 已知 碳酸电离常数为 、 ,当溶液 时, 。
题组二
1. [2022广东,14分]铬及其化合物在催化、金属防腐等方面具有重要应用。
(1) 催化剂 可由 加热分解制备,反应同时生成无污染气体。
① 完成化学方程式: 。
② 催化丙烷脱氢过程中,部分反应历程如图1, 过程的焓变为 (列式表示)。
图1
③ 可用于 的催化氧化。设计从 出发经过3步反应制备 的路
线 (用“ ”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
① 下列有关 溶液的说法正确的有 。
A. 加入少量硫酸,溶液的 不变
B. 加入少量水稀释,溶液中离子总数增加
C. 加入少量 溶液,反应 的平衡逆向移动
D. 加入少量 固体,平衡时 与 的比值保持不变
② 时, 溶液中 随 的变化关系如图2。当 时,设 、 与 的平衡浓度分别为 、 、 ,则 、 、 之间的关系式为 ;计算溶液中 的平衡浓度(写出计算过程,结果保留两位有效数字)。
图2
③ 在稀溶液中,一种物质对光的吸收程度( )与其所吸收光的波长 有关;在一定波长范围内,最大 对应的波长 取决于物质的结构特征;浓度越高, 越大。混合溶液在某一波长的 是各组分吸收程度之和。为研究 对反应 和 平衡的影响,配制浓度相同、 不同的 稀溶液,测得其 随 的变化曲线如图3。波长 、 和 中,与 的 最接近的是 ;溶液 从 变到 的过程中, 的值 (填“增大”“减小”或“不变”)。
图3
2. [2020江苏,14分] 循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1) 催化加氢。在密闭容器中,向含有催化剂的 溶液( 与 溶液反应制得)中通入 生成 ,其离子方程式为 ;其他条件不变, 转化为 的转化率随温度的变化如图1所示。反应温度在 范围内, 催化加氢的转化率迅速上升,其主要原因是 。
(2) 燃料电池。研究 燃料电池性能的装置如图2所示,两电极区间用允许 、 通过的半透膜隔开。
① 电池负极电极反应式为 ;放电过程中需补充的物质A为 (填化学式)。
② 图2所示的 燃料电池放电的本质是通过 与 的反应,将化学能转化为电能,其反应的离子方程式为 。
图2
(3) 催化释氢。在催化剂作用下, 分解生成 和 可能的反应机理如图3所示。
图3
① 催化释氢反应除生成 外,还生成 (填化学式)。
② 研究发现:其他条件不变时,以 溶液代替 催化释氢的效果更佳,其具体优点是 。
题组三
1. [2021湖南,14分]氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ.氨热分解法制氢气
相关化学键的键能数据
化学键
键能 946 436.0 390.8
在一定温度下,利用催化剂将 分解为 和 。回答下列问题:
(1) 反应 ;
(2) 已知该反应的 ,在下列哪些温度下反应能自发进行 (填标号);
A. B. C. D.
(3) 某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将 通入 的密闭容器中进行反应(此时容器内总压为 ),各物质的分压随时间的变化曲线如图所示。
① 若保持容器体积不变, 时反应达到平衡,用 的浓度变化表示 时间内的反应速率 (用含 的代数式表示);
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是 (用图中 、 、 、 表示),理由是 ;
③ 在该温度下,反应的标准平衡常数 (已知:分压 总压×该组分物质的量分数,对于反应 ,其中 , 、 、 、 为各组分的平衡分压)。
方法Ⅱ.氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。
(4) 电解过程中 的移动方向为 (填“从左往右”或“从右往左”);
(5) 阳极的电极反应式为 。
2. [2021浙江1月选考,10分]“氯碱工业”以电解饱和食盐水为基础制取氯气等产品,氯气是实验室和工业上的常用气体。
请回答:
(1) 电解饱和食盐水制取氯气的化学方程式是 。
(2) 下列说法不正确的是 。
A. 可采用碱石灰干燥氯气
B. 可通过排饱和食盐水法收集氯气
C. 常温下,可通过加压使氯气液化而储存于钢瓶中
D. 工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸
(3) 在一定温度下,氯气溶于水的过程及其平衡常数为:
其中 为 的平衡压强, 为 在水溶液中的平衡浓度。
① 的焓变 0。(填“ ”“ ”或“ ”)
② 平衡常数 的表达式为 。
③ 氯气在水中的溶解度(以物质的量浓度表示)为 ,则 。(用平衡压强 和上述平衡常数表示,忽略 的电离)
(4) 工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为 )为原料生产 ,相应的化学方程式为:
Ⅰ
Ⅱ
结合数据说明氯化过程中加碳的理由 。
(5) 在一定温度下,以 为催化剂,氯苯和 在 中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为 ,反应 测得氯苯 转化为邻二氯苯, 转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是 。
A. 适当提高反应温度 B. 改变催化剂
C. 适当降低反应温度 D. 改变反应物浓度
3. [2020全国卷Ⅱ,14分]天然气的主要成分为 ,一般还含有 等烃类,是重要的燃料和化工原料。
(1) 乙烷在一定条件可发生如下反应: ,相关物质的燃烧热数据如表所示:
物质
燃烧热
① 。
② 提高该反应平衡转化率的方法有 。
③ 容器中通入等物质的量的乙烷和氢气,在等压下 发生上述反应,乙烷的平衡转化率为 。反应的平衡常数 (用平衡分压代替平衡浓度计算,分压 总压×物质的量分数)。
(2) 高温下,甲烷生成乙烷的反应如下: 。反应在初期阶段的速率方程为 ,其中 为反应速率常数。
① 设反应开始时的反应速率为 ,甲烷的转化率为 时的反应速率为 ,则 。
② 对于处于初期阶段的该反应,下列说法正确的是 。
A. 增加甲烷浓度, 增大 B. 增加 浓度, 增大
C. 乙烷的生成速率逐渐增大 D. 降低反应温度, 减小
(3) 和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
① 阴极上的反应式为 。
② 若生成的乙烯和乙烷的体积比为 ,则消耗的 和 体积比为 。
专题十三 化学反应原理的综合应用
题组一
1. [2021海南,10分]碳及其化合物间的转化广泛存在于自然界及人类的生产和生活中。已知 , 时:
葡萄糖 完全燃烧生成 和 ,放出 热量。
回答问题:
(1) 时, 与 经光合作用生成葡萄糖 和 的热化学方程式为 。
[解析]由已知①可得 ,则 与 经光合作用生成葡萄糖和氧气的热化学方程式为 。
(2) , 时,气态分子断开 化学键的焓变称为键焓。已知 、 键的键焓分别为 、 , 分子中碳氧键的键焓为 。
[解析]设 中碳氧键的键焓为 ,根据键焓定义,由已知②可得 ,解得 。
(3) 溶于水的 只有部分转化为 ,大部分以水合 的形式存在,水合 可用 表示。已知 时, 的平衡常数 ,正反应的速率可表示为 ,逆反应的速率可表示为 ,则 (用含 的代数式表示)。
[解析]反应达平衡时, ,又反应达平衡时,正、逆反应速率相等,即 ,故 。
(4) 时,潮湿的石膏雕像表面会发生反应: ,其平衡常数 。[已知 ,
[解析]已知 , ,则该反应的 。
(5) 溶洞景区限制参观的游客数量,主要原因之一是游客呼吸产生的气体对钟乳石有破坏作用,从化学平衡的角度说明其原因钟乳石的主要成分是 ,游客呼出的 气体可与 发生反应 ,且 使 平衡正向移动, 与 结合又使平衡 正向移动,从而使钟乳石遭到破坏。
2. [2021全国乙卷,15分]一氯化碘 是一种卤素互化物,具有强氧化性,可与金属直接反应,也可用作有机合成中的碘化剂。回答下列问题:
(1) 历史上海藻提碘中得到一种红棕色液体,由于性质相似, 误认为是 ,从而错过了一种新元素的发现。该元素是溴(或 )。
[解析]根据题给信息“得到一种红棕色液体”,且含有一种新元素,结合卤素的性质,可知所得液体中含有的新元素应为溴(或 )。
(2) 氯铂酸钡 固体加热时部分分解为 、 和 , 时平衡常数 。在一硬质玻璃烧瓶中加入过量 ,抽真空后,通过一支管通入碘蒸气(然后将支管封闭)。在 ,碘蒸气初始压强为 。 平衡时,测得烧瓶中压强为 ,则 ,反应 的平衡常数 (列出计算式即可)。
[解析]结合 可得 时 ,则平衡时 。相同温度、相同容积下,气体物质的量之比等于压强之比,设平衡时 减小的压强为 ,根据三段式法得
根据平衡时总压强为 得 ,解得 ,则平衡时 。结合上述分析可知反应 的平衡常数 。
(3) 测定和计算了在 范围内下列反应的平衡常数
得到 和 均为线性关系,如图所示:
① 由图可知, 分解为 和 反应的 大于0(填“大于”或“小于”)。
[解析]结合图像 可知,随着横坐标逐渐增大,即温度逐渐降低, 逐渐减小,即平衡逆向移动,说明该反应的正反应为吸热反应,即 大于0。
② 反应 的 (用 、 表示);该反应的 大于0(填“大于”或“小于”),写出推理过程设 ,即 ,由图可知: ,则 , (2分)。
[解析]结合题中信息可知 、 ,故反应 的平衡常数 。设 ,即 ,据题图可知 ,则 ,即 ,故 ,由此可判断出 为吸热反应,即 大于0。
(4) 曾研究了 光化学分解反应,在一定频率 光的照射下机理为:
其中 表示一个光子能量, 表示 的激发态。可知,分解 的 需要吸收 的光子。
[解析]结合在光的照射下 分解的反应机理可得,总反应为 ,可知分解 时需吸收 光子。
3. [2020天津节选,13分]利用太阳能光解水,制备的 用于还原 合成有机物,可实现资源的再利用。回答下列问题:
Ⅰ.半导体光催化剂浸入水或电解质溶液中,光照时可在其表面得到产物
(1) 图1为该催化剂在水中发生光催化反应的原理示意图。光解水能量转化形式为光能转化为化学能。
图1
[解析]在光照下,水转化为 、 ,故能量转化形式为光能转化为化学能。
(2) 若将该催化剂置于 溶液中,产物之一为 ,另一产物为 。若将该催化剂置于 溶液中,产物之一为 ,写出生成另一产物的离子反应式 。
[解析] 转化为 的过程中,硫元素化合价升高,根据氧化还原反应中化合价有升必有降的规律及反应体系中只有 、 、 、 四种元素,可知另一产物为 。在催化剂存在的条件下, 溶液通过反应生成 ,氧元素的化合价升高,故有单质银生成,相应的离子反应式为 。
Ⅱ.用 还原 可以在一定条件下合成 (不考虑副反应)
(3) 某温度下,恒容密闭容器中, 和 的起始浓度分别为 和 ,反应平衡时, 的产率为 ,该温度下反应平衡常数的值为 。
[解析]列三段式如下:
。
(4) 恒压下, 和 的起始物质的量比为 时,该反应在无分子筛膜时甲醇的平衡产率和有分子筛膜时甲醇的产率随温度的变化如图2所示,其中分子筛膜能选择性分离出 。
图2
① 甲醇平衡产率随温度升高而降低的原因为该反应为放热反应,温度升高,平衡逆向移动(或平衡常数减小)。
[解析]该反应是放热反应,温度升高有利于平衡逆向移动,甲醇的平衡产率随温度升高而降低。
② 点甲醇产率高于 点的原因为分子筛膜从反应体系中不断分离出 ,有利于反应正向进行,甲醇产率升高。
[解析] 点对应反应有分子筛膜,分子筛膜能选择性分离出水,有利于反应正向进行,故 点甲醇产率高于 点甲醇产率。
③ 根据图2,在此条件下采用该分子筛膜时的最佳反应温度为210 。
[解析]由图2知,当温度为 时,甲醇的产率最高,因此最佳反应温度为 。
Ⅲ.调节溶液 可实现工业废气 的捕获和释放
(5) 已知 碳酸电离常数为 、 ,当溶液 时, ∶ 。
[解析] , , 时, ,则 , ,进而可得 ,故有 。
题组二
1. [2022广东,14分]铬及其化合物在催化、金属防腐等方面具有重要应用。
(1) 催化剂 可由 加热分解制备,反应同时生成无污染气体。
① 完成化学方程式: 。
[解析]根据化学方程式中反应前后 的化合价降低,且反应生成无污染气体,推出生成的无污染气体为 ,根据 和 得失电子守恒配平反应,确定 、 和 前的化学计量数均为1,再由 、 原子守恒,确定另一产物为 ,且 前的化学计量数为4。
② 催化丙烷脱氢过程中,部分反应历程如图1, 过程的焓变为 (列式表示)。
图1
[解析]从图像看出, 的能量比 的高,则 转化为 的反应为吸热反应,焓变为正值,反应共经历三个过程,均为吸热过程,第一个过程的焓变为 ,第二个过程的焓变为 ,第三个过程的焓变为 ,根据盖斯定律,将三个过程的焓变相加即为 转化为 过程的焓变。
③ 可用于 的催化氧化。设计从 出发经过3步反应制备 的路线 (用“ ”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为 。
[解析]从 出发经过3步反应制备 的路线: 催化氧化生成 , 被氧气氧化生成 , 溶于水生成 。 为无色, 为红棕色。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
① 下列有关 溶液的说法正确的有BD。
A. 加入少量硫酸,溶液的 不变
B. 加入少量水稀释,溶液中离子总数增加
C. 加入少量 溶液,反应 的平衡逆向移动
D. 加入少量 固体,平衡时 与 的比值保持不变
[解析]反应 反应 得 。 项,加入少量硫酸,总反应平衡逆向移动,但根据勒夏特列原理知,平衡移动只能削弱,不能消除,平衡后,溶液中 依然增大,所以溶液的 变小,错误; 项,由总反应知,生成物的离子总数比反应物的多,在加入少量水稀释时,生成物的浓度比反应物的浓度下降得快,所以加入少量水后,平衡正向移动,生成物的离子总数增多,正确; 项,加入少量 溶液,反应 的平衡正向移动,使得 的浓度减小,进而导致反应 的平衡正向移动,错误; 项,反应 的平衡常数可表示为 ,加入少量 固体,不会引起溶液温度的变化,而 仅与温度有关,所以 不变,平衡时 的比值也不变,正确。
② 时, 溶液中 随 的变化关系如图2。当 时,设 、 与 的平衡浓度分别为 、 、 ,则 、 、 之间的关系式为 (2分); 当溶液 时, ,因此可忽略溶液中 ,即 ,反应 的平衡常数 ,联立两个方程式可得 ;计算溶液中 的平衡浓度(写出计算过程,结果保留两位有效数字)。
图2
[解析] 时, 溶液中 原子的总浓度为 ,由 原子守恒知, ,则有 。
③ 在稀溶液中,一种物质对光的吸收程度( )与其所吸收光的波长 有关;在一定波长范围内,最大 对应的波长 取决于物质的结构特征;浓度越高, 越大。混合溶液在某一波长的 是各组分吸收程度之和。为研究 对反应 和 平衡的影响,配制浓度相同、 不同的 稀溶液,测得其 随 的变化曲线如图3。波长 、 和 中,与 的 最接近的是 ;溶液 从 变到 的过程中, 的值增大(填“增大”“减小”或“不变”)。
图3
[解析]根据反应 、 可知,溶液 越大,溶液中 越大,混合溶液在某一波长的 越大,溶液的 越大,溶液中 越大,因此与 的 最接近的是 ; , ,溶液 从 变到 的过程中, 变大, 变小,而 不变,所以 的值增大。
2. [2020江苏,14分] 循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1) 催化加氢。在密闭容器中,向含有催化剂的 溶液( 与 溶液反应制得)中通入 生成 ,其离子方程式为 ;其他条件不变, 转化为 的转化率随温度的变化如图1所示。反应温度在 范围内, 催化加氢的转化率迅速上升,其主要原因是温度升高反应速率增大,温度升高催化剂的活性增强。
[解析] 和 在催化剂的作用下反应生成 ,根据得失电子守恒、原子守恒和电荷守恒可写出反应的离子方程式。温度升高,反应速率增大,同时升高温度催化剂的活性增强, 催化加氢的反应速率增大,相同反应时间内, 催化加氢的转化率迅速上升。
(2) 燃料电池。研究 燃料电池性能的装置如图2所示,两电极区间用允许 、 通过的半透膜隔开。
① 电池负极电极反应式为 (2分);放电过程中需补充的物质A为 (填化学式)。
[解析]负极发生氧化反应,碱性条件下, (其中的碳元素可看作 价)被氧化生成 (其中的碳元素为 价),则负极的电极反应式为 。正极反应中, 被还原为 , 再被 在酸性条件下氧化为 ,因为最终有 生成, 氧化 的过程中要消耗 ,故需要补充的物质 为 。
② 图2所示的 燃料电池放电的本质是通过 与 的反应,将化学能转化为电能,其反应的离子方程式为 或 。
图2
[解析]结合上述分析可知, 与 反应的离子方程式为 或 。
(3) 催化释氢。在催化剂作用下, 分解生成 和 可能的反应机理如图3所示。
图3
① 催化释氢反应除生成 外,还生成(填化学式)。
[解析]根据原子守恒并结合题图3,可知 催化释氢反应除生成 外,还生成 。
② 研究发现:其他条件不变时,以 溶液代替 催化释氢的效果更佳,其具体优点是提高释放氢气的速率,提高释放出氢气的纯度。
[解析]从题图3可以看出, 催化释氢的第一步是转化为 ,故以 溶液代替 催化释氢,可以提高释放氢气的速率,又 催化释氢时,氢元素的来源单一,提高释放出氢气的纯度。
题组三
1. [2021湖南,14分]氨气中氢含量高,是一种优良的小分子储氢载体,且安全、易储运,可通过下面两种方法由氨气得到氢气。
方法Ⅰ.氨热分解法制氢气
相关化学键的键能数据
化学键
键能 946 436.0 390.8
在一定温度下,利用催化剂将 分解为 和 。回答下列问题:
(1) 反应 ;
[解析]根据键能与反应热的关系,知 反应物键能之和-生成物键能之和 。
(2) 已知该反应的 ,在下列哪些温度下反应能自发进行 CD(填标号);
A. B. C. D.
[解析]因为反应自发进行,故 , ,即温度高于 ,选 、 。
(3) 某兴趣小组对该反应进行了实验探究。在一定温度和催化剂的条件下,将 通入 的密闭容器中进行反应(此时容器内总压为 ),各物质的分压随时间的变化曲线如图所示。
① 若保持容器体积不变, 时反应达到平衡,用 的浓度变化表示 时间内的反应速率 (用含 的代数式表示);
[解析]根据 ,由图像可知, 时 , ,设 时气体的总物质的量为 ,则 ,解得 ,则 时 ,故 。
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是 (用图中 、 、 、 表示),理由是 时,快速缩小容器体积为原来的一半,即对反应体系加压,压强增大为原来的2倍, 的分压瞬时增大为原来的2倍,随后反应 平衡逆向移动, 的分压减小,符合该变化趋势的为 线;
[解析] 时,快速缩小容器体积为原来的一半,即将反应体系的压强增大为原来的2倍, 的分压瞬时增大为原来的2倍,随后反应 的平衡逆向移动, 的分压减小,变化趋势的曲线为 线。
③ 在该温度下,反应的标准平衡常数 0.48(已知:分压 总压×该组分物质的量分数,对于反应 ,其中 , 、 、 、 为各组分的平衡分压)。
[解析]根据平衡时总压为 , 、 、 的分压分别是 、 、 ,代入公式得 。
方法Ⅱ.氨电解法制氢气
利用电解原理,将氨转化为高纯氢气,其装置如图所示。
(4) 电解过程中 的移动方向为从右往左(填“从左往右”或“从右往左”);
[解析]因为左侧电极上 , 失去电子,所以左侧电极为阳极,电解质溶液中的 向阳极移动,移动方向为从右往左。
(5) 阳极的电极反应式为 。
[解析]阳极反应是 ,电解质溶液为 溶液,故阳极的电极反应式为 。
2. [2021浙江1月选考,10分]“氯碱工业”以电解饱和食盐水为基础制取氯气等产品,氯气是实验室和工业上的常用气体。
请回答:
(1) 电解饱和食盐水制取氯气的化学方程式是 。
[解析]电解饱和食盐水得到 、 、 ,由此可写出化学方程式。
(2) 下列说法不正确的是A。
A. 可采用碱石灰干燥氯气
B. 可通过排饱和食盐水法收集氯气
C. 常温下,可通过加压使氯气液化而储存于钢瓶中
D. 工业上,常用氢气和氯气反应生成的氯化氢溶于水制取盐酸
[解析] 可与碱石灰反应, 项错误; 在饱和食盐水中溶解度很小, 项正确;常温下 与铁不反应,可储存于钢瓶中, 项正确。
(3) 在一定温度下,氯气溶于水的过程及其平衡常数为:
其中 为 的平衡压强, 为 在水溶液中的平衡浓度。
① 的焓变 0。(填“ ”“ ”或“ ”)
[解析] 溶于水是熵值减小的过程, 易溶于水, 溶于水具有自发性,熵减不利于过程自发进行,故其溶于水是放热的过程,即 。
② 平衡常数 的表达式为 。
[解析]由平衡常数的定义知, 。
③ 氯气在水中的溶解度(以物质的量浓度表示)为 ,则 。(用平衡压强 和上述平衡常数表示,忽略 的电离)
[解析]设与水反应消耗的 浓度为 ,则反应生成的 , , , , 的溶解度 的平衡浓度 的消耗浓度 。
(4) 工业上,常采用“加碳氯化”的方法以高钛渣(主要成分为 )为原料生产 ,相应的化学方程式为:
Ⅰ
Ⅱ
结合数据说明氯化过程中加碳的理由反应Ⅰ Ⅱ得: , Ⅰ Ⅱ 远大于 Ⅰ,反应Ⅱ使 氯化为 得以实现; Ⅰ Ⅱ ,反应Ⅱ可为反应Ⅰ提供所需的能量。
[解析]加碳可消耗反应Ⅰ中生成的 发生反应Ⅱ,由反应Ⅰ Ⅱ可得到反应 , ,并且反应Ⅱ放热,所以反应Ⅱ的存在使 生成 的反应更易进行。
(5) 在一定温度下,以 为催化剂,氯苯和 在 中发生平行反应,分别生成邻二氯苯和对二氯苯,两产物浓度之比与反应时间无关。反应物起始浓度均为 ,反应 测得氯苯 转化为邻二氯苯, 转化为对二氯苯。保持其他条件不变,若要提高产物中邻二氯苯的比例,可采用的措施是AB。
A. 适当提高反应温度 B. 改变催化剂
C. 适当降低反应温度 D. 改变反应物浓度
[解析]从反应 测得氯苯 转化为邻二氯苯, 转化为对二氯苯可知,氯苯生成邻二氯苯的活化能较大,反应速率较慢,受温度的影响较大,因此升高温度可提高产物中邻二氯苯的比例, 项正确、 项错误;催化剂具有选择性,选用有利于生成邻二氯苯的催化剂可提高产物中邻二氯苯的比例, 项正确;改变反应物浓度会影响反应速率,但由“两产物浓度之比与反应时间无关”知改变反应物浓度无法提高产物中邻二氯苯的比例, 项错误。
3. [2020全国卷Ⅱ,14分]天然气的主要成分为 ,一般还含有 等烃类,是重要的燃料和化工原料。
(1) 乙烷在一定条件可发生如下反应: ,相关物质的燃烧热数据如表所示:
物质
燃烧热
① 137 。
[解析]根据题表中数据信息可写出热化学方程式 、 、 ,根据盖斯定律,由 得 。
② 提高该反应平衡转化率的方法有升高温度、减小压强(增大体积)。
[解析]由于该反应为吸热反应、且为气体分子数增大的反应,因此可通过升高温度、减小体系压强等提高该反应的平衡转化率。
③ 容器中通入等物质的量的乙烷和氢气,在等压下 发生上述反应,乙烷的平衡转化率为 。反应的平衡常数 (用平衡分压代替平衡浓度计算,分压 总压×物质的量分数)。
[解析]设起始时 和 的物质的量均为 ,列出三段式:
平衡时 、 和 对应的分压分别为 、 和 ,则该反应的平衡常数 。
(2) 高温下,甲烷生成乙烷的反应如下: 。反应在初期阶段的速率方程为 ,其中 为反应速率常数。
① 设反应开始时的反应速率为 ,甲烷的转化率为 时的反应速率为 ,则 。
[解析]设反应初始时 ,根据初期阶段的速率方程可知 ,题给反应反应前后气体分子数不变,当 的转化率为 时, ,则此时 。
② 对于处于初期阶段的该反应,下列说法正确的是AD。
A. 增加甲烷浓度, 增大 B. 增加 浓度, 增大
C. 乙烷的生成速率逐渐增大 D. 降低反应温度, 减小
[解析]由 可知, 的浓度越大,反应速率 越大, 项正确;增加 浓度, 的浓度减小或不变,则 减小或不变, 项错误;随着反应的进行, 的浓度逐渐减小,则反应速率逐渐减小, 项错误;降低温度,该反应进行非常缓慢甚至停止,即 也随着减小, 项正确。
(3) 和 都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
① 阴极上的反应式为 。
[解析]结合图示可知 在阴极上发生还原反应生成 ,即阴极上的反应式为 。
② 若生成的乙烯和乙烷的体积比为 ,则消耗的 和 体积比为 。
[解析]设生成 和 的物质的量分别为 和 ,则反应中转移电子的物质的量为 ,根据碳原子守恒,可知反应的 为 ;由 转移 电子,需消耗 ,则反应中消耗 和 的体积比为 。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
