2019-2023年化学高考真题分类练--专题十一 电解质溶液(含解析)
文档属性
| 名称 | 2019-2023年化学高考真题分类练--专题十一 电解质溶液(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-17 15:42:02 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
2019-2023年化学高考真题分类
专题十一 电解质溶液
题组一
1. [2023湖南,3分]常温下,用浓度为 的 标准溶液滴定浓度均为 的 和 的混合溶液,滴定过程中溶液的 随 的变化曲线如图所示。下列说法错误的是( )
A. 约为
B. 点
C. 点
D. 水的电离程度:
2. [2022北京,3分]2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是( )
A. 醋酸钠是强电解质
B. 醋酸钠晶体与冰都是离子晶体
C. 常温下,醋酸钠溶液的
D. 该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
3. [2022浙江1月选考,2分]已知 时二元酸 的 , 。下列说法正确的是( )
A. 在等浓度的 、 溶液中,水的电离程度前者小于后者
B. 向 的 溶液中通入 气体(忽略溶液体积的变化)至 ,则 的电离度为
C. 向 溶液中加入 溶液至 ,则
D. 取 的 溶液 ,加蒸馏水稀释至 ,则该溶液
4. [2021天津,3分]常温下,下列有关电解质溶液的叙述正确的是( )
A. 在 溶液中
B. 在 溶液中
C. 在 溶液中
D. 氨水和 溶液混合,形成 的溶液中
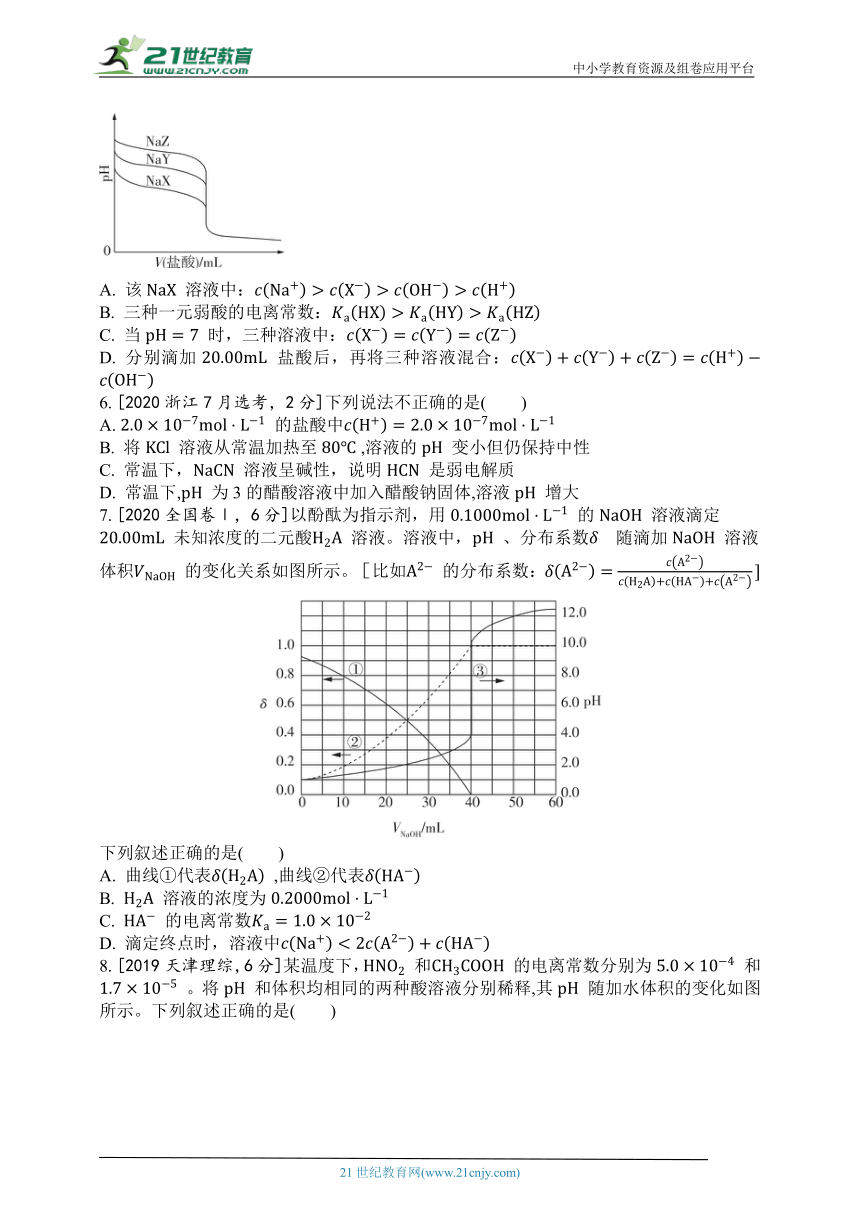
5. [2021湖南,3分]常温下,用 的盐酸分别滴定 浓度均为 的三种一元弱酸的钠盐 、 、 溶液,滴定曲线如图所示。下列判断错误的是( )
A. 该 溶液中:
B. 三种一元弱酸的电离常数:
C. 当 时,三种溶液中:
D. 分别滴加 盐酸后,再将三种溶液混合:
6. [2020浙江7月选考,2分]下列说法不正确的是( )
A. 的盐酸中
B. 将 溶液从常温加热至 ,溶液的 变小但仍保持中性
C. 常温下, 溶液呈碱性,说明 是弱电解质
D. 常温下, 为3的醋酸溶液中加入醋酸钠固体,溶液 增大
7. [2020全国卷Ⅰ,6分]以酚酞为指示剂,用 的 溶液滴定 未知浓度的二元酸 溶液。溶液中, 、分布系数 随滴加 溶液体积 的变化关系如图所示。[比如 的分布系数:
下列叙述正确的是( )
A. 曲线①代表 ,曲线②代表
B. 溶液的浓度为
C. 的电离常数
D. 滴定终点时,溶液中
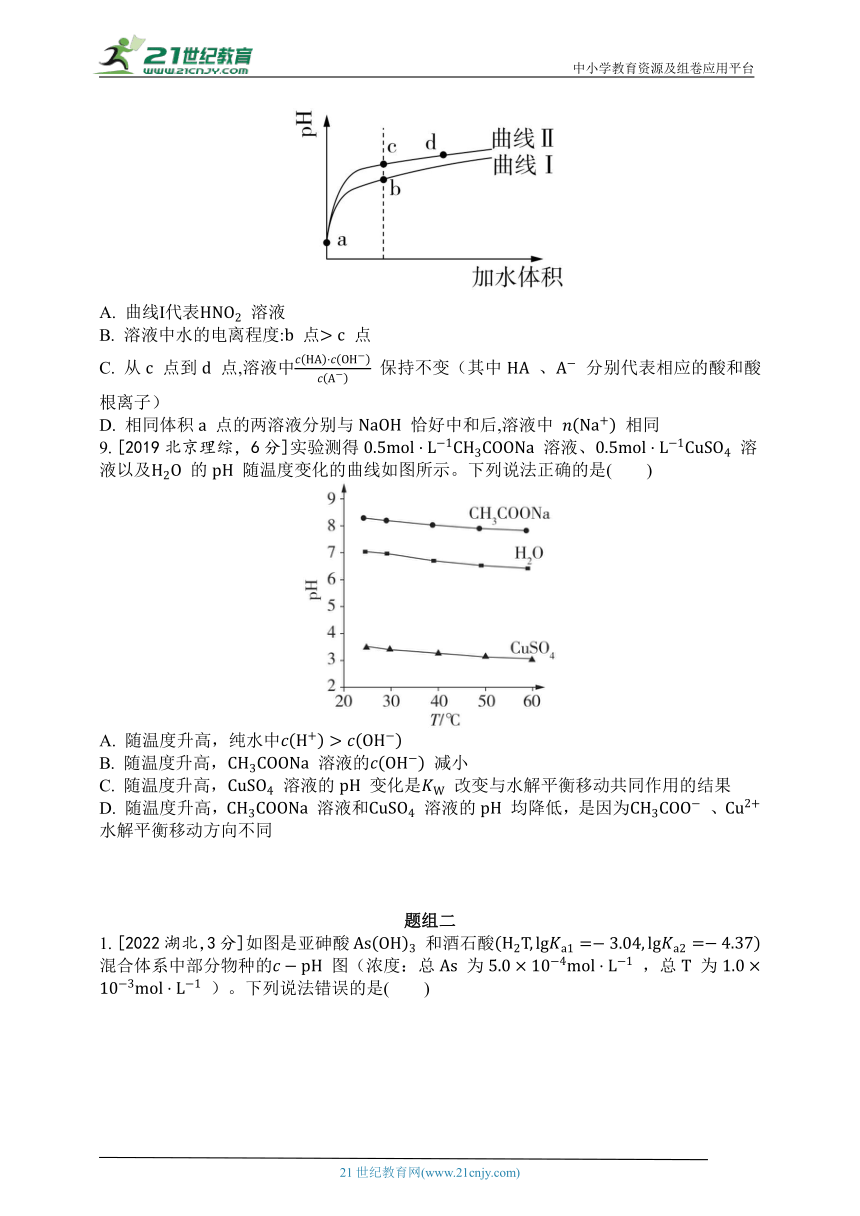
8. [2019天津理综,6分]某温度下, 和 的电离常数分别为 和 。将 和体积均相同的两种酸溶液分别稀释,其 随加水体积的变化如图所示。下列叙述正确的是( )
A. 曲线Ⅰ代表 溶液
B. 溶液中水的电离程度: 点 点
C. 从 点到 点,溶液中 保持不变(其中 、 分别代表相应的酸和酸根离子)
D. 相同体积 点的两溶液分别与 恰好中和后,溶液中 相同
9. [2019北京理综,6分]实验测得 溶液、 溶液以及 的 随温度变化的曲线如图所示。下列说法正确的是( )
A. 随温度升高,纯水中
B. 随温度升高, 溶液的 减小
C. 随温度升高, 溶液的 变化是 改变与水解平衡移动共同作用的结果
D. 随温度升高, 溶液和 溶液的 均降低,是因为 、 水解平衡移动方向不同
题组二
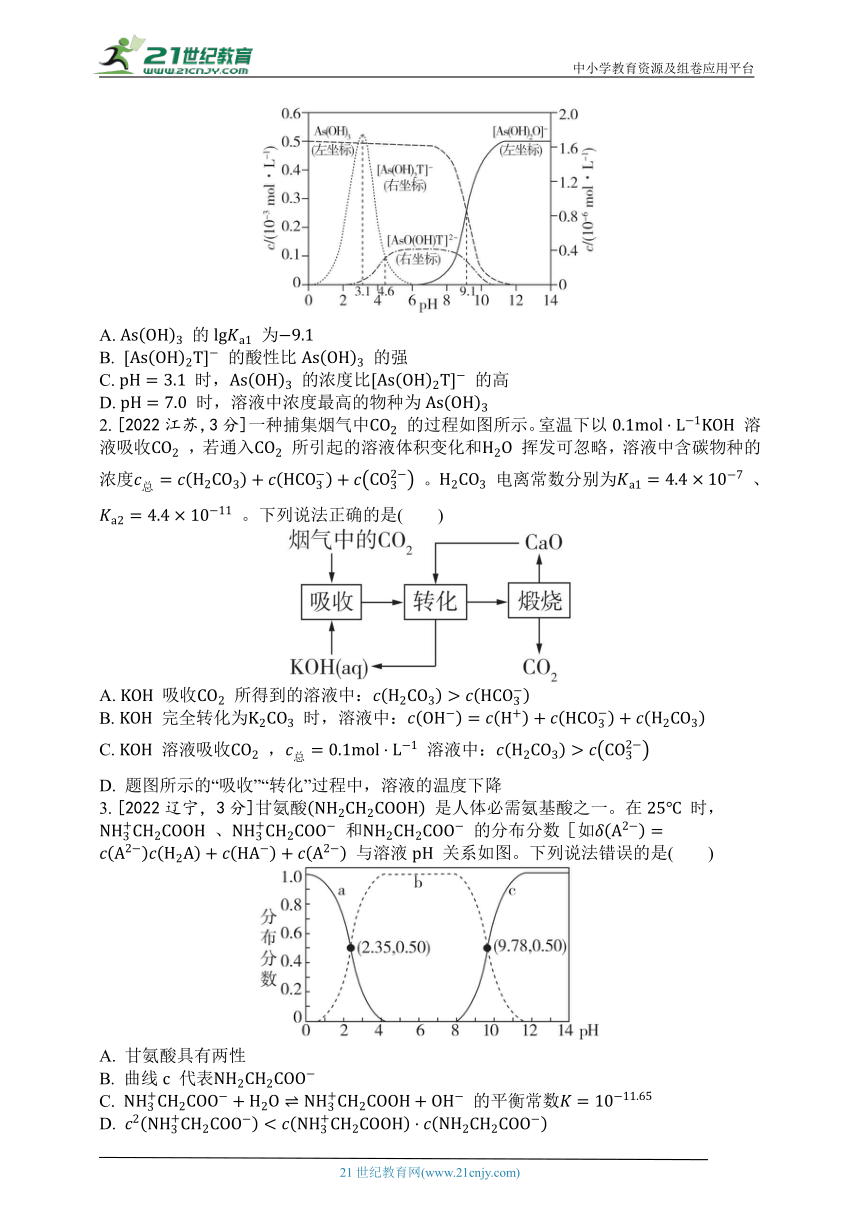
1. [2022湖北,3分]如图是亚砷酸 和酒石酸 混合体系中部分物种的 图(浓度:总 为 ,总 为 )。下列说法错误的是( )
A. 的 为
B. 的酸性比 的强
C. 时, 的浓度比 的高
D. 时,溶液中浓度最高的物种为
2. [2022江苏,3分]一种捕集烟气中 的过程如图所示。室温下以 溶液吸收 ,若通入 所引起的溶液体积变化和 挥发可忽略,溶液中含碳物种的浓度 。 电离常数分别为 、 。下列说法正确的是( )
A. 吸收 所得到的溶液中:
B. 完全转化为 时,溶液中:
C. 溶液吸收 , 溶液中:
D. 题图所示的“吸收”“转化”过程中,溶液的温度下降
3. [2022辽宁,3分]甘氨酸 是人体必需氨基酸之一。在 时, 、 和 的分布分数[如 与溶液 关系如图。下列说法错误的是( )
A. 甘氨酸具有两性
B. 曲线 代表
C. 的平衡常数
D.
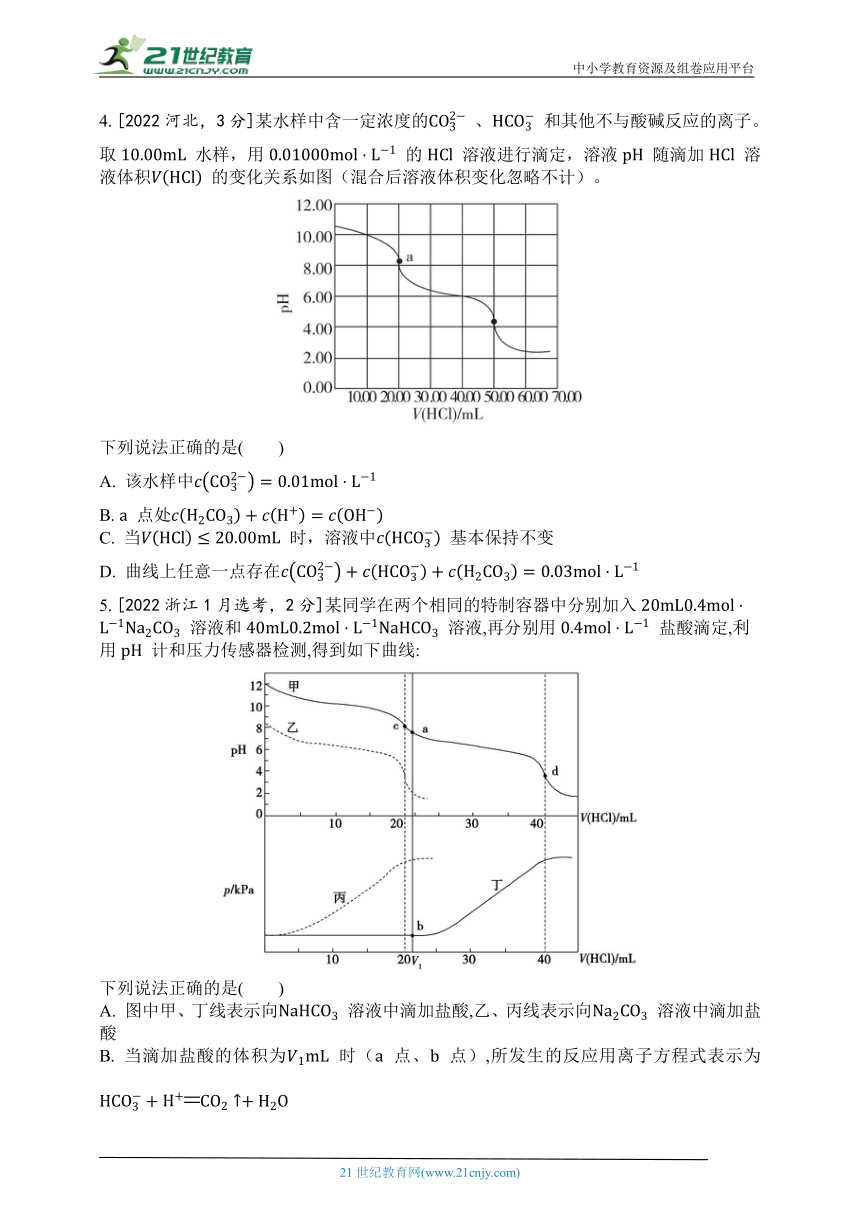
4. [2022河北,3分]某水样中含一定浓度的 、 和其他不与酸碱反应的离子。取 水样,用 的 溶液进行滴定,溶液 随滴加 溶液体积 的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是( )
A. 该水样中
B. 点处
C. 当 时,溶液中 基本保持不变
D. 曲线上任意一点存在
5. [2022浙江1月选考,2分]某同学在两个相同的特制容器中分别加入 溶液和 溶液,再分别用 盐酸滴定,利用 计和压力传感器检测,得到如下曲线:
下列说法正确的是( )
A. 图中甲、丁线表示向 溶液中滴加盐酸,乙、丙线表示向 溶液中滴加盐酸
B. 当滴加盐酸的体积为 时( 点、 点),所发生的反应用离子方程式表示为
C. 根据 图,滴定分析时, 点可用酚酞、 点可用甲基橙作指示剂指示滴定终点
D. 和 溶液中均满足:
6. [2021浙江1月选考,2分]实验测得 溶液、 溶液的 分别随温度与稀释加水量的变化如图所示。已知 时 和 的电离常数均为 。下列说法不正确的是( )
A. 图中实线表示 随加水量的变化,虚线表示 随温度的变化
B. 将 溶液加水稀释至浓度为 ,溶液 变化值小于
C. 随温度升高, 增大, 溶液中 减小, 增大, 减小
D. 时稀释相同倍数的 溶液与 溶液中:
7. [2020浙江7月选考,2分]常温下,用 氨水滴定 浓度均为 的 和 的混合液,下列说法不正确的是( )
A. 在氨水滴定前, 和 的混合液中
B. 当滴入氨水 时,
C. 当滴入氨水 时,
D. 当溶液呈中性时,氨水滴入量大于 ,
题组三
1. [2023浙江1月选考,3分]甲酸 是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分 , 为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始 关系如图(已知甲酸 ),下列说法不正确的是( )
A. 活性成分 在水中存在平衡:
B. 的废水中
C. 废水初始 ,随 下降,甲酸的电离被抑制,与 作用的 数目减少
D. 废水初始 ,离子交换树脂活性成分主要以 形态存在
2. [2022全国乙卷,6分]常温下,一元酸 的 。在某体系中, 与 离子不能穿过隔膜,未电离的 可自由穿过该膜(如图所示)。设溶液中 ,当达到平衡时,下列叙述正确的是( )
A. 溶液Ⅰ中
B. 溶液Ⅱ中 的电离度 为
C. 溶液Ⅰ和Ⅱ中的 不相等
D. 溶液Ⅰ和Ⅱ中的 之比为
3. [2021江苏,3分]室温下,通过下列实验探究 、 溶液的性质。
实验1:用 试纸测量 溶液的 ,测得 约为8
实验2:将 溶液与 溶液等体积混合,产生白色沉淀
实验3:向 溶液中通入 ,溶液 从12下降到约为9
实验4:向 溶液中滴加新制饱和氯水,氯水颜色褪去
下列说法正确的是( )
A. 由实验1可得出:
B. 实验2中两溶液混合时有:
C. 实验3中发生反应的离子方程式为
D. 实验4中
4. [2021福建,4分]如图为某实验测得 溶液在升温过程中(不考虑水挥发)的 变化曲线。
下列说法正确的是( )
A. 点溶液的 比 点溶液的小
B. 点时,
C. 点溶液中,
D. 段, 减小说明升温抑制了 的水解
5. [2021湖北,3分]常温下,已知 溶液中含磷物种的浓度之和为 ,溶液中各含磷物种的 关系如图所示。图中 表示各含磷物种的浓度负对数 , 表示 的浓度负对数 ; 、 、 三点的坐标: , , 。下列说法正确的是( )
A. 曲线①表示 随 的变化
B. 的结构简式为
C. 的溶液中:
D. 的平衡常数
6. [2021辽宁,3分]用 盐酸滴定 溶液,溶液中 、 、 的分布分数 随 变化曲线及滴定曲线如图。下列说法正确的是( )
[如 分布分数:
A. 的 为 B. 点:
C. 第一次突变,可选酚酞作指示剂 D.
7. [2020浙江1月选考,2分]下列说法不正确的是( )
A. 的溶液不一定呈碱性
B. 中和 和体积均相等的氨水、 溶液,所需 的物质的量相同
C. 相同温度下, 相等的盐酸、 溶液中, 相等
D. 氨水和盐酸反应后的溶液,若溶液呈中性,则
8. [2019浙江4月选考,2分]室温下,取 某二元酸 ,滴加 溶液。
已知: , 。下列说法不正确的是( )
A. 溶液中有
B. 当滴加至中性时,溶液中 ,用去 溶液的体积小于
C. 当用去 溶液体积 时,溶液的 ,此时溶液中有
D. 当用去 溶液体积 时,此时溶液中有
题组四
1. [2023全国甲卷,6分]下图为 、 和 在水中达沉淀溶解平衡时的 关系图( ; 可认为 离子沉淀完全)。下列叙述正确的是( )
A. 由 点可求得
B. 时 的溶解度为
C. 浓度均为 的 和 可通过分步沉淀进行分离
D. 、 混合溶液中 时二者不会同时沉淀
2. [2023全国乙卷,6分]一定温度下, 和 的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A. 点条件下能生成 沉淀,也能生成 沉淀
B. 点时, ,
C. 的平衡常数
D. 向 、 均为 的混合溶液中滴加 溶液,先产生 沉淀
3. [2023新课标卷,6分]向 饱和溶液(有足量 固体)中滴加氨水,发生反应 和 。 与 的关系如下图所示(其中 代表 、 、 或 )。
下列说法错误的是( )
A. 曲线Ⅰ可视为 溶解度随 浓度变化曲线
B. 的溶度积常数
C. 反应 的平衡常数 的值为
D. 时,溶液中
4. [2022山东,4分]工业上以 为原料生产 ,对其工艺条件进行研究。现有含 的 、 溶液,含 的 、 溶液。在一定 范围内,四种溶液中 随 的变化关系如图所示。下列说法错误的是( )
A. 反应 的平衡常数
B.
C. 曲线④代表含 的 溶液的变化曲线
D. 对含 且 和 初始浓度均为 的混合溶液, 时才发生沉淀转化
5. [2022湖南,3分]室温时,用 的标准 溶液滴定 浓度相等的 、 和 混合溶液,通过电位滴定法获得 与 的关系曲线如图所示[忽略沉淀对离子的吸附作用。若溶液中离子浓度小于 时,认为该离子沉淀完全。 , , ]。
下列说法正确的是( )
A. 点:有白色沉淀生成
B. 原溶液中 的浓度为
C. 当 沉淀完全时,已经有部分 沉淀
D. 点:
6. [2021全国甲卷,6分]已知相同温度下, 。某温度下,饱和溶液中 、 与 的关系如图所示。
下列说法正确的是( )
A. 曲线①代表 的沉淀溶解曲线
B. 该温度下 的 值为
C. 加适量 固体可使溶液由 点变到 点
D. 时两溶液中
7. [2021全国乙卷,6分] 是一元弱酸,难溶盐 的饱和溶液中 随 而变化, 不发生水解。实验发现, 时 为线性关系,如图中实线所示。
下列叙述错误的是( )
A. 溶液 时,
B. 的溶度积
C. 溶液 时,
D. 的电离常数
8. [2021江苏,3分]室温下,用 溶液浸泡 粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知 , 。下列说法正确的是( )
A. 溶液中存在:
B. 反应 正向进行,需满足
C. 过滤后所得清液中一定存在: 且
D. 滤渣中加入醋酸发生反应的离子方程式:
题组五
一、选择题
1. [2022山东,2分]实验室用基准 配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定 标准溶液。下列说法错误的是( )
A. 可用量筒量取 标准溶液置于锥形瓶中
B. 应选用配带塑料塞的容量瓶配制 标准溶液
C. 应选用烧杯而非称量纸称量 固体
D. 达到滴定终点时溶液显橙色
2. [2022重庆,3分]某小组模拟成垢-除垢过程如下。
水溶液
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A. 经过步骤①,溶液中
B. 经过步骤②,溶液中
C. 经过步骤②,溶液中
D. 经过步骤③,溶液中
3. [2022福建,4分]探究醋酸浓度与电离度 关系的步骤如下,与相关步骤对应的操作或叙述正确的是( )
步骤 操作或叙述
A Ⅰ.用 标准溶液标定醋酸溶液浓度 滴定时应始终注视滴定管中的液面
B Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液 应使用干燥的容量瓶
C Ⅲ.测定步骤Ⅱ中所得溶液的 应在相同温度下测定
D Ⅳ.计算不同浓度溶液中醋酸的电离度 计算式为
4. [2022福建,4分]锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有 、 、 和 杂质离子,可在 范围内调节 对其净化(即相关离子浓度 )。 时, 与 关系如图[碱性过强时 和 会部分溶解]。下列说法正确的是( )
A. 可被净化的 区间最大
B. 加入适量 ,可进一步提升净化程度
C. 净化的先后顺序: 、 、 、
D.
二、非选择题
5. [2022广东,14分]食醋是烹饪美食的调味品,有效成分主要为醋酸(用 表示)。 的应用与其电离平衡密切相关。 时, 的 。
(1) 配制 的 溶液,需 溶液的体积为 。
(2) 下列关于 容量瓶的操作,正确的是( )。
A. B.
C. D.
(3) 某小组研究 下 电离平衡的影响因素。
提出假设 稀释 溶液或改变 浓度, 电离平衡会发生移动。
设计方案并完成实验 用浓度均为 的 和 溶液,按下表配制总体积相同的系列溶液;测定 ,记录数据。
① 根据表中信息,补充数据: , 。
② 由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡 (填“正”或“逆”)向移动;结合表中数据,给出判断理由:
③由实验Ⅱ 可知,增大 浓度, 电离平衡逆向移动。
实验结论 假设成立。
(4) 小组分析上表数据发现:随着 的增加, 的值逐渐接近 的 。
查阅资料获悉:一定条件下,按 配制的溶液中, 的值等于 的 。
对比数据发现,实验 中 与资料数据 存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定 溶液的浓度再验证。
(ⅰ) 移取 溶液,加入2滴酚酞溶液,用 溶液滴定至终点,消耗体积为 ,则该 溶液的浓度为 。画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ) 用上述 溶液和 溶液,配制等物质的量的 与 混合溶液,测定 ,结果与资料数据相符。
(5) 小组进一步提出:如果只有浓度均约为 的 和 溶液,如何准确测定 的 小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ 移取 溶液,用 溶液滴定至终点,消耗 溶液
Ⅱ ,测得溶液的 为4.76
实验总结 得到的结果与资料数据相符,方案可行。
(6) 根据 可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途 。
专题十一 电解质溶液
题组一
1. [2023湖南,3分]常温下,用浓度为 的 标准溶液滴定浓度均为 的 和 的混合溶液,滴定过程中溶液的 随 的变化曲线如图所示。下列说法错误的是( D )
A. 约为
B. 点
C. 点
D. 水的电离程度:
[解析]
根据 ,可近似认为 点 ,又 点 , ,故 , 项正确; 点 恰好被完全中和,由物料守恒可得溶液中 , 项正确; 点溶液 ,即以 的电离为主,即溶液中 , 项正确; 、 两点溶液呈酸性,水的电离均受到抑制,溶液 越小,水的电离受抑制程度越大, 点酸碱恰好完全中和, 水解促进水的电离, 点 过量,又抑制水的电离,故 项错误。
2. [2022北京,3分]2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是( B )
A. 醋酸钠是强电解质
B. 醋酸钠晶体与冰都是离子晶体
C. 常温下,醋酸钠溶液的
D. 该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
[解析]醋酸钠属于盐,溶于水或熔融时完全电离,是强电解质, 项正确;醋酸钠晶体是离子晶体,但冰是分子晶体, 项错误;常温下,醋酸钠溶液由于 水解呈碱性, , 项正确;该溶液中加入少量醋酸钠固体,醋酸钠的溶解平衡向结晶方向移动,析出晶体, 项正确。
3. [2022浙江1月选考,2分]已知 时二元酸 的 , 。下列说法正确的是( B )
A. 在等浓度的 、 溶液中,水的电离程度前者小于后者
B. 向 的 溶液中通入 气体(忽略溶液体积的变化)至 ,则 的电离度为
C. 向 溶液中加入 溶液至 ,则
D. 取 的 溶液 ,加蒸馏水稀释至 ,则该溶液
[解析]盐类的水解促进水的电离, 比 易水解,等浓度的溶液前者水的电离程度更大, 项错误;设 溶液在 时 的电离度是 ,则 ,解得 , 项正确;溶液 时, ,由 ,可得 , , 项错误;因为加水稀释促进 的电离,所以稀释10倍后溶液 变化 , 项错误。
4. [2021天津,3分]常温下,下列有关电解质溶液的叙述正确的是( A )
A. 在 溶液中
B. 在 溶液中
C. 在 溶液中
D. 氨水和 溶液混合,形成 的溶液中
[解析] 是三元弱酸,其各步电离依次变难,电离出的酸根离子浓度依次减小, 项正确;根据电荷守恒, 溶液中 , 项错误;由元素质量守恒知, 溶液中 , 项错误;氨水和 的混合溶液的 ,则 ,由电荷守恒知 ,故 , 项错误。
【解后反思】 掌握三大守恒关系的应用
5. [2021湖南,3分]常温下,用 的盐酸分别滴定 浓度均为 的三种一元弱酸的钠盐 、 、 溶液,滴定曲线如图所示。下列判断错误的是( C )
A. 该 溶液中:
B. 三种一元弱酸的电离常数:
C. 当 时,三种溶液中:
D. 分别滴加 盐酸后,再将三种溶液混合:
[解析] 项, 溶液因 水解显碱性,则 , ,因为水解较微弱,所以有 ,正确。 项,由题图可知,未加盐酸时,等浓度的三种盐溶液的 ,则酸性 ,正确。 项, 时, 、 、 三种溶液中所加盐酸体积依次增大,则溶液中 浓度依次减小, 浓度依次增大,又三种溶液中均有 ,结合电荷守恒知 , , ,故 、 、 浓度依次减小,错误。 项,加入 盐酸后,三种溶液混合后的混合溶液中 ,结合电荷守恒知 ,正确。
6. [2020浙江7月选考,2分]下列说法不正确的是( A )
A. 的盐酸中
B. 将 溶液从常温加热至 ,溶液的 变小但仍保持中性
C. 常温下, 溶液呈碱性,说明 是弱电解质
D. 常温下, 为3的醋酸溶液中加入醋酸钠固体,溶液 增大
[解析]极稀的溶液中, 电离出的 不能忽略,故 大于 , 项错误;水的电离是吸热的,升高温度促进水的电离,氢离子浓度和氢氧根离子浓度均增大, 减小,但氢离子浓度和氢氧根离子浓度仍相等,溶液呈中性, 项正确;常温下, 溶液呈碱性,说明 是强碱弱酸盐, 是弱酸, 项正确;醋酸溶液中加入醋酸钠,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小, 增大, 项正确。
7. [2020全国卷Ⅰ,6分]以酚酞为指示剂,用 的 溶液滴定 未知浓度的二元酸 溶液。溶液中, 、分布系数 随滴加 溶液体积 的变化关系如图所示。[比如 的分布系数:
下列叙述正确的是( C )
A. 曲线①代表 ,曲线②代表
B. 溶液的浓度为
C. 的电离常数
D. 滴定终点时,溶液中
[解析]由题图可知加入 溶液时达到滴定终点,又 为二元酸,则 溶液的浓度为 ,由题图可知,没有加入 溶液时, 溶液的 约为 ,分析可知 第一步完全电离,曲线①代表 ,曲线②代表 , 、 项错误;由题图可知 时溶液 ,即 时溶液 ,则 , 项正确;滴定终点时溶液中存在的离子有 、 、 、 、 ,根据电荷守恒有 ,此时 ,则 , 项错误。
8. [2019天津理综,6分]某温度下, 和 的电离常数分别为 和 。将 和体积均相同的两种酸溶液分别稀释,其 随加水体积的变化如图所示。下列叙述正确的是( C )
A. 曲线Ⅰ代表 溶液
B. 溶液中水的电离程度: 点 点
C. 从 点到 点,溶液中 保持不变(其中 、 分别代表相应的酸和酸根离子)
D. 相同体积 点的两溶液分别与 恰好中和后,溶液中 相同
[解析]根据 和 的电离常数,可知酸性: 。相同 的两种酸溶液,稀释相同倍数时,弱酸的 变化较小,故曲线Ⅰ代表 溶液, 项错误;两种酸溶液中水的电离受到抑制, 点溶液 小于 点溶液 ,则 点对应酸电离出的 大,对水的电离抑制程度大,故水的电离程度: 点 点, 项错误;溶液中 ,从 点到 点, 的电离平衡正向移动,但 、 的值不变,故 不变, 项正确;相同体积 点的两溶液中,由于 ,故 ,因此与 恰好中和后,溶液中 不同, 项错误。
【解后反思】 对于 相同的两种酸溶液:①酸性越弱,其物质的量浓度越大;②稀释相同倍数时,酸性越弱,其对应溶液的 变化越小;③相同体积的两种酸溶液,酸性越弱,中和 的能力越强。
9. [2019北京理综,6分]实验测得 溶液、 溶液以及 的 随温度变化的曲线如图所示。下列说法正确的是( C )
A. 随温度升高,纯水中
B. 随温度升高, 溶液的 减小
C. 随温度升高, 溶液的 变化是 改变与水解平衡移动共同作用的结果
D. 随温度升高, 溶液和 溶液的 均降低,是因为 、 水解平衡移动方向不同
[解析]任何温度时,纯水中 浓度与 浓度始终相等, 项错误;随温度升高, 水解程度增大,溶液中 增大,且温度升高,水的电离程度增大, 也增大, 项错误;温度升高,水的电离程度增大, 增大,又 水解使溶液显酸性,温度升高,水解平衡正向移动,故 增大, 项正确;温度升高,能使电离平衡和水解平衡均向正反应方向移动,而 溶液随温度升高 降低的原因是水的电离程度增大得多,而 溶液随温度升高 降低的原因是 水解程度增大得多, 项错误。
题组二
1. [2022湖北,3分]如图是亚砷酸 和酒石酸 混合体系中部分物种的 图(浓度:总 为 ,总 为 )。下列说法错误的是( D )
A. 的 为
B. 的酸性比 的强
C. 时, 的浓度比 的高
D. 时,溶液中浓度最高的物种为
[解析] 的 ,由题图知, 时, ,则 , 项正确; 的 ,由题图知, 时, ,则 的 ,故 比 的酸性强, 项正确; 时, 的浓度略低于 ,而 的浓度略高于 , 项正确;结合题干和上述分析知,酒石酸的酸性远强于 ,且溶液中总 的浓度小于总 的浓度,所以当 时,溶液中浓度最高的物种不是 , 项错误。
2. [2022江苏,3分]一种捕集烟气中 的过程如图所示。室温下以 溶液吸收 ,若通入 所引起的溶液体积变化和 挥发可忽略,溶液中含碳物种的浓度 。 电离常数分别为 、 。下列说法正确的是( C )
A. 吸收 所得到的溶液中:
B. 完全转化为 时,溶液中:
C. 溶液吸收 , 溶液中:
D. 题图所示的“吸收”“转化”过程中,溶液的温度下降
[解析] 项, 吸收 可能生成 ,此时由于 以第一步水解为主,故溶液中 ,也可能生成 ,由于 的水解很微弱,故此时溶液中 ,还可能生成 和 的混合物,同理,溶液中亦存在 ,错误; 项, 溶液中存在质子守恒 ,错误; 项,由于 溶液的浓度为 , ,即 ,此等式为 溶液的元素质量守恒式,故此时所得溶液为 溶液, 存在水解平衡 ,电离平衡 ,由 可知, 的水解程度大于电离程度,故 ,正确; 项,“吸收”时发生的反应和“转化”时发生的反应均为放热反应,故溶液的温度升高,错误。
3. [2022辽宁,3分]甘氨酸 是人体必需氨基酸之一。在 时, 、 和 的分布分数[如 与溶液 关系如图。下列说法错误的是( D )
A. 甘氨酸具有两性
B. 曲线 代表
C. 的平衡常数
D.
[解析]甘氨酸在溶液中存在平衡 、 , 减小,①平衡正向移动, 浓度增大,故曲线 代表 ,同理,曲线 代表 ,则曲线 代表 。由图中点 可知, ,同理,由点 可知, 。
甘氨酸中含有氨基和羧基,具有两性, 项正确;由上述分析可知, 项正确, 项正确; ,故 , 项错误。
【解后反思】 对于物种分布分数图像,一般选择“交点”处不同微粒的等浓度关系,代入电离常数公式计算各级电离常数。
4. [2022河北,3分]某水样中含一定浓度的 、 和其他不与酸碱反应的离子。取 水样,用 的 溶液进行滴定,溶液 随滴加 溶液体积 的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是( C )
A. 该水样中
B. 点处
C. 当 时,溶液中 基本保持不变
D. 曲线上任意一点存在
[解析]
由以上分析知, 项错误;根据水样中所含离子种类及图像分析可知, 点处能水解的离子主要为 ,根据质子守恒可得 , 项错误;水样中 , 时,随着 溶液的加入, 被稀释,但由于发生反应 ,又有 生成, 点时 仍为 , 项正确;根据图像分析及碳元素守恒可知,起始时水样中 ,但随着 溶液的加入,溶液被稀释,该值减小, 项错误。
5. [2022浙江1月选考,2分]某同学在两个相同的特制容器中分别加入 溶液和 溶液,再分别用 盐酸滴定,利用 计和压力传感器检测,得到如下曲线:
下列说法正确的是( C )
A. 图中甲、丁线表示向 溶液中滴加盐酸,乙、丙线表示向 溶液中滴加盐酸
B. 当滴加盐酸的体积为 时( 点、 点),所发生的反应用离子方程式表示为
C. 根据 图,滴定分析时, 点可用酚酞、 点可用甲基橙作指示剂指示滴定终点
D. 和 溶液中均满足:
[解析]因为 比 的水解程度大,且 溶液浓度比 溶液大,故 溶液的初始 较大,甲线表示向 溶液中滴加盐酸,向 溶液中滴加盐酸时, ,开始加入盐酸时没有 产生,故丁线表示向 溶液中滴加盐酸, 项错误;从图像可以看出, 点尚未放出 ,此时反应的离子方程式是 , 项错误;图像显示 点 在 ,则可以用酚酞作指示剂, 点 在 ,则可以用甲基橙作指示剂, 项正确;根据质子守恒, 溶液 , 项错误。
6. [2021浙江1月选考,2分]实验测得 溶液、 溶液的 分别随温度与稀释加水量的变化如图所示。已知 时 和 的电离常数均为 。下列说法不正确的是( C )
A. 图中实线表示 随加水量的变化,虚线表示 随温度的变化
B. 将 溶液加水稀释至浓度为 ,溶液 变化值小于
C. 随温度升高, 增大, 溶液中 减小, 增大, 减小
D. 时稀释相同倍数的 溶液与 溶液中:
[解析]加水稀释促进盐类的水解,但 或 浓度减小,根据图像,可以得出图中实线表示 随加水量的变化,虚线表示 随温度的变化, 正确;氯化铵溶液加水稀释至浓度为 ,即稀释了 倍,但加水稀释促进盐类水解,溶液 的变化值小于 , 正确;温度升高,水的离子积增大,促进醋酸钠水解,溶液中的 增大, 不正确;稀释相同的倍数,因为 时, 和 的电离常数相同,所以 和 的水解程度相同,所以有 , 正确。
7. [2020浙江7月选考,2分]常温下,用 氨水滴定 浓度均为 的 和 的混合液,下列说法不正确的是( D )
A. 在氨水滴定前, 和 的混合液中
B. 当滴入氨水 时,
C. 当滴入氨水 时,
D. 当溶液呈中性时,氨水滴入量大于 ,
[解析] 是强电解质,完全电离,醋酸是弱电解质,部分电离,浓度相同的 和 的混合液中 , 项正确;当滴入氨水 时,加入的氨水的体积、浓度和初始醋酸溶液的体积、浓度均相等,由元素质量守恒可知, , 项正确;当滴入氨水 时,溶液中溶质为 和 ,根据电荷守恒式 ,元素质量守恒式 ,可得 , 项正确;恰好反应时,生成等物质的量的氯化铵和醋酸铵,此时溶液呈酸性,若溶液呈中性,则氨水滴入量大于 ,根据电荷守恒式 及 可知, , 项错误。
题组三
1. [2023浙江1月选考,3分]甲酸 是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分 , 为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始 关系如图(已知甲酸 ),下列说法不正确的是( D )
A. 活性成分 在水中存在平衡:
B. 的废水中
C. 废水初始 ,随 下降,甲酸的电离被抑制,与 作用的 数目减少
D. 废水初始 ,离子交换树脂活性成分主要以 形态存在
[解析]活性成分 中 能与水电离出的 形成配位键,因此在水中存在平衡: , 项正确; 的废水中, ,根据甲酸 ,得 , 项正确;废水初始 ,随 下降, 增大,电离平衡 逆向移动,甲酸的电离被抑制, 减小,与 作用的 数目减少, 项正确;废水初始 时回收率小于 ,说明吸附在树脂上的甲酸根较少,活性成分主要以 形态存在, 项错误。
2. [2022全国乙卷,6分]常温下,一元酸 的 。在某体系中, 与 离子不能穿过隔膜,未电离的 可自由穿过该膜(如图所示)。设溶液中 ,当达到平衡时,下列叙述正确的是( B )
A. 溶液Ⅰ中
B. 溶液Ⅱ中 的电离度 为
C. 溶液Ⅰ和Ⅱ中的 不相等
D. 溶液Ⅰ和Ⅱ中的 之比为
[解析] ,溶液Ⅰ呈中性, ,若 ,则 ,明显不符合实际情况, 项错误;溶液Ⅱ中, , 项正确; 可以自由通过隔膜,溶液Ⅰ、Ⅱ中 应相等, 项错误;溶液Ⅰ、Ⅱ中 相等,由 ,可得 Ⅰ Ⅰ Ⅱ Ⅱ ,则 ,溶液Ⅰ中, , ,同理溶液Ⅱ中, ,故 , 项错误。
3. [2021江苏,3分]室温下,通过下列实验探究 、 溶液的性质。
实验1:用 试纸测量 溶液的 ,测得 约为8
实验2:将 溶液与 溶液等体积混合,产生白色沉淀
实验3:向 溶液中通入 ,溶液 从12下降到约为9
实验4:向 溶液中滴加新制饱和氯水,氯水颜色褪去
下列说法正确的是( C )
A. 由实验1可得出:
B. 实验2中两溶液混合时有:
C. 实验3中发生反应的离子方程式为
D. 实验4中
[解析] 项, 溶液的 约为8,说明 的水解程度大于电离程度,即 ,错误; 项,实验2中产生白色沉淀,则 ,错误; 项,实验3中 与 反应生成 ,溶液的碱性减弱,发生反应的离子方程式为 ,正确; 项,饱和氯水中存在: ,实验4中向 溶液中滴加饱和氯水, 与 发生反应,促进 溶于水,氯水的黄绿色逐渐褪去, 减小,错误。
4. [2021福建,4分]如图为某实验测得 溶液在升温过程中(不考虑水挥发)的 变化曲线。
下列说法正确的是( A )
A. 点溶液的 比 点溶液的小
B. 点时,
C. 点溶液中,
D. 段, 减小说明升温抑制了 的水解
[解析] 溶液呈碱性,说明 的水解程度大于电离程度,升高温度, 的水解程度增大, 增大,故 点溶液的 比 点溶液的小, 项正确; 点溶液呈碱性,说明 的水解程度大于电离程度,即 ,则 , 项错误; 点溶液呈碱性, ,根据电荷守恒: ,知 , 项错误; 段,温度升高,促进 水解, 增大,而 减小是因为升高温度,促进水的电离, 也增大,且 增大的程度比 大, 项错误。
5. [2021湖北,3分]常温下,已知 溶液中含磷物种的浓度之和为 ,溶液中各含磷物种的 关系如图所示。图中 表示各含磷物种的浓度负对数 , 表示 的浓度负对数 ; 、 、 三点的坐标: , , 。下列说法正确的是( D )
A. 曲线①表示 随 的变化
B. 的结构简式为
C. 的溶液中:
D. 的平衡常数
[解析]图像中含 物质只有3种,说明 为二元弱酸。随着 逐渐增大, 减小,根据 、 ,知 逐渐减小, 先增大后减小, 逐渐增大, ,则 逐渐增大, 先减小后增大, 逐渐减小,故曲线③表示 ,曲线②表示 ,曲线①表示 , 项错误。 为二元弱酸,其结构简式为, 项错误。 即 ,由题图可知,此时, ,即 ,而 ,故 , 项错误。 点时, , ,则 的 , 点时, , ,则 的 ;反应 ,反应 ,由反应①-反应②可得 ,则平衡常数 , 项正确。
6. [2021辽宁,3分]用 盐酸滴定 溶液,溶液中 、 、 的分布分数 随 变化曲线及滴定曲线如图。下列说法正确的是( C )
[如 分布分数:
A. 的 为 B. 点:
C. 第一次突变,可选酚酞作指示剂 D.
[解析]
未滴入盐酸时,溶液中 最大,随着盐酸的滴入, 浓度逐渐增大,当加入 盐酸时 达到最大,继续滴入盐酸,溶液中 浓度开始减小,而 逐渐增大,故图中①表示 ,②表示 ,③表示 。 点对应的 ,则 的 , 项错误; 点时 , 项错误;根据题图可知,第一次突跃溶液呈碱性,所以可选用酚酞作指示剂, 项正确;加入 盐酸时, 恰好全部转化为 ,根据 和 溶液的体积为 ,可计算出 , 项错误。
【易错警示】 本题是酸滴定盐,溶液最初显碱性,曲线①表示 ,切勿从原点开始分析,误认为曲线③表示 。
7. [2020浙江1月选考,2分]下列说法不正确的是( B )
A. 的溶液不一定呈碱性
B. 中和 和体积均相等的氨水、 溶液,所需 的物质的量相同
C. 相同温度下, 相等的盐酸、 溶液中, 相等
D. 氨水和盐酸反应后的溶液,若溶液呈中性,则
[解析]没有给出温度, 的溶液不一定呈碱性, 正确; 相同的氨水和氢氧化钠溶液,氨水的物质的量浓度大,所以中和 和体积均相等的氨水、氢氧化钠溶液,氨水消耗 的物质的量多, 错误;相同温度下,盐酸和醋酸溶液中 相等时,因为水的离子积常数相等,所以两溶液中的 也相等, 正确;混合后溶液中的电荷守恒式为 ,溶液呈中性,即 ,所以 , 正确。
8. [2019浙江4月选考,2分]室温下,取 某二元酸 ,滴加 溶液。
已知: , 。下列说法不正确的是( B )
A. 溶液中有
B. 当滴加至中性时,溶液中 ,用去 溶液的体积小于
C. 当用去 溶液体积 时,溶液的 ,此时溶液中有
D. 当用去 溶液体积 时,此时溶液中有
[解析]对于 溶液而言,根据电荷守恒可知 ,根据元素质量守恒可知 ,又 第一步完全电离,故 ,将 代入 可得 ,故 , 项正确;当溶液呈中性时 ,由电荷守恒可得 ,若用去的 溶液体积为 ,此时溶液的溶质为 ,由于 只电离,不水解,故此时溶液呈酸性,要使溶液呈中性,则 溶液的体积必须大于 , 项错误;当用去 溶液体积 时,溶液呈酸性, ,由 , ,根据质子守恒得 ,故 , 项正确;当用去 溶液体积 时,根据元素质量守恒可知 , 项正确。
题组四
1. [2023全国甲卷,6分]下图为 、 和 在水中达沉淀溶解平衡时的 关系图( ; 可认为 离子沉淀完全)。下列叙述正确的是( C )
A. 由 点可求得
B. 时 的溶解度为
C. 浓度均为 的 和 可通过分步沉淀进行分离
D. 、 混合溶液中 时二者不会同时沉淀
[解析] 点 、 ,则 , 错误; 时 对应的 ,即 ,故 的溶解度为 , 错误;由图可知, 时的 小于 时的 ,则可通过调 分步沉淀浓度均为 的 和 , 正确;由题图可知, 沉淀完全时, , ,此时 ,此时 刚开始沉淀,浓度约为 ,而题中 ,则 、 会同时沉淀, 错误。
2. [2023全国乙卷,6分]一定温度下, 和 的沉淀溶解平衡曲线如图所示。
下列说法正确的是( C )
A. 点条件下能生成 沉淀,也能生成 沉淀
B. 点时, ,
C. 的平衡常数
D. 向 、 均为 的混合溶液中滴加 溶液,先产生 沉淀
[解析]
结合上述分析可知, 、 错误;该反应的平衡常数 , 正确;该混合溶液中形成 沉淀所需的 ,形成 沉淀所需的 ,形成 所需的 较小,所以先产生 沉淀, 错误。
3. [2023新课标卷,6分]向 饱和溶液(有足量 固体)中滴加氨水,发生反应 和 。 与 的关系如下图所示(其中 代表 、 、 或 )。
下列说法错误的是( A )
A. 曲线Ⅰ可视为 溶解度随 浓度变化曲线
B. 的溶度积常数
C. 反应 的平衡常数 的值为
D. 时,溶液中
[解析] 饱和溶液中存在 ,当滴入的氨水非常少时,可以认为 浓度和 浓度相等,随着氨水的滴入, 浓度减小, 的沉淀溶解平衡正向移动, 浓度增大, 的溶解度也增大,故曲线Ⅲ表示 ,曲线Ⅳ表示 ,曲线Ⅳ也可视为 的溶解度随 浓度的变化曲线, 错误; 的溶度积常数 仅与温度有关,由图可知,当 时, , ,则 ,B正确;随着氨水的滴入, 先转化为 , 再转化为 ,所以开始时, 浓度比 浓度小,则曲线Ⅰ表示 ,曲线Ⅱ表示 ,反应 的平衡常数 , 正确;结合上述分析及题图知,当 时,溶液中 , 正确。
4. [2022山东,4分]工业上以 为原料生产 ,对其工艺条件进行研究。现有含 的 、 溶液,含 的 、 溶液。在一定 范围内,四种溶液中 随 的变化关系如图所示。下列说法错误的是( D )
A. 反应 的平衡常数
B.
C. 曲线④代表含 的 溶液的变化曲线
D. 对含 且 和 初始浓度均为 的混合溶液, 时才发生沉淀转化
[解析]含 的 溶液中存在 ,改变溶液 对 溶解平衡无影响, 越大, 越小,故①代表含 的 溶液,②代表含 的 溶液;含 的 溶液中存在 、 ,减小 , 水解平衡正向移动,促使 溶解平衡正向移动, 增大, 相同时, 越大, 越小,故③代表含 的 溶液,④代表含 的 溶液。该反应的平衡常数 , 项正确;由 可知, ,②为含 的 溶液,则 , , 项正确;由上述分析可知, 项正确;由以上分析可知,该溶液中 ,根据图示知, 时即可发生沉淀的转化, 项错误。
5. [2022湖南,3分]室温时,用 的标准 溶液滴定 浓度相等的 、 和 混合溶液,通过电位滴定法获得 与 的关系曲线如图所示[忽略沉淀对离子的吸附作用。若溶液中离子浓度小于 时,认为该离子沉淀完全。 , , ]。
下列说法正确的是( C )
A. 点:有白色沉淀生成
B. 原溶液中 的浓度为
C. 当 沉淀完全时,已经有部分 沉淀
D. 点:
[解析]三种卤化银组成形式相同, 小的物质先形成沉淀,故 点时形成的是黄色的 沉淀, 项错误;由题图知,当消耗 溶液时,溶液中 、 、 均沉淀完全,由于三种卤素离子浓度相同,故每种离子完全沉淀时均消耗 溶液,则 ,解得 , 项错误;当 恰好沉淀完全时,溶液体积为 ,溶液中 ,此时 ,故此时有部分 形成了沉淀, 项正确; 点时溶液中 、 、 均沉淀完全, 过量, 最大, 项错误。
6. [2021全国甲卷,6分]已知相同温度下, 。某温度下,饱和溶液中 、 与 的关系如图所示。
下列说法正确的是( B )
A. 曲线①代表 的沉淀溶解曲线
B. 该温度下 的 值为
C. 加适量 固体可使溶液由 点变到 点
D. 时两溶液中
[解析]当横坐标均为5.1时,即 时,阴离子浓度 点 点, 、 两点均在沉淀溶解平衡曲线上,即溶度积常数 点 点,根据相同温度下, 知,曲线①代表 的沉淀溶解曲线,曲线②代表 的沉淀溶解曲线, 项错误;根据曲线①过横纵坐标均为5.0的点可知,溶解平衡体系中 ,则该温度下 , 项正确;加适量 固体,溶液中 增大,由于温度保持不变,即溶液中 减小,可使溶液由 点向 点移动, 项错误;当 时, 点平衡时 , 点平衡时 ,即两溶液中 , 项错误。
【解后反思】 曲线上任意一点都达到沉淀溶解平衡状态 。温度不变时, 不变,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。曲线上方区域的点所示溶液均为过饱和溶液, 。曲线下方区域的点所示溶液均为不饱和溶液, 。
7. [2021全国乙卷,6分] 是一元弱酸,难溶盐 的饱和溶液中 随 而变化, 不发生水解。实验发现, 时 为线性关系,如图中实线所示。
下列叙述错误的是( C )
A. 溶液 时,
B. 的溶度积
C. 溶液 时,
D. 的电离常数
[解析]溶液 时 ,由题图知,此时 , , 项正确;由题图知,当 时,可看作溶液中有较大浓度的 ,此时 的水解极大地被抑制,溶液中 ,则 , 项正确; 的饱和溶液因 水解而显碱性,只有加入一定量的酸才能使溶液显中性,若加入的酸不是 ,则溶液中除含有 、 、 、 四种离子外还含有其他阴离子,由电荷守恒原理知, 项错误;溶液中 ,根据 , 知,溶液中 ,两式联立可得 ,化简可得 , ,由题图知, 时, ,将数据代入计算得 , 项正确。
8. [2021江苏,3分]室温下,用 溶液浸泡 粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知 , 。下列说法正确的是( C )
A. 溶液中存在:
B. 反应 正向进行,需满足
C. 过滤后所得清液中一定存在: 且
D. 滤渣中加入醋酸发生反应的离子方程式:
[解析] 项, 溶液中的质子守恒式为 ,错误; 项,该反应的平衡常数 ,当 ,即 时,反应正向进行,错误; 项,滤渣溶于醋酸产生气泡,说明滤渣中含 ,则上层清液中存在 的沉淀溶解平衡,即存在 ,若 完全反应,则上层清液中存在 ,若 有剩余,则上层清液中存在 ,正确; 项,醋酸为弱酸,不可以拆开,错误。
题组五
一、选择题
1. [2022山东,2分]实验室用基准 配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定 标准溶液。下列说法错误的是( A )
A. 可用量筒量取 标准溶液置于锥形瓶中
B. 应选用配带塑料塞的容量瓶配制 标准溶液
C. 应选用烧杯而非称量纸称量 固体
D. 达到滴定终点时溶液显橙色
[解析]量取 标准溶液应选择碱式滴定管或移液管, 项错误; 溶液呈碱性,能与玻璃中的二氧化硅反应,因此应选用配带塑料塞的容量瓶配制 标准溶液, 项正确;碳酸钠有吸湿性和一定的腐蚀性,称量碳酸钠固体时应选用烧杯, 项正确;达到滴定终点时溶液呈酸性,显橙色, 项正确。
2. [2022重庆,3分]某小组模拟成垢-除垢过程如下。
水溶液
忽略体积变化,且步骤②中反应完全。下列说法正确的是( D )
A. 经过步骤①,溶液中
B. 经过步骤②,溶液中
C. 经过步骤②,溶液中
D. 经过步骤③,溶液中
[解析]步骤①, 和 恰好完全反应, ,得到 和 ,根据物料守恒 知, 项错误;步骤②,发生反应 ,生成 ,剩余 和 , , 项错误;经过步骤②,溶液中存在物料守恒 , 项错误;步骤③加入 冰醋酸,根据物料守恒, , 项正确。
3. [2022福建,4分]探究醋酸浓度与电离度 关系的步骤如下,与相关步骤对应的操作或叙述正确的是(C)
步骤 操作或叙述
A Ⅰ.用 标准溶液标定醋酸溶液浓度 滴定时应始终注视滴定管中的液面
B Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液 应使用干燥的容量瓶
C Ⅲ.测定步骤Ⅱ中所得溶液的 应在相同温度下测定
D Ⅳ.计算不同浓度溶液中醋酸的电离度 计算式为
[解析]中和滴定时,应始终注视锥形瓶内溶液颜色的变化, 错误;用标定后的溶液配制不同浓度的醋酸溶液,由于最后需加蒸馏水定容,因此容量瓶无需干燥, 错误;由于醋酸的电离过程吸热,温度不同,醋酸的电离程度不同,溶液中 不同,因此需要在相同的温度下测定 溶液的 , 正确;醋酸的电离度等于已电离的醋酸分子占总醋酸分子的百分数,因此计算式为 , 错误。
4. [2022福建,4分]锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有 、 、 和 杂质离子,可在 范围内调节 对其净化(即相关离子浓度 )。 时, 与 关系如图[碱性过强时 和 会部分溶解]。下列说法正确的是( B )
A. 可被净化的 区间最大
B. 加入适量 ,可进一步提升净化程度
C. 净化的先后顺序: 、 、 、
D.
[解析]由题图可知,当 介于约 时, 被净化,当 介于约 时, 被净化,故 错误;结合题意及题图可知,加入适量 将 氧化为 可提升净化程度, 正确;由图像可以看出净化的先后顺序为 、 、 、 , 错误;结合题图知,溶度积的大小顺序为 , 错误。
二、非选择题
5. [2022广东,14分]食醋是烹饪美食的调味品,有效成分主要为醋酸(用 表示)。 的应用与其电离平衡密切相关。 时, 的 。
(1) 配制 的 溶液,需 溶液的体积为 (1分) 。
[解析]根据配制前后溶质的物质的量不变,列式: , ,得 。
(2) 下列关于 容量瓶的操作,正确的是C。
A. B.
C. D.
[解析]振荡时应用瓶塞塞住容量瓶口,不可用手指压住容量瓶口, 项错误;定容时眼睛应该平视刻度线且胶头滴管的尖嘴不能插入容量瓶内, 项错误;转移溶液时用玻璃棒引流,且玻璃棒下端紧靠在容量瓶刻度线以下的内壁上, 项正确;缺少另一只手托住瓶底, 项错误。
(3) 某小组研究 下 电离平衡的影响因素。
提出假设 稀释 溶液或改变 浓度, 电离平衡会发生移动。
设计方案并完成实验 用浓度均为 的 和 溶液,按下表配制总体积相同的系列溶液;测定 ,记录数据。
① 根据表中信息,补充数据: 3.00, 。
[解析]实验 中, ,两种溶液的浓度相等,当 时, ,为保证溶液的总体积为 ,则 。
② 由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡正(填“正”或“逆”)向移动;结合表中数据,给出判断理由:实验Ⅱ中的 的浓度为实验Ⅰ的 ,稀释10倍后,假设电离平衡不移动,理论 为 ,实际 为 ,说明稀释 溶液时,促进了 的电离。
[解析]由实验Ⅰ、Ⅱ的数据分析,实验Ⅱ中 的浓度为实验Ⅰ中的 ,但是 没有从2.86变为 , 浓度相对变大(实际 为 ),说明稀释 溶液时,促进了 的电离。
③由实验Ⅱ 可知,增大 浓度, 电离平衡逆向移动。
实验结论 假设成立。
(4) 小组分析上表数据发现:随着 的增加, 的值逐渐接近 的 。
查阅资料获悉:一定条件下,按 配制的溶液中, 的值等于 的 。
对比数据发现,实验 中 与资料数据 存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定 溶液的浓度再验证。
(ⅰ) 移取 溶液,加入2滴酚酞溶液,用 溶液滴定至终点,消耗体积为 ,则该 溶液的浓度为 。画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ) 用上述 溶液和 溶液,配制等物质的量的 与 混合溶液,测定 ,结果与资料数据相符。
[答案]
[解析] 与 以物质的量为 反应,则 , 。 与 完全反应时,生成强碱弱酸盐 ,滴定终点时,溶液显碱性,所以加入 溶液时,对应的滴定终点溶液的 。
(5) 小组进一步提出:如果只有浓度均约为 的 和 溶液,如何准确测定 的 小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ 移取 溶液,用 溶液滴定至终点,消耗 溶液
Ⅱ 移取 溶液,向其中加入 溶液,测得溶液的 为4.76
实验总结 得到的结果与资料数据相符,方案可行。
[解析]醋酸的电离平衡: ,平衡常数 ,当 时, ,故在Ⅱ中,向 溶液中加入 溶液,反应后的溶液中 和 浓度相等,测定溶液的 ,即可得出 。
(6) 根据 可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途 、杀菌消毒(其他合理答案也可)。
[解析] 为弱酸,可以用于自来水的杀菌消毒。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2019-2023年化学高考真题分类
专题十一 电解质溶液
题组一
1. [2023湖南,3分]常温下,用浓度为 的 标准溶液滴定浓度均为 的 和 的混合溶液,滴定过程中溶液的 随 的变化曲线如图所示。下列说法错误的是( )
A. 约为
B. 点
C. 点
D. 水的电离程度:
2. [2022北京,3分]2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是( )
A. 醋酸钠是强电解质
B. 醋酸钠晶体与冰都是离子晶体
C. 常温下,醋酸钠溶液的
D. 该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
3. [2022浙江1月选考,2分]已知 时二元酸 的 , 。下列说法正确的是( )
A. 在等浓度的 、 溶液中,水的电离程度前者小于后者
B. 向 的 溶液中通入 气体(忽略溶液体积的变化)至 ,则 的电离度为
C. 向 溶液中加入 溶液至 ,则
D. 取 的 溶液 ,加蒸馏水稀释至 ,则该溶液
4. [2021天津,3分]常温下,下列有关电解质溶液的叙述正确的是( )
A. 在 溶液中
B. 在 溶液中
C. 在 溶液中
D. 氨水和 溶液混合,形成 的溶液中
5. [2021湖南,3分]常温下,用 的盐酸分别滴定 浓度均为 的三种一元弱酸的钠盐 、 、 溶液,滴定曲线如图所示。下列判断错误的是( )
A. 该 溶液中:
B. 三种一元弱酸的电离常数:
C. 当 时,三种溶液中:
D. 分别滴加 盐酸后,再将三种溶液混合:
6. [2020浙江7月选考,2分]下列说法不正确的是( )
A. 的盐酸中
B. 将 溶液从常温加热至 ,溶液的 变小但仍保持中性
C. 常温下, 溶液呈碱性,说明 是弱电解质
D. 常温下, 为3的醋酸溶液中加入醋酸钠固体,溶液 增大
7. [2020全国卷Ⅰ,6分]以酚酞为指示剂,用 的 溶液滴定 未知浓度的二元酸 溶液。溶液中, 、分布系数 随滴加 溶液体积 的变化关系如图所示。[比如 的分布系数:
下列叙述正确的是( )
A. 曲线①代表 ,曲线②代表
B. 溶液的浓度为
C. 的电离常数
D. 滴定终点时,溶液中
8. [2019天津理综,6分]某温度下, 和 的电离常数分别为 和 。将 和体积均相同的两种酸溶液分别稀释,其 随加水体积的变化如图所示。下列叙述正确的是( )
A. 曲线Ⅰ代表 溶液
B. 溶液中水的电离程度: 点 点
C. 从 点到 点,溶液中 保持不变(其中 、 分别代表相应的酸和酸根离子)
D. 相同体积 点的两溶液分别与 恰好中和后,溶液中 相同
9. [2019北京理综,6分]实验测得 溶液、 溶液以及 的 随温度变化的曲线如图所示。下列说法正确的是( )
A. 随温度升高,纯水中
B. 随温度升高, 溶液的 减小
C. 随温度升高, 溶液的 变化是 改变与水解平衡移动共同作用的结果
D. 随温度升高, 溶液和 溶液的 均降低,是因为 、 水解平衡移动方向不同
题组二
1. [2022湖北,3分]如图是亚砷酸 和酒石酸 混合体系中部分物种的 图(浓度:总 为 ,总 为 )。下列说法错误的是( )
A. 的 为
B. 的酸性比 的强
C. 时, 的浓度比 的高
D. 时,溶液中浓度最高的物种为
2. [2022江苏,3分]一种捕集烟气中 的过程如图所示。室温下以 溶液吸收 ,若通入 所引起的溶液体积变化和 挥发可忽略,溶液中含碳物种的浓度 。 电离常数分别为 、 。下列说法正确的是( )
A. 吸收 所得到的溶液中:
B. 完全转化为 时,溶液中:
C. 溶液吸收 , 溶液中:
D. 题图所示的“吸收”“转化”过程中,溶液的温度下降
3. [2022辽宁,3分]甘氨酸 是人体必需氨基酸之一。在 时, 、 和 的分布分数[如 与溶液 关系如图。下列说法错误的是( )
A. 甘氨酸具有两性
B. 曲线 代表
C. 的平衡常数
D.
4. [2022河北,3分]某水样中含一定浓度的 、 和其他不与酸碱反应的离子。取 水样,用 的 溶液进行滴定,溶液 随滴加 溶液体积 的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是( )
A. 该水样中
B. 点处
C. 当 时,溶液中 基本保持不变
D. 曲线上任意一点存在
5. [2022浙江1月选考,2分]某同学在两个相同的特制容器中分别加入 溶液和 溶液,再分别用 盐酸滴定,利用 计和压力传感器检测,得到如下曲线:
下列说法正确的是( )
A. 图中甲、丁线表示向 溶液中滴加盐酸,乙、丙线表示向 溶液中滴加盐酸
B. 当滴加盐酸的体积为 时( 点、 点),所发生的反应用离子方程式表示为
C. 根据 图,滴定分析时, 点可用酚酞、 点可用甲基橙作指示剂指示滴定终点
D. 和 溶液中均满足:
6. [2021浙江1月选考,2分]实验测得 溶液、 溶液的 分别随温度与稀释加水量的变化如图所示。已知 时 和 的电离常数均为 。下列说法不正确的是( )
A. 图中实线表示 随加水量的变化,虚线表示 随温度的变化
B. 将 溶液加水稀释至浓度为 ,溶液 变化值小于
C. 随温度升高, 增大, 溶液中 减小, 增大, 减小
D. 时稀释相同倍数的 溶液与 溶液中:
7. [2020浙江7月选考,2分]常温下,用 氨水滴定 浓度均为 的 和 的混合液,下列说法不正确的是( )
A. 在氨水滴定前, 和 的混合液中
B. 当滴入氨水 时,
C. 当滴入氨水 时,
D. 当溶液呈中性时,氨水滴入量大于 ,
题组三
1. [2023浙江1月选考,3分]甲酸 是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分 , 为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始 关系如图(已知甲酸 ),下列说法不正确的是( )
A. 活性成分 在水中存在平衡:
B. 的废水中
C. 废水初始 ,随 下降,甲酸的电离被抑制,与 作用的 数目减少
D. 废水初始 ,离子交换树脂活性成分主要以 形态存在
2. [2022全国乙卷,6分]常温下,一元酸 的 。在某体系中, 与 离子不能穿过隔膜,未电离的 可自由穿过该膜(如图所示)。设溶液中 ,当达到平衡时,下列叙述正确的是( )
A. 溶液Ⅰ中
B. 溶液Ⅱ中 的电离度 为
C. 溶液Ⅰ和Ⅱ中的 不相等
D. 溶液Ⅰ和Ⅱ中的 之比为
3. [2021江苏,3分]室温下,通过下列实验探究 、 溶液的性质。
实验1:用 试纸测量 溶液的 ,测得 约为8
实验2:将 溶液与 溶液等体积混合,产生白色沉淀
实验3:向 溶液中通入 ,溶液 从12下降到约为9
实验4:向 溶液中滴加新制饱和氯水,氯水颜色褪去
下列说法正确的是( )
A. 由实验1可得出:
B. 实验2中两溶液混合时有:
C. 实验3中发生反应的离子方程式为
D. 实验4中
4. [2021福建,4分]如图为某实验测得 溶液在升温过程中(不考虑水挥发)的 变化曲线。
下列说法正确的是( )
A. 点溶液的 比 点溶液的小
B. 点时,
C. 点溶液中,
D. 段, 减小说明升温抑制了 的水解
5. [2021湖北,3分]常温下,已知 溶液中含磷物种的浓度之和为 ,溶液中各含磷物种的 关系如图所示。图中 表示各含磷物种的浓度负对数 , 表示 的浓度负对数 ; 、 、 三点的坐标: , , 。下列说法正确的是( )
A. 曲线①表示 随 的变化
B. 的结构简式为
C. 的溶液中:
D. 的平衡常数
6. [2021辽宁,3分]用 盐酸滴定 溶液,溶液中 、 、 的分布分数 随 变化曲线及滴定曲线如图。下列说法正确的是( )
[如 分布分数:
A. 的 为 B. 点:
C. 第一次突变,可选酚酞作指示剂 D.
7. [2020浙江1月选考,2分]下列说法不正确的是( )
A. 的溶液不一定呈碱性
B. 中和 和体积均相等的氨水、 溶液,所需 的物质的量相同
C. 相同温度下, 相等的盐酸、 溶液中, 相等
D. 氨水和盐酸反应后的溶液,若溶液呈中性,则
8. [2019浙江4月选考,2分]室温下,取 某二元酸 ,滴加 溶液。
已知: , 。下列说法不正确的是( )
A. 溶液中有
B. 当滴加至中性时,溶液中 ,用去 溶液的体积小于
C. 当用去 溶液体积 时,溶液的 ,此时溶液中有
D. 当用去 溶液体积 时,此时溶液中有
题组四
1. [2023全国甲卷,6分]下图为 、 和 在水中达沉淀溶解平衡时的 关系图( ; 可认为 离子沉淀完全)。下列叙述正确的是( )
A. 由 点可求得
B. 时 的溶解度为
C. 浓度均为 的 和 可通过分步沉淀进行分离
D. 、 混合溶液中 时二者不会同时沉淀
2. [2023全国乙卷,6分]一定温度下, 和 的沉淀溶解平衡曲线如图所示。
下列说法正确的是( )
A. 点条件下能生成 沉淀,也能生成 沉淀
B. 点时, ,
C. 的平衡常数
D. 向 、 均为 的混合溶液中滴加 溶液,先产生 沉淀
3. [2023新课标卷,6分]向 饱和溶液(有足量 固体)中滴加氨水,发生反应 和 。 与 的关系如下图所示(其中 代表 、 、 或 )。
下列说法错误的是( )
A. 曲线Ⅰ可视为 溶解度随 浓度变化曲线
B. 的溶度积常数
C. 反应 的平衡常数 的值为
D. 时,溶液中
4. [2022山东,4分]工业上以 为原料生产 ,对其工艺条件进行研究。现有含 的 、 溶液,含 的 、 溶液。在一定 范围内,四种溶液中 随 的变化关系如图所示。下列说法错误的是( )
A. 反应 的平衡常数
B.
C. 曲线④代表含 的 溶液的变化曲线
D. 对含 且 和 初始浓度均为 的混合溶液, 时才发生沉淀转化
5. [2022湖南,3分]室温时,用 的标准 溶液滴定 浓度相等的 、 和 混合溶液,通过电位滴定法获得 与 的关系曲线如图所示[忽略沉淀对离子的吸附作用。若溶液中离子浓度小于 时,认为该离子沉淀完全。 , , ]。
下列说法正确的是( )
A. 点:有白色沉淀生成
B. 原溶液中 的浓度为
C. 当 沉淀完全时,已经有部分 沉淀
D. 点:
6. [2021全国甲卷,6分]已知相同温度下, 。某温度下,饱和溶液中 、 与 的关系如图所示。
下列说法正确的是( )
A. 曲线①代表 的沉淀溶解曲线
B. 该温度下 的 值为
C. 加适量 固体可使溶液由 点变到 点
D. 时两溶液中
7. [2021全国乙卷,6分] 是一元弱酸,难溶盐 的饱和溶液中 随 而变化, 不发生水解。实验发现, 时 为线性关系,如图中实线所示。
下列叙述错误的是( )
A. 溶液 时,
B. 的溶度积
C. 溶液 时,
D. 的电离常数
8. [2021江苏,3分]室温下,用 溶液浸泡 粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知 , 。下列说法正确的是( )
A. 溶液中存在:
B. 反应 正向进行,需满足
C. 过滤后所得清液中一定存在: 且
D. 滤渣中加入醋酸发生反应的离子方程式:
题组五
一、选择题
1. [2022山东,2分]实验室用基准 配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定 标准溶液。下列说法错误的是( )
A. 可用量筒量取 标准溶液置于锥形瓶中
B. 应选用配带塑料塞的容量瓶配制 标准溶液
C. 应选用烧杯而非称量纸称量 固体
D. 达到滴定终点时溶液显橙色
2. [2022重庆,3分]某小组模拟成垢-除垢过程如下。
水溶液
忽略体积变化,且步骤②中反应完全。下列说法正确的是( )
A. 经过步骤①,溶液中
B. 经过步骤②,溶液中
C. 经过步骤②,溶液中
D. 经过步骤③,溶液中
3. [2022福建,4分]探究醋酸浓度与电离度 关系的步骤如下,与相关步骤对应的操作或叙述正确的是( )
步骤 操作或叙述
A Ⅰ.用 标准溶液标定醋酸溶液浓度 滴定时应始终注视滴定管中的液面
B Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液 应使用干燥的容量瓶
C Ⅲ.测定步骤Ⅱ中所得溶液的 应在相同温度下测定
D Ⅳ.计算不同浓度溶液中醋酸的电离度 计算式为
4. [2022福建,4分]锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有 、 、 和 杂质离子,可在 范围内调节 对其净化(即相关离子浓度 )。 时, 与 关系如图[碱性过强时 和 会部分溶解]。下列说法正确的是( )
A. 可被净化的 区间最大
B. 加入适量 ,可进一步提升净化程度
C. 净化的先后顺序: 、 、 、
D.
二、非选择题
5. [2022广东,14分]食醋是烹饪美食的调味品,有效成分主要为醋酸(用 表示)。 的应用与其电离平衡密切相关。 时, 的 。
(1) 配制 的 溶液,需 溶液的体积为 。
(2) 下列关于 容量瓶的操作,正确的是( )。
A. B.
C. D.
(3) 某小组研究 下 电离平衡的影响因素。
提出假设 稀释 溶液或改变 浓度, 电离平衡会发生移动。
设计方案并完成实验 用浓度均为 的 和 溶液,按下表配制总体积相同的系列溶液;测定 ,记录数据。
① 根据表中信息,补充数据: , 。
② 由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡 (填“正”或“逆”)向移动;结合表中数据,给出判断理由:
③由实验Ⅱ 可知,增大 浓度, 电离平衡逆向移动。
实验结论 假设成立。
(4) 小组分析上表数据发现:随着 的增加, 的值逐渐接近 的 。
查阅资料获悉:一定条件下,按 配制的溶液中, 的值等于 的 。
对比数据发现,实验 中 与资料数据 存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定 溶液的浓度再验证。
(ⅰ) 移取 溶液,加入2滴酚酞溶液,用 溶液滴定至终点,消耗体积为 ,则该 溶液的浓度为 。画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ) 用上述 溶液和 溶液,配制等物质的量的 与 混合溶液,测定 ,结果与资料数据相符。
(5) 小组进一步提出:如果只有浓度均约为 的 和 溶液,如何准确测定 的 小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ 移取 溶液,用 溶液滴定至终点,消耗 溶液
Ⅱ ,测得溶液的 为4.76
实验总结 得到的结果与资料数据相符,方案可行。
(6) 根据 可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途 。
专题十一 电解质溶液
题组一
1. [2023湖南,3分]常温下,用浓度为 的 标准溶液滴定浓度均为 的 和 的混合溶液,滴定过程中溶液的 随 的变化曲线如图所示。下列说法错误的是( D )
A. 约为
B. 点
C. 点
D. 水的电离程度:
[解析]
根据 ,可近似认为 点 ,又 点 , ,故 , 项正确; 点 恰好被完全中和,由物料守恒可得溶液中 , 项正确; 点溶液 ,即以 的电离为主,即溶液中 , 项正确; 、 两点溶液呈酸性,水的电离均受到抑制,溶液 越小,水的电离受抑制程度越大, 点酸碱恰好完全中和, 水解促进水的电离, 点 过量,又抑制水的电离,故 项错误。
2. [2022北京,3分]2022年3月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是( B )
A. 醋酸钠是强电解质
B. 醋酸钠晶体与冰都是离子晶体
C. 常温下,醋酸钠溶液的
D. 该溶液中加入少量醋酸钠固体可以促进醋酸钠晶体析出
[解析]醋酸钠属于盐,溶于水或熔融时完全电离,是强电解质, 项正确;醋酸钠晶体是离子晶体,但冰是分子晶体, 项错误;常温下,醋酸钠溶液由于 水解呈碱性, , 项正确;该溶液中加入少量醋酸钠固体,醋酸钠的溶解平衡向结晶方向移动,析出晶体, 项正确。
3. [2022浙江1月选考,2分]已知 时二元酸 的 , 。下列说法正确的是( B )
A. 在等浓度的 、 溶液中,水的电离程度前者小于后者
B. 向 的 溶液中通入 气体(忽略溶液体积的变化)至 ,则 的电离度为
C. 向 溶液中加入 溶液至 ,则
D. 取 的 溶液 ,加蒸馏水稀释至 ,则该溶液
[解析]盐类的水解促进水的电离, 比 易水解,等浓度的溶液前者水的电离程度更大, 项错误;设 溶液在 时 的电离度是 ,则 ,解得 , 项正确;溶液 时, ,由 ,可得 , , 项错误;因为加水稀释促进 的电离,所以稀释10倍后溶液 变化 , 项错误。
4. [2021天津,3分]常温下,下列有关电解质溶液的叙述正确的是( A )
A. 在 溶液中
B. 在 溶液中
C. 在 溶液中
D. 氨水和 溶液混合,形成 的溶液中
[解析] 是三元弱酸,其各步电离依次变难,电离出的酸根离子浓度依次减小, 项正确;根据电荷守恒, 溶液中 , 项错误;由元素质量守恒知, 溶液中 , 项错误;氨水和 的混合溶液的 ,则 ,由电荷守恒知 ,故 , 项错误。
【解后反思】 掌握三大守恒关系的应用
5. [2021湖南,3分]常温下,用 的盐酸分别滴定 浓度均为 的三种一元弱酸的钠盐 、 、 溶液,滴定曲线如图所示。下列判断错误的是( C )
A. 该 溶液中:
B. 三种一元弱酸的电离常数:
C. 当 时,三种溶液中:
D. 分别滴加 盐酸后,再将三种溶液混合:
[解析] 项, 溶液因 水解显碱性,则 , ,因为水解较微弱,所以有 ,正确。 项,由题图可知,未加盐酸时,等浓度的三种盐溶液的 ,则酸性 ,正确。 项, 时, 、 、 三种溶液中所加盐酸体积依次增大,则溶液中 浓度依次减小, 浓度依次增大,又三种溶液中均有 ,结合电荷守恒知 , , ,故 、 、 浓度依次减小,错误。 项,加入 盐酸后,三种溶液混合后的混合溶液中 ,结合电荷守恒知 ,正确。
6. [2020浙江7月选考,2分]下列说法不正确的是( A )
A. 的盐酸中
B. 将 溶液从常温加热至 ,溶液的 变小但仍保持中性
C. 常温下, 溶液呈碱性,说明 是弱电解质
D. 常温下, 为3的醋酸溶液中加入醋酸钠固体,溶液 增大
[解析]极稀的溶液中, 电离出的 不能忽略,故 大于 , 项错误;水的电离是吸热的,升高温度促进水的电离,氢离子浓度和氢氧根离子浓度均增大, 减小,但氢离子浓度和氢氧根离子浓度仍相等,溶液呈中性, 项正确;常温下, 溶液呈碱性,说明 是强碱弱酸盐, 是弱酸, 项正确;醋酸溶液中加入醋酸钠,醋酸根离子浓度增大,醋酸的电离平衡逆向移动,氢离子浓度减小, 增大, 项正确。
7. [2020全国卷Ⅰ,6分]以酚酞为指示剂,用 的 溶液滴定 未知浓度的二元酸 溶液。溶液中, 、分布系数 随滴加 溶液体积 的变化关系如图所示。[比如 的分布系数:
下列叙述正确的是( C )
A. 曲线①代表 ,曲线②代表
B. 溶液的浓度为
C. 的电离常数
D. 滴定终点时,溶液中
[解析]由题图可知加入 溶液时达到滴定终点,又 为二元酸,则 溶液的浓度为 ,由题图可知,没有加入 溶液时, 溶液的 约为 ,分析可知 第一步完全电离,曲线①代表 ,曲线②代表 , 、 项错误;由题图可知 时溶液 ,即 时溶液 ,则 , 项正确;滴定终点时溶液中存在的离子有 、 、 、 、 ,根据电荷守恒有 ,此时 ,则 , 项错误。
8. [2019天津理综,6分]某温度下, 和 的电离常数分别为 和 。将 和体积均相同的两种酸溶液分别稀释,其 随加水体积的变化如图所示。下列叙述正确的是( C )
A. 曲线Ⅰ代表 溶液
B. 溶液中水的电离程度: 点 点
C. 从 点到 点,溶液中 保持不变(其中 、 分别代表相应的酸和酸根离子)
D. 相同体积 点的两溶液分别与 恰好中和后,溶液中 相同
[解析]根据 和 的电离常数,可知酸性: 。相同 的两种酸溶液,稀释相同倍数时,弱酸的 变化较小,故曲线Ⅰ代表 溶液, 项错误;两种酸溶液中水的电离受到抑制, 点溶液 小于 点溶液 ,则 点对应酸电离出的 大,对水的电离抑制程度大,故水的电离程度: 点 点, 项错误;溶液中 ,从 点到 点, 的电离平衡正向移动,但 、 的值不变,故 不变, 项正确;相同体积 点的两溶液中,由于 ,故 ,因此与 恰好中和后,溶液中 不同, 项错误。
【解后反思】 对于 相同的两种酸溶液:①酸性越弱,其物质的量浓度越大;②稀释相同倍数时,酸性越弱,其对应溶液的 变化越小;③相同体积的两种酸溶液,酸性越弱,中和 的能力越强。
9. [2019北京理综,6分]实验测得 溶液、 溶液以及 的 随温度变化的曲线如图所示。下列说法正确的是( C )
A. 随温度升高,纯水中
B. 随温度升高, 溶液的 减小
C. 随温度升高, 溶液的 变化是 改变与水解平衡移动共同作用的结果
D. 随温度升高, 溶液和 溶液的 均降低,是因为 、 水解平衡移动方向不同
[解析]任何温度时,纯水中 浓度与 浓度始终相等, 项错误;随温度升高, 水解程度增大,溶液中 增大,且温度升高,水的电离程度增大, 也增大, 项错误;温度升高,水的电离程度增大, 增大,又 水解使溶液显酸性,温度升高,水解平衡正向移动,故 增大, 项正确;温度升高,能使电离平衡和水解平衡均向正反应方向移动,而 溶液随温度升高 降低的原因是水的电离程度增大得多,而 溶液随温度升高 降低的原因是 水解程度增大得多, 项错误。
题组二
1. [2022湖北,3分]如图是亚砷酸 和酒石酸 混合体系中部分物种的 图(浓度:总 为 ,总 为 )。下列说法错误的是( D )
A. 的 为
B. 的酸性比 的强
C. 时, 的浓度比 的高
D. 时,溶液中浓度最高的物种为
[解析] 的 ,由题图知, 时, ,则 , 项正确; 的 ,由题图知, 时, ,则 的 ,故 比 的酸性强, 项正确; 时, 的浓度略低于 ,而 的浓度略高于 , 项正确;结合题干和上述分析知,酒石酸的酸性远强于 ,且溶液中总 的浓度小于总 的浓度,所以当 时,溶液中浓度最高的物种不是 , 项错误。
2. [2022江苏,3分]一种捕集烟气中 的过程如图所示。室温下以 溶液吸收 ,若通入 所引起的溶液体积变化和 挥发可忽略,溶液中含碳物种的浓度 。 电离常数分别为 、 。下列说法正确的是( C )
A. 吸收 所得到的溶液中:
B. 完全转化为 时,溶液中:
C. 溶液吸收 , 溶液中:
D. 题图所示的“吸收”“转化”过程中,溶液的温度下降
[解析] 项, 吸收 可能生成 ,此时由于 以第一步水解为主,故溶液中 ,也可能生成 ,由于 的水解很微弱,故此时溶液中 ,还可能生成 和 的混合物,同理,溶液中亦存在 ,错误; 项, 溶液中存在质子守恒 ,错误; 项,由于 溶液的浓度为 , ,即 ,此等式为 溶液的元素质量守恒式,故此时所得溶液为 溶液, 存在水解平衡 ,电离平衡 ,由 可知, 的水解程度大于电离程度,故 ,正确; 项,“吸收”时发生的反应和“转化”时发生的反应均为放热反应,故溶液的温度升高,错误。
3. [2022辽宁,3分]甘氨酸 是人体必需氨基酸之一。在 时, 、 和 的分布分数[如 与溶液 关系如图。下列说法错误的是( D )
A. 甘氨酸具有两性
B. 曲线 代表
C. 的平衡常数
D.
[解析]甘氨酸在溶液中存在平衡 、 , 减小,①平衡正向移动, 浓度增大,故曲线 代表 ,同理,曲线 代表 ,则曲线 代表 。由图中点 可知, ,同理,由点 可知, 。
甘氨酸中含有氨基和羧基,具有两性, 项正确;由上述分析可知, 项正确, 项正确; ,故 , 项错误。
【解后反思】 对于物种分布分数图像,一般选择“交点”处不同微粒的等浓度关系,代入电离常数公式计算各级电离常数。
4. [2022河北,3分]某水样中含一定浓度的 、 和其他不与酸碱反应的离子。取 水样,用 的 溶液进行滴定,溶液 随滴加 溶液体积 的变化关系如图(混合后溶液体积变化忽略不计)。
下列说法正确的是( C )
A. 该水样中
B. 点处
C. 当 时,溶液中 基本保持不变
D. 曲线上任意一点存在
[解析]
由以上分析知, 项错误;根据水样中所含离子种类及图像分析可知, 点处能水解的离子主要为 ,根据质子守恒可得 , 项错误;水样中 , 时,随着 溶液的加入, 被稀释,但由于发生反应 ,又有 生成, 点时 仍为 , 项正确;根据图像分析及碳元素守恒可知,起始时水样中 ,但随着 溶液的加入,溶液被稀释,该值减小, 项错误。
5. [2022浙江1月选考,2分]某同学在两个相同的特制容器中分别加入 溶液和 溶液,再分别用 盐酸滴定,利用 计和压力传感器检测,得到如下曲线:
下列说法正确的是( C )
A. 图中甲、丁线表示向 溶液中滴加盐酸,乙、丙线表示向 溶液中滴加盐酸
B. 当滴加盐酸的体积为 时( 点、 点),所发生的反应用离子方程式表示为
C. 根据 图,滴定分析时, 点可用酚酞、 点可用甲基橙作指示剂指示滴定终点
D. 和 溶液中均满足:
[解析]因为 比 的水解程度大,且 溶液浓度比 溶液大,故 溶液的初始 较大,甲线表示向 溶液中滴加盐酸,向 溶液中滴加盐酸时, ,开始加入盐酸时没有 产生,故丁线表示向 溶液中滴加盐酸, 项错误;从图像可以看出, 点尚未放出 ,此时反应的离子方程式是 , 项错误;图像显示 点 在 ,则可以用酚酞作指示剂, 点 在 ,则可以用甲基橙作指示剂, 项正确;根据质子守恒, 溶液 , 项错误。
6. [2021浙江1月选考,2分]实验测得 溶液、 溶液的 分别随温度与稀释加水量的变化如图所示。已知 时 和 的电离常数均为 。下列说法不正确的是( C )
A. 图中实线表示 随加水量的变化,虚线表示 随温度的变化
B. 将 溶液加水稀释至浓度为 ,溶液 变化值小于
C. 随温度升高, 增大, 溶液中 减小, 增大, 减小
D. 时稀释相同倍数的 溶液与 溶液中:
[解析]加水稀释促进盐类的水解,但 或 浓度减小,根据图像,可以得出图中实线表示 随加水量的变化,虚线表示 随温度的变化, 正确;氯化铵溶液加水稀释至浓度为 ,即稀释了 倍,但加水稀释促进盐类水解,溶液 的变化值小于 , 正确;温度升高,水的离子积增大,促进醋酸钠水解,溶液中的 增大, 不正确;稀释相同的倍数,因为 时, 和 的电离常数相同,所以 和 的水解程度相同,所以有 , 正确。
7. [2020浙江7月选考,2分]常温下,用 氨水滴定 浓度均为 的 和 的混合液,下列说法不正确的是( D )
A. 在氨水滴定前, 和 的混合液中
B. 当滴入氨水 时,
C. 当滴入氨水 时,
D. 当溶液呈中性时,氨水滴入量大于 ,
[解析] 是强电解质,完全电离,醋酸是弱电解质,部分电离,浓度相同的 和 的混合液中 , 项正确;当滴入氨水 时,加入的氨水的体积、浓度和初始醋酸溶液的体积、浓度均相等,由元素质量守恒可知, , 项正确;当滴入氨水 时,溶液中溶质为 和 ,根据电荷守恒式 ,元素质量守恒式 ,可得 , 项正确;恰好反应时,生成等物质的量的氯化铵和醋酸铵,此时溶液呈酸性,若溶液呈中性,则氨水滴入量大于 ,根据电荷守恒式 及 可知, , 项错误。
题组三
1. [2023浙江1月选考,3分]甲酸 是重要的化工原料。工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分 , 为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始 关系如图(已知甲酸 ),下列说法不正确的是( D )
A. 活性成分 在水中存在平衡:
B. 的废水中
C. 废水初始 ,随 下降,甲酸的电离被抑制,与 作用的 数目减少
D. 废水初始 ,离子交换树脂活性成分主要以 形态存在
[解析]活性成分 中 能与水电离出的 形成配位键,因此在水中存在平衡: , 项正确; 的废水中, ,根据甲酸 ,得 , 项正确;废水初始 ,随 下降, 增大,电离平衡 逆向移动,甲酸的电离被抑制, 减小,与 作用的 数目减少, 项正确;废水初始 时回收率小于 ,说明吸附在树脂上的甲酸根较少,活性成分主要以 形态存在, 项错误。
2. [2022全国乙卷,6分]常温下,一元酸 的 。在某体系中, 与 离子不能穿过隔膜,未电离的 可自由穿过该膜(如图所示)。设溶液中 ,当达到平衡时,下列叙述正确的是( B )
A. 溶液Ⅰ中
B. 溶液Ⅱ中 的电离度 为
C. 溶液Ⅰ和Ⅱ中的 不相等
D. 溶液Ⅰ和Ⅱ中的 之比为
[解析] ,溶液Ⅰ呈中性, ,若 ,则 ,明显不符合实际情况, 项错误;溶液Ⅱ中, , 项正确; 可以自由通过隔膜,溶液Ⅰ、Ⅱ中 应相等, 项错误;溶液Ⅰ、Ⅱ中 相等,由 ,可得 Ⅰ Ⅰ Ⅱ Ⅱ ,则 ,溶液Ⅰ中, , ,同理溶液Ⅱ中, ,故 , 项错误。
3. [2021江苏,3分]室温下,通过下列实验探究 、 溶液的性质。
实验1:用 试纸测量 溶液的 ,测得 约为8
实验2:将 溶液与 溶液等体积混合,产生白色沉淀
实验3:向 溶液中通入 ,溶液 从12下降到约为9
实验4:向 溶液中滴加新制饱和氯水,氯水颜色褪去
下列说法正确的是( C )
A. 由实验1可得出:
B. 实验2中两溶液混合时有:
C. 实验3中发生反应的离子方程式为
D. 实验4中
[解析] 项, 溶液的 约为8,说明 的水解程度大于电离程度,即 ,错误; 项,实验2中产生白色沉淀,则 ,错误; 项,实验3中 与 反应生成 ,溶液的碱性减弱,发生反应的离子方程式为 ,正确; 项,饱和氯水中存在: ,实验4中向 溶液中滴加饱和氯水, 与 发生反应,促进 溶于水,氯水的黄绿色逐渐褪去, 减小,错误。
4. [2021福建,4分]如图为某实验测得 溶液在升温过程中(不考虑水挥发)的 变化曲线。
下列说法正确的是( A )
A. 点溶液的 比 点溶液的小
B. 点时,
C. 点溶液中,
D. 段, 减小说明升温抑制了 的水解
[解析] 溶液呈碱性,说明 的水解程度大于电离程度,升高温度, 的水解程度增大, 增大,故 点溶液的 比 点溶液的小, 项正确; 点溶液呈碱性,说明 的水解程度大于电离程度,即 ,则 , 项错误; 点溶液呈碱性, ,根据电荷守恒: ,知 , 项错误; 段,温度升高,促进 水解, 增大,而 减小是因为升高温度,促进水的电离, 也增大,且 增大的程度比 大, 项错误。
5. [2021湖北,3分]常温下,已知 溶液中含磷物种的浓度之和为 ,溶液中各含磷物种的 关系如图所示。图中 表示各含磷物种的浓度负对数 , 表示 的浓度负对数 ; 、 、 三点的坐标: , , 。下列说法正确的是( D )
A. 曲线①表示 随 的变化
B. 的结构简式为
C. 的溶液中:
D. 的平衡常数
[解析]图像中含 物质只有3种,说明 为二元弱酸。随着 逐渐增大, 减小,根据 、 ,知 逐渐减小, 先增大后减小, 逐渐增大, ,则 逐渐增大, 先减小后增大, 逐渐减小,故曲线③表示 ,曲线②表示 ,曲线①表示 , 项错误。 为二元弱酸,其结构简式为, 项错误。 即 ,由题图可知,此时, ,即 ,而 ,故 , 项错误。 点时, , ,则 的 , 点时, , ,则 的 ;反应 ,反应 ,由反应①-反应②可得 ,则平衡常数 , 项正确。
6. [2021辽宁,3分]用 盐酸滴定 溶液,溶液中 、 、 的分布分数 随 变化曲线及滴定曲线如图。下列说法正确的是( C )
[如 分布分数:
A. 的 为 B. 点:
C. 第一次突变,可选酚酞作指示剂 D.
[解析]
未滴入盐酸时,溶液中 最大,随着盐酸的滴入, 浓度逐渐增大,当加入 盐酸时 达到最大,继续滴入盐酸,溶液中 浓度开始减小,而 逐渐增大,故图中①表示 ,②表示 ,③表示 。 点对应的 ,则 的 , 项错误; 点时 , 项错误;根据题图可知,第一次突跃溶液呈碱性,所以可选用酚酞作指示剂, 项正确;加入 盐酸时, 恰好全部转化为 ,根据 和 溶液的体积为 ,可计算出 , 项错误。
【易错警示】 本题是酸滴定盐,溶液最初显碱性,曲线①表示 ,切勿从原点开始分析,误认为曲线③表示 。
7. [2020浙江1月选考,2分]下列说法不正确的是( B )
A. 的溶液不一定呈碱性
B. 中和 和体积均相等的氨水、 溶液,所需 的物质的量相同
C. 相同温度下, 相等的盐酸、 溶液中, 相等
D. 氨水和盐酸反应后的溶液,若溶液呈中性,则
[解析]没有给出温度, 的溶液不一定呈碱性, 正确; 相同的氨水和氢氧化钠溶液,氨水的物质的量浓度大,所以中和 和体积均相等的氨水、氢氧化钠溶液,氨水消耗 的物质的量多, 错误;相同温度下,盐酸和醋酸溶液中 相等时,因为水的离子积常数相等,所以两溶液中的 也相等, 正确;混合后溶液中的电荷守恒式为 ,溶液呈中性,即 ,所以 , 正确。
8. [2019浙江4月选考,2分]室温下,取 某二元酸 ,滴加 溶液。
已知: , 。下列说法不正确的是( B )
A. 溶液中有
B. 当滴加至中性时,溶液中 ,用去 溶液的体积小于
C. 当用去 溶液体积 时,溶液的 ,此时溶液中有
D. 当用去 溶液体积 时,此时溶液中有
[解析]对于 溶液而言,根据电荷守恒可知 ,根据元素质量守恒可知 ,又 第一步完全电离,故 ,将 代入 可得 ,故 , 项正确;当溶液呈中性时 ,由电荷守恒可得 ,若用去的 溶液体积为 ,此时溶液的溶质为 ,由于 只电离,不水解,故此时溶液呈酸性,要使溶液呈中性,则 溶液的体积必须大于 , 项错误;当用去 溶液体积 时,溶液呈酸性, ,由 , ,根据质子守恒得 ,故 , 项正确;当用去 溶液体积 时,根据元素质量守恒可知 , 项正确。
题组四
1. [2023全国甲卷,6分]下图为 、 和 在水中达沉淀溶解平衡时的 关系图( ; 可认为 离子沉淀完全)。下列叙述正确的是( C )
A. 由 点可求得
B. 时 的溶解度为
C. 浓度均为 的 和 可通过分步沉淀进行分离
D. 、 混合溶液中 时二者不会同时沉淀
[解析] 点 、 ,则 , 错误; 时 对应的 ,即 ,故 的溶解度为 , 错误;由图可知, 时的 小于 时的 ,则可通过调 分步沉淀浓度均为 的 和 , 正确;由题图可知, 沉淀完全时, , ,此时 ,此时 刚开始沉淀,浓度约为 ,而题中 ,则 、 会同时沉淀, 错误。
2. [2023全国乙卷,6分]一定温度下, 和 的沉淀溶解平衡曲线如图所示。
下列说法正确的是( C )
A. 点条件下能生成 沉淀,也能生成 沉淀
B. 点时, ,
C. 的平衡常数
D. 向 、 均为 的混合溶液中滴加 溶液,先产生 沉淀
[解析]
结合上述分析可知, 、 错误;该反应的平衡常数 , 正确;该混合溶液中形成 沉淀所需的 ,形成 沉淀所需的 ,形成 所需的 较小,所以先产生 沉淀, 错误。
3. [2023新课标卷,6分]向 饱和溶液(有足量 固体)中滴加氨水,发生反应 和 。 与 的关系如下图所示(其中 代表 、 、 或 )。
下列说法错误的是( A )
A. 曲线Ⅰ可视为 溶解度随 浓度变化曲线
B. 的溶度积常数
C. 反应 的平衡常数 的值为
D. 时,溶液中
[解析] 饱和溶液中存在 ,当滴入的氨水非常少时,可以认为 浓度和 浓度相等,随着氨水的滴入, 浓度减小, 的沉淀溶解平衡正向移动, 浓度增大, 的溶解度也增大,故曲线Ⅲ表示 ,曲线Ⅳ表示 ,曲线Ⅳ也可视为 的溶解度随 浓度的变化曲线, 错误; 的溶度积常数 仅与温度有关,由图可知,当 时, , ,则 ,B正确;随着氨水的滴入, 先转化为 , 再转化为 ,所以开始时, 浓度比 浓度小,则曲线Ⅰ表示 ,曲线Ⅱ表示 ,反应 的平衡常数 , 正确;结合上述分析及题图知,当 时,溶液中 , 正确。
4. [2022山东,4分]工业上以 为原料生产 ,对其工艺条件进行研究。现有含 的 、 溶液,含 的 、 溶液。在一定 范围内,四种溶液中 随 的变化关系如图所示。下列说法错误的是( D )
A. 反应 的平衡常数
B.
C. 曲线④代表含 的 溶液的变化曲线
D. 对含 且 和 初始浓度均为 的混合溶液, 时才发生沉淀转化
[解析]含 的 溶液中存在 ,改变溶液 对 溶解平衡无影响, 越大, 越小,故①代表含 的 溶液,②代表含 的 溶液;含 的 溶液中存在 、 ,减小 , 水解平衡正向移动,促使 溶解平衡正向移动, 增大, 相同时, 越大, 越小,故③代表含 的 溶液,④代表含 的 溶液。该反应的平衡常数 , 项正确;由 可知, ,②为含 的 溶液,则 , , 项正确;由上述分析可知, 项正确;由以上分析可知,该溶液中 ,根据图示知, 时即可发生沉淀的转化, 项错误。
5. [2022湖南,3分]室温时,用 的标准 溶液滴定 浓度相等的 、 和 混合溶液,通过电位滴定法获得 与 的关系曲线如图所示[忽略沉淀对离子的吸附作用。若溶液中离子浓度小于 时,认为该离子沉淀完全。 , , ]。
下列说法正确的是( C )
A. 点:有白色沉淀生成
B. 原溶液中 的浓度为
C. 当 沉淀完全时,已经有部分 沉淀
D. 点:
[解析]三种卤化银组成形式相同, 小的物质先形成沉淀,故 点时形成的是黄色的 沉淀, 项错误;由题图知,当消耗 溶液时,溶液中 、 、 均沉淀完全,由于三种卤素离子浓度相同,故每种离子完全沉淀时均消耗 溶液,则 ,解得 , 项错误;当 恰好沉淀完全时,溶液体积为 ,溶液中 ,此时 ,故此时有部分 形成了沉淀, 项正确; 点时溶液中 、 、 均沉淀完全, 过量, 最大, 项错误。
6. [2021全国甲卷,6分]已知相同温度下, 。某温度下,饱和溶液中 、 与 的关系如图所示。
下列说法正确的是( B )
A. 曲线①代表 的沉淀溶解曲线
B. 该温度下 的 值为
C. 加适量 固体可使溶液由 点变到 点
D. 时两溶液中
[解析]当横坐标均为5.1时,即 时,阴离子浓度 点 点, 、 两点均在沉淀溶解平衡曲线上,即溶度积常数 点 点,根据相同温度下, 知,曲线①代表 的沉淀溶解曲线,曲线②代表 的沉淀溶解曲线, 项错误;根据曲线①过横纵坐标均为5.0的点可知,溶解平衡体系中 ,则该温度下 , 项正确;加适量 固体,溶液中 增大,由于温度保持不变,即溶液中 减小,可使溶液由 点向 点移动, 项错误;当 时, 点平衡时 , 点平衡时 ,即两溶液中 , 项错误。
【解后反思】 曲线上任意一点都达到沉淀溶解平衡状态 。温度不变时, 不变,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。曲线上方区域的点所示溶液均为过饱和溶液, 。曲线下方区域的点所示溶液均为不饱和溶液, 。
7. [2021全国乙卷,6分] 是一元弱酸,难溶盐 的饱和溶液中 随 而变化, 不发生水解。实验发现, 时 为线性关系,如图中实线所示。
下列叙述错误的是( C )
A. 溶液 时,
B. 的溶度积
C. 溶液 时,
D. 的电离常数
[解析]溶液 时 ,由题图知,此时 , , 项正确;由题图知,当 时,可看作溶液中有较大浓度的 ,此时 的水解极大地被抑制,溶液中 ,则 , 项正确; 的饱和溶液因 水解而显碱性,只有加入一定量的酸才能使溶液显中性,若加入的酸不是 ,则溶液中除含有 、 、 、 四种离子外还含有其他阴离子,由电荷守恒原理知, 项错误;溶液中 ,根据 , 知,溶液中 ,两式联立可得 ,化简可得 , ,由题图知, 时, ,将数据代入计算得 , 项正确。
8. [2021江苏,3分]室温下,用 溶液浸泡 粉末,一段时间后过滤,向滤渣中加稀醋酸,产生气泡。已知 , 。下列说法正确的是( C )
A. 溶液中存在:
B. 反应 正向进行,需满足
C. 过滤后所得清液中一定存在: 且
D. 滤渣中加入醋酸发生反应的离子方程式:
[解析] 项, 溶液中的质子守恒式为 ,错误; 项,该反应的平衡常数 ,当 ,即 时,反应正向进行,错误; 项,滤渣溶于醋酸产生气泡,说明滤渣中含 ,则上层清液中存在 的沉淀溶解平衡,即存在 ,若 完全反应,则上层清液中存在 ,若 有剩余,则上层清液中存在 ,正确; 项,醋酸为弱酸,不可以拆开,错误。
题组五
一、选择题
1. [2022山东,2分]实验室用基准 配制标准溶液并标定盐酸浓度,应选甲基橙为指示剂,并以盐酸滴定 标准溶液。下列说法错误的是( A )
A. 可用量筒量取 标准溶液置于锥形瓶中
B. 应选用配带塑料塞的容量瓶配制 标准溶液
C. 应选用烧杯而非称量纸称量 固体
D. 达到滴定终点时溶液显橙色
[解析]量取 标准溶液应选择碱式滴定管或移液管, 项错误; 溶液呈碱性,能与玻璃中的二氧化硅反应,因此应选用配带塑料塞的容量瓶配制 标准溶液, 项正确;碳酸钠有吸湿性和一定的腐蚀性,称量碳酸钠固体时应选用烧杯, 项正确;达到滴定终点时溶液呈酸性,显橙色, 项正确。
2. [2022重庆,3分]某小组模拟成垢-除垢过程如下。
水溶液
忽略体积变化,且步骤②中反应完全。下列说法正确的是( D )
A. 经过步骤①,溶液中
B. 经过步骤②,溶液中
C. 经过步骤②,溶液中
D. 经过步骤③,溶液中
[解析]步骤①, 和 恰好完全反应, ,得到 和 ,根据物料守恒 知, 项错误;步骤②,发生反应 ,生成 ,剩余 和 , , 项错误;经过步骤②,溶液中存在物料守恒 , 项错误;步骤③加入 冰醋酸,根据物料守恒, , 项正确。
3. [2022福建,4分]探究醋酸浓度与电离度 关系的步骤如下,与相关步骤对应的操作或叙述正确的是(C)
步骤 操作或叙述
A Ⅰ.用 标准溶液标定醋酸溶液浓度 滴定时应始终注视滴定管中的液面
B Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液 应使用干燥的容量瓶
C Ⅲ.测定步骤Ⅱ中所得溶液的 应在相同温度下测定
D Ⅳ.计算不同浓度溶液中醋酸的电离度 计算式为
[解析]中和滴定时,应始终注视锥形瓶内溶液颜色的变化, 错误;用标定后的溶液配制不同浓度的醋酸溶液,由于最后需加蒸馏水定容,因此容量瓶无需干燥, 错误;由于醋酸的电离过程吸热,温度不同,醋酸的电离程度不同,溶液中 不同,因此需要在相同的温度下测定 溶液的 , 正确;醋酸的电离度等于已电离的醋酸分子占总醋酸分子的百分数,因此计算式为 , 错误。
4. [2022福建,4分]锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有 、 、 和 杂质离子,可在 范围内调节 对其净化(即相关离子浓度 )。 时, 与 关系如图[碱性过强时 和 会部分溶解]。下列说法正确的是( B )
A. 可被净化的 区间最大
B. 加入适量 ,可进一步提升净化程度
C. 净化的先后顺序: 、 、 、
D.
[解析]由题图可知,当 介于约 时, 被净化,当 介于约 时, 被净化,故 错误;结合题意及题图可知,加入适量 将 氧化为 可提升净化程度, 正确;由图像可以看出净化的先后顺序为 、 、 、 , 错误;结合题图知,溶度积的大小顺序为 , 错误。
二、非选择题
5. [2022广东,14分]食醋是烹饪美食的调味品,有效成分主要为醋酸(用 表示)。 的应用与其电离平衡密切相关。 时, 的 。
(1) 配制 的 溶液,需 溶液的体积为 (1分) 。
[解析]根据配制前后溶质的物质的量不变,列式: , ,得 。
(2) 下列关于 容量瓶的操作,正确的是C。
A. B.
C. D.
[解析]振荡时应用瓶塞塞住容量瓶口,不可用手指压住容量瓶口, 项错误;定容时眼睛应该平视刻度线且胶头滴管的尖嘴不能插入容量瓶内, 项错误;转移溶液时用玻璃棒引流,且玻璃棒下端紧靠在容量瓶刻度线以下的内壁上, 项正确;缺少另一只手托住瓶底, 项错误。
(3) 某小组研究 下 电离平衡的影响因素。
提出假设 稀释 溶液或改变 浓度, 电离平衡会发生移动。
设计方案并完成实验 用浓度均为 的 和 溶液,按下表配制总体积相同的系列溶液;测定 ,记录数据。
① 根据表中信息,补充数据: 3.00, 。
[解析]实验 中, ,两种溶液的浓度相等,当 时, ,为保证溶液的总体积为 ,则 。
② 由实验Ⅰ和Ⅱ可知,稀释 溶液,电离平衡正(填“正”或“逆”)向移动;结合表中数据,给出判断理由:实验Ⅱ中的 的浓度为实验Ⅰ的 ,稀释10倍后,假设电离平衡不移动,理论 为 ,实际 为 ,说明稀释 溶液时,促进了 的电离。
[解析]由实验Ⅰ、Ⅱ的数据分析,实验Ⅱ中 的浓度为实验Ⅰ中的 ,但是 没有从2.86变为 , 浓度相对变大(实际 为 ),说明稀释 溶液时,促进了 的电离。
③由实验Ⅱ 可知,增大 浓度, 电离平衡逆向移动。
实验结论 假设成立。
(4) 小组分析上表数据发现:随着 的增加, 的值逐渐接近 的 。
查阅资料获悉:一定条件下,按 配制的溶液中, 的值等于 的 。
对比数据发现,实验 中 与资料数据 存在一定差异;推测可能由物质浓度准确程度不够引起,故先准确测定 溶液的浓度再验证。
(ⅰ) 移取 溶液,加入2滴酚酞溶液,用 溶液滴定至终点,消耗体积为 ,则该 溶液的浓度为 。画出上述过程的滴定曲线示意图并标注滴定终点。
(ⅱ) 用上述 溶液和 溶液,配制等物质的量的 与 混合溶液,测定 ,结果与资料数据相符。
[答案]
[解析] 与 以物质的量为 反应,则 , 。 与 完全反应时,生成强碱弱酸盐 ,滴定终点时,溶液显碱性,所以加入 溶液时,对应的滴定终点溶液的 。
(5) 小组进一步提出:如果只有浓度均约为 的 和 溶液,如何准确测定 的 小组同学设计方案并进行实验。请完成下表中Ⅱ的内容。
Ⅰ 移取 溶液,用 溶液滴定至终点,消耗 溶液
Ⅱ 移取 溶液,向其中加入 溶液,测得溶液的 为4.76
实验总结 得到的结果与资料数据相符,方案可行。
[解析]醋酸的电离平衡: ,平衡常数 ,当 时, ,故在Ⅱ中,向 溶液中加入 溶液,反应后的溶液中 和 浓度相等,测定溶液的 ,即可得出 。
(6) 根据 可以判断弱酸的酸性强弱。写出一种无机弱酸及其用途 、杀菌消毒(其他合理答案也可)。
[解析] 为弱酸,可以用于自来水的杀菌消毒。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
