2019-2023年化学高考真题分类练--专题五 金属及其化合物(含解析)
文档属性
| 名称 | 2019-2023年化学高考真题分类练--专题五 金属及其化合物(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-17 00:00:00 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2019-2023年化学高考真题分类
专题五 金属及其化合物
题组一
一、选择题
1. [2022山东,4分]高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含 、 元素的杂质)为主要原料制备 粉的工艺流程如下,可能用到的数据见下表。
开始沉淀 1.9 4.2 6.2
沉淀完全 3.2 6.7 8.2
下列说法错误的是( )
A. 固体 主要成分是 和 ;金属 为
B. 浸取时,增大 压强可促进金属离子浸出
C. 中和调 的范围为
D. 还原时,增大溶液酸度有利于 的生成
2. [2021湖南,3分]一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( )
A. 物质 常选用生石灰
B. 工业上常用电解熔融 制备金属镁
C. “氯化”过程中发生的反应为
D. “煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水
3. [2020浙江7月选考,2分]下列说法正确的是( )
A. 在空气中加热可得固体
B. 加入到过量 溶液中可得
C. 在沸腾炉中与 反应主要生成
D. 溶液中加入少量 粉末生成 和
4. [2020浙江1月选考,2分]下列说法不正确的是( )
A. 可通过 溶液与过量氨水作用得到
B. 铁锈的主要成分可表示为
C. 钙单质可以从 中置换出
D. 可用 还原 制备单质
5. [2019江苏,2分]下列有关化学反应的叙述正确的是( )
A. 在稀硝酸中发生钝化
B. 和稀盐酸反应制取
C. 与过量氨水反应生成
D. 室温下 与空气中 反应制取
6. [2019天津理综,6分]下列有关金属及其化合物的应用不合理的是( )
A. 将废铁屑加入 溶液中,可用于除去工业废气中的
B. 铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多 等)不利于作物生长,可施加熟石灰进行改良
D. 无水 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
二、非选择题
7. [2022天津,14分]金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1) 基态 原子的价层电子轨道表示式为。
(2) 熔点为 ,工业上采用电解熔融 制备金属 。电解反应方程式如下:
加入 的目的是 。
(3) 的电子式为。
在 和 时, 与 反应生成 放热 ,写出该反应的热化学方程式: 。
(4) 采用空气和 为原料可直接制备 。空气与熔融金属 反应前,需依次通过 、 (填序号)。
.浓硫酸 .饱和食盐水
溶液 溶液
(5) 钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为 。
(6) 天然碱的主要成分为 , 经充分加热得到 的质量为 。
8. [2021全国乙卷,14分]磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的 如表所示。
金属离子
开始沉淀的 2.2 3.5 9.5 12.4
沉淀完全 的 3.2 4.7 11.1 13.8
回答下列问题:
(1) “焙烧”中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐。写出 转化为 的化学方程式 。
(2) “水浸”后“滤液”的 约为 ,在“分步沉淀”时用氨水逐步调节 至 ,依次析出的金属离子是 。
(3) “母液①”中 浓度为 。
(4) “水浸渣”在 “酸溶”,最适合的酸是 。“酸溶渣”的成分是 、 。
(5) “酸溶”后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是 。
(6) 将“母液①”和“母液②”混合,吸收尾气,经处理得 ,循环利用。
题组二
一、选择题
1. [2022湖北,3分] 和 的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是( )
A. 与 都能在水中与氨形成配合物
B. 和 的熔点都比 的低
C. 和 均可表现出弱酸性
D. 和 的氢化物都不能在酸中稳定存在
2. [2022湖南,3分]铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( )
A. 不宜用陶瓷作吸收塔内衬材料
B. 采用溶液喷淋法可提高吸收塔内烟气吸收效率
C. 合成槽中产物主要有 和
D. 滤液可回收进入吸收塔循环利用
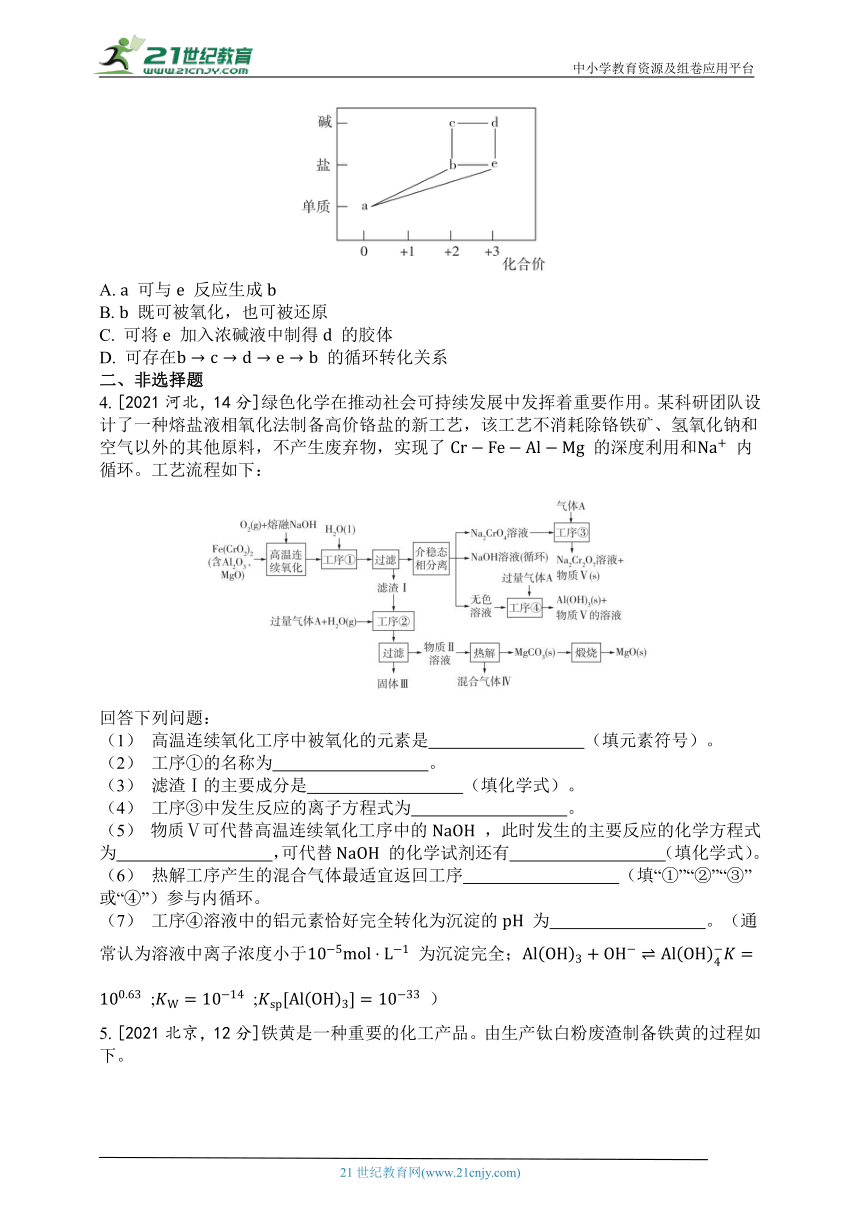
3. [2021广东,2分]部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A. 可与 反应生成
B. 既可被氧化,也可被还原
C. 可将 加入浓碱液中制得 的胶体
D. 可存在 的循环转化关系
二、非选择题
4. [2021河北,14分]绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了 的深度利用和 内循环。工艺流程如下:
回答下列问题:
(1) 高温连续氧化工序中被氧化的元素是 (填元素符号)。
(2) 工序①的名称为 。
(3) 滤渣Ⅰ的主要成分是 (填化学式)。
(4) 工序③中发生反应的离子方程式为 。
(5) 物质Ⅴ可代替高温连续氧化工序中的 ,此时发生的主要反应的化学方程式为 ,可代替 的化学试剂还有 (填化学式)。
(6) 热解工序产生的混合气体最适宜返回工序 (填“①”“②”“③”或“④”)参与内循环。
(7) 工序④溶液中的铝元素恰好完全转化为沉淀的 为 。(通常认为溶液中离子浓度小于 为沉淀完全; ; ; )
5. [2021北京,12分]铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
资料:ⅰ.钛白粉废渣成分:主要为 ,含少量 和不溶物
ⅲ. 生成 ,开始沉淀时 ,完全沉淀时
生成 ,开始沉淀时 ,完全沉淀时
(1) 纯化
① 加入过量铁粉的目的是 。
② 充分反应后,分离混合物的方法是 。
(2) 制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度 溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至 为6.0时开始通空气并记录 变化(如图)。
① 产生白色沉淀的离子方程式是 。
② 产生白色沉淀后的 低于资料ⅲ中的6.3。原因是:沉淀生成后 (填“ ”“ ”或“ ”)。
③ 时段, 几乎不变; 时段, 明显降低。结合方程式解释原因: 。
④ 时制得铁黄晶种。若继续通入空气, 后 几乎不变,此时溶液中 仍降低,但 增加,且 降低量大于 增加量。结合总方程式说明原因: 。
(3) 产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。
资料: , 不与稀碱液反应
过量,会使测定结果 (填“偏大”“偏小”或“不受影响”)。
题组三
1. [2023湖北,14分]学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1) 铜与浓硝酸反应的装置如图,仪器A的名称为 ,装置B的作用为 。
(2) 铜与过量 反应的探究如下:
实验②中 溶解的离子方程式为 ;
产生的气体为 。比较实验①和②,从氧化还原角度说明 的作用是 。
(3) 用足量 处理实验②新制的溶液得到沉淀 ,元素分析表明 为铜的氧化物,提纯干燥后的 在惰性氛围下加热, 完全分解为 黑色氧化物 , 。 的化学式为 。
(4) 取含 粗品 (杂质不参加反应)与过量的酸性 完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用 标准溶液滴定,滴定终点时消耗 标准溶液 。(已知: , )标志滴定终点的现象是 ,粗品中 的相对含量为 。
2. [2022山东,12分]实验室利用 和亚硫酰氯 制备无水 的装置如图所示(加热及夹持装置略)。已知 沸点为 ,遇水极易反应生成两种酸性气体。
回答下列问题:
(1) 实验开始先通 。一段时间后,先加热装置 (填“ ”或“ ”)。装置 内发生反应的化学方程式为 。装置 、 共同起到的作用是 。
(2) 现有含少量杂质的 ,为测定 值进行如下实验:
实验Ⅰ:称取 样品,用足量稀硫酸溶解后,用 标准溶液滴定 达终点时消耗 (滴定过程中 转化为 , 不反应)。
实验Ⅱ:另取 样品,利用上述装置与足量 反应后,固体质量为 。则 ;下列情况会导致 测量值偏小的是 (填标号)。
A.样品中含少量 杂质
B.样品与 反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
(3) 用上述装置,根据反应 制备 。已知 与 分子结构相似,与 互溶,但极易水解。选择合适仪器并组装蒸馏装置对 、 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧ (填序号),先馏出的物质为 。
3. [2022福建,13分]粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含 、 和 等)提铝的工艺流程如下:
回答下列问题:
(1) “浸出”时适当升温的主要目的是 , 发生反应的离子方程式为 。
(2) “浸渣”的主要成分除残余 外,还有 。实验测得, 粉煤灰 的质量分数为 经浸出、干燥后得到 “浸渣” 的质量分数为 , 的浸出率为 。
(3) “沉铝”时,体系中三种物质的溶解度曲线如图所示,加入 沉铝的目的是 ,“沉铝”的最佳方案为 。
(4) “焙烧”时,主要反应的化学方程式为 。
(5) “水浸”后得到的“滤液2”可返回 工序循环使用。
专题五 金属及其化合物
题组一
一、选择题
1. [2022山东,4分]高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含 、 元素的杂质)为主要原料制备 粉的工艺流程如下,可能用到的数据见下表。
开始沉淀 1.9 4.2 6.2
沉淀完全 3.2 6.7 8.2
下列说法错误的是( D )
A. 固体 主要成分是 和 ;金属 为
B. 浸取时,增大 压强可促进金属离子浸出
C. 中和调 的范围为
D. 还原时,增大溶液酸度有利于 的生成
[解析]
由上述分析知, 项正确;浸取时,增大 压强即增大反应物浓度,可加快反应速率,促进金属离子浸出, 项正确;中和调 是为了沉淀 而不沉淀 、 ,结合表中数据可知,调 的范围为 , 项正确;还原时发生反应 ,故增大溶液酸度不利于 的生成, 项错误。
2. [2021湖南,3分]一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( D )
A. 物质 常选用生石灰
B. 工业上常用电解熔融 制备金属镁
C. “氯化”过程中发生的反应为
D. “煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水
[解析] 项,苦卤水中有 ,沉镁时加入生石灰, 与 反应生成 , 与 反应生成 ,正确; 项, 是离子化合物,熔点不是很高,电解熔融 时发生反应 ,正确; 项,煅烧 生成 ,“氯化”时加入 、 ,反应生成 和 ,正确; 项,加热 溶液会促进 水解生成 ,最终得不到无水 ,错误。
3. [2020浙江7月选考,2分]下列说法正确的是( A )
A. 在空气中加热可得固体
B. 加入到过量 溶液中可得
C. 在沸腾炉中与 反应主要生成
D. 溶液中加入少量 粉末生成 和
[解析] 不稳定,在空气中加热可得到 , 项正确;镁加入过量的 溶液中只发生反应 ,得不到 , 项错误; 在沸腾炉中与氧气反应得到的是 ,不能得到 , 项错误;二氧化锰能催化过氧化氢分解,过氧化氢分解得到氧气和水, 项错误。
4. [2020浙江1月选考,2分]下列说法不正确的是( D )
A. 可通过 溶液与过量氨水作用得到
B. 铁锈的主要成分可表示为
C. 钙单质可以从 中置换出
D. 可用 还原 制备单质
[解析]向硫酸铜溶液中加入过量氨水能生成 , 正确;铁锈的主要成分是 的水合物,可表示为 , 正确;钙的还原性比钠强,类比钠能置换出四氯化钛中的钛,可知钙单质可以从熔融四氯化钛中置换出钛, 正确;镁的还原性比氢气强,不能用氢气还原氧化镁制备单质镁, 错误。
5. [2019江苏,2分]下列有关化学反应的叙述正确的是( C )
A. 在稀硝酸中发生钝化
B. 和稀盐酸反应制取
C. 与过量氨水反应生成
D. 室温下 与空气中 反应制取
[解析] 项,常温下, 在浓硝酸中会发生钝化,错误; 项, 与浓盐酸在加热条件下发生反应生成 ,与稀盐酸不反应,错误; 项,氨水过量, 与 发生反应生成 ,正确; 项,室温下, 与空气中 反应生成 ,错误。
6. [2019天津理综,6分]下列有关金属及其化合物的应用不合理的是( C )
A. 将废铁屑加入 溶液中,可用于除去工业废气中的
B. 铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多 等)不利于作物生长,可施加熟石灰进行改良
D. 无水 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
[解析]将废铁屑加入 溶液中,可用于除去工业废气中的 ,发生反应 、 , 项正确;铝中添加适量锂,制得的铝合金密度小、硬度大,可用于航空工业, 项正确;盐碱地中施加熟石灰,发生反应 ,生成的 为强碱,不利于作物生长, 项错误;无水 吸水后会发生颜色变化,可用于判断变色硅胶是否吸水, 项正确。
二、非选择题
7. [2022天津,14分]金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1) 基态 原子的价层电子轨道表示式为。
[解析]基态 原子的价层电子排布式为 ,价层电子轨道表示式为
(2) 熔点为 ,工业上采用电解熔融 制备金属 。电解反应方程式如下:
加入 的目的是作助熔剂,降低 的熔点,节省能耗。
[解析] 的熔点为 ,加入 时电解温度为 ,因此加入 的目的是降低 熔点,从而节省能耗。
(3) 的电子式为。
在 和 时, 与 反应生成 放热 ,写出该反应的热化学方程式: 。
[解析] 为离子化合物,电子式为。 ,生成 放热 ,则其 。
(4) 采用空气和 为原料可直接制备 。空气与熔融金属 反应前,需依次通过 (1分)、 (1分)(填序号)。
.浓硫酸 .饱和食盐水
溶液 溶液
[解析]空气中的水和二氧化碳能与 反应,所以与熔融金属 反应前,需依次通过氢氧化钠溶液和浓硫酸除去二氧化碳和水。
(5) 钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为 。
[解析] 位于晶胞的顶点和面心,个数为 , 位于晶胞体内,个数为8,则该氧化物的化学式为 。
(6) 天然碱的主要成分为 , 经充分加热得到 的质量为159 。
[解析]根据钠元素守恒, 经充分加热得到 ,其质量为 。
8. [2021全国乙卷,14分]磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的 如表所示。
金属离子
开始沉淀的 2.2 3.5 9.5 12.4
沉淀完全 的 3.2 4.7 11.1 13.8
回答下列问题:
(1) “焙烧”中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐。写出 转化为 的化学方程式 。
[解析]结合题图及题给信息可知焙烧时 转化为 ,尾气应为 ,则 焙烧生成 的化学方程式为 。
(2) “水浸”后“滤液”的 约为 ,在“分步沉淀”时用氨水逐步调节 至 ,依次析出的金属离子是 、 、 。
[解析]结合相关金属离子开始沉淀以及沉淀完全时的 可知,加氨水调节 至11.6的过程中, 、 、 依次沉淀。
(3) “母液①”中 浓度为 。
[解析]根据 沉淀完全时的 ,可知溶液中 时,溶液中 ,则 ,母液①的 ,即溶液中 ,则此时溶液中 。
(4) “水浸渣”在 “酸溶”,最适合的酸是硫酸。“酸溶渣”的成分是 (1分)、 。
[解析]由于常见的盐酸和硝酸均具有挥发性,且水浸渣需在 酸溶,因此最适宜的酸为硫酸。由于 不溶于硫酸,焙烧过程中得到的 微溶于水,故酸溶渣的成分为 、 。
(5) “酸溶”后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是 。
[解析]酸溶后适当加热能促进 水解生成 ,反应的离子方程式为 。
(6) 将“母液①”和“母液②”混合,吸收尾气,经处理得 ,循环利用。
[解析]结合题图流程可知,母液①中含有氨水、硫酸铵,母液②中含有硫酸,二者混合后再吸收尾气 ,经处理得到 。
题组二
一、选择题
1. [2022湖北,3分] 和 的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是( A )
A. 与 都能在水中与氨形成配合物
B. 和 的熔点都比 的低
C. 和 均可表现出弱酸性
D. 和 的氢化物都不能在酸中稳定存在
[解析] 不能在水中与氨形成配合物, 项错误; 和 均为分子晶体, 为离子晶体,故 的熔点较高, 项正确; 、 两元素性质相似,则 和 都能与 反应,均表现出弱酸性, 项正确; 和 的电负性比 小, 和 的氢化物中的 为 价,在酸中能与 发生归中反应,故 项正确。
2. [2022湖南,3分]铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( C )
A. 不宜用陶瓷作吸收塔内衬材料
B. 采用溶液喷淋法可提高吸收塔内烟气吸收效率
C. 合成槽中产物主要有 和
D. 滤液可回收进入吸收塔循环利用
[解析]
陶瓷中的 能与 反应, 项正确;喷淋法能使溶液与烟气充分接触,提高吸收效率, 项正确; 根据流程梳理知,产物主要有 和 , 项错误;滤液中含有 ,可用作吸收塔中的吸收剂, 项正确。
3. [2021广东,2分]部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( C )
A. 可与 反应生成
B. 既可被氧化,也可被还原
C. 可将 加入浓碱液中制得 的胶体
D. 可存在 的循环转化关系
[解析] 能与 发生归中反应生成 , 项正确; 既有氧化性又有还原性,既能被氧化又能被还原, 项正确;将 加入浓碱溶液中得到 沉淀,而不能制得 胶体, 项错误;溶液中可存在循环转化: , 项正确。
【思路点拨】 由题图可知, 为 , 为亚铁盐, 为铁盐; 、 均为碱且 分别为 价和 价,则 为 、 为 。
二、非选择题
4. [2021河北,14分]绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了 的深度利用和 内循环。工艺流程如下:
回答下列问题:
(1) 高温连续氧化工序中被氧化的元素是 、 (填元素符号)。
[解析]根据工艺流程图,高温连续氧化工序中发生的氧化还原反应为 ,故被氧化的元素为 、 。
(2) 工序①的名称为水浸。
[解析]工序①中加入液体水,为水浸过程。
(3) 滤渣Ⅰ的主要成分是 、 (填化学式)。
[解析]根据流程图,高温连续氧化时 不反应,经过工序①, 转化为 ,又高温连续氧化时生成的 不溶于水,因此滤渣Ⅰ的主要成分为 、 。
(4) 工序③中发生反应的离子方程式为 。
[解析]工序③中 转化为 ,分析流程知无色溶液中含有 ,结合工序④,可推知气体 为 ,则工序③中发生反应的离子方程式为 。
(5) 物质Ⅴ可代替高温连续氧化工序中的 ,此时发生的主要反应的化学方程式为 ,可代替 的化学试剂还有 (填化学式)。
[解析]物质Ⅴ为 ,若代替连续氧化工序中的 ,发生的主要反应的化学方程式为 ,可代替 的化学试剂还有 。
(6) 热解工序产生的混合气体最适宜返回工序②(填“①”“②”“③”或“④”)参与内循环。
[解析]滤渣Ⅰ的主要成分为 、 ,通入过量的 和 , 转化为 ,热解时 发生分解反应,得到的混合气体为 和 ,因此最适宜返回工序②进行内循环。
(7) 工序④溶液中的铝元素恰好完全转化为沉淀的 为 。(通常认为溶液中离子浓度小于 为沉淀完全; ; ; )
[解析]工序④中发生反应 、 ,当 沉淀完全时,根据 ,知 , , 。
5. [2021北京,12分]铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
资料:ⅰ.钛白粉废渣成分:主要为 ,含少量 和不溶物
ⅲ. 生成 ,开始沉淀时 ,完全沉淀时
生成 ,开始沉淀时 ,完全沉淀时
(1) 纯化
① 加入过量铁粉的目的是与硫酸反应,使得 平衡正向移动,沉钛;防止二价铁被氧化(任答一点即可)。
[解析]钛白粉废渣中加入蒸馏水溶解,溶液中存在 ,加入的过量铁粉能消耗 ,促使该平衡正向移动,达到沉钛的目的,同时还能防止 被氧化。
② 充分反应后,分离混合物的方法是过滤。
[解析]充分反应后通过过滤的方法分离固体和溶液。
(2) 制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度 溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至 为6.0时开始通空气并记录 变化(如图)。
① 产生白色沉淀的离子方程式是 。
[解析] 溶液中加入氨水产生的白色沉淀为 ,其离子方程式为 。
② 产生白色沉淀后的 低于资料ⅲ中的6.3。原因是:沉淀生成后 (填“ ”“ ”或“ ”)。
[解析]产生白色沉淀后,溶液 ,即溶液中 减小,根据 可知溶液中 。
③ 时段, 几乎不变; 时段, 明显降低。结合方程式解释原因: 为6.0左右,发生反应 ,因此 几乎不变,之后发生反应 ,溶液中 浓度增大, 减小。
[解析]由实验现象知, 为6.0左右,溶液中发生反应 ,故 时段 几乎不变,而 时段溶液中 被氧化生成 且产生 ,即 ,溶液中 浓度增大, 减小。
④ 时制得铁黄晶种。若继续通入空气, 后 几乎不变,此时溶液中 仍降低,但 增加,且 降低量大于 增加量。结合总方程式说明原因:溶液中同时存在反应 和 ,总反应为 ,因此 的减小量大于 的增加量。
[解析]据题图可知 时刻后,溶液的 几乎不变,溶液中同时存在反应 和 ,总反应为 ,故溶液中 的减小量大于 的增加量。
(3) 产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。
资料: , 不与稀碱液反应
过量,会使测定结果不受影响(填“偏大”“偏小”或“不受影响”)。
[解析]结合测定流程,可知 用于中和过量的 标准溶液,过量的 不与 标准溶液反应,故对测定结果无影响。
题组三
1. [2023湖北,14分]学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1) 铜与浓硝酸反应的装置如图,仪器A的名称为具支试管,装置B的作用为安全瓶(防倒吸)。
[解析]仪器 的名称为具支试管; 与浓 反应产生的尾气直接用 溶液吸收会引发溶液倒吸,装置 起安全瓶的作用,防止倒吸。
(2) 铜与过量 反应的探究如下:
实验②中 溶解的离子方程式为 ;
产生的气体为 。比较实验①和②,从氧化还原角度说明 的作用是增强 的氧化性。
[解析] 在稀 作用下,被 氧化生成 和 ,溶液变蓝。 作用下, 会被催化分解生成 。在 溶液中 不能氧化 ,在稀 中 能氧化 ,说明 使得 的氧化性增强。
(3) 用足量 处理实验②新制的溶液得到沉淀 ,元素分析表明 为铜的氧化物,提纯干燥后的 在惰性氛围下加热, 完全分解为 黑色氧化物 , 。 的化学式为 。
[解析] 为铜的氧化物,设 的化学式为 ,其在惰性氛围下分解生成黑色氧化物 ,则:
则 ,又 ,解得 ,则 的化学式为 。
(4) 取含 粗品 (杂质不参加反应)与过量的酸性 完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用 标准溶液滴定,滴定终点时消耗 标准溶液 。(已知: , )标志滴定终点的现象是滴入最后半滴 标准溶液时,溶液蓝色刚好褪去,且半分钟内不恢复,粗品中 的相对含量为 。
[解析] 在酸性条件下生成 , 与 反应生成 , 遇淀粉变蓝,用 标准溶液滴定 ,当滴入最后半滴 标准溶液时,溶液的蓝色褪去,且半分钟内不恢复时,表明 已完全反应,达到滴定终点。 中 为 价、 为 价,结合已知反应可知, 在酸性条件下与 发生反应 ,则 ,则样品中 , 。
2. [2022山东,12分]实验室利用 和亚硫酰氯 制备无水 的装置如图所示(加热及夹持装置略)。已知 沸点为 ,遇水极易反应生成两种酸性气体。
回答下列问题:
(1) 实验开始先通 。一段时间后,先加热装置 (填“ ”或“ ”)。装置 内发生反应的化学方程式为 。装置 、 共同起到的作用是冷凝并回收利用 (冷凝回流)。
[解析]根据 遇水极易反应生成两种酸性气体,知应先加热装置 ,后加热装置 ,以使 分解产生的水蒸气及时被 吸收,防止 水解。装置 内发生的反应可以看成是 先分解产生 和水蒸气,水蒸气再与 发生反应生成 、 。装置 为球形冷凝管,装置 为长导管,共同起到冷凝并回收利用 的作用。
(2) 现有含少量杂质的 ,为测定 值进行如下实验:
实验Ⅰ:称取 样品,用足量稀硫酸溶解后,用 标准溶液滴定 达终点时消耗 (滴定过程中 转化为 , 不反应)。
实验Ⅱ:另取 样品,利用上述装置与足量 反应后,固体质量为 。则 ;下列情况会导致 测量值偏小的是 (填标号)。
A.样品中含少量 杂质
B.样品与 反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
[解析]实验Ⅰ的反应原理为 ,则 ;实验Ⅱ中 ,固体减少的质量为水的质量,则 ,故 。若样品中含有少量 杂质,则消耗的 标准溶液体积偏大, 值偏大,根据 知, 测量值偏小, 项正确;样品与 反应时失水不充分,则 偏小, 测量值偏小, 项正确;实验Ⅰ中称重后样品发生了潮解,对 含量的测定无影响, 测量值不变, 项错误;滴定达终点时发现滴定管尖嘴内有气泡生成,则 值偏小, 测量值偏大, 项错误。
(3) 用上述装置,根据反应 制备 。已知 与 分子结构相似,与 互溶,但极易水解。选择合适仪器并组装蒸馏装置对 、 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧⑥⑩③⑤(填序号),先馏出的物质为 。
[解析]根据蒸馏装置组成特点及 极易水解,按照由下到上、由左到右的仪器组装原则知,仪器安装顺序为①⑨⑧⑥⑩③⑤,⑤用于吸收空气中水分,防止 水解。 与 分子结构相似,均为分子晶体, 的相对分子质量大,沸点高,则先馏出的是沸点较低的 。
3. [2022福建,13分]粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含 、 和 等)提铝的工艺流程如下:
回答下列问题:
(1) “浸出”时适当升温的主要目的是提高浸出率(或提高浸出速率), 发生反应的离子方程式为 。
[解析]升高温度,化学反应速率加快,从而提高“浸出”时的浸出率, 属于两性氧化物,既可以与强酸反应生成盐和水,又可以与强碱反应生成盐和水, 与硫酸反应的离子方程式为 。
(2) “浸渣”的主要成分除残余 外,还有 和 。实验测得, 粉煤灰 的质量分数为 经浸出、干燥后得到 “浸渣” 的质量分数为 , 的浸出率为 。
[解析]由于 与硫酸不反应, 微溶,因此“浸渣”的主要成分除残余 外,还有 和 ; 粉煤灰 的质量分数为 中 ,“浸渣” 的质量分数为 中 ,则 的浸出率为 。
(3) “沉铝”时,体系中三种物质的溶解度曲线如图所示,加入 沉铝的目的是使更多的铝元素转化为晶体析出,同时保证晶体纯度,“沉铝”的最佳方案为高温溶解再冷却结晶。
[解析]由同离子效应和题图知,“沉铝”时,向 溶液中加入 ,可以使更多的铝元素转化为 析出,同时保证纯度,由题图可以看出, 的溶解度受温度影响最大,因此“沉铝”的最佳方案为高温溶解、冷却结晶。
(4) “焙烧”时,主要反应的化学方程式为 或 。
[解析]由流程图可以看出,“焙烧”时生成气体,所得固体产物经“水浸”得到 ,则根据元素守恒可得到 高温分解的化学方程式为 或 。
(5) “水浸”后得到的“滤液2”可返回沉铝工序循环使用。
[解析]“水浸”后得到的“滤液2”的主要成分为 ,可返回沉铝工序循环使用。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2019-2023年化学高考真题分类
专题五 金属及其化合物
题组一
一、选择题
1. [2022山东,4分]高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含 、 元素的杂质)为主要原料制备 粉的工艺流程如下,可能用到的数据见下表。
开始沉淀 1.9 4.2 6.2
沉淀完全 3.2 6.7 8.2
下列说法错误的是( )
A. 固体 主要成分是 和 ;金属 为
B. 浸取时,增大 压强可促进金属离子浸出
C. 中和调 的范围为
D. 还原时,增大溶液酸度有利于 的生成
2. [2021湖南,3分]一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( )
A. 物质 常选用生石灰
B. 工业上常用电解熔融 制备金属镁
C. “氯化”过程中发生的反应为
D. “煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水
3. [2020浙江7月选考,2分]下列说法正确的是( )
A. 在空气中加热可得固体
B. 加入到过量 溶液中可得
C. 在沸腾炉中与 反应主要生成
D. 溶液中加入少量 粉末生成 和
4. [2020浙江1月选考,2分]下列说法不正确的是( )
A. 可通过 溶液与过量氨水作用得到
B. 铁锈的主要成分可表示为
C. 钙单质可以从 中置换出
D. 可用 还原 制备单质
5. [2019江苏,2分]下列有关化学反应的叙述正确的是( )
A. 在稀硝酸中发生钝化
B. 和稀盐酸反应制取
C. 与过量氨水反应生成
D. 室温下 与空气中 反应制取
6. [2019天津理综,6分]下列有关金属及其化合物的应用不合理的是( )
A. 将废铁屑加入 溶液中,可用于除去工业废气中的
B. 铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多 等)不利于作物生长,可施加熟石灰进行改良
D. 无水 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
二、非选择题
7. [2022天津,14分]金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1) 基态 原子的价层电子轨道表示式为。
(2) 熔点为 ,工业上采用电解熔融 制备金属 。电解反应方程式如下:
加入 的目的是 。
(3) 的电子式为。
在 和 时, 与 反应生成 放热 ,写出该反应的热化学方程式: 。
(4) 采用空气和 为原料可直接制备 。空气与熔融金属 反应前,需依次通过 、 (填序号)。
.浓硫酸 .饱和食盐水
溶液 溶液
(5) 钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为 。
(6) 天然碱的主要成分为 , 经充分加热得到 的质量为 。
8. [2021全国乙卷,14分]磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的 如表所示。
金属离子
开始沉淀的 2.2 3.5 9.5 12.4
沉淀完全 的 3.2 4.7 11.1 13.8
回答下列问题:
(1) “焙烧”中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐。写出 转化为 的化学方程式 。
(2) “水浸”后“滤液”的 约为 ,在“分步沉淀”时用氨水逐步调节 至 ,依次析出的金属离子是 。
(3) “母液①”中 浓度为 。
(4) “水浸渣”在 “酸溶”,最适合的酸是 。“酸溶渣”的成分是 、 。
(5) “酸溶”后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是 。
(6) 将“母液①”和“母液②”混合,吸收尾气,经处理得 ,循环利用。
题组二
一、选择题
1. [2022湖北,3分] 和 的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是( )
A. 与 都能在水中与氨形成配合物
B. 和 的熔点都比 的低
C. 和 均可表现出弱酸性
D. 和 的氢化物都不能在酸中稳定存在
2. [2022湖南,3分]铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( )
A. 不宜用陶瓷作吸收塔内衬材料
B. 采用溶液喷淋法可提高吸收塔内烟气吸收效率
C. 合成槽中产物主要有 和
D. 滤液可回收进入吸收塔循环利用
3. [2021广东,2分]部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A. 可与 反应生成
B. 既可被氧化,也可被还原
C. 可将 加入浓碱液中制得 的胶体
D. 可存在 的循环转化关系
二、非选择题
4. [2021河北,14分]绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了 的深度利用和 内循环。工艺流程如下:
回答下列问题:
(1) 高温连续氧化工序中被氧化的元素是 (填元素符号)。
(2) 工序①的名称为 。
(3) 滤渣Ⅰ的主要成分是 (填化学式)。
(4) 工序③中发生反应的离子方程式为 。
(5) 物质Ⅴ可代替高温连续氧化工序中的 ,此时发生的主要反应的化学方程式为 ,可代替 的化学试剂还有 (填化学式)。
(6) 热解工序产生的混合气体最适宜返回工序 (填“①”“②”“③”或“④”)参与内循环。
(7) 工序④溶液中的铝元素恰好完全转化为沉淀的 为 。(通常认为溶液中离子浓度小于 为沉淀完全; ; ; )
5. [2021北京,12分]铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
资料:ⅰ.钛白粉废渣成分:主要为 ,含少量 和不溶物
ⅲ. 生成 ,开始沉淀时 ,完全沉淀时
生成 ,开始沉淀时 ,完全沉淀时
(1) 纯化
① 加入过量铁粉的目的是 。
② 充分反应后,分离混合物的方法是 。
(2) 制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度 溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至 为6.0时开始通空气并记录 变化(如图)。
① 产生白色沉淀的离子方程式是 。
② 产生白色沉淀后的 低于资料ⅲ中的6.3。原因是:沉淀生成后 (填“ ”“ ”或“ ”)。
③ 时段, 几乎不变; 时段, 明显降低。结合方程式解释原因: 。
④ 时制得铁黄晶种。若继续通入空气, 后 几乎不变,此时溶液中 仍降低,但 增加,且 降低量大于 增加量。结合总方程式说明原因: 。
(3) 产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。
资料: , 不与稀碱液反应
过量,会使测定结果 (填“偏大”“偏小”或“不受影响”)。
题组三
1. [2023湖北,14分]学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1) 铜与浓硝酸反应的装置如图,仪器A的名称为 ,装置B的作用为 。
(2) 铜与过量 反应的探究如下:
实验②中 溶解的离子方程式为 ;
产生的气体为 。比较实验①和②,从氧化还原角度说明 的作用是 。
(3) 用足量 处理实验②新制的溶液得到沉淀 ,元素分析表明 为铜的氧化物,提纯干燥后的 在惰性氛围下加热, 完全分解为 黑色氧化物 , 。 的化学式为 。
(4) 取含 粗品 (杂质不参加反应)与过量的酸性 完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用 标准溶液滴定,滴定终点时消耗 标准溶液 。(已知: , )标志滴定终点的现象是 ,粗品中 的相对含量为 。
2. [2022山东,12分]实验室利用 和亚硫酰氯 制备无水 的装置如图所示(加热及夹持装置略)。已知 沸点为 ,遇水极易反应生成两种酸性气体。
回答下列问题:
(1) 实验开始先通 。一段时间后,先加热装置 (填“ ”或“ ”)。装置 内发生反应的化学方程式为 。装置 、 共同起到的作用是 。
(2) 现有含少量杂质的 ,为测定 值进行如下实验:
实验Ⅰ:称取 样品,用足量稀硫酸溶解后,用 标准溶液滴定 达终点时消耗 (滴定过程中 转化为 , 不反应)。
实验Ⅱ:另取 样品,利用上述装置与足量 反应后,固体质量为 。则 ;下列情况会导致 测量值偏小的是 (填标号)。
A.样品中含少量 杂质
B.样品与 反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
(3) 用上述装置,根据反应 制备 。已知 与 分子结构相似,与 互溶,但极易水解。选择合适仪器并组装蒸馏装置对 、 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧ (填序号),先馏出的物质为 。
3. [2022福建,13分]粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含 、 和 等)提铝的工艺流程如下:
回答下列问题:
(1) “浸出”时适当升温的主要目的是 , 发生反应的离子方程式为 。
(2) “浸渣”的主要成分除残余 外,还有 。实验测得, 粉煤灰 的质量分数为 经浸出、干燥后得到 “浸渣” 的质量分数为 , 的浸出率为 。
(3) “沉铝”时,体系中三种物质的溶解度曲线如图所示,加入 沉铝的目的是 ,“沉铝”的最佳方案为 。
(4) “焙烧”时,主要反应的化学方程式为 。
(5) “水浸”后得到的“滤液2”可返回 工序循环使用。
专题五 金属及其化合物
题组一
一、选择题
1. [2022山东,4分]高压氢还原法可直接从溶液中提取金属粉。以硫化铜精矿(含 、 元素的杂质)为主要原料制备 粉的工艺流程如下,可能用到的数据见下表。
开始沉淀 1.9 4.2 6.2
沉淀完全 3.2 6.7 8.2
下列说法错误的是( D )
A. 固体 主要成分是 和 ;金属 为
B. 浸取时,增大 压强可促进金属离子浸出
C. 中和调 的范围为
D. 还原时,增大溶液酸度有利于 的生成
[解析]
由上述分析知, 项正确;浸取时,增大 压强即增大反应物浓度,可加快反应速率,促进金属离子浸出, 项正确;中和调 是为了沉淀 而不沉淀 、 ,结合表中数据可知,调 的范围为 , 项正确;还原时发生反应 ,故增大溶液酸度不利于 的生成, 项错误。
2. [2021湖南,3分]一种工业制备无水氯化镁的工艺流程如下:
下列说法错误的是( D )
A. 物质 常选用生石灰
B. 工业上常用电解熔融 制备金属镁
C. “氯化”过程中发生的反应为
D. “煅烧”后的产物中加稀盐酸,将所得溶液加热蒸发也可得到无水
[解析] 项,苦卤水中有 ,沉镁时加入生石灰, 与 反应生成 , 与 反应生成 ,正确; 项, 是离子化合物,熔点不是很高,电解熔融 时发生反应 ,正确; 项,煅烧 生成 ,“氯化”时加入 、 ,反应生成 和 ,正确; 项,加热 溶液会促进 水解生成 ,最终得不到无水 ,错误。
3. [2020浙江7月选考,2分]下列说法正确的是( A )
A. 在空气中加热可得固体
B. 加入到过量 溶液中可得
C. 在沸腾炉中与 反应主要生成
D. 溶液中加入少量 粉末生成 和
[解析] 不稳定,在空气中加热可得到 , 项正确;镁加入过量的 溶液中只发生反应 ,得不到 , 项错误; 在沸腾炉中与氧气反应得到的是 ,不能得到 , 项错误;二氧化锰能催化过氧化氢分解,过氧化氢分解得到氧气和水, 项错误。
4. [2020浙江1月选考,2分]下列说法不正确的是( D )
A. 可通过 溶液与过量氨水作用得到
B. 铁锈的主要成分可表示为
C. 钙单质可以从 中置换出
D. 可用 还原 制备单质
[解析]向硫酸铜溶液中加入过量氨水能生成 , 正确;铁锈的主要成分是 的水合物,可表示为 , 正确;钙的还原性比钠强,类比钠能置换出四氯化钛中的钛,可知钙单质可以从熔融四氯化钛中置换出钛, 正确;镁的还原性比氢气强,不能用氢气还原氧化镁制备单质镁, 错误。
5. [2019江苏,2分]下列有关化学反应的叙述正确的是( C )
A. 在稀硝酸中发生钝化
B. 和稀盐酸反应制取
C. 与过量氨水反应生成
D. 室温下 与空气中 反应制取
[解析] 项,常温下, 在浓硝酸中会发生钝化,错误; 项, 与浓盐酸在加热条件下发生反应生成 ,与稀盐酸不反应,错误; 项,氨水过量, 与 发生反应生成 ,正确; 项,室温下, 与空气中 反应生成 ,错误。
6. [2019天津理综,6分]下列有关金属及其化合物的应用不合理的是( C )
A. 将废铁屑加入 溶液中,可用于除去工业废气中的
B. 铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业
C. 盐碱地(含较多 等)不利于作物生长,可施加熟石灰进行改良
D. 无水 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水
[解析]将废铁屑加入 溶液中,可用于除去工业废气中的 ,发生反应 、 , 项正确;铝中添加适量锂,制得的铝合金密度小、硬度大,可用于航空工业, 项正确;盐碱地中施加熟石灰,发生反应 ,生成的 为强碱,不利于作物生长, 项错误;无水 吸水后会发生颜色变化,可用于判断变色硅胶是否吸水, 项正确。
二、非选择题
7. [2022天津,14分]金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1) 基态 原子的价层电子轨道表示式为。
[解析]基态 原子的价层电子排布式为 ,价层电子轨道表示式为
(2) 熔点为 ,工业上采用电解熔融 制备金属 。电解反应方程式如下:
加入 的目的是作助熔剂,降低 的熔点,节省能耗。
[解析] 的熔点为 ,加入 时电解温度为 ,因此加入 的目的是降低 熔点,从而节省能耗。
(3) 的电子式为。
在 和 时, 与 反应生成 放热 ,写出该反应的热化学方程式: 。
[解析] 为离子化合物,电子式为。 ,生成 放热 ,则其 。
(4) 采用空气和 为原料可直接制备 。空气与熔融金属 反应前,需依次通过 (1分)、 (1分)(填序号)。
.浓硫酸 .饱和食盐水
溶液 溶液
[解析]空气中的水和二氧化碳能与 反应,所以与熔融金属 反应前,需依次通过氢氧化钠溶液和浓硫酸除去二氧化碳和水。
(5) 钠的某氧化物晶胞如图,图中所示钠离子全部位于晶胞内。由晶胞图判断该氧化物的化学式为 。
[解析] 位于晶胞的顶点和面心,个数为 , 位于晶胞体内,个数为8,则该氧化物的化学式为 。
(6) 天然碱的主要成分为 , 经充分加热得到 的质量为159 。
[解析]根据钠元素守恒, 经充分加热得到 ,其质量为 。
8. [2021全国乙卷,14分]磁选后的炼铁高钛炉渣,主要成分有 、 、 、 、 以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的 如表所示。
金属离子
开始沉淀的 2.2 3.5 9.5 12.4
沉淀完全 的 3.2 4.7 11.1 13.8
回答下列问题:
(1) “焙烧”中, 、 几乎不发生反应, 、 、 、 转化为相应的硫酸盐。写出 转化为 的化学方程式 。
[解析]结合题图及题给信息可知焙烧时 转化为 ,尾气应为 ,则 焙烧生成 的化学方程式为 。
(2) “水浸”后“滤液”的 约为 ,在“分步沉淀”时用氨水逐步调节 至 ,依次析出的金属离子是 、 、 。
[解析]结合相关金属离子开始沉淀以及沉淀完全时的 可知,加氨水调节 至11.6的过程中, 、 、 依次沉淀。
(3) “母液①”中 浓度为 。
[解析]根据 沉淀完全时的 ,可知溶液中 时,溶液中 ,则 ,母液①的 ,即溶液中 ,则此时溶液中 。
(4) “水浸渣”在 “酸溶”,最适合的酸是硫酸。“酸溶渣”的成分是 (1分)、 。
[解析]由于常见的盐酸和硝酸均具有挥发性,且水浸渣需在 酸溶,因此最适宜的酸为硫酸。由于 不溶于硫酸,焙烧过程中得到的 微溶于水,故酸溶渣的成分为 、 。
(5) “酸溶”后,将溶液适当稀释并加热, 水解析出 沉淀,该反应的离子方程式是 。
[解析]酸溶后适当加热能促进 水解生成 ,反应的离子方程式为 。
(6) 将“母液①”和“母液②”混合,吸收尾气,经处理得 ,循环利用。
[解析]结合题图流程可知,母液①中含有氨水、硫酸铵,母液②中含有硫酸,二者混合后再吸收尾气 ,经处理得到 。
题组二
一、选择题
1. [2022湖北,3分] 和 的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是( A )
A. 与 都能在水中与氨形成配合物
B. 和 的熔点都比 的低
C. 和 均可表现出弱酸性
D. 和 的氢化物都不能在酸中稳定存在
[解析] 不能在水中与氨形成配合物, 项错误; 和 均为分子晶体, 为离子晶体,故 的熔点较高, 项正确; 、 两元素性质相似,则 和 都能与 反应,均表现出弱酸性, 项正确; 和 的电负性比 小, 和 的氢化物中的 为 价,在酸中能与 发生归中反应,故 项正确。
2. [2022湖南,3分]铝电解厂烟气净化的一种简单流程如下:
下列说法错误的是( C )
A. 不宜用陶瓷作吸收塔内衬材料
B. 采用溶液喷淋法可提高吸收塔内烟气吸收效率
C. 合成槽中产物主要有 和
D. 滤液可回收进入吸收塔循环利用
[解析]
陶瓷中的 能与 反应, 项正确;喷淋法能使溶液与烟气充分接触,提高吸收效率, 项正确; 根据流程梳理知,产物主要有 和 , 项错误;滤液中含有 ,可用作吸收塔中的吸收剂, 项正确。
3. [2021广东,2分]部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( C )
A. 可与 反应生成
B. 既可被氧化,也可被还原
C. 可将 加入浓碱液中制得 的胶体
D. 可存在 的循环转化关系
[解析] 能与 发生归中反应生成 , 项正确; 既有氧化性又有还原性,既能被氧化又能被还原, 项正确;将 加入浓碱溶液中得到 沉淀,而不能制得 胶体, 项错误;溶液中可存在循环转化: , 项正确。
【思路点拨】 由题图可知, 为 , 为亚铁盐, 为铁盐; 、 均为碱且 分别为 价和 价,则 为 、 为 。
二、非选择题
4. [2021河北,14分]绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了 的深度利用和 内循环。工艺流程如下:
回答下列问题:
(1) 高温连续氧化工序中被氧化的元素是 、 (填元素符号)。
[解析]根据工艺流程图,高温连续氧化工序中发生的氧化还原反应为 ,故被氧化的元素为 、 。
(2) 工序①的名称为水浸。
[解析]工序①中加入液体水,为水浸过程。
(3) 滤渣Ⅰ的主要成分是 、 (填化学式)。
[解析]根据流程图,高温连续氧化时 不反应,经过工序①, 转化为 ,又高温连续氧化时生成的 不溶于水,因此滤渣Ⅰ的主要成分为 、 。
(4) 工序③中发生反应的离子方程式为 。
[解析]工序③中 转化为 ,分析流程知无色溶液中含有 ,结合工序④,可推知气体 为 ,则工序③中发生反应的离子方程式为 。
(5) 物质Ⅴ可代替高温连续氧化工序中的 ,此时发生的主要反应的化学方程式为 ,可代替 的化学试剂还有 (填化学式)。
[解析]物质Ⅴ为 ,若代替连续氧化工序中的 ,发生的主要反应的化学方程式为 ,可代替 的化学试剂还有 。
(6) 热解工序产生的混合气体最适宜返回工序②(填“①”“②”“③”或“④”)参与内循环。
[解析]滤渣Ⅰ的主要成分为 、 ,通入过量的 和 , 转化为 ,热解时 发生分解反应,得到的混合气体为 和 ,因此最适宜返回工序②进行内循环。
(7) 工序④溶液中的铝元素恰好完全转化为沉淀的 为 。(通常认为溶液中离子浓度小于 为沉淀完全; ; ; )
[解析]工序④中发生反应 、 ,当 沉淀完全时,根据 ,知 , , 。
5. [2021北京,12分]铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
资料:ⅰ.钛白粉废渣成分:主要为 ,含少量 和不溶物
ⅲ. 生成 ,开始沉淀时 ,完全沉淀时
生成 ,开始沉淀时 ,完全沉淀时
(1) 纯化
① 加入过量铁粉的目的是与硫酸反应,使得 平衡正向移动,沉钛;防止二价铁被氧化(任答一点即可)。
[解析]钛白粉废渣中加入蒸馏水溶解,溶液中存在 ,加入的过量铁粉能消耗 ,促使该平衡正向移动,达到沉钛的目的,同时还能防止 被氧化。
② 充分反应后,分离混合物的方法是过滤。
[解析]充分反应后通过过滤的方法分离固体和溶液。
(2) 制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度 溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至 为6.0时开始通空气并记录 变化(如图)。
① 产生白色沉淀的离子方程式是 。
[解析] 溶液中加入氨水产生的白色沉淀为 ,其离子方程式为 。
② 产生白色沉淀后的 低于资料ⅲ中的6.3。原因是:沉淀生成后 (填“ ”“ ”或“ ”)。
[解析]产生白色沉淀后,溶液 ,即溶液中 减小,根据 可知溶液中 。
③ 时段, 几乎不变; 时段, 明显降低。结合方程式解释原因: 为6.0左右,发生反应 ,因此 几乎不变,之后发生反应 ,溶液中 浓度增大, 减小。
[解析]由实验现象知, 为6.0左右,溶液中发生反应 ,故 时段 几乎不变,而 时段溶液中 被氧化生成 且产生 ,即 ,溶液中 浓度增大, 减小。
④ 时制得铁黄晶种。若继续通入空气, 后 几乎不变,此时溶液中 仍降低,但 增加,且 降低量大于 增加量。结合总方程式说明原因:溶液中同时存在反应 和 ,总反应为 ,因此 的减小量大于 的增加量。
[解析]据题图可知 时刻后,溶液的 几乎不变,溶液中同时存在反应 和 ,总反应为 ,故溶液中 的减小量大于 的增加量。
(3) 产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。
资料: , 不与稀碱液反应
过量,会使测定结果不受影响(填“偏大”“偏小”或“不受影响”)。
[解析]结合测定流程,可知 用于中和过量的 标准溶液,过量的 不与 标准溶液反应,故对测定结果无影响。
题组三
1. [2023湖北,14分]学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:
(1) 铜与浓硝酸反应的装置如图,仪器A的名称为具支试管,装置B的作用为安全瓶(防倒吸)。
[解析]仪器 的名称为具支试管; 与浓 反应产生的尾气直接用 溶液吸收会引发溶液倒吸,装置 起安全瓶的作用,防止倒吸。
(2) 铜与过量 反应的探究如下:
实验②中 溶解的离子方程式为 ;
产生的气体为 。比较实验①和②,从氧化还原角度说明 的作用是增强 的氧化性。
[解析] 在稀 作用下,被 氧化生成 和 ,溶液变蓝。 作用下, 会被催化分解生成 。在 溶液中 不能氧化 ,在稀 中 能氧化 ,说明 使得 的氧化性增强。
(3) 用足量 处理实验②新制的溶液得到沉淀 ,元素分析表明 为铜的氧化物,提纯干燥后的 在惰性氛围下加热, 完全分解为 黑色氧化物 , 。 的化学式为 。
[解析] 为铜的氧化物,设 的化学式为 ,其在惰性氛围下分解生成黑色氧化物 ,则:
则 ,又 ,解得 ,则 的化学式为 。
(4) 取含 粗品 (杂质不参加反应)与过量的酸性 完全反应后,调节溶液至弱酸性。以淀粉为指示剂,用 标准溶液滴定,滴定终点时消耗 标准溶液 。(已知: , )标志滴定终点的现象是滴入最后半滴 标准溶液时,溶液蓝色刚好褪去,且半分钟内不恢复,粗品中 的相对含量为 。
[解析] 在酸性条件下生成 , 与 反应生成 , 遇淀粉变蓝,用 标准溶液滴定 ,当滴入最后半滴 标准溶液时,溶液的蓝色褪去,且半分钟内不恢复时,表明 已完全反应,达到滴定终点。 中 为 价、 为 价,结合已知反应可知, 在酸性条件下与 发生反应 ,则 ,则样品中 , 。
2. [2022山东,12分]实验室利用 和亚硫酰氯 制备无水 的装置如图所示(加热及夹持装置略)。已知 沸点为 ,遇水极易反应生成两种酸性气体。
回答下列问题:
(1) 实验开始先通 。一段时间后,先加热装置 (填“ ”或“ ”)。装置 内发生反应的化学方程式为 。装置 、 共同起到的作用是冷凝并回收利用 (冷凝回流)。
[解析]根据 遇水极易反应生成两种酸性气体,知应先加热装置 ,后加热装置 ,以使 分解产生的水蒸气及时被 吸收,防止 水解。装置 内发生的反应可以看成是 先分解产生 和水蒸气,水蒸气再与 发生反应生成 、 。装置 为球形冷凝管,装置 为长导管,共同起到冷凝并回收利用 的作用。
(2) 现有含少量杂质的 ,为测定 值进行如下实验:
实验Ⅰ:称取 样品,用足量稀硫酸溶解后,用 标准溶液滴定 达终点时消耗 (滴定过程中 转化为 , 不反应)。
实验Ⅱ:另取 样品,利用上述装置与足量 反应后,固体质量为 。则 ;下列情况会导致 测量值偏小的是 (填标号)。
A.样品中含少量 杂质
B.样品与 反应时失水不充分
C.实验Ⅰ中,称重后样品发生了潮解
D.滴定达终点时发现滴定管尖嘴内有气泡生成
[解析]实验Ⅰ的反应原理为 ,则 ;实验Ⅱ中 ,固体减少的质量为水的质量,则 ,故 。若样品中含有少量 杂质,则消耗的 标准溶液体积偏大, 值偏大,根据 知, 测量值偏小, 项正确;样品与 反应时失水不充分,则 偏小, 测量值偏小, 项正确;实验Ⅰ中称重后样品发生了潮解,对 含量的测定无影响, 测量值不变, 项错误;滴定达终点时发现滴定管尖嘴内有气泡生成,则 值偏小, 测量值偏大, 项错误。
(3) 用上述装置,根据反应 制备 。已知 与 分子结构相似,与 互溶,但极易水解。选择合适仪器并组装蒸馏装置对 、 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧⑥⑩③⑤(填序号),先馏出的物质为 。
[解析]根据蒸馏装置组成特点及 极易水解,按照由下到上、由左到右的仪器组装原则知,仪器安装顺序为①⑨⑧⑥⑩③⑤,⑤用于吸收空气中水分,防止 水解。 与 分子结构相似,均为分子晶体, 的相对分子质量大,沸点高,则先馏出的是沸点较低的 。
3. [2022福建,13分]粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含 、 和 等)提铝的工艺流程如下:
回答下列问题:
(1) “浸出”时适当升温的主要目的是提高浸出率(或提高浸出速率), 发生反应的离子方程式为 。
[解析]升高温度,化学反应速率加快,从而提高“浸出”时的浸出率, 属于两性氧化物,既可以与强酸反应生成盐和水,又可以与强碱反应生成盐和水, 与硫酸反应的离子方程式为 。
(2) “浸渣”的主要成分除残余 外,还有 和 。实验测得, 粉煤灰 的质量分数为 经浸出、干燥后得到 “浸渣” 的质量分数为 , 的浸出率为 。
[解析]由于 与硫酸不反应, 微溶,因此“浸渣”的主要成分除残余 外,还有 和 ; 粉煤灰 的质量分数为 中 ,“浸渣” 的质量分数为 中 ,则 的浸出率为 。
(3) “沉铝”时,体系中三种物质的溶解度曲线如图所示,加入 沉铝的目的是使更多的铝元素转化为晶体析出,同时保证晶体纯度,“沉铝”的最佳方案为高温溶解再冷却结晶。
[解析]由同离子效应和题图知,“沉铝”时,向 溶液中加入 ,可以使更多的铝元素转化为 析出,同时保证纯度,由题图可以看出, 的溶解度受温度影响最大,因此“沉铝”的最佳方案为高温溶解、冷却结晶。
(4) “焙烧”时,主要反应的化学方程式为 或 。
[解析]由流程图可以看出,“焙烧”时生成气体,所得固体产物经“水浸”得到 ,则根据元素守恒可得到 高温分解的化学方程式为 或 。
(5) “水浸”后得到的“滤液2”可返回沉铝工序循环使用。
[解析]“水浸”后得到的“滤液2”的主要成分为 ,可返回沉铝工序循环使用。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
