9.1金属的冶炼方法课件(共28张ppt)2023-2024学年高一化学(苏教版2019必修第二册)
文档属性
| 名称 | 9.1金属的冶炼方法课件(共28张ppt)2023-2024学年高一化学(苏教版2019必修第二册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-04-15 00:00:00 | ||
图片预览








文档简介
(共28张PPT)
金属与人类文明
金属的冶炼方法
专题九
第一节
授课人:
1.能从物质性质与反应条件角度解释不同金属冶炼方法的差异。
2.认识我国古代文明与金属冶炼的关系。
3.掌握铝热反应原理及实验,了解铝的冶炼方法。
学习目标
在妇好墓中,考古学家们发
现了91根青铜戈、 4件铜铲、
37件铜镞,同时还有四把
大钺。这四把大钺中有两把
是目前出土的体积最大的铜
钺,加上木柲之后,重量超
过10公斤以上。
妇好墓出土的铜钺
妇好 [fù zǐ]
史上最强大嫂
一、金属的存在形式及冶炼方法
如:金Au、铂Pt
1、游离态:极少数金属元素在自然界以单质形式存在
金属的存在形式
单质活动性较弱
自然铜
金
2、化合态:大部分金属元素在自然界以化合物形式存在
如: 铁Fe、铝Al等
一、金属的存在形式及冶炼方法
铝土矿(Al2O3 ) 赤铁矿(Fe2O3 )
单质活动性较强
黄铜矿(CuFeS2)
3、一些金属元素以离子或矿石的形式分布于海洋中, 如钠Na、镁Mg、锰Mn等
一、金属的存在形式及冶炼方法
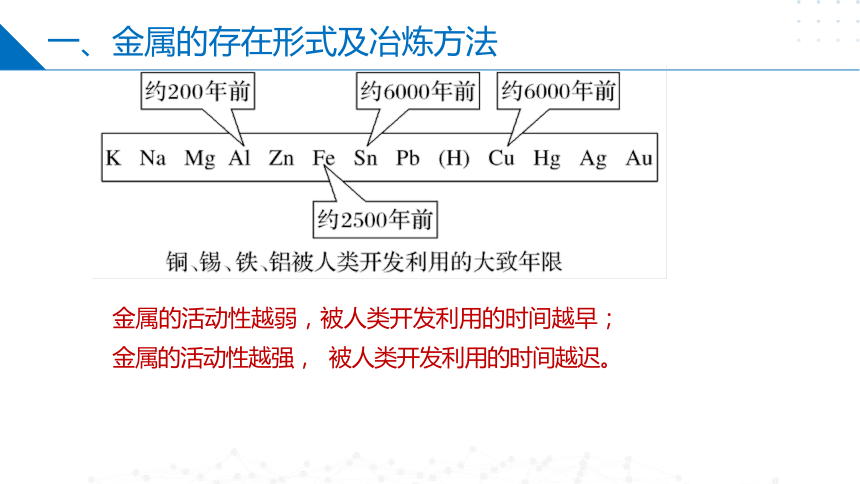
金属的活动性越弱,被人类开发利用的时间越早;
金属的活动性越强, 被人类开发利用的时间越迟。
一、金属的存在形式及冶炼方法
金属的冶炼:
利用化学反应使金属元素从化合态变为游离态的过程。
实质:
金属离子 金属单质,即Mn++ne- M。
一、金属的存在形式及冶炼方法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg A g Pt Au
金属活动性逐渐减弱
适用于极不活泼的金属的冶炼。
通过熔铸的方法即可对金属进行加工和锻造。
金子的密度比沙子大得多,在水的冲击下沙粒被水流带走, 而金就留在容器里。
一、金属的存在形式及冶炼方法
沙里淘金
物理提 取法
如: Pt Au
适用于金属活动性顺序表中氢以后的金属冶炼。
解法
如: Hg Ag
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag
Pt Au
一、金属的存在形式及冶炼方法
4Ag+O2 ↑
2Hg+O2 ↑。
金属活动性逐渐减弱
热分
2Ag2O
2HgO
一、金属的存在形式及冶炼方法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
用还原剂(CO、 C、H2和活泼金属等)还原金属氧化物,
适合冶炼金属活动性顺序表中锌到铜之间的大多数金属。
如: Zn Fe Sn Pb Cu
高温
Fe2O3+3CO====2Fe+3CO2
2Fe+Al2O3
高炉炼铁
铝热法炼铁
Fe2O3+2Al
高温 还原法
▲ 高炉炼铁
高炉炼铁
石灰石 铁矿石
出铁口比出渣口低:
由于生铁的密度比 炉渣大。
SiO2+CaO CaSiO3
(炉渣的主要成分)
一、金属的存在形式及冶炼方法
CaCO3 === CaO+CO2 ↑ 焦炭
目的:
维持炉内高温
造渣
(生铁)
高温
一、金属的存在形式及冶炼方法
3CO+Fe2O3=高=温=2Fe+3CO2
C+O2 CO2 放热
C+CO2 =2CO
高炉炼铁
铝热法炼铁
一、金属的存在形式及冶炼方法
实验现象
①镁条剧烈燃烧;
②氧化铁粉末和铝粉发生剧烈的反应;
③反应放出大量的热,并发出耀眼的白光;
④纸漏斗的下部被烧穿,有熔融物落入沙中
一、金属的存在形式及冶炼方法
铝热法炼铁
铝热法炼铁
(1)在高温条件下进行。(2)反应迅速并放出大量的热。
特点 ( 3)新生成的金属单质呈熔融态且易与Al2O3分离。
①冶炼熔点较高、 活动性弱于Al的金属,如钒、铬、锰等。
②金属焊接,如焊接钢轨等
一、金属的存在形式及冶炼方法
应用
铝热反应注意事项:
1 铝热反应的引燃剂为镁带,助燃剂为氯酸钾。
一、金属的存在形式及冶炼方法
2 铝热剂为混合物,是由铝粉和某些难熔的金属氧化物(Fe2O3、
Fe3O4、 Cr2O3、V2O5、MnO2等)粉末按一定比例组成的。
铝热反应注意事项:
3 镁带要打磨除去表面的氧化膜,否则难以点燃;氧化铁粉末与铝
粉要选择干燥的;铝粉要用没有被氧化的,否则反应难以进行。
4 蒸发皿中的细沙要适量,既要防止蒸发皿炸裂,又要防止熔
一、金属的存在形式及冶炼方法
融的液体溅出伤人。
适合冶炼金属活动性较强的金属(一般为金属活动性
顺序表中铝及铝前面的金属)。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag
Pt Au
一、金属的存在形式及冶炼方法
如: K Ca Na Mg Al
金属活动性逐渐减弱
电解法
MgCl2 (熔融)
↑ , 2NaCl (熔融)
Cl2 ↑ ,
一、金属的存在形式及冶炼方法
Mg+Cl2
2Na+
工业上冶炼Al时用Al2O3而不用AlCl3 ,因为AlCl3为共价化合物,熔化
后不导电。此外,冶炼Al时需加入冰晶石(Na3AlF6),以降低熔化温度 (从2054℃降低至900℃) 。
一、金属的存在形式及冶炼方法
4Al + 3O2 ↑
2Al2O3
===
冰晶石
通电
NaOH溶液 CO2
①溶解 ③酸化
铝土矿 NaAlO2溶液 Al(OH)3 Al2O3
NaAlO2 + CO2 + 2H2O === Al(OH)3 ↓+ NaHCO3
2Al(OH)3 Al2O3+3H2O
一、金属的存在形式及冶炼方法
⑥ 2Al2O3 + 3O2 ↑
石
4Al
②过滤 ④过滤 ⑤灼烧
① Al2O3 +2NaOH === 2NaAlO2 + H2O
铝的冶炼
③
⑤
Al
⑥电解
例1、氧化还原反应广泛用于金属的冶炼。下列说法中不正确的是
( C )A.铝热法还原铁的反应中,放出的热能使铁熔化B.湿法炼 铜与火法炼铜的反应中,铜元素都发生还原反应C.Mg可由电解熔 融的MgO制取, Na可由电解熔融的NaCl制取D.冶炼铁的主要原料 有铁矿石、焦炭、空气、石灰石等,其中石灰石的作用是除去铁矿 石中的脉石(二氧化硅)
典例解析
金属的存在形式及冶炼方法
金属存在形式
金属冶炼方法
炼铁方法
练铝过程
课堂小结
随堂练习
1.下列有关金属冶炼的说法正确的是( C )A.制Na:高
温分解NaCl制备NaB.制Al:将Al( OH)3溶于盐酸中,电 解所得AlCl3溶液C.制Fe:用焦炭和空气反应产生的CO在 高温下还原铁矿石中的铁的氧化物D.制Cu:“熬胆矾铁釜, 久之亦化为铜”发生了分解反应
随堂练习
2.硅在自然界只以化合态形式存在,如铁矿石中的硅主要以脉石(SiO2)
的形式存在。炼铁时为了除去脉石, 向炼铁高炉中加入石灰石。该过程
不可能涉及的化学反应是(B )
A.CaCO3 CaO+CO2 ↑
B.2FeO+Si 2Fe+SiO2
C.C+CO2 2CO
D.CaO+SiO2 CaSiO3
谢谢观看
T H A N K S
金属与人类文明
金属的冶炼方法
专题九
第一节
授课人:
1.能从物质性质与反应条件角度解释不同金属冶炼方法的差异。
2.认识我国古代文明与金属冶炼的关系。
3.掌握铝热反应原理及实验,了解铝的冶炼方法。
学习目标
在妇好墓中,考古学家们发
现了91根青铜戈、 4件铜铲、
37件铜镞,同时还有四把
大钺。这四把大钺中有两把
是目前出土的体积最大的铜
钺,加上木柲之后,重量超
过10公斤以上。
妇好墓出土的铜钺
妇好 [fù zǐ]
史上最强大嫂
一、金属的存在形式及冶炼方法
如:金Au、铂Pt
1、游离态:极少数金属元素在自然界以单质形式存在
金属的存在形式
单质活动性较弱
自然铜
金
2、化合态:大部分金属元素在自然界以化合物形式存在
如: 铁Fe、铝Al等
一、金属的存在形式及冶炼方法
铝土矿(Al2O3 ) 赤铁矿(Fe2O3 )
单质活动性较强
黄铜矿(CuFeS2)
3、一些金属元素以离子或矿石的形式分布于海洋中, 如钠Na、镁Mg、锰Mn等
一、金属的存在形式及冶炼方法
金属的活动性越弱,被人类开发利用的时间越早;
金属的活动性越强, 被人类开发利用的时间越迟。
一、金属的存在形式及冶炼方法
金属的冶炼:
利用化学反应使金属元素从化合态变为游离态的过程。
实质:
金属离子 金属单质,即Mn++ne- M。
一、金属的存在形式及冶炼方法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg A g Pt Au
金属活动性逐渐减弱
适用于极不活泼的金属的冶炼。
通过熔铸的方法即可对金属进行加工和锻造。
金子的密度比沙子大得多,在水的冲击下沙粒被水流带走, 而金就留在容器里。
一、金属的存在形式及冶炼方法
沙里淘金
物理提 取法
如: Pt Au
适用于金属活动性顺序表中氢以后的金属冶炼。
解法
如: Hg Ag
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag
Pt Au
一、金属的存在形式及冶炼方法
4Ag+O2 ↑
2Hg+O2 ↑。
金属活动性逐渐减弱
热分
2Ag2O
2HgO
一、金属的存在形式及冶炼方法
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性逐渐减弱
用还原剂(CO、 C、H2和活泼金属等)还原金属氧化物,
适合冶炼金属活动性顺序表中锌到铜之间的大多数金属。
如: Zn Fe Sn Pb Cu
高温
Fe2O3+3CO====2Fe+3CO2
2Fe+Al2O3
高炉炼铁
铝热法炼铁
Fe2O3+2Al
高温 还原法
▲ 高炉炼铁
高炉炼铁
石灰石 铁矿石
出铁口比出渣口低:
由于生铁的密度比 炉渣大。
SiO2+CaO CaSiO3
(炉渣的主要成分)
一、金属的存在形式及冶炼方法
CaCO3 === CaO+CO2 ↑ 焦炭
目的:
维持炉内高温
造渣
(生铁)
高温
一、金属的存在形式及冶炼方法
3CO+Fe2O3=高=温=2Fe+3CO2
C+O2 CO2 放热
C+CO2 =2CO
高炉炼铁
铝热法炼铁
一、金属的存在形式及冶炼方法
实验现象
①镁条剧烈燃烧;
②氧化铁粉末和铝粉发生剧烈的反应;
③反应放出大量的热,并发出耀眼的白光;
④纸漏斗的下部被烧穿,有熔融物落入沙中
一、金属的存在形式及冶炼方法
铝热法炼铁
铝热法炼铁
(1)在高温条件下进行。(2)反应迅速并放出大量的热。
特点 ( 3)新生成的金属单质呈熔融态且易与Al2O3分离。
①冶炼熔点较高、 活动性弱于Al的金属,如钒、铬、锰等。
②金属焊接,如焊接钢轨等
一、金属的存在形式及冶炼方法
应用
铝热反应注意事项:
1 铝热反应的引燃剂为镁带,助燃剂为氯酸钾。
一、金属的存在形式及冶炼方法
2 铝热剂为混合物,是由铝粉和某些难熔的金属氧化物(Fe2O3、
Fe3O4、 Cr2O3、V2O5、MnO2等)粉末按一定比例组成的。
铝热反应注意事项:
3 镁带要打磨除去表面的氧化膜,否则难以点燃;氧化铁粉末与铝
粉要选择干燥的;铝粉要用没有被氧化的,否则反应难以进行。
4 蒸发皿中的细沙要适量,既要防止蒸发皿炸裂,又要防止熔
一、金属的存在形式及冶炼方法
融的液体溅出伤人。
适合冶炼金属活动性较强的金属(一般为金属活动性
顺序表中铝及铝前面的金属)。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag
Pt Au
一、金属的存在形式及冶炼方法
如: K Ca Na Mg Al
金属活动性逐渐减弱
电解法
MgCl2 (熔融)
↑ , 2NaCl (熔融)
Cl2 ↑ ,
一、金属的存在形式及冶炼方法
Mg+Cl2
2Na+
工业上冶炼Al时用Al2O3而不用AlCl3 ,因为AlCl3为共价化合物,熔化
后不导电。此外,冶炼Al时需加入冰晶石(Na3AlF6),以降低熔化温度 (从2054℃降低至900℃) 。
一、金属的存在形式及冶炼方法
4Al + 3O2 ↑
2Al2O3
===
冰晶石
通电
NaOH溶液 CO2
①溶解 ③酸化
铝土矿 NaAlO2溶液 Al(OH)3 Al2O3
NaAlO2 + CO2 + 2H2O === Al(OH)3 ↓+ NaHCO3
2Al(OH)3 Al2O3+3H2O
一、金属的存在形式及冶炼方法
⑥ 2Al2O3 + 3O2 ↑
石
4Al
②过滤 ④过滤 ⑤灼烧
① Al2O3 +2NaOH === 2NaAlO2 + H2O
铝的冶炼
③
⑤
Al
⑥电解
例1、氧化还原反应广泛用于金属的冶炼。下列说法中不正确的是
( C )A.铝热法还原铁的反应中,放出的热能使铁熔化B.湿法炼 铜与火法炼铜的反应中,铜元素都发生还原反应C.Mg可由电解熔 融的MgO制取, Na可由电解熔融的NaCl制取D.冶炼铁的主要原料 有铁矿石、焦炭、空气、石灰石等,其中石灰石的作用是除去铁矿 石中的脉石(二氧化硅)
典例解析
金属的存在形式及冶炼方法
金属存在形式
金属冶炼方法
炼铁方法
练铝过程
课堂小结
随堂练习
1.下列有关金属冶炼的说法正确的是( C )A.制Na:高
温分解NaCl制备NaB.制Al:将Al( OH)3溶于盐酸中,电 解所得AlCl3溶液C.制Fe:用焦炭和空气反应产生的CO在 高温下还原铁矿石中的铁的氧化物D.制Cu:“熬胆矾铁釜, 久之亦化为铜”发生了分解反应
随堂练习
2.硅在自然界只以化合态形式存在,如铁矿石中的硅主要以脉石(SiO2)
的形式存在。炼铁时为了除去脉石, 向炼铁高炉中加入石灰石。该过程
不可能涉及的化学反应是(B )
A.CaCO3 CaO+CO2 ↑
B.2FeO+Si 2Fe+SiO2
C.C+CO2 2CO
D.CaO+SiO2 CaSiO3
谢谢观看
T H A N K S
